Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Farmacologia-Sem 3
Cargado por
ebrainamiba0 calificaciones0% encontró este documento útil (0 votos)
2 vistas3 páginasEl documento describe los receptores de la insulina y su mecanismo de acción. Existen dos tipos de receptores: el receptor de insulina tipo 1, que se encuentra principalmente en el hígado, tejido adiposo y músculo esquelético y es el principal responsable de la acción metabólica de la insulina; y el receptor de insulina tipo 2, que se encuentra principalmente en el cerebro, placenta y células sanguíneas y regula la proliferación y diferenciación celular. Cuando la insulina se une a los receptores
Descripción original:
Título original
Farmacologia-sem 3 - copia
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl documento describe los receptores de la insulina y su mecanismo de acción. Existen dos tipos de receptores: el receptor de insulina tipo 1, que se encuentra principalmente en el hígado, tejido adiposo y músculo esquelético y es el principal responsable de la acción metabólica de la insulina; y el receptor de insulina tipo 2, que se encuentra principalmente en el cerebro, placenta y células sanguíneas y regula la proliferación y diferenciación celular. Cuando la insulina se une a los receptores
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
2 vistas3 páginasFarmacologia-Sem 3
Cargado por
ebrainamibaEl documento describe los receptores de la insulina y su mecanismo de acción. Existen dos tipos de receptores: el receptor de insulina tipo 1, que se encuentra principalmente en el hígado, tejido adiposo y músculo esquelético y es el principal responsable de la acción metabólica de la insulina; y el receptor de insulina tipo 2, que se encuentra principalmente en el cerebro, placenta y células sanguíneas y regula la proliferación y diferenciación celular. Cuando la insulina se une a los receptores
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
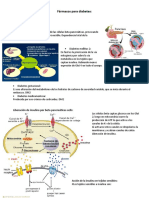
Asignatura: Farmacologia
Estudiante: Nayeli Chinchilla Herrada
Paralelo: 100
¿Cuál es el
problema/p ¿Qué piensa mi ¿Qué
¿Qué piensas sobre ello?
regunta o compañero? compartiremos?
tópico?
El receptor de la insulina es Existen dos tipos Compartimos
una glicoproteina de receptores que la insulina es
transmembrana compleja que son: un componente
consistente en 4 Receptor de esencial en el
subunidades: insulina tipo 1 tratamiento de la
dos subunidades adel lado (IR-A): Se cetoacidosis
extracelular encuentra diabética. Su
dos subunidades b poseen principalmente acción sobre la
un dominio extracelular, un en el hígado, glucosa, los
dominio transmembrana y tejido adiposo y cuerpos
¿Cuáles son un dominio intracelular. músculo cetónicos y la
los Las 4 subunidades derivan de esquelético. Es el función celular
receptores un pro-receptor único receptor principal permite revertir
de la insulina codificado por un gen para la acción la enfermedad y
en la localizado en el cromosoma metabólica de la prevenir
cetoacidosis? 19. insulina. complicaciones
Las dos subunidades a están Receptor de graves.
unidas entre sí por un puente insulina tipo 2
disulfuro. Además, cada una (IR-B): Se
de las subunidades a está encuentra
unida a una subunidad b por principalmente
un puente disulfuro en el cerebro,
formando un placenta y células
heterotetrámero. sanguíneas. Su
Cuando se activa por la función principal
insulina, la parte intracelular es regular la
de una de las subunidades b proliferación y
actúa como tirosina-protein diferenciación
kinasa específica. celular.
Ambos tipos de subunidades son
glicoproteínas cuya parte de
carbohidrato juega un
importante papel, ya que la
eliminación de galactosa y ácido
siálico reduce su afinidad hacia la
insulina.
La insulina se une a la porción N-
terminal de la subunidad a y al
hacerlo ocasiona un cambio
conformacional de la
subunidadb, cambio que
estimula la actividad la actividad
kinasa del receptor.
La unión de la insulina a las
subunidades a del receptor
provoca un cambio
conformacional de las
subunidades beta, lo que induce
la autofosforilización en 6
residuos de tirosina. La
fosforilización de la subunidad
beta induce la fosforilización de
la proteínaIRS-1 (insulin receptor
substrate 1). Esta fosforilización
induce la unión covalente de la
IRS-1 con otras nuevas proteínas
específicas que tienen en común
un dominio-SH2. Esta proteínas
son: fosfatitidilinositol 3-kinasa
(PI3-kinasa)
fosfotirosina fosfatasa (SHPTP2)
GRB-2 (Proteína unida al receptor
del factor de crecimiento 2)
Otras proteínas SH2 (actúan
como lectores que "leen" las
modificaciones químicas
(fosforilación) en otras proteínas,
permitiendo la transmisión y
coordinación de señales dentro
de la célula).
A través de un mecanismo,
todavía no bien dilucidado, la PI3-
Kinasa activa una proteina de
membrana, la proteína
transportadora de la glucosa
[GLU] que toma la glucosa del
medio extracelular y la
transporta al interior de la célula.
La GRB-2 no tiene una actividad
enzimática intrínseca, pero une la
IRP-1 con la vía metabólica de la
Ras. La proteína Ras es una
importante proteína implicada en
el crecimiento y metabolismo de
las células que se mueve en
círculo entre su forma activa
unida al GTP y una forma inactiva
unida al GDP.
La insulina, al actuar sobre la
GRB-2 activa esta proteína, la
cual a su vez mediante un factor
de intercambio llamado SOS, une
la IRS-1 a la Ras (p21ras). La
activación de la p21ras resulta
finalmente en la activación de
una proteína kinasa mitógeno-
activada que es considerada
como un factor de transcripción.
La fosfotirosina fosfatasa
SHPTP2, una vez activada por la
fosforilización de la IRS-1,
mediante mecanismos todavía
no bien conocidos, induce la
fosforilización de proteínas
nucleares, lo que a su vez, induce
la síntesis de proteínas y lípidos.
También podría gustarte
- Hormonas PancreaticasDocumento93 páginasHormonas PancreaticasFredi de Jesus Morales ViteAún no hay calificaciones
- FISIOLOGÍA DEL SISTEMA ENDOCRINO Páncreas Endocrino Insulin A, Glucagon, ADocumento72 páginasFISIOLOGÍA DEL SISTEMA ENDOCRINO Páncreas Endocrino Insulin A, Glucagon, Aapi-371148392% (13)
- Acceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017De EverandAcceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017Aún no hay calificaciones
- Metabolismo y efectos adversos de los CannabinoidesDe EverandMetabolismo y efectos adversos de los CannabinoidesAún no hay calificaciones
- Fisiologia Del Pancreas y Del Tejido AdiposoDocumento21 páginasFisiologia Del Pancreas y Del Tejido AdipososoniaAún no hay calificaciones
- Bioquímica de La Diabetes MellitusDocumento19 páginasBioquímica de La Diabetes MellitusEmilyMezaLunaAún no hay calificaciones
- BronquiectasiasDocumento61 páginasBronquiectasiasramon100% (5)
- Hipoglucemientes Orales, InsulinasDocumento14 páginasHipoglucemientes Orales, InsulinasMarcela AvilaAún no hay calificaciones
- Fasciolasis 20Documento39 páginasFasciolasis 20AlexanderKevinOrdoñezPachecoAún no hay calificaciones
- Páncreas EndocrinoDocumento32 páginasPáncreas EndocrinoElba Morales PonceAún no hay calificaciones
- Libro Psicodiagnostico Clinico PsicocliDocumento167 páginasLibro Psicodiagnostico Clinico Psicoclicalita2912100% (3)
- Farmacología Cuarto Parcial TrabajoDocumento44 páginasFarmacología Cuarto Parcial TrabajoIngrid Elizabeth Meléndez RomeroAún no hay calificaciones
- Fisiopatologia DBDocumento88 páginasFisiopatologia DBAxel BautistaAún no hay calificaciones
- InsulinaDocumento14 páginasInsulinadorianAún no hay calificaciones
- Resumen 02 BioquimicaDocumento3 páginasResumen 02 Bioquimicamiguelangel zeballos huamaniAún no hay calificaciones
- Diabetes 2Documento9 páginasDiabetes 2Camila SanchezAún no hay calificaciones
- El Receptor InsulínicoDocumento3 páginasEl Receptor InsulínicoKeisy HernandezAún no hay calificaciones
- Diabetes MellitusDocumento7 páginasDiabetes MellitusEduardo MiramontesAún no hay calificaciones
- Defining The Underlying Defect in Insulin Action in Type 2Documento24 páginasDefining The Underlying Defect in Insulin Action in Type 2JOEL ANDRE SANCHEZ GILAún no hay calificaciones
- 024 Receptores Tirosina Cinasa Como Blancos FarmacolgicosDocumento13 páginas024 Receptores Tirosina Cinasa Como Blancos FarmacolgicossefiefAún no hay calificaciones
- Señales Intracelulares Control GlucosaDocumento13 páginasSeñales Intracelulares Control GlucosaKevin San Martin SanchezAún no hay calificaciones
- Semana 06-EndocrinoDocumento14 páginasSemana 06-EndocrinoMaria Gracia Dioses RamírezAún no hay calificaciones
- EnzimologíaDocumento6 páginasEnzimologíaDaniela DiazAún no hay calificaciones
- Insulina y GlucagondocxDocumento22 páginasInsulina y GlucagondocxTanya Castillo ElizaldeAún no hay calificaciones
- Vitae 5600Documento13 páginasVitae 5600abril ibarraAún no hay calificaciones
- Fármacos para DiabetesDocumento6 páginasFármacos para DiabetesCRISTÓBAL IGNACIO AROSAún no hay calificaciones
- Abp TerminadoDocumento8 páginasAbp TerminadoFacundo Mario UmpierrezAún no hay calificaciones
- Via de Señalizacion de La InsulinaDocumento2 páginasVia de Señalizacion de La InsulinaJoab MaycaAún no hay calificaciones
- Sind. Hipo e Hipersecreción de InsulinaDocumento38 páginasSind. Hipo e Hipersecreción de Insulinahemer666100% (5)
- Clasificación de Los HipoglucémicosDocumento11 páginasClasificación de Los Hipoglucémicoscristina rojasAún no hay calificaciones
- Proteina Receptor de InsulinaDocumento23 páginasProteina Receptor de InsulinaEstefania Olmos MoralesAún no hay calificaciones
- Receptor de InsulinaDocumento32 páginasReceptor de InsulinaMage TelizAún no hay calificaciones
- DiabetesDocumento10 páginasDiabetesSel TMAún no hay calificaciones
- INSULINAaDocumento4 páginasINSULINAaGeranni RondonAún no hay calificaciones
- Farmacología de HipoglucemiantesDocumento9 páginasFarmacología de HipoglucemiantesAxel .iAún no hay calificaciones
- Hormonas Pancreáticas y AntidiabéticosDocumento33 páginasHormonas Pancreáticas y AntidiabéticosKidderleng Sotelo FittoriaAún no hay calificaciones
- Trabajo Escrito. Producción de InsulinaDocumento15 páginasTrabajo Escrito. Producción de InsulinaEdnaAún no hay calificaciones
- Guía de Lectura - Obesidad, RI y SM - EditableDocumento30 páginasGuía de Lectura - Obesidad, RI y SM - EditableDahiana BergesAún no hay calificaciones
- Diabetes Mellitus - FármacosDocumento8 páginasDiabetes Mellitus - FármacosSharmiAún no hay calificaciones
- DISCUSIONDocumento10 páginasDISCUSIONbryan guidosAún no hay calificaciones
- Insulin Oter ApiaDocumento15 páginasInsulin Oter Apia61219870Aún no hay calificaciones
- Endocrino 4Documento17 páginasEndocrino 4Carolina CAún no hay calificaciones
- Farmacoquímica EndocrinoDocumento23 páginasFarmacoquímica EndocrinoJair Rios ÑontolAún no hay calificaciones
- KatzungDocumento25 páginasKatzungCrisley Evita Quispe PelaezAún no hay calificaciones
- Trabajo Escrito. Producción de InsulinaDocumento15 páginasTrabajo Escrito. Producción de InsulinaEdnaAún no hay calificaciones
- Farmacos Utilizados en El Tratamiento de La Diabetes MellitusDocumento29 páginasFarmacos Utilizados en El Tratamiento de La Diabetes MellitusElizabeth QuevedoAún no hay calificaciones
- PáncreasDocumento41 páginasPáncreasMaria Isabel Llamoga MiñanoAún no hay calificaciones
- Seminario Receptores FisiologíaDocumento12 páginasSeminario Receptores FisiologíaGilmar Daniel MincholaAún no hay calificaciones
- Insulina ResumenDocumento5 páginasInsulina ResumenAbigail Rodriguez TuestaAún no hay calificaciones
- Insulinoterapia. Insulinización Temprana. Análogos de Insulina PDFDocumento34 páginasInsulinoterapia. Insulinización Temprana. Análogos de Insulina PDFCEATECAún no hay calificaciones
- InsulinaDocumento7 páginasInsulinaroberto.barajas9059Aún no hay calificaciones
- SEMINARIODocumento17 páginasSEMINARIOSebas GuevAún no hay calificaciones
- 9 - Comunicacion Celular - Biologia (12-10-11)Documento48 páginas9 - Comunicacion Celular - Biologia (12-10-11)Bertha GuivinAún no hay calificaciones
- UntitledDocumento4 páginasUntitledMartin GuzmánAún no hay calificaciones
- Comunicación Intracelular y Transmision Intracelular de SeñalesDocumento4 páginasComunicación Intracelular y Transmision Intracelular de SeñalesBelen IñigoAún no hay calificaciones
- Insulina, Albumina y DistrofinaDocumento3 páginasInsulina, Albumina y DistrofinaDoreli Aranzazú Chávez DíazAún no hay calificaciones
- Artículos de Revisión: ResumenDocumento11 páginasArtículos de Revisión: ResumenFernando PinoAún no hay calificaciones
- Segundos MensajerosDocumento43 páginasSegundos MensajerosMonroy FernandoAún no hay calificaciones
- ENDOCRINODocumento63 páginasENDOCRINONai. E.Aún no hay calificaciones
- Presentación Informativa Diabetes Ilustrado Blanco AzulDocumento14 páginasPresentación Informativa Diabetes Ilustrado Blanco Azulm.trigo5Aún no hay calificaciones
- Diabetes MellitusDocumento32 páginasDiabetes MellitusAlejandro CVAún no hay calificaciones
- 43622-Texto Del Artículo-203119-1-10-20140522Documento10 páginas43622-Texto Del Artículo-203119-1-10-20140522keara73dAún no hay calificaciones
- Wa0182.Documento5 páginasWa0182.ebrainamibaAún no hay calificaciones
- Texto - de - Aprendizaje 2do - Secundaria 2024 149 232 1Documento84 páginasTexto - de - Aprendizaje 2do - Secundaria 2024 149 232 1ebrainamibaAún no hay calificaciones
- CARATULASSSSSDocumento4 páginasCARATULASSSSSebrainamibaAún no hay calificaciones
- Formato para Cronogramas. Mensual y DiarioDocumento2 páginasFormato para Cronogramas. Mensual y DiarioebrainamibaAún no hay calificaciones
- RamiroDocumento21 páginasRamiroebrainamibaAún no hay calificaciones
- Formato Del PSP 2024-Act.Documento4 páginasFormato Del PSP 2024-Act.ebrainamiba0% (1)
- 2do Diagnostico LuchitoDocumento2 páginas2do Diagnostico LuchitoebrainamibaAún no hay calificaciones
- Cam. Multiverso de La FeDocumento2 páginasCam. Multiverso de La FeebrainamibaAún no hay calificaciones
- Pdc-Prim-Multigrado 2024Documento6 páginasPdc-Prim-Multigrado 2024ebrainamiba0% (1)
- Documento de Transferencia Milas CrazyDocumento2 páginasDocumento de Transferencia Milas CrazyebrainamibaAún no hay calificaciones
- Manual de Práctica Profesional 2023 Tercera ParteDocumento11 páginasManual de Práctica Profesional 2023 Tercera ParteebrainamibaAún no hay calificaciones
- Manual de Práctica Profesional 2023 Segunda ParteDocumento10 páginasManual de Práctica Profesional 2023 Segunda ParteebrainamibaAún no hay calificaciones
- Lsalud 2010Documento8 páginasLsalud 2010Noemí Dominga CarabajalAún no hay calificaciones
- Pedagoga 2 Planeacion Primera Semana Del 1 Al 4 de Junio 2022 Las Brisas - Grupo 14Documento9 páginasPedagoga 2 Planeacion Primera Semana Del 1 Al 4 de Junio 2022 Las Brisas - Grupo 14Luz MartinezAún no hay calificaciones
- Puntos Claves ORLDocumento6 páginasPuntos Claves ORLValeria VictoriaAún no hay calificaciones
- Pie DiabeticoDocumento9 páginasPie DiabeticoJimmy Zuñiga LòpezAún no hay calificaciones
- Estado EpilépticoDocumento19 páginasEstado EpilépticoJerry GarciaAún no hay calificaciones
- La Fiebre PerperalDocumento3 páginasLa Fiebre PerperalCarmen Gonzales CornelioAún no hay calificaciones
- Cuales Son Los Efectos de La Contaminacion Del Aire en ArequipaDocumento5 páginasCuales Son Los Efectos de La Contaminacion Del Aire en ArequiparoxanaAún no hay calificaciones
- Guía 2 Grado Séptimo - Docx Mayo 4 A Mayo 15Documento4 páginasGuía 2 Grado Séptimo - Docx Mayo 4 A Mayo 15mariana valdivieso sanchezAún no hay calificaciones
- Proyecto RS Vi Psicologia (Presencial)Documento29 páginasProyecto RS Vi Psicologia (Presencial)Kevin P. CisnerosAún no hay calificaciones
- Caso ClínicoDocumento13 páginasCaso ClínicoJael WarschawskyAún no hay calificaciones
- Electrocardiografía Clínica BásicaDocumento30 páginasElectrocardiografía Clínica BásicaAGUILAR SOTO ENRIQUEAún no hay calificaciones
- Narcisismo - ¿Cuándo Es Sano y Cuándo Constituye Un TrastornoDocumento14 páginasNarcisismo - ¿Cuándo Es Sano y Cuándo Constituye Un TrastornoDidactimanías SaltaAún no hay calificaciones
- Celulitis InfecciosaDocumento3 páginasCelulitis Infecciosapaolacraxker22Aún no hay calificaciones
- EvolucionesDocumento9 páginasEvolucionesGabriela Gaona CuevaAún no hay calificaciones
- Macrólidos FarmacosDocumento12 páginasMacrólidos FarmacosRony Rueda GarcésAún no hay calificaciones
- La SaludDocumento8 páginasLa SaludStefaniAún no hay calificaciones
- CCO1 Dra. Laguna - Versión AlumnoDocumento2 páginasCCO1 Dra. Laguna - Versión AlumnoCamila Rodriguez AgurtoAún no hay calificaciones
- Notas de EnfermeriaDocumento4 páginasNotas de EnfermeriaAdanxitto Perez GalarzaAún no hay calificaciones
- Informe MetodosDocumento3 páginasInforme MetodosSantiago VanegasAún no hay calificaciones
- Charla Equipo de Proteccion PersonalDocumento7 páginasCharla Equipo de Proteccion PersonalJohana Aracely QuintuñaAún no hay calificaciones
- Telesalud en Diabetes Mellitus 2 ColombiaDocumento14 páginasTelesalud en Diabetes Mellitus 2 Colombiamariojosehurtado3955Aún no hay calificaciones
- Transversalidad y Trabajo Colegiado3 - VFDocumento28 páginasTransversalidad y Trabajo Colegiado3 - VFIvonne QuijanoAún no hay calificaciones
- CojaDocumento29 páginasCojaAdelaida MuquincheAún no hay calificaciones
- Enfermedades de Transmision SexualDocumento7 páginasEnfermedades de Transmision SexualNathalie OsorioAún no hay calificaciones
- COLMEDICOSDocumento4 páginasCOLMEDICOSLeidy CastroAún no hay calificaciones
- Amiloide 2020Documento23 páginasAmiloide 2020Constanza CastilloAún no hay calificaciones
- Grupo 2-La Delincuencia Juvenil Como Fenomeno Social en La Republica Dominicana 2015-2016Documento14 páginasGrupo 2-La Delincuencia Juvenil Como Fenomeno Social en La Republica Dominicana 2015-2016Eva Desireé Herrera Rodriguez100% (1)