Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Agentes Reductores
Cargado por
Amor MiraveteDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Agentes Reductores
Cargado por
Amor MiraveteCopyright:
Formatos disponibles
Reductores
Los agentes reductores son sustancias químicas que tienen la capacidad de donar electrones
o aceptar protones durante una reacción, llevando a cabo la reducción de otras especies
químicas. En química orgánica, los agentes reductores son ampliamente utilizados para
transformar compuestos orgánicos mediante la adición de hidrógeno o la donación de
electrones. Aquí tienes algunos agentes reductores comunes en reacciones orgánicas:
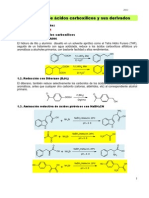
1. Litol (lialh₄): También conocido como hidruro de aluminio y litio, es uno de los
agentes reductores más fuertes y versátiles. Puede reducir aldehídos, cetonas,
ésteres, ácidos carboxílicos y nitrilos a sus correspondientes alcoholes o aminas.
2. Borohidruro de Sodio (nabh₄): Es un agente reductor más suave que el litol y se
utiliza comúnmente para reducir aldehídos y cetonas a sus alcoholes
correspondientes. También puede reducir ésteres y ácidos carboxílicos, pero no es lo
suficientemente reactivo para reducir nitrilos o amidas.
3. Hidrógeno (H₂) con catalizadores metálicos: La hidrogenación catalítica es una
forma común de reducción en la que el hidrógeno molecular reacciona en presencia
de un catalizador metálico como paladio (Pd), platino (Pt) o níquel (Ni). Esta
reacción se utiliza para reducir aldehídos, cetonas, alquenos y nitrocompuestos a sus
productos reducidos.
4. Hidruro de Sodio (nah): Aunque más comúnmente utilizado como una base fuerte,
el hidruro de sodio también puede actuar como agente reductor en ciertas
condiciones.
5. Dihidruro de Dimetilsulfuro (nabh₃CN): Se utiliza en la reducción selectiva de
cetonas a alcohol secundario.
6. Catalizador de Raney Níquel (Ni): Se utiliza para la hidrogenación de aldehídos y
cetonas.
7. Sulfuro de Sodio (Na₂S): En algunas situaciones, el sulfuro de sodio puede actuar
como agente reductor.
Es importante seleccionar el agente reductor adecuado según la naturaleza de los sustratos y
los productos deseados. La elección del agente reductor puede influir en la selectividad de
la reacción y en la formación de productos específicos. Además, las condiciones de
reacción, como la temperatura y el disolvente, también pueden desempeñar un papel crucial
en el éxito de la reducción orgánica.
Referencias:
1. Libretexts. (2022, 2 noviembre). 8.2: Agentes oxidantes y reductores. Libretexts
Español. Https://espanol.libretexts.org/Quimica/Qu%C3%admica_Introductoria
%2C_Conceptual_y_GOB/Qu
%C3%admica_para_Tiempos_Cambiantes_(Hill_y_mccreary)/08%3A_Oxidaci
%C3%b3n_y_Reducci%C3%b3n/
8.02%3A_Agentes_Oxidantes_y_Reductores#:~:text=El%20agente%20oxidante
%20es%20una,su%20estado%20de%20oxidaci%C3%b3n%20aumenta.
2. Ejemplos de reductores. (s. F.). Https://www.quimicas.net/2015/11/ejemplos-de-
reductores.html
3. 4.2.2 Agentes oxidantes y reductores | Química general. (s. F.).
Http://corinto.pucp.edu.pe/quimicageneral/contenido/422-agentes-oxidantes-y-
reductores.html
También podría gustarte
- 7 Ejercicios Resueltos de Aldehidos y CetonasDocumento3 páginas7 Ejercicios Resueltos de Aldehidos y CetonasKelly Gabriela Misse Colmenares54% (13)
- Practica 11 Yodo y TiosulfatoDocumento32 páginasPractica 11 Yodo y TiosulfatoEDDY100% (1)
- Propiedades de Los Catalizadores y Ejemplos PDFDocumento5 páginasPropiedades de Los Catalizadores y Ejemplos PDFKevin Guarderas0% (1)
- Reducción de Ácidos Carboxílicos y Sus DerivadosDocumento10 páginasReducción de Ácidos Carboxílicos y Sus DerivadosSilvia Rivera Sivila50% (2)
- Operaciones auxiliares elementales en laboratorio y en procesos en la industria química y afines. QUIE0308De EverandOperaciones auxiliares elementales en laboratorio y en procesos en la industria química y afines. QUIE0308Calificación: 5 de 5 estrellas5/5 (1)
- Propiedades Química de Los AlcoholesDocumento6 páginasPropiedades Química de Los AlcoholesDani Delgado GálvezAún no hay calificaciones
- Uso y Aplicaciones de Los HidrurosDocumento3 páginasUso y Aplicaciones de Los HidrurosANELL DORALISA CARVAJAL TUMBACO100% (6)
- 1 Nomenclatura Orgánica 2020Documento48 páginas1 Nomenclatura Orgánica 2020Juan Lozano GarnicaAún no hay calificaciones
- Investigacion Titulaciones RedoxDocumento11 páginasInvestigacion Titulaciones RedoxGunnyDeleonAún no hay calificaciones
- Informe General de Reducción de 1-Nitro Naftaleno A 1-Nalftil AminaDocumento24 páginasInforme General de Reducción de 1-Nitro Naftaleno A 1-Nalftil AminaRuben Antonio Gomez RodríguezAún no hay calificaciones
- Info HidrogenaciónDocumento11 páginasInfo HidrogenaciónDiego Lopez YangaliAún no hay calificaciones
- Proceso de HidrogenaciónDocumento22 páginasProceso de Hidrogenaciónnstor025Aún no hay calificaciones
- Antecedentes de La QOII7,8Documento12 páginasAntecedentes de La QOII7,8Ulises Martinez FriasAún no hay calificaciones
- Reducción de Enlaces Múltiples C - CDocumento12 páginasReducción de Enlaces Múltiples C - CSilvia Rivera SivilaAún no hay calificaciones
- HidrogenizacionDocumento5 páginasHidrogenizacionAnonymous jEkog7IAún no hay calificaciones
- Practica 2 ReactoresDocumento11 páginasPractica 2 ReactoresAroubba LimonAún no hay calificaciones
- Funcion Quimica Hidrogenadas HidrurosDocumento25 páginasFuncion Quimica Hidrogenadas HidrurosFernando MuñozAún no hay calificaciones
- CATALIZADORESDocumento9 páginasCATALIZADORESFabrizioDelgadoSandovalAún no hay calificaciones
- Agentes Oxidantes y ReductoresDocumento10 páginasAgentes Oxidantes y ReductoresAngie Mendoza100% (1)
- Previo m-NITROANILINADocumento9 páginasPrevio m-NITROANILINAM.EspkmAún no hay calificaciones
- HidrogenaciónDocumento6 páginasHidrogenaciónLeandroBlacioAún no hay calificaciones
- NR - 26 - 45-52 - 2 - 3 ES-desbloqueadoDocumento12 páginasNR - 26 - 45-52 - 2 - 3 ES-desbloqueadoDaniela Orellana ArnezAún no hay calificaciones
- Reacciones de HidrogenaciónDocumento2 páginasReacciones de HidrogenaciónMarco Antonio Pomahuali BravoAún no hay calificaciones
- Quimica Teoria 16Documento32 páginasQuimica Teoria 16DeaTh Bastion -.Aún no hay calificaciones
- Analisis Generalidades de Volumetría Redox - EstudiantesDocumento6 páginasAnalisis Generalidades de Volumetría Redox - EstudiantesMaritza DiazAún no hay calificaciones
- Quimica Teoria 16-1Documento24 páginasQuimica Teoria 16-1DeaTh Bastion -.Aún no hay calificaciones
- Agentes OxidantesDocumento2 páginasAgentes OxidanteschiquiAún no hay calificaciones
- Exposicion Gases IndustrialesDocumento24 páginasExposicion Gases IndustrialesOriana VargasAún no hay calificaciones
- Reducción de Ésteres y Ácidos CarboxílicosDocumento5 páginasReducción de Ésteres y Ácidos CarboxílicosAndrés VelázquezAún no hay calificaciones
- Cat A Liz AdoresDocumento5 páginasCat A Liz AdoresOscar CarballoAún no hay calificaciones
- LaboratorioDocumento26 páginasLaboratorioAnonymous kcTJSDyAún no hay calificaciones
- S12 - 31 - Reacciones Redox - 2022Documento17 páginasS12 - 31 - Reacciones Redox - 2022Nicole AparcanaAún no hay calificaciones
- Informe Previo-P6-LqoiiDocumento5 páginasInforme Previo-P6-LqoiiVALERIA GOMEZ ROMEROAún no hay calificaciones
- Descomposición Catalítica Del Peróxido de HidrogenoDocumento3 páginasDescomposición Catalítica Del Peróxido de HidrogenoAle Noguez33% (3)
- Agentes Oxidantes y Agentes ReductoresDocumento10 páginasAgentes Oxidantes y Agentes ReductoresXochitl Yazmin Dolores RodriguezAún no hay calificaciones
- Ayuditas Bioquimica P9Documento23 páginasAyuditas Bioquimica P9Michel Cardenas SimonAún no hay calificaciones
- Preparacion Del Catalizador de Platino o Catalizador de AdamsDocumento2 páginasPreparacion Del Catalizador de Platino o Catalizador de AdamsManuelUshoAún no hay calificaciones
- Informe Practica Grupos FuncionalesDocumento17 páginasInforme Practica Grupos FuncionalesJuan Camilo TepudAún no hay calificaciones
- HidrogenacionDocumento19 páginasHidrogenacionAdali Reyes JulcaAún no hay calificaciones
- Determinacion Del Contenido de CobreDocumento23 páginasDeterminacion Del Contenido de CobreHugo RodriguezAún no hay calificaciones
- Practica - 5 - Grupos Funcionales - ButiraldehidoDocumento14 páginasPractica - 5 - Grupos Funcionales - ButiraldehidoTzirathAún no hay calificaciones
- RedoxDocumento9 páginasRedoxEstephani CerveraAún no hay calificaciones
- Informe QuímicaDocumento13 páginasInforme QuímicaXAVIER ISRAEL CHANCUSIG QUILUMBAAún no hay calificaciones
- Practica 4 Practica 4Documento15 páginasPractica 4 Practica 4ethan pamatzAún no hay calificaciones
- HIDROGENODocumento15 páginasHIDROGENOYessica Diaz LimaAún no hay calificaciones
- Reporte 5 Quimica 4 Soluciones 1Documento17 páginasReporte 5 Quimica 4 Soluciones 1Fernando de LeonAún no hay calificaciones
- UuuuyDocumento7 páginasUuuuyNayeli Montemayor AlvaradoAún no hay calificaciones
- Previo No.4 Organica2Documento5 páginasPrevio No.4 Organica2Fanny MartínezAún no hay calificaciones
- DocumentoDocumento2 páginasDocumentoAnjela SantosAún no hay calificaciones
- Pre Lab 1 AQIDocumento13 páginasPre Lab 1 AQIJavier Alejandro Contreras PachecoAún no hay calificaciones
- Preinforme e Informe Quimica FinalDocumento24 páginasPreinforme e Informe Quimica Finalwilliam rodriguezAún no hay calificaciones
- Presentación Volumetría Oxido-ReducciónDocumento21 páginasPresentación Volumetría Oxido-ReducciónJosé ErizaAún no hay calificaciones
- Resumen de Volumetría RedoxDocumento2 páginasResumen de Volumetría RedoxBrayanAún no hay calificaciones
- VolLetrías REDOXDocumento28 páginasVolLetrías REDOXALEX DANTE MENDOZA JARAAún no hay calificaciones
- Proceso de Producción de NaOHDocumento10 páginasProceso de Producción de NaOHJaneth LozgAún no hay calificaciones
- Obtencion Butiraldehido Por Oxidación de N-ButanolDocumento12 páginasObtencion Butiraldehido Por Oxidación de N-ButanolGibrán Ramirez GarcíaAún no hay calificaciones
- Trabajo Escrito AnaliticaDocumento10 páginasTrabajo Escrito AnaliticaAna ArizalAún no hay calificaciones
- CatalizadoresDocumento3 páginasCatalizadoresJorge RamosAún no hay calificaciones
- CATALIZADORESDocumento3 páginasCATALIZADOREScarolina giraldoAún no hay calificaciones
- Butanal FuncionalesDocumento16 páginasButanal FuncionalesJavier BarraganAún no hay calificaciones
- Unidad #8 Volumetrias RedoxDocumento8 páginasUnidad #8 Volumetrias RedoxPamela Hilari TiconaAún no hay calificaciones
- Práctica 5Documento10 páginasPráctica 5Andress GonzálezAún no hay calificaciones
- Laboratorio de Química Orgánica: Identificación de Aldehídos Y CetonasDocumento20 páginasLaboratorio de Química Orgánica: Identificación de Aldehídos Y CetonasWitman PayajoAún no hay calificaciones
- Quimica AldehïdosDocumento13 páginasQuimica AldehïdosErick AguileraAún no hay calificaciones
- Alcohol EsDocumento37 páginasAlcohol EskarynwblablaAún no hay calificaciones
- La Química OrgánicaDocumento26 páginasLa Química OrgánicapaolaAún no hay calificaciones
- Aldehidos y CetonasDocumento4 páginasAldehidos y CetonasMayra Janette Jane SkłodowskaAún no hay calificaciones
- FormaldehídoDocumento2 páginasFormaldehídoYordi PonceAún no hay calificaciones
- XilenoDocumento37 páginasXilenoYinnaAquim0% (1)
- AldehidosDocumento10 páginasAldehidosJean Carlos QvisPeAún no hay calificaciones
- Guía Grupos FuncionalesDocumento20 páginasGuía Grupos FuncionalesNOBODYAún no hay calificaciones
- Reacciones de Aldehidos y CetonasDocumento11 páginasReacciones de Aldehidos y CetonasAlex CubaAún no hay calificaciones
- Aldehidos y CetonasDocumento4 páginasAldehidos y Cetonastigres1212Aún no hay calificaciones
- Practica 5 Quimica Organica IiDocumento22 páginasPractica 5 Quimica Organica IiTatiana DelesmaAún no hay calificaciones
- Reacciones de Cetonas y AldehidosDocumento3 páginasReacciones de Cetonas y AldehidosDiego Espinoza CoronelAún no hay calificaciones
- Aldehídos y Óxido de EtilenoDocumento10 páginasAldehídos y Óxido de EtilenoStEfy SabandoAún no hay calificaciones
- Tema de ExposiciónDocumento3 páginasTema de ExposiciónJuanAún no hay calificaciones
- AldehídosDocumento10 páginasAldehídosFatima100% (1)
- Grupo 2-Act 5Documento14 páginasGrupo 2-Act 5Angiela LZAún no hay calificaciones
- Actividad 3 Nomenclatura de Aldehídos, Cetonas y Ácidos CarboxílicosDocumento5 páginasActividad 3 Nomenclatura de Aldehídos, Cetonas y Ácidos CarboxílicosJesus SanchezAún no hay calificaciones
- Aldehidos y Cetonas SusselDocumento11 páginasAldehidos y Cetonas Susselsussel badayAún no hay calificaciones
- Pactica de LaboratorioDocumento19 páginasPactica de LaboratorioedisonAún no hay calificaciones
- UNDÉCIMODocumento91 páginasUNDÉCIMOvalentinaAún no hay calificaciones
- Obtencion de N - Z - Fenilmetilen AnilinaDocumento5 páginasObtencion de N - Z - Fenilmetilen AnilinaJuanDavidPBAún no hay calificaciones
- Prueba de QuimicaDocumento5 páginasPrueba de QuimicaJohan Alx RianhosAún no hay calificaciones
- Reglas de La IUPAC 2Documento12 páginasReglas de La IUPAC 2José Antonio García-Olveros GonzálezAún no hay calificaciones
- Propiedades y Reacciones de Los Aldehidos y CetonasDocumento9 páginasPropiedades y Reacciones de Los Aldehidos y CetonasSamuel Fernando DelgadoAún no hay calificaciones
- Clase 2-Aldehidos y CetonasDocumento38 páginasClase 2-Aldehidos y CetonasC C Joze G AdoAún no hay calificaciones
- Libro Ultimo QuimicaDocumento210 páginasLibro Ultimo Quimicaprografic.3020Aún no hay calificaciones