Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Metabolismo Intermedio...
Cargado por
Dalia Lucana0 calificaciones0% encontró este documento útil (0 votos)
10 vistas18 páginasÁrea VETERINARIA
Título original
METABOLISMO INTERMEDIO...
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoÁrea VETERINARIA
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
10 vistas18 páginasMetabolismo Intermedio...
Cargado por
Dalia LucanaÁrea VETERINARIA
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 18
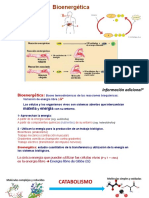
OXIDACIONES BIOLÓGICAS
Desde el punto de vista químico la oxidación se define
como la eliminación de electrones, en tanto que la
reducción es la ganancia de electrones.
Ejemplo:
En química inorgánica el H en presencia del O2 se
produce una reacción de óxido de reducción rápida y
explosiva formándose agua H2O liberándose gran
cantidad de energía.
2H2 +O2 2H2O + EE
Luego con la utilización de esa energía la reacción se
invierte descomponiéndose el H2O en sus elementos
componentes, llamado electrolisis;
EE 2H2O 2H2 +O2
En química orgánica la reacción análoga a la electrolisis al
agua es la fotosíntesis;
Luz Cloroplasto.
6CO2 + 6H2O C6H12O6 + 6O2
Reducción del CO2 Glucosa
(forma reducida = gano de electrones)
C6 H12 O6 + 6O2 6CO2 +6 H2O +EE
Enzimas y coenzimas que
intervienen en la oxidación y
reducción.
Oxidasas
Deshidrogenasas aerobia
NAD+ / NADH+H
Deshidrogenasa Anaerobia
NADP+ / NADPH
Hidroperoxidasas
Oxigenasas FAD/ FADH2
FMN/FMNH2
NAD+ / NADH+H
GLUCOSA C6H12O6 G -6 - P + 0,07KJ/mol
Hexoquinasa
OXIDACIONES BIOLÓGICAS
La bioenergética o termodinámica bioquímica, es el
estudio de los cambios de energía que acompaña a las
reacciones bioquímicas.
Los sistemas biológicos son en esencia isotérmicos y usan
energía química para impulsar procesos vivos.
En general, la Bioenergética se relaciona con la
Termodinámica, en particular con el tema de la Energía
Libre, en especial la Energía Libre de Gibbs.
Los sistemas biológicos se conforman a las leyes generales de la
termodinámica:
La primera ley de la termodinámica establece que la energía total
de un sistema, incluso sus alrededores permanece constante,
estipula que, aunque la energía se puede convertir de una forma a
otra, la energía total del sistema ha de permanecer constante.
La segunda ley de termodinámica establece que, para que un
proceso ocurra de manera espontánea, es necesario que la
entropía total de un sistema aumente.
En condiciones de temperatura y presión constantes, el vínculo
entre el cambio de energía libre (G) de un sistema que está
reaccionando y el cambio de entropía (S) se expresa por medio
de la ecuación que sigue, que combina las dos leyes de la
termodinámica.
G = H - TS
Donde H es el cambio de la entalpia (calor), T es
temperatura absoluta y S cambio de entropía. Ej:
H = -81kJ/mol G = H - TS
S = - 180 J/K G = 8100J - 298 K (-180 J/K)
T = 25 C = -81000 + 53640
= - 27360 J = -27.36KJ
El resultado de energía libre G -27.kj significa que la
reacción es espontanea.
Si G es negativa, la reacción es (espontaneo) con
pérdida de energía libre; esto es exergónica. Si además,
G es de gran magnitud, la reacción avanza casi hasta
completarse y es, en esencia, irreversible. Por otra
parte.
si G es positiva (no espontanea) la reacción solo
procede si es factible ganar energía libre, de modo que
es endergónico. Si además, G es de gran magnitud,
el sistema es estable, con poca o ninguna tendencia a
que ocurra una reacción.
Si G es igual a cero, el sistema está en equilibrio y no
tiene lugar un cambio neto.
Acoplamiento energético.
La conversión del metabolito A en el metabolito B ocurre
con liberación de energía libre para convertir en metabolito
C en el metabolito D.
A+C I B+D
Los términos exergónico y endergónicos, en lugar de
términos químicos normales “exotérmicos” y
“Endotérmicos” indican que un proceso está acompañado
de pérdida o ganancia respectivamente de energía libre en
cualquier forma no siempre como calor.
En general, el ATP o trifosfato de adenosina es la
conexión entre los sistemas que producen la energía y
los que la utilizan; la degradación oxidativa de los
alimentos es un proceso exergónico son endergónicos y
utilizan la energía química almacenada en forma de
ATP y NADH.
Ley de la conservación de la
energía.
No se crea ni se destruye energía alguna en estas
reacciones, al invertir una reacción que absorbió la
energía no se puede producir más energía de lo
almacenado inicialmente. El organismo animal utiliza
el 40% del 100% de energía producida por la oxidación
de la glucosa que es de 688.500kcal/g.
Producción y utilización de los
fosfatos.
La cantidad de energía liberada por la oxidación
completa de un alimento se llama energía libre de la
oxidación del alimento, y generalmente se representa
mediante el símbolo ∆G. La energía libre se expresa
habitualmente en calorías por mol de sustancia.
Por ejemplo, la cantidad de energía libre generada por la
oxidación de 1 mol de glucosa (180 gramos de glucosa) es
de 686.000 calorías.
El trifosfato de adenosina (ATP) es un nucleótido
compuesto químico lábil presente en todas las células y
cuya estructura química se muestra a continuación;
GRACIAS
POR SU
ATENCIÓN
También podría gustarte
- BioenergeticaDocumento15 páginasBioenergeticaEdwin Daniel Navarro ValenzuelaAún no hay calificaciones
- T10 BioenergéticaDocumento69 páginasT10 BioenergéticaAniri MaciasAún no hay calificaciones
- Bioenergética 2014-1Documento33 páginasBioenergética 2014-1Erick Ramirez del AguilaAún no hay calificaciones
- Waldorf en CasaDocumento9 páginasWaldorf en Casaarteg100% (1)
- Bioenergetica PDFDocumento20 páginasBioenergetica PDFameliaAún no hay calificaciones
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- Unidad 3. Categorias de La Clasificación Taxonómica de Suelos.Documento42 páginasUnidad 3. Categorias de La Clasificación Taxonómica de Suelos.Angela Daniela Escobar RamirezAún no hay calificaciones
- Manual de Transición Agroecológica para La Agricultura FamiliarDocumento212 páginasManual de Transición Agroecológica para La Agricultura FamiliarCristian ChamblasAún no hay calificaciones
- 4.4 RegeneracionDocumento4 páginas4.4 RegeneracionMilca Sarai Martinez AvalosAún no hay calificaciones
- Termodinamica y BioenergeticaDocumento5 páginasTermodinamica y BioenergeticaIsa OrellanaAún no hay calificaciones
- BioenergeticaDocumento27 páginasBioenergeticaFrancismar Ruiz DoranteAún no hay calificaciones
- Curso-Tuneles y Movimiento de TierrasDocumento283 páginasCurso-Tuneles y Movimiento de TierrasEfrain Mendoza100% (1)
- BioenergeticaDocumento50 páginasBioenergeticaRosMarie Tamayo67% (3)
- Resumen Quimica BiologicaDocumento87 páginasResumen Quimica BiologicaquekaAún no hay calificaciones
- Termodinamica y BioenergéticaDocumento52 páginasTermodinamica y BioenergéticaMartin BartolotteAún no hay calificaciones
- Bioenergética PDFDocumento6 páginasBioenergética PDFalexmaras95100% (1)
- Bioenergetica y Oxidacion Biologica ResumenDocumento13 páginasBioenergetica y Oxidacion Biologica ResumenPamela AquinoAún no hay calificaciones
- Tema 8 - BioenergéticaDocumento11 páginasTema 8 - BioenergéticaLara MaríaAún no hay calificaciones
- Informe 1 0.5Documento6 páginasInforme 1 0.5Daniel RebolledoAún no hay calificaciones
- Bioquimica Compuestos FosforiladosDocumento5 páginasBioquimica Compuestos FosforiladosjuergenfrankAún no hay calificaciones
- BIOENERGETICADocumento4 páginasBIOENERGETICAAbril SanbaAún no hay calificaciones
- Cap 4 Traducido CompletoDocumento10 páginasCap 4 Traducido CompletoDiego QuinterosAún no hay calificaciones
- Principios de BioenergeticaDocumento15 páginasPrincipios de BioenergeticaRuth Yeimi Ochasara FrancoAún no hay calificaciones
- Bio Energetic A 1Documento9 páginasBio Energetic A 1Rafael Paz100% (1)
- Tema 11. BIOENERGETICADocumento60 páginasTema 11. BIOENERGETICAJonathan BalancanAún no hay calificaciones
- Reacción QuímicaDocumento16 páginasReacción QuímicaCynthia GonzalesAún no hay calificaciones
- Clase IDocumento35 páginasClase IdanAún no hay calificaciones
- Tema 3 BioenergeticaDocumento58 páginasTema 3 BioenergeticaAxel IgleciasAún no hay calificaciones
- Traducción Del Anexo 1Documento10 páginasTraducción Del Anexo 1daniela Ortiz HernandezAún no hay calificaciones
- Bio Energetic ADocumento8 páginasBio Energetic AMichelle Herrera PeraltaAún no hay calificaciones
- 1 3-BioenergéticaDocumento16 páginas1 3-BioenergéticaJUanAún no hay calificaciones
- Tema 1Documento8 páginasTema 1Laura OlmiiAún no hay calificaciones
- Bqii. M1Documento37 páginasBqii. M1claudiaspam031216Aún no hay calificaciones
- BioenergeticaDocumento25 páginasBioenergeticaadolfo moralesAún no hay calificaciones
- Guía de BioenergéticaDocumento8 páginasGuía de BioenergéticaAlejandra GómezAún no hay calificaciones
- BioenergéticaDocumento8 páginasBioenergéticaVeeronica RdzAún no hay calificaciones
- Taller Bioenergetica 584532Documento9 páginasTaller Bioenergetica 584532lilia garciaAún no hay calificaciones
- Termoqu Mica 2017Documento45 páginasTermoqu Mica 2017Sarita Reina MartínezAún no hay calificaciones
- BioenergeticaDocumento15 páginasBioenergeticaIvonneGonzálezCarranza0% (1)
- Bender Murray Bioquimica Ilustrada 29a Capitulo MuestraDocumento6 páginasBender Murray Bioquimica Ilustrada 29a Capitulo MuestraAlix HernandezAún no hay calificaciones
- Semana 8 BioenergéticaDocumento42 páginasSemana 8 BioenergéticaWilliam Misme MontesinosAún no hay calificaciones
- Semana 5 BioenergéticaDocumento29 páginasSemana 5 BioenergéticaArturo Collazos MendozaAún no hay calificaciones
- Pc0 - Termodinámica (ATP y OB)Documento55 páginasPc0 - Termodinámica (ATP y OB)Bathory LunaAún no hay calificaciones
- BioenergéticaDocumento84 páginasBioenergéticaLuisAún no hay calificaciones
- Clase Bioenergetica y Metabolismo VDocumento39 páginasClase Bioenergetica y Metabolismo VVale NtinaAún no hay calificaciones
- Presentacion 1 Bioenergetica 13 de MayoDocumento23 páginasPresentacion 1 Bioenergetica 13 de MayoJubitza Paredes MamaniAún no hay calificaciones
- TERMODINÁMICA. Cap 7, Química BlancoDocumento4 páginasTERMODINÁMICA. Cap 7, Química BlancoEve ZermathenAún no hay calificaciones
- BIOQUIMICADocumento113 páginasBIOQUIMICACarolina CAún no hay calificaciones
- Tercera Entrega - CalificadaDocumento14 páginasTercera Entrega - CalificadayanethvesgaAún no hay calificaciones
- Diapositivas de Metabolismo de Carb 02Documento120 páginasDiapositivas de Metabolismo de Carb 02edwin banda roqueAún no hay calificaciones
- Bio Energetic A Enzimas Metab LCDocumento86 páginasBio Energetic A Enzimas Metab LCJesús BautistaAún no hay calificaciones
- BIOENERGETICADocumento47 páginasBIOENERGETICASofia Montiel Ochoa100% (1)
- Semana 9 BioenergéticaDocumento90 páginasSemana 9 BioenergéticaAlison YalleAún no hay calificaciones
- Tema 2 BioqDocumento13 páginasTema 2 BioqAlexandra María Marín BernalAún no hay calificaciones
- BIOENERGETICADocumento15 páginasBIOENERGETICADiegoAún no hay calificaciones
- Capitulo 12 Bioenerg MED 15Documento7 páginasCapitulo 12 Bioenerg MED 15TheBenjaxAún no hay calificaciones
- Clase 1 - BIOENERGETICA 2020Documento20 páginasClase 1 - BIOENERGETICA 2020Sandra TorelliAún no hay calificaciones
- T16 Intro BioenergeticaDocumento17 páginasT16 Intro BioenergeticaYEAG92Aún no hay calificaciones
- Antologia de BioquimicaDocumento17 páginasAntologia de BioquimicaMonica Marlene Vera BravoAún no hay calificaciones
- Clase de Enzimología Del Viernes 23 de JulioDocumento29 páginasClase de Enzimología Del Viernes 23 de JulioJhordy MamaniAún no hay calificaciones
- Unidad 1-BIOQUIMICADocumento4 páginasUnidad 1-BIOQUIMICANAHOMI GARCIA HEREDIAAún no hay calificaciones
- Metabolismo en Los MicroorganismosDocumento134 páginasMetabolismo en Los Microorganismosvanesa sanchezAún no hay calificaciones
- Esquemas Clase de BioenergeticaDocumento28 páginasEsquemas Clase de BioenergeticaLeo AlvialAún no hay calificaciones
- Chaparral DiapoDocumento19 páginasChaparral DiapoWathsonWeningerMoriFloresAún no hay calificaciones
- Introduccion y Marco Teorico de La GeomorfologiaDocumento6 páginasIntroduccion y Marco Teorico de La GeomorfologiaSebastian Vega VilleraAún no hay calificaciones
- Factor de EnsuciamientoDocumento17 páginasFactor de Ensuciamientodelux5858100% (3)
- Teorias de Evolucion 1° MediosDocumento13 páginasTeorias de Evolucion 1° MediosDANIELA SANCHEZ MARTINEZAún no hay calificaciones
- Modelamiento de FlujoDocumento141 páginasModelamiento de FlujoPedro MontesAún no hay calificaciones
- Problemas de Potencia IIDocumento2 páginasProblemas de Potencia IIXam Josh QuirozAún no hay calificaciones
- Guía 1. - Presentación de La PSU Ciencias-FísicaDocumento24 páginasGuía 1. - Presentación de La PSU Ciencias-FísicaWilfredo AlegreAún no hay calificaciones
- Tarea 3 - Grupo6Documento5 páginasTarea 3 - Grupo6Cristina AbdoAún no hay calificaciones
- Trabajo Final IARDocumento7 páginasTrabajo Final IARManuela Restrepo RoldánAún no hay calificaciones
- Cef-1701 16380778 1.1Documento6 páginasCef-1701 16380778 1.1Eros GarciaAún no hay calificaciones
- RENDIMIENTO DE LA MOTONIVELADORA - ModificadoDocumento5 páginasRENDIMIENTO DE LA MOTONIVELADORA - ModificadoJorge Gutierrez BalderramaAún no hay calificaciones
- Materiales Conductores, Semiconductores y Superconductores (Autoguardado)Documento41 páginasMateriales Conductores, Semiconductores y Superconductores (Autoguardado)QcHeAún no hay calificaciones
- Guía No. 15 Gestión Ambiental y SSTDocumento11 páginasGuía No. 15 Gestión Ambiental y SSTSergio RomeroAún no hay calificaciones
- Soluciones QuimicaDocumento3 páginasSoluciones Quimicajuan perdomoAún no hay calificaciones
- Depósitos de ETRDocumento8 páginasDepósitos de ETRJosé Patricio Ortega RojasAún no hay calificaciones
- Sesión Martes 10 Agosto - IrinaaaaaaDocumento5 páginasSesión Martes 10 Agosto - IrinaaaaaaJoseMartinYesquenBancesAún no hay calificaciones
- Geografia de AmericaDocumento8 páginasGeografia de AmericaIvan GamarraAún no hay calificaciones
- Guía No.1. Medio Ambiente Séptimos.Documento4 páginasGuía No.1. Medio Ambiente Séptimos.Luisa LopezAún no hay calificaciones
- MRRD - Progreso 12Documento35 páginasMRRD - Progreso 12anon_361069274100% (2)
- VitalismoDocumento11 páginasVitalismoCarlos BeltranAún no hay calificaciones
- Physics Paper 1 SL SpanishDocumento15 páginasPhysics Paper 1 SL SpanishGonzalo Pastor0% (2)
- Material de Laboratorio y DensidadDocumento8 páginasMaterial de Laboratorio y DensidadpatiAún no hay calificaciones
- Calculo de Ciclo RankineDocumento5 páginasCalculo de Ciclo RankineSanti Romero BonillaAún no hay calificaciones
- La Energía Nuclear PDFDocumento8 páginasLa Energía Nuclear PDFgiseAún no hay calificaciones
- Fisica Cuantica Problemas ResueltosDocumento17 páginasFisica Cuantica Problemas ResueltosLiz DominguezAún no hay calificaciones