Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Trabajo de Quimica N°4
Cargado por
LUIS FERNANDO FONSECA COYLADescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Trabajo de Quimica N°4
Cargado por
LUIS FERNANDO FONSECA COYLACopyright:
Formatos disponibles
IAF-I-A QUIMICA GENERAL
CARRERA PROFESIONAL DE INGENIERIA AMBIENTAL Y FORESTAL
IAF-I-A QUIMICA GENERAL
INFORME:04
GRUPO: 5
TEMA: ENLACE QUÍMICO
DOCENTE:
Mg. JESÚS LUZMILA BENIQUE CARREÓN
PRESENTADO POR:
FLORES SANCHEZ DARLYN V
FONSECA COYLA LUIS FERNANDO
FUENTES CHURA YURI ADRIAN
GAUNA HUARCAYA LHUZ NIDIA
FECHA DE ENTREGA: 03/11/2021
CICLO: I
JULIACA – PERU
2021
CARRERA PROFESIONAL DE INGENIERIA AMBIRNTAL Y FORESTAL Página 1
IAF-I-A QUIMICA GENERAL
PRÁCTICA N° 04
ENLACE QUÍMICO
I. LOGRO:
• Determinar la diferencia entre un enlace iónico, covalente y metálico.
• Comprobar la relación entre el enlace químico y la propiedad de la sustancia
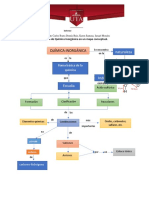
II. FUNDAMENTO TEÓRICO
CARRERA PROFESIONAL DE INGENIERIA AMBIRNTAL Y FORESTAL Página 2
IAF-I-A QUIMICA GENERAL
I. PROCEDIMIENTO EXPERIMENTAL
Experiencia Nº 01: Solubilidad frente al agua.
• Colocar 10 ml de agua destilada en vaso de precipitado y agregar 4 ml de la
sustancia, realizar para cada una de las sustancias, observar para sus resultados.
SOLUBLE INMISIBLE INSOLUBLE SOLUBLE SOLUBLE INMISIBLE
La solubilidad o Insolubilidad de estos compuestos se deben a sus enlaces químicos por lo tanto también a
sus propiedades. Los compuestos como el Sulfato de Cobre, el Cloruro de Sodio y el Ácido Clorhídrico se
disuelven más fácilmente en el Agua Destilada por ambos (soluto y solvente) son de naturaleza apolar, es
decir, sus enlacen se rompen para formar nuevos compuestos. Mientras que el Tetracloruro de Carbono, el
Benceno y las Virutas de Aluminio son compuestos polares, por lo tanto, no se disuelven en el Agua Destilada
ya que no son semejantes y no existe suficiente energía como para vencer las fuerzas de atracción entre los
átomos.
Experiencia N°2: Conductividad eléctrica.
• Con la ayuda de un equipo de Conductividad eléctrica, determine su actividad en las diferentes
soluciones preparadas.
Equipo de conductividad
Si le damos un medio para que puedan
pasar los electrones el foco se encenderá.
• De las siguientes soluciones: cloruro de sodio 1 N, ácido clorhídrico 1N, sulfato cúprico 1 N, además:
bencina, alcohol, azúcar y agua de caño.
(NaCL) solido=es conductor eléctrico (HCL) es conductor (CuSO4) es conductor
(NaCL) disuelto en agua=es conductor eléctrico eléctrico
eléctrico
CARRERA PROFESIONAL DE INGENIERIA AMBIRNTAL Y FORESTAL Página 3
IAF-I-A QUIMICA GENERAL
(Alcohol) no conduce la (Agua de caño) poco, pero (Azúcar) no es un conductor
electricidad, no tiene iones si conduce electricidad de electricidad
• Introducir los electrodos de carbón o cobre en las soluciones a una profundidad siempre uniforme.
Si tiene conductividad, que liberan
iones, cationes y aniones
RESULTADOS:
Compuesto Formula Solubilidad Tipo de enlace
Sulfato cúprico SuSO4 Soluble Iónico
Tetracloruro de carbono CCl4 Insoluble Apolar
Benceno C6H6 Insoluble Apolar
Cloruro de sodio NaCl Soluble Iónico
Ácido Clorhídrico HCl Soluble Iónico
Aluminio Al Insoluble Apolar
Experimento Nº02: Conductividad eléctrica de las soluciones preparadas.
Compuesto Conducti Iones COMP. COVALEN ELECTRÓLITO
vidad
NO
POLAR APOLAR FUERTE DÉBIL ELECTRÓL
Cobre
Si Cu+ --------- ---------- Si -------- ----------
Agua
destilada No ------------- --------- Si ---------- --------- Si
-
Agua potable Si
Parcialmente No Si ----------- --------- Si -----------
Sulfato sodio +
Si -2 ---------- ----------- Si ---------- -------------
Na
SO4
CARRERA PROFESIONAL DE INGENIERIA AMBIRNTAL Y FORESTAL Página 4
IAF-I-A QUIMICA GENERAL
Cloruro de sodio +
Si _ ----------- ----------- Si ---------- --------------
Na Cl
Ácido clorhídrico +
Si _ ----------- ----------- Si --------- --------------
H Cl
Benceno
No --------------- --------- Si ------------ ----------- Si
--- -
Tetracloruro de
carbono No --------------- --------- Si ------------ ---------- Si
---- -
Etanol
No --------------- --------- Si ------------ ---------- Si
---- -
papa Contiene
Si agua + sal y ---------- ---------- Si --------- --------------
rompen en
iones +
_
Na
Cl
Zumo de limón
Si ------------- ---------- ------------ Si ---------- ---------------
---
V. CUESTIONARIO:
1. Represente las estructuras de Lewis de los compuestos: SO4-2, H3PO4 e indique los, enlaces
sigma, pi, coordinados que existe y carga forma en cada uno de ellos.
SO4-2 N° e- (v)= 6+6(4)+2 = 32 e-
N° e- (8)= (6+6)+4(8)= 44 e-
N° e- (enl) = 44 – 32 = 12 e- = 5pares
N° e- (no enl) = 32-12= 20 e-=10pares
Enlaces sigma=4, enlace pi=2, enlace coordinados=0.
H3PO4 N°e-(v)= 1(3)+5(1)+4(6)=32
N°e-(8)= 5(8)+3(2)= 44
N°e-(enl)= 46-32 =14= 7pares
N°e-(no enl)= 32-14= 18e- =9pares
Enlaces sigma=6, enlace pi=0, enlace coordinados=1.
2. Indique que moléculas no obedecen la regla del octeto.
a) BCl3 b) PCl3 c) CF4
ya que las configuraciones electrónicas de los elementos son
CARRERA PROFESIONAL DE INGENIERIA AMBIRNTAL Y FORESTAL Página 5
IAF-I-A QUIMICA GENERAL
3. Cuantos enlaces covalentes coordinados podría formar la molécula de agua? Demuestre.
Los enlaces covalentes coordinados se dan cuando un átomo brinda sus dos electrones
para enlazar a otro átomo.
4. Con respecto a las moléculas: NO3- y HClO3. ¿Cuál será la proposición incorrecta?
a) En el ion (NO3-), hay dos enlaces sigma y un enlace coordinado. (V)
b) Al átomo de cloro le rodean 12 electrones, tres enlaces sigma y un enlace pi (F)
Hay dos enlaces pi no uno
c) De las dos moléculas uno de ellos presenta un par de electrones libres más. (V)
d) Las dos moléculas presentan enlace covalente múltiple. (V)
BIBLIOGRAFIA
Jara, C. y Cueva R. (2001). Problemas de Química y como resolverlos. Lima: RACSO
EDITORES.
Jerome L. y Lawrence M. (2000). Química General. Madrid: Lito Camargo.
https://www.youtube.com/watch?v=kDz3sOwp_wA&t=1s
https://youtu.be/fN--5xKvizQ
https://youtu.be/0yTMd9xfzDc
CARRERA PROFESIONAL DE INGENIERIA AMBIRNTAL Y FORESTAL Página 6
También podría gustarte
- Hidróxido de CalcioDocumento16 páginasHidróxido de CalcioLuisaFernandaSalazar80% (5)
- Propiedades de Los CarbohidratosDocumento12 páginasPropiedades de Los CarbohidratosNancy FonsecaAún no hay calificaciones
- Revista Química OrgánicaDocumento43 páginasRevista Química Orgánicaelena mciiAún no hay calificaciones
- Electrobeneficio de CobrepaolaDocumento21 páginasElectrobeneficio de CobrepaolaLibros Argón100% (1)
- Cianuracion Del OroDocumento105 páginasCianuracion Del OroCristhian Rodriguez RomaníAún no hay calificaciones
- Informe de Laboratorio Cationes Del Grupo 4Documento17 páginasInforme de Laboratorio Cationes Del Grupo 4Neper Torres67% (3)
- Informe 6 Hidrocarburos OrganicaDocumento11 páginasInforme 6 Hidrocarburos OrganicaYuli ZárateAún no hay calificaciones
- TECNICAS HIDROMETALURGIA Parte1Documento50 páginasTECNICAS HIDROMETALURGIA Parte1Leonel Dotta50% (2)
- Informe Pract 2 . - Evaluación y Estudio Fisicoquímico de AguaDocumento25 páginasInforme Pract 2 . - Evaluación y Estudio Fisicoquímico de AguaCESAR TABACOAún no hay calificaciones
- Practica 5 Oxido-ReduccionDocumento9 páginasPractica 5 Oxido-Reduccionrest relax100% (1)
- Cuestionario de Enlace Quimico1Documento4 páginasCuestionario de Enlace Quimico1202311908Aún no hay calificaciones
- Informe 33333333333333333333333333Documento20 páginasInforme 33333333333333333333333333Dafne Flores MendozaAún no hay calificaciones
- INTRODUCCIÓNDocumento6 páginasINTRODUCCIÓNAyrton Creus BocanegraAún no hay calificaciones
- Reporte Práctica 3 Enlace QuímicoDocumento3 páginasReporte Práctica 3 Enlace QuímicoPAUL OWUEN MOYA SILENCIOAún no hay calificaciones
- EstequiometriaDocumento7 páginasEstequiometriaGerson JPAún no hay calificaciones
- Practica #3 Enlace QuimicoDocumento11 páginasPractica #3 Enlace QuimicoVANESSA VEGA CASTILLOAún no hay calificaciones
- Azufre Y Sulfuros: I. Marco TeóricoDocumento9 páginasAzufre Y Sulfuros: I. Marco TeóricoJoaquin Leonardo Ochoa NuñezAún no hay calificaciones
- Practica #7 Enlace QuimicoDocumento2 páginasPractica #7 Enlace QuimicoGIANELLA DARLA ROMERO CUBILLASAún no hay calificaciones
- Guía de Práctica Laboratorio - Quimica General 2022-2Documento10 páginasGuía de Práctica Laboratorio - Quimica General 2022-2Jossue MolinaAún no hay calificaciones
- Grupos IA y IIA Tabla PeriódicaDocumento4 páginasGrupos IA y IIA Tabla PeriódicaJose Cartagena ZubietaAún no hay calificaciones
- Laboratorio 5Documento6 páginasLaboratorio 5Charlton H. Pretel D.Aún no hay calificaciones
- Prácticas de Quimica Organica CarrascoDocumento21 páginasPrácticas de Quimica Organica CarrascoMariano Montalvo FonsecaAún no hay calificaciones
- PRÁCTICA No 6Documento13 páginasPRÁCTICA No 6KulieAún no hay calificaciones
- Guia 2 Compuestos Oxigenados IDocumento6 páginasGuia 2 Compuestos Oxigenados IGeorgie VegaAún no hay calificaciones
- AcidosDocumento37 páginasAcidosJimena EchevarriaAún no hay calificaciones
- Reporte #3 - Grupo 8Documento3 páginasReporte #3 - Grupo 8JEREMY ANDRE LOA BENITESAún no hay calificaciones
- PRACTICA QUIMICA - CONDUCTIVIDAD, SOLUB. Y P. FUSION Hugo04Documento9 páginasPRACTICA QUIMICA - CONDUCTIVIDAD, SOLUB. Y P. FUSION Hugo04hugoloaiza880Aún no hay calificaciones
- Cianuro de PotasioDocumento7 páginasCianuro de PotasioSteeven OrdoñezAún no hay calificaciones
- Tema 8.1 Aldehidos y Cetonas, Estructura Molecular, Grupo Carbonilo, Propiedades FisicasDocumento19 páginasTema 8.1 Aldehidos y Cetonas, Estructura Molecular, Grupo Carbonilo, Propiedades FisicasYELMAR ALVARADO GUTIERREZAún no hay calificaciones
- Informe 4 - Química General - PrácticaDocumento6 páginasInforme 4 - Química General - PrácticaMelania Ghisel Sanchez HerasAún no hay calificaciones
- PM II 5o REACTIVOS MODIFICADORESDocumento55 páginasPM II 5o REACTIVOS MODIFICADORESPaulina Diaz Diaz100% (1)
- Practica #9 Acidos Carboxilicos Sintesis y PropiedadesDocumento11 páginasPractica #9 Acidos Carboxilicos Sintesis y PropiedadesFRANCISCO RAMON CHAVEZ RIEGA0% (1)
- Problemas RESUELTOS de PrecipitacionDocumento17 páginasProblemas RESUELTOS de PrecipitacionA Ver Pacheco100% (1)
- Hidroxido de CalcioDocumento16 páginasHidroxido de CalcioBryhan Padillo cuevaAún no hay calificaciones
- Labo 5Documento11 páginasLabo 5Jhoel CornejoAún no hay calificaciones
- Práctica #2Documento11 páginasPráctica #2Sebas SoriaAún no hay calificaciones
- Cuestionario 6 - Óxido-ReducciónDocumento4 páginasCuestionario 6 - Óxido-ReducciónAdalid Leonela AdalidAún no hay calificaciones
- Guia Practica QuimicaDocumento9 páginasGuia Practica QuimicaKathi VCAún no hay calificaciones
- Informe de Laboratorio 3 IMPRIMIRDocumento9 páginasInforme de Laboratorio 3 IMPRIMIRDaisuke BasadoAún no hay calificaciones
- Teoria Reacc. Por HumedaDocumento9 páginasTeoria Reacc. Por HumedaSilvy CastilloAún no hay calificaciones
- Practica #9 Acidos Carboxilicos Sintesis y PropiedadesDocumento29 páginasPractica #9 Acidos Carboxilicos Sintesis y PropiedadesAllison ArcanaAún no hay calificaciones
- Tema 14Documento31 páginasTema 14Andrea Carolina Smith FernandezAún no hay calificaciones
- Guia 5 Reconocimiento Alcoholes Aldehidos CetonaDocumento6 páginasGuia 5 Reconocimiento Alcoholes Aldehidos CetonaDanielpsebastianAún no hay calificaciones
- Práctica 1 Electrolisis - Eq#1Documento17 páginasPráctica 1 Electrolisis - Eq#1Ramos Carpio RosarioAún no hay calificaciones
- DETALLES EXPERIMENTALES A y BDocumento5 páginasDETALLES EXPERIMENTALES A y BerickAún no hay calificaciones
- Trabajo Practico Enlace y NomenclaturaDocumento3 páginasTrabajo Practico Enlace y NomenclaturaJesus MamaniAún no hay calificaciones
- Informe de Laboratorio 3 IMPRIMIRDocumento8 páginasInforme de Laboratorio 3 IMPRIMIRCarolAlvarado0% (1)
- Información Previa Prácticas 14 y 15Documento8 páginasInformación Previa Prácticas 14 y 15castro Hernandez EliothAún no hay calificaciones
- Unidadiii 130510173913 Phpapp02Documento64 páginasUnidadiii 130510173913 Phpapp02Job Valle MezaAún no hay calificaciones
- Falta CuadroDocumento10 páginasFalta CuadroWalter Obregón SánchezAún no hay calificaciones
- Laboratorio 7 - Química GeneralDocumento8 páginasLaboratorio 7 - Química GeneralestefanyAún no hay calificaciones
- Problemas RESUELTOS PrecipitacionDocumento37 páginasProblemas RESUELTOS PrecipitacionSuzy KuticuteAún no hay calificaciones
- GUÍA No.04 RECONOCIMIENTO DE TIPO DE ENLACEDocumento22 páginasGUÍA No.04 RECONOCIMIENTO DE TIPO DE ENLACERichard Arevalo100% (1)
- Cationes IaDocumento29 páginasCationes IaWilson David EnriquezAún no hay calificaciones
- Enlace Quimico y Reactividad - Laboratorio 4Documento5 páginasEnlace Quimico y Reactividad - Laboratorio 4Diego Guillen Garcia100% (1)
- Informe 1 Precipitación, Filtración y SecadoDocumento5 páginasInforme 1 Precipitación, Filtración y SecadoireneAún no hay calificaciones
- Enlace KimikoDocumento8 páginasEnlace KimikoJazmin Avalos MaldonadoAún no hay calificaciones
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADe EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAAún no hay calificaciones
- Solubilidad de Compuestos OrgánicosDocumento12 páginasSolubilidad de Compuestos OrgánicosAimeé Jimena Alfaro ReyesAún no hay calificaciones
- Sintesis y Caracterización Del TrioxalatoferratoIII de PotasioDocumento13 páginasSintesis y Caracterización Del TrioxalatoferratoIII de Potasiokevin smithAún no hay calificaciones
- Práctica 1 y 2 de Elaboración de JabónDocumento10 páginasPráctica 1 y 2 de Elaboración de JabónAngela MendozaAún no hay calificaciones
- Coleccion Minerales Instituto Geologia UNAMDocumento47 páginasColeccion Minerales Instituto Geologia UNAMMarco Antonio Cabrera PenicheAún no hay calificaciones
- InformeDocumento3 páginasInformeCarlos IbarraAún no hay calificaciones
- Biotecnología Aplicado A MineríaDocumento27 páginasBiotecnología Aplicado A Mineríanlinaresg100% (8)
- DibenzalacetonaDocumento6 páginasDibenzalacetonaWilliam VilelaAún no hay calificaciones
- Unidad 4 Componentes No Carbonosos Del Petroleo-ComprimidoDocumento28 páginasUnidad 4 Componentes No Carbonosos Del Petroleo-ComprimidoMaryzol Cruz DuranAún no hay calificaciones
- Cómo Funcionan Las Bolsas Térmicas de Acetato SódicoDocumento4 páginasCómo Funcionan Las Bolsas Térmicas de Acetato SódicoAnonymous jQLTsOAún no hay calificaciones
- ClorometilDocumento2 páginasClorometilmarita3yahuana3guerr100% (1)
- Unidadii Aminoacidos Peptidos Proteinas 21268 PDFDocumento52 páginasUnidadii Aminoacidos Peptidos Proteinas 21268 PDFColín Poblete BaezaAún no hay calificaciones
- Lluvia ÁcidaDocumento2 páginasLluvia ÁcidaAlberto LepelAún no hay calificaciones
- Fosfolípidos en Capa FinaDocumento2 páginasFosfolípidos en Capa FinaLore WorsnopAún no hay calificaciones
- Competencia Aux Qmc-2018Documento6 páginasCompetencia Aux Qmc-2018Nina Yujra Ramiro100% (2)
- Nomenclatura y Grupos FuncionalesDocumento167 páginasNomenclatura y Grupos Funcionalesjuan100% (1)
- Sqc-33954 Energias Industriales S ADocumento21 páginasSqc-33954 Energias Industriales S AJAVIERA VERA AVALOSAún no hay calificaciones
- Tratamiento Del AguaDocumento10 páginasTratamiento Del AguaGugui MagunaAún no hay calificaciones
- Analisis Cualitativo de AnionesDocumento20 páginasAnalisis Cualitativo de AnionesWenceslao Andres Garcia GutierezAún no hay calificaciones
- Fundamentos BiorremediacionDocumento5 páginasFundamentos BiorremediacionVictor GalanAún no hay calificaciones
- Taller de Quimica Noveno I PeriodoDocumento4 páginasTaller de Quimica Noveno I Periodo09C JUAN MIGUEL SOSSA MARTINEZAún no hay calificaciones
- 3-Hidrocarburos InsaturadosDocumento40 páginas3-Hidrocarburos InsaturadosRicarda Montoya MundoAún no hay calificaciones
- Compuestos Organicos NitrogenadosDocumento8 páginasCompuestos Organicos Nitrogenadosjhonatan cobosAún no hay calificaciones
- Unidad IVDocumento35 páginasUnidad IVJacqueline Hernandez HernandezAún no hay calificaciones
- MetalurgiaDocumento3 páginasMetalurgiafredmanAún no hay calificaciones
- 1G Química AplicadaDocumento5 páginas1G Química AplicadaNatalia Ordenes100% (2)
- Química Orgánica Guia#2Documento6 páginasQuímica Orgánica Guia#2EduardoPerezAún no hay calificaciones
- Practica #1 Condensación AldolicaDocumento9 páginasPractica #1 Condensación Aldolicadavhen OcampoAún no hay calificaciones
- Teoría de Lewis. Equipo 3Documento14 páginasTeoría de Lewis. Equipo 3Arianeth chamanAún no hay calificaciones
- Práctica 4Documento6 páginasPráctica 4Fabiola DannaAún no hay calificaciones