Documentos de Académico
Documentos de Profesional
Documentos de Cultura
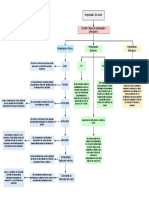
Propiedades Coligativas
Cargado por
ANGIE DEYANIRA SUAREZ MEDINADescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Propiedades Coligativas
Cargado por
ANGIE DEYANIRA SUAREZ MEDINACopyright:
Formatos disponibles
Experimentación 11
DETERMINACIÓN DE LA MASA MOLAR DEL
AZUFRE
Experimentación 11
Laboratorio De Química General II
Ciclo Escolar: 2022 B
Alumna: Angie Deyanira Suarez Medina
Código: 218811537
Sección: 3
Angie Deyanira Suarez Medina
Código: 218811537
Laboratorio de Química General II, Sección 3
12 de noviembre de 2022
Página|1
Experimentación 11
DETERMINACIÓN DE LA MASA MOLAR DEL AZUFRE
Objetivo
Determinar la masa molar del azufre y proponer su fórmula molecular por medio del
descenso del punto de congelación de una disolución de azufre/alcanfor.
Fundamentos
Algunas propiedades físicas de las disoluciones presentan diferencias importantes
respecto a las del disolvente puro. Por ejemplo, el agua pura se congela a 0ºC, pero
las disoluciones acuosas se congelan a temperaturas más bajas. El abatimiento del
punto de congelación y la elevación del punto de ebullición son ejemplos de
propiedades físicas de las disoluciones que dependen de la cantidad
(concentración) pero no del tipo o la identidad de las partículas de soluto. Tales
propiedades de denominan propiedades coligativas. (Coligativo significa “que
depende de la colección”; las propiedades coligativas dependen del efecto colectivo
del número de partículas de soluto.) (Brown et al. 2004, p.502)
Cuando una disolución se congela, lo usual es que se separen cristales de
disolvente puro; las moléculas de soluto normalmente no son solubles en la fase
sólida del disolvente. (Brown et al. 2004, p.506)
Los químicos han utilizado el conjunto de propiedades coligativas, disminución de
la presión de vapor, descenso del punto de congelación, elevación del punto de
ebullición, y la presión osmótica, para cálculos de masas moleculares el punto de
congelación puede utilizarse para calcular una masa molar y, con información
adicional, una fórmula molecular. Para ayudar a comprender cómo se hace esto, se
presenta un procedimiento de tres etapas en forma de respuestas a tres cuestiones
separadas. En otros casos, debe estar dispuesto a desarrollar su propio
procedimiento en etapas. La precisión del método del descenso del punto de
congelación puede mejorarse utilizando un disolvente con un valor mayor. (Petrucci
et al.2011, p.582)
El punto de congelación de un líquido es la temperatura a la cual las fuerzas de
atracción entre las moléculas son lo suficientemente grandes como para superar su
Angie Deyanira Suarez Medina
Código: 218811537
Laboratorio de Química General II, Sección 3
12 de noviembre de 2022
Página|2
Experimentación 11
energía cinética y causar un cambio de fase del estado líquido al estado sólido. En
términos estrictos, el punto de congelación (fusión) de una sustancia es la
temperatura a la cual las fases sólida y líquida se encuentran en equilibrio. Cuando
una solución diluida se congela, el solvente es el primero que comienza a
solidificarse y el soluto queda en una solución más concentrada. En una solución,
las moléculas de solvente se encuentran un poco más separadas entre sí (por la
presencia de las partículas de soluto) de lo que estarían en el solvente puro. En
consecuencia, la temperatura de la solución debe estar por debajo del punto de
congelación del solvente puro para poder congelarse. Se ha encontrado que la
depresión del punto de congelación ∆𝑇𝑓 de las soluciones no electrolíticas es igual a
la molalidad del soluto multiplicada por una constante de proporcionalidad que
recibe el nombre de constante de depresión del punto de congelación 𝐾𝑓 . (La f en el
símbolo 𝐾𝑓 corresponde al inglés freezing: “congelación”). Por lo tanto la depresión
del punto de congelación se describe ∆𝑇𝑓 = 𝐾𝑓 𝑚. (Whitten et al. 2015, p.525)
Proceso experimental
Se pesaron en la balanza analítica 5.00 g de alcanfor utilizando una capsula de
plástico y en otra capsula se pesó 0.150 g de azufre; se colocó en un tubo la masa
de alcanfor y se colocó en baño de aceite, se insertó un termómetro cuidando que
el bulbo quedara rodeando el alcanfor. se calentó lentamente hasta fundir todo el
alcanfor, se suspendió el calentamiento y se registró la temperatura cuando el
alcanfor empezó a solidificar, en seguida se agregó el azufre y se volvió a calentar
a baño de aceite, cuando fundió la mezcla, se homogenizó y se dejó calentar, en
seguida se registró la temperatura cuando empezó a solidificar.
Resultados y discusión
Por medio del descenso del punto de congelación de una disolución de azufre y
alcanfor, se obtuvo como masa molar del azufre 168 mol y S5 como fórmula
molecular.
Conclusiones
Se determinó que la masa molar del azufre fue de 168 mol y la formula molecular
del azufre fue S5
Angie Deyanira Suarez Medina
Código: 218811537
Laboratorio de Química General II, Sección 3
12 de noviembre de 2022
Página|3
Experimentación 11
Referencias bibliográficas
Brown, T. L., LeMay, H. E., Bursten, B. E. & Burdge, J. R. (2004). Quimica.
En La ciencia central (9.a ed.). PEARSON EDUCACIÓN
Petrucci, R. H., Herring, F. G., Madura, J. D., & Bissonnette, C. (2011).
Química General (10a Edición). Patience Hall, Madrid.
Whitten, K. W., DAVIS, R. E., PECK, M. L. & STANLEY, G. G. (2015).
Química. En Quimica (10.a ed.). Cengage Learning.
Angie Deyanira Suarez Medina
Código: 218811537
Laboratorio de Química General II, Sección 3
12 de noviembre de 2022
Página|4
También podría gustarte
- Informe 6 - Propiedades ColigativasDocumento3 páginasInforme 6 - Propiedades ColigativasEmma with Double MAún no hay calificaciones
- Informe 10 CriosDocumento7 páginasInforme 10 CriosMi LeAún no hay calificaciones
- Informe Nº5 de General II (Propiedades Coligativas)Documento16 páginasInforme Nº5 de General II (Propiedades Coligativas)AldoCabreraFernandez87% (23)
- Curba de SolubilidadDocumento8 páginasCurba de SolubilidadAnonymous OpqYVA2Bq100% (2)
- Informe 2 Propiedades Coligativas.Documento6 páginasInforme 2 Propiedades Coligativas.CAMILO ANDRES MELO CISNEROSAún no hay calificaciones
- Lab. Propiedades ColigativasDocumento2 páginasLab. Propiedades ColigativasMarithza Yadira Galindo LozanoAún no hay calificaciones
- Crioscopia 1Documento7 páginasCrioscopia 1Gatita CrissAún no hay calificaciones
- PDF Articulo 3 Determinacion de La Curva de Solubilidad para Nitrato de Potasio y Otra Sal - CompressDocumento11 páginasPDF Articulo 3 Determinacion de La Curva de Solubilidad para Nitrato de Potasio y Otra Sal - CompressBrenda RuizAún no hay calificaciones
- Reporte de Lab - Práctica 3 - Brig 2 - Equipo 7 - IamDocumento16 páginasReporte de Lab - Práctica 3 - Brig 2 - Equipo 7 - IamXimena RubioAún no hay calificaciones
- Solutos en Agua (Alimentos)Documento8 páginasSolutos en Agua (Alimentos)Karen FavelaAún no hay calificaciones
- Reporte #2 A.cuantitativoDocumento25 páginasReporte #2 A.cuantitativoTatianaGodínezMarroquínAún no hay calificaciones
- Descenso CrioscopicoDocumento5 páginasDescenso Crioscopicorafael valdes manguAún no hay calificaciones
- SOLUBILIDADDocumento13 páginasSOLUBILIDADAntonio TorresAún no hay calificaciones
- Taller de Ingenieria D.A IVDocumento6 páginasTaller de Ingenieria D.A IVbolanos.julianaAún no hay calificaciones
- Experimento 3 de Quimica (Punto de Funsion)Documento7 páginasExperimento 3 de Quimica (Punto de Funsion)Yurem Adjamir RojasAún no hay calificaciones
- 05.-Determinación Crioscópica Del Peso MolecularDocumento15 páginas05.-Determinación Crioscópica Del Peso MolecularDalton Einsten Darwin0% (1)
- Taller Corte 3 - QuimicaDocumento8 páginasTaller Corte 3 - QuimicaSantiago MartinezAún no hay calificaciones
- Informe 7 SolubilidadDocumento5 páginasInforme 7 SolubilidadDANIELA ALVARADO ANNICCHIARICOAún no hay calificaciones
- Practica NIlaDocumento15 páginasPractica NIlaNadia Denisse Corona HernandezAún no hay calificaciones
- SM FCB G1 P2Documento9 páginasSM FCB G1 P2CristianAún no hay calificaciones
- Informe 2Documento10 páginasInforme 2RAUL ROJAS RAMOSAún no hay calificaciones
- CRIOSDocumento4 páginasCRIOSAngel LuisAún no hay calificaciones
- Analisis Cuanti Protocolo 1Documento14 páginasAnalisis Cuanti Protocolo 1JENIFER NICOLE CATALÁN BARILLASAún no hay calificaciones
- Informe 1 - Orgánica - Recristalizacion y SublimacionDocumento5 páginasInforme 1 - Orgánica - Recristalizacion y SublimacionDavid Colorado VegaAún no hay calificaciones
- Informe de LABORATORIO N°5 Liquidos y SolucionesDocumento17 páginasInforme de LABORATORIO N°5 Liquidos y SolucionesJuan Jose MF0% (1)
- Diferencia Entre Compuestos Organicos e InorganicosDocumento11 páginasDiferencia Entre Compuestos Organicos e InorganicosWendy Faroni Cruz Valverde100% (1)
- Práctica No.4 ColigativasDocumento7 páginasPráctica No.4 ColigativasDaniel AvendañoAún no hay calificaciones
- 4.laboratorio de Quimica Industrial Disoluciones y SolubilidadDocumento12 páginas4.laboratorio de Quimica Industrial Disoluciones y Solubilidadalejandro suarezAún no hay calificaciones
- Propiedades Coligativas de La Nieve de GarrafaDocumento6 páginasPropiedades Coligativas de La Nieve de GarrafaJANE BARAJASAún no hay calificaciones
- Informe de Química - Propiedades ColigativasDocumento8 páginasInforme de Química - Propiedades ColigativasBRANDON PADILLA FLOREZAún no hay calificaciones
- Informe Físicoquímica-CriosDocumento19 páginasInforme Físicoquímica-CriosDaniel Carmen OrozcoAún no hay calificaciones
- Informe Propiedades ColigativasDocumento4 páginasInforme Propiedades ColigativasFabian FarfanAún no hay calificaciones
- Informe de Quimica Solubilidad y MiscibilidadDocumento4 páginasInforme de Quimica Solubilidad y MiscibilidadPilar Fernandez Rodriguez100% (1)
- Informe N5Documento6 páginasInforme N5Carlos Jose EstevesAún no hay calificaciones
- Depresión Del Punto de Congelacion Del AguaDocumento7 páginasDepresión Del Punto de Congelacion Del AguaMayerlis GomezAún no hay calificaciones
- Práctica # 1 Equilibrio de Solubilidad Preparación de Cristales A Partir de Disoluciones SobresaturadasDocumento20 páginasPráctica # 1 Equilibrio de Solubilidad Preparación de Cristales A Partir de Disoluciones SobresaturadasBryan Estuardo De León EstradaAún no hay calificaciones
- Practica de Disoluciones 2015Documento13 páginasPractica de Disoluciones 2015Elaine LaraAún no hay calificaciones
- 3 - BPTQI22 Guía SolubilidadDocumento6 páginas3 - BPTQI22 Guía SolubilidadDaniel AraujoAún no hay calificaciones
- Universidad Nacional de Ingeniería Facultad de Ingeniería Química Y TextilDocumento8 páginasUniversidad Nacional de Ingeniería Facultad de Ingeniería Química Y TextilmarialuisallamocaAún no hay calificaciones
- Propiedades Coligativas de Las Soluciones. Lab 4Documento6 páginasPropiedades Coligativas de Las Soluciones. Lab 4ronaldoAún no hay calificaciones
- Práctica 5Documento8 páginasPráctica 5Itzel Daniela Solis TinocoAún no hay calificaciones
- Prelaboratorio 2Documento5 páginasPrelaboratorio 2Israel Isaías Armas NicolaldeAún no hay calificaciones
- INFORME N°5 LABORATORIO - Terminado.Documento18 páginasINFORME N°5 LABORATORIO - Terminado.Melany Fernández.100% (1)
- Materia 9Documento14 páginasMateria 9Kevin PerdomoAún no hay calificaciones
- Informe 2. Descenso Del Punto de CongelacionDocumento2 páginasInforme 2. Descenso Del Punto de CongelacionYenifer Liceth Martinez100% (2)
- Reporte de Laboratorio Practica 1Documento4 páginasReporte de Laboratorio Practica 1Luís LópezAún no hay calificaciones
- QUIMICA INORGANICA I Informe #2Documento7 páginasQUIMICA INORGANICA I Informe #2Erika HoyosAún no hay calificaciones
- Informe 2Documento5 páginasInforme 2emelyAún no hay calificaciones
- KNO3Documento7 páginasKNO3Anonymous sePzYYd2dAún no hay calificaciones
- Informe de Practicas 2da Unidad TF 1aDocumento45 páginasInforme de Practicas 2da Unidad TF 1aNoly AlfaroAún no hay calificaciones
- B91444 - Reporte#2 Cristalizacion de AcetanilidaDocumento5 páginasB91444 - Reporte#2 Cristalizacion de AcetanilidaIgnacio Calvo SolanoAún no hay calificaciones
- Informe 6 SolubilidadDocumento8 páginasInforme 6 SolubilidadPaola RamirezAún no hay calificaciones
- Reporte Practica 4Documento4 páginasReporte Practica 4Dario HQAún no hay calificaciones
- RV04 - Solubilidad (1) - Jeremy y ValeriaDocumento5 páginasRV04 - Solubilidad (1) - Jeremy y ValeriaJeremyAún no hay calificaciones
- Informe 7 - Propiedades ColigativasDocumento12 páginasInforme 7 - Propiedades ColigativasAlex Ostos AlvaAún no hay calificaciones
- Informe RecristalizaciónDocumento3 páginasInforme RecristalizaciónJonat ChAún no hay calificaciones
- PRACTICA 1 Purificacin de Acã Cido BenzoicoDocumento7 páginasPRACTICA 1 Purificacin de Acã Cido BenzoicoKaren Michelle Gonzalez AguirreAún no hay calificaciones
- Como Deben Hacer Un InformeDocumento10 páginasComo Deben Hacer Un InformeDiana Paola CamachoAún no hay calificaciones
- Sistema TermodinámicoDocumento3 páginasSistema TermodinámicoANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Tipos de ColisionesDocumento7 páginasTipos de ColisionesANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Energía Potencial ElásticaDocumento5 páginasEnergía Potencial ElásticaANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- 1.4 Ecuación de BernoulliDocumento2 páginas1.4 Ecuación de BernoulliANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Exp. 2. - ADSM - DisolucionesDocumento2 páginasExp. 2. - ADSM - DisolucionesANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Reporte de Practica 2y3 - ADSM.Documento5 páginasReporte de Practica 2y3 - ADSM.ANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- 3.5 - Calor y TrabajoDocumento4 páginas3.5 - Calor y TrabajoANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Reporte de Practica 7 Placas de Chladni - Suarez AngieDocumento7 páginasReporte de Practica 7 Placas de Chladni - Suarez AngieANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Reporte de Practica 4. - .Suarez AngieDocumento5 páginasReporte de Practica 4. - .Suarez AngieANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Reporte de Practica 5 Gas Ideal - Suarez AngieDocumento6 páginasReporte de Practica 5 Gas Ideal - Suarez AngieANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Sistemas CoordenadosDocumento10 páginasSistemas CoordenadosANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Movimiento Circular y RelativoDocumento18 páginasMovimiento Circular y RelativoANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Tiro Libre y Tiro VerticalDocumento9 páginasTiro Libre y Tiro VerticalANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- ADSM - Actividad 1.3Documento5 páginasADSM - Actividad 1.3ANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Conceptos Básicos Del Movimiento Rotacional: Mecánica Angie Deyanira Suarez MedinaDocumento14 páginasConceptos Básicos Del Movimiento Rotacional: Mecánica Angie Deyanira Suarez MedinaANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Metodos de Separacion de Mezclas - Angie Deyanira Suarez MedinaDocumento5 páginasMetodos de Separacion de Mezclas - Angie Deyanira Suarez MedinaANGIE DEYANIRA SUAREZ MEDINAAún no hay calificaciones
- Reporte Grupal Nro 6 - Preparación de Soluciones y Estandarización Ácido-Base.Documento13 páginasReporte Grupal Nro 6 - Preparación de Soluciones y Estandarización Ácido-Base.Oscar EduardoAún no hay calificaciones
- Anatomía y Fisiología Tarea 4Documento2 páginasAnatomía y Fisiología Tarea 4melany1de1los-848806Aún no hay calificaciones
- ReactivosDocumento7 páginasReactivosAntonella PazAún no hay calificaciones
- Reacciones Químicas InorgánicasDocumento34 páginasReacciones Químicas InorgánicasSebastian CedilloAún no hay calificaciones
- Tema 8Documento28 páginasTema 8Paula CastroAún no hay calificaciones
- Lineamientos LaboratorioDocumento4 páginasLineamientos LaboratorioCynthia RodriguezAún no hay calificaciones
- EJERCICIO %-PPM - para Desarrollar - Documentos de GoogleDocumento2 páginasEJERCICIO %-PPM - para Desarrollar - Documentos de GoogleLaura RojasAún no hay calificaciones
- Molienda y Tamizado Expo MasaDocumento15 páginasMolienda y Tamizado Expo MasaJHON FABER FORERO BARCOAún no hay calificaciones
- ElementoDocumento9 páginasElementoMaelo BorinqueñoAún no hay calificaciones
- Ingenieria de Reacciones Quimicas I: Interpretación de Datos Cinéticos ExperimentalesDocumento90 páginasIngenieria de Reacciones Quimicas I: Interpretación de Datos Cinéticos ExperimentalesmiriamAún no hay calificaciones
- Ficha Técnica FORTGRID UX50 MarvDocumento2 páginasFicha Técnica FORTGRID UX50 MarvYassiel TeresaAún no hay calificaciones
- AA2-EV1. Mapa Conceptual - Propiedades Químicas Del Suelo - .DrawioDocumento1 páginaAA2-EV1. Mapa Conceptual - Propiedades Químicas Del Suelo - .Drawiolaura sofia reyes martinez100% (1)
- Mayo de 2010: Norma IberdrolaDocumento7 páginasMayo de 2010: Norma IberdrolaAlvaro Garcia DelgadoAún no hay calificaciones
- 1° Practica Del Laboratorio de Química OrgánicaDocumento11 páginas1° Practica Del Laboratorio de Química OrgánicaHéctor MendozaAún no hay calificaciones
- Oxidación de P-XilenoDocumento211 páginasOxidación de P-XilenoANDRES JAIMES ESCALERAAún no hay calificaciones
- Yeso y CalDocumento7 páginasYeso y CalWitdeggar FariñasAún no hay calificaciones
- 10 Pets. Trabajos en Altura - TOAZ - InfoDocumento12 páginas10 Pets. Trabajos en Altura - TOAZ - InfofiorellaAún no hay calificaciones
- Grupo 6, Tabiques.Documento21 páginasGrupo 6, Tabiques.Candi ArmandoAún no hay calificaciones
- Informe de Salida Del CampoDocumento6 páginasInforme de Salida Del CampoRoni Chipani RataAún no hay calificaciones
- 1 Año Bachillerato 13 de SepDocumento4 páginas1 Año Bachillerato 13 de SepAlan KijijiAún no hay calificaciones
- Tema 5 Carbohidratos Guia Julio NadalesDocumento8 páginasTema 5 Carbohidratos Guia Julio NadalesEly CadenasAún no hay calificaciones
- Ensayo de Fisiologia 3Documento8 páginasEnsayo de Fisiologia 3Mary SilvaAún no hay calificaciones
- FT Aluminio Serie 19Documento4 páginasFT Aluminio Serie 19Jose Valdez NeyraAún no hay calificaciones
- Cuest Diagnos SFMP II 20Documento15 páginasCuest Diagnos SFMP II 20asriel owoAún no hay calificaciones
- Practica de Retroalimentacion de Indicadores de Logro P4Documento3 páginasPractica de Retroalimentacion de Indicadores de Logro P4Sofia SilberbergAún no hay calificaciones
- Primer Parcial Ic 361 Bci Mecanica de Suelos 1Documento6 páginasPrimer Parcial Ic 361 Bci Mecanica de Suelos 1Enr EdisonAún no hay calificaciones
- Hidrocarburos AlifáticosDocumento8 páginasHidrocarburos AlifáticosKeiver De Aguas SarmientoAún no hay calificaciones
- MeCaTeC MeCaCorr 750 Application Instructions - ESDocumento2 páginasMeCaTeC MeCaCorr 750 Application Instructions - ESerikaAún no hay calificaciones
- Taller 1 EA-I-2019Documento9 páginasTaller 1 EA-I-2019Natalia Rico TorresAún no hay calificaciones
- Equilibrio Liquido Vapor Etanol 1 Agua 2Documento10 páginasEquilibrio Liquido Vapor Etanol 1 Agua 2RuthmangandyAún no hay calificaciones