Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Virus Intestinales
Cargado por
Franche OportoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Virus Intestinales
Cargado por
Franche OportoCopyright:
Formatos disponibles
DIAGNÓSTICO DE LAS INFECCIONES VÍRICAS GASTROINTESTINALES
Javier Buesa Gómez, Pilar López-Andújar y Jesús Rodríguez Díaz
Departamento de Microbiología, Facultad de Medicina y Hospital Clínico Universitario,
Universidad de Valencia
Las gastroenteritis agudas se encuentran entre las enfermedades más frecuentes del
ser humano, solamente superadas por las infecciones víricas respiratorias agudas (Dolin et
al., 1987). La microscopía electrónica demostró al principio de la década de los 70 la
existencia de partículas víricas en muestras de heces de pacientes aquejados de
gastroenteritis aguda, principalmente en niños. Desde entonces se ha avanzado mucho en
el conocimiento de estas infecciones intestinales, superando dificultades determinadas por
las propias características biológicas de los virus implicados, principalmente su difícil, y a
veces imposible, adaptación al cultivo en líneas celulares. Los principales virus productores
de gastroenteritis en el ser humano son los rotavirus, calicivirus, astrovirus y adenovirus.
Otros virus, tales como los coronavirus, torovirus, picobirnavirus y picornavirus (virus Aichi)
son también causa de diarrea, pero con menor trascendencia epidemiológica (Tabla 1).
Tabla 1. Virus productores de gastroenteritis en la especie humana.
• Rotavirus (grupos A, B, C)
• Calicivirus: virus tipo Norwalk (NLV) y tipo Sapporo (SLV)
• Astrovirus
• Adenovirus entéricos (serotipos 40 y 41)
• Coronavirus-like
• Torovirus
• virus Aichi (Picornaviridae)
• Picobirnavirus
MICROSCOPÍA ELECTRÓNICA
Todos estos agentes víricos son fácilmente detectados por microscopía electrónica
(ME) cuando se encuentran en elevadas concentraciones en las heces, lo que con
frecuencia ocurre en las personas infectadas que presentan sintomatología, aunque se
estima que se requiere del orden de 106 partículas víricas por gramo de muestra para poder
ser observadas. La inmunomicroscopía electrónica, utilizando antisueros o anticuerpos
monoclonales, incrementa la sensibilidad de la ME, y además sirve para demostrar la
agregación de partículas víricas por los anticuerpos específicos, una de las observaciones
consideradas como demostrativas del papel patógeno de los distintos virus.
Estas técnicas continúan siendo de gran utilidad en el diagnóstico de las
gastroenteritis víricas, siempre, por supuesto, que se pueda disponer de un microscopio
electrónico y de personal entrenado. El procesamiento de las muestras no es complejo ni
laborioso, y en pocos minutos se puede realizar una tinción negativa con ácido
fosfotúngstico. La gran ventaja de la microscopía electrónica respecto a otras técnicas
diagnósticas es que permite encontrar cualquier virus, sin que el procedimiento limite la
identidad del agente detectado, como sucede con las técnicas inmunológicas o moleculares.
La mayoría de los virus son fácilmente reconocibles por su morfología, y algunos virus se
diagnostican principalmente por este procedimiento (torovirus, coronavirus). Por microscopía
electrónica se detectan, además, virus que en muchos laboratorios no se investigan por
otras técnicas (rotavirus de grupos B y C, calicivirus, etc.).
ROTAVIRUS
Los rotavirus del grupo A constituyen la principal causa de gastroenteritis grave en
niños de todo el mundo. Producen unos 125 millones de infecciones cada año en los países
en desarrollo y son causa de 873.000 fallecimientos anuales (Glass et al., 1994).
Tres proteínas estructurales de rotavirus tienen gran importancia para clasificar a
estos virus según su antigenicidad. La proteína VP6, que constituye la cápsida interna del
virión, es responsable de la existencia de siete serogrupos (A-G). Las infecciones humanas
son producidas principalmente por rotavirus del grupo A y, en menor medida, o con otras
características epidemiológicas, por los grupos B y C. El resto de grupos de rotavirus
producen infecciones en los animales, aun cuando los del A infectan también algunas
especies animales, además del hombre. Los rotavirus humanos del grupo A se subdividen
en dos subgrupos (I y II) en función de la especificidad de la VP6.
La proteína VP4, que constituye las espículas del virión, y la glucoproteína VP7 de la
cápsida externa determinan la existencia de serotipos P y G, respectivamente. Los serotipos
P que infectan a humanos son P1A, P1B, P2A, P3, P4, P5 y P8 (Steele et al., 1993). La
escasez de sueros específicos frente a estos serotipos ha hecho que, actualmente, se
determine más a menudo el genotipo P por la técnica de RT-PCR que el serotipo, siendo los
genotipos más frecuentes P[4], P[6], P[8] y P[9]. Se han descrito 14 serotipos G, aunque los
más frecuentes infectando al ser humano son G1-G4.
El diagnóstico de las infecciones por rotavirus se hace habitualmente detectando la
existencia de antígeno vírico en muestras de heces, con frecuencia la proteína VP6. El
aislamiento en cultivo es difícil y carece de interés diagnóstico. Los métodos inmunológicos
detectan solamente rotavirus del grupo A, ya que por el momento no existen métodos
comercializados para detectar rotavirus de grupos B y C. Los formatos técnicos utilizados
son el EIA convencional (en placa o en tubo), el EIA de membrana, la aglutinación con látex
y la inmunocromatografía.
Los métodos moleculares detectan la presencia de RNA vírico, bien poniendo de
manifiesto segmentos de RNA bicatenario mediante la electroforesis en gel de poliacrilamida
(PAGE), o bien amplificando por reacción en cadena de la polimerasa (PCR) el DNAc
previamente sintetizado por reacción de transcripción inversa (RT-PCR). Estos métodos
requieren la extracción previa del ácido nucleico vírico y la eliminación de inhibidores que
pueden interferir en la reacción de RT-PCR (Buesa et al., 1996). Por otro lado, tienen la
ventaja de que permiten caracterizar los diferentes aislados, bien por el patrón
electroforético del RNA vírico (electroforetipo) o bien determinando el genotipo G (Gouvea et
al., 1990) y P (Gentsch et al., 1992) por PCR semi-anidada, disponiendo de los cebadores
adecuados. La detección de rotavirus de grupos B y C se puede realizar también utilizando
cebadores específicos (Gouvea et al., 1991). Estas técnicas han abierto la posibilidad de
estudiar la evolución y la variabilidad de los rotavirus en diferentes regiones geográficas y a
lo largo del tiempo (Buesa et al., 2000).
ADENOVIRUS ENTÉRICOS (SEROTIPOS 40 y 41)
Estos adenovirus, también denominados “fastidiosos” por ser difíciles de cultivar en
las líneas celulares habituales, aunque sí se propagan en las líneas Graham 293 y Chang,
se caracterizan por su marcado tropismo intestinal. Estos serotipos constituyen el 59 % de
los adenovirus encontrados en las heces y causan un 7% de casos de diarrea en niños
(Jong et al., 1983). El diagnóstico de las infecciones por adenovirus entéricos se establece
habitualmente por método de EIA, aglutinación de látex o inmunocromatografía. Otros
métodos de caracterización de adenovirus entéricos son el análisis de polimorfismo de
fragmentos de restricción (RFLPs), PCR y la hibridación en dot-blot.
ASTROVIRUS
Los astrovirus (familia Astroviridae) producen un 2-8% de las gastroenteritis infantiles
en forma de casos esporádicos y brotes de diarrea en comunidades, hospitales y
guarderías. Es posible su aislamiento en cultivo de líneas celulares LLC-MK2 o Caco-2, en
presencia de tripsina. Se han descrito ocho serotipos, de los que el serotipo 1 es el más
común. El diagnóstico puede establecerse, además de por ME, por cultivo y por EIA
comercial, y por RT-PCR (Mitchell et al. 1999). Es también factible realizar el tipado por
análisis con enzimas de restricción de los productos de PCR (RFLP) y por secuenciación.
CALICIVIRUS HUMANOS
El virus Norwalk es el prototipo de los calicivirus humanos, durante mucho tiempo
también denominados “pequeños virus redondos estructurados” (small round-structured
viruses, SRSV), y actualmente considerado un miembro del género “virus Norwalk-like”
(NLV). Otro género lo constituyen los “virus Sapporo-like” (SLV) que, junto con los géneros
Lagovirus y Vesivirus, se integran en la familia Caliciviridae. Los NLV se dividen en tres
genogrupos, GGI, GGII y GGIII. Los genogrupos GGI y GGII infectan a los humanos, e
incluyen 5 y 10 clusters genéticos, respectivamente. Los virus del GGIII se han detectado en
ganado bovino y porcino. Al genogrupo GGI pertenecen, por ejemplo, los virus Norwalk,
Southampton y Desert Shield, mientras que en el GGII se incluyen los virus Hawaii, México,
Lordsdale y Grimsby, entre otros. Los calicivirus humanos no se han conseguido propagar
en cultivos celulares, lo que ha supuesto una importante limitación para su estudio. Sin
embargo, la expresión de la proteína de la cápsida vírica en células de insecto mediante el
sistema de baculovirus recombinantes ha permitido producir partículas pseudovíricas (virus-
like particles o VLP) que se han utilizado como fuente de antígeno para obtener sueros y
anticuerpos monoclonales.
El diagnóstico de las infecciones gastrointestinales por calicivirus humanos se realiza
actualmente mediante la detección del ácido nucleico por técnica de RT-PCR, utilizando
distintos pares de oligonucleótidos. Una excelente revisión sobre el diagnóstico de las
infecciones por calicivirus humanos fue publicada recientemente por Atmar y Estes (2001).
La mayoría de los cebadores descritos en la literatura amplifican secuencias de la región de
la RNA polimerasa viral, la más conservada del genoma. Los cebadores más ampliamente
utilizados son los descritos por Ando et al. (1995), Green et al. (1995), Le Guyader et al.
(1996) y Vinjé et al. (1996). A pesar de numerosos esfuerzos por desarrollar cebadores
universales o degenerados que pudiesen detectar todas las cepas de calicivirus humanos
circulantes, este objetivo no se ha logrado. Sin embargo, la mayoría de las cepas de NLV
son detectadas con los cebadores descritos por Vinjé et al. (1996) y por Le Guyader et al.
(1996). La RT-PCR está permitiendo diagnosticar no sólo los casos clínicos de infecciones
por calicivirus, sino también detectar su en muestras ambientales, agua y alimentos (Green
et al., 1998). La información proporcionada por estos estudios ha permitido reconocer a los
calicivirus como la principal causa de gastroenteritis epidémica. Mediante RT-PCR es
posible detectar también las infecciones por (SLV) (Vinjé et al., 2000), que afectan, sobre
todo, a niños pequeños, e incluso se han diseñado cebadores que detectan tanto NLV como
SLV (Jiang et al., 1999).
La diversidad genética de los calicivirus humanos está siendo estudiada mediante
genotipado de las cepas aisladas. Además de la secuenciación de los amplificados de PCR,
otros métodos aplicados con éxito al tipado molecular de calicivirus son la hibridación en blot
de línea rinversa (reverse line blot hybridization) (Vinjé et al, 2000) y el análisis de movilidad
de híbridos (heteroduplex mobility assay) (Mattick et al, 2000), que permiten analizar
simultáneamente un elevado número de cepas, por lo que están especialmente indicados en
laboratorios de referencia.
Se han diseñado en varios laboratorios métodos de enzimoinmunoensayo para
detectar antígeno vírico pero, hasta el momento, no se ha comercializado ninguno. Estos
ensayos utilizan sueros policlonales (Jiang et al, 1995) o anticuerpos monoclonales
(Herrmann et al, 1995) obtenidos frente a partículas pseudovíricas, y su principal limitación
es que tienen, en general, un espectro limitado, por lo que sólo detectan determinados
serotipos.
OTROS VIRUS ENTEROPATÓGENOS
Otros virus causantes de cuadros de gastroenteritis parecen merecer un menor
interés en cuanto al desarrollo de métodos diagnósticos, tanto inmunológicos como
moleculares, lo que se justificaría por su menor importancia epidemiológica. Se trata de virus
como los coronavirus entéricos, los torovirus o el virus Aichi. Este último fue aislado en
Japón en 1991 en células BSC-1 a partir de pacientes con gastroenteritis asociada al
consumo de ostras (Yamashita et al, 1991). La secuenciación del genoma completo de este
virus demostró que se trata de un Picornavirus (Yamashita et al, 1998). Queda todavía por
determinar la prevalencia de las infecciones por este virus en otros países además de
Japón, Pakistán y otras zonas del sudeste asiático.
Los coronavirus entéricos humanos se asocian a gastroenteritis en los neonatos, en
donde se les ha implicado como causa de enterocolitis necrosante y, en general, en niños
menores de 12 años. Los torovirus están implicados en la producción de diarrea, en
ocasiones sanguinolenta, con frecuencia de adquisición nosocomial. Asímismo, los
picobirnavirus, virus con genoma constituido por dos segmentos de RNA bicatenario, se han
detectado principalmente los pacientes infectados por el VIH (Giordano et al, 1999).
El desarrollo de métodos de detección de antígenos (aglutinación de látex, ELISA,
inmunocromatografía) para estos virus entéricos supondría una gran avance para permitir su
diagnóstico en la práctica asistencial, lo que redundaría en un mejor conocimiento de su
importancia epidemiológica y de la fisiopatología de las enfermedades que producen.
BIBLIOGRAFIA
ANDO T, MONROE SS, GENTSCH JR, JIN Q, LEWIS DC, GLASS RI. Detection and differentiation
of antigenically distinct small round-structured viruses (Norwalk-like viruses) by
reverse transcription-PCR and southern hybridization. J Clin Microbiol 1995; 33:64-
71.
ATMAR RL, ESTES MK. Diagnosis of noncultivatable gastroenteritis viruses, the human
caliciviruses. Clin Microbiol Rev 2001; 14:15-37.
BUESA J, COLOMINA J, RAGA J, VILLANUEVA A, PRAT J. Evaluation of reverse transcription and
polymerase chain reaction (RT/PCR) for the detection of rotaviruses: applications of
the assay. Res Virol 1996; 147:353-361.
BUESA J, DE SOUZA CO, ASENSI M, MARTÍNEZ C, PRAT J, GIL MT VP7 and VP4 genotypes
among rotavirus strains recovered from children with gastroenteritis over a 3-year
period in Valencia, Spain. Eur J Epidemiol 2000; 16:501-506.
DE JONG JC, W EIGAND R, KIDD AH et al. Candidate adenoviruses 40 and 41: fastidious
adenoviruses from human infant stools. J Med Virol 1983; 11:215-231.
También podría gustarte
- Microbiología Médica I: Patógenos y Microbioma HumanoDe EverandMicrobiología Médica I: Patógenos y Microbioma HumanoAún no hay calificaciones
- Infecciones Viricas GastrointestinalesDocumento2 páginasInfecciones Viricas GastrointestinalesRomi OrtizAún no hay calificaciones
- Virus del Nilo Occidental ¿Estamos preparados?: Una perspectiva One HealthDe EverandVirus del Nilo Occidental ¿Estamos preparados?: Una perspectiva One HealthAún no hay calificaciones
- Coccidiosis Intestinal en El Perú Actualización de Su Frecuencia, Transmisión y Diagnóstico de LaboratorioDocumento5 páginasCoccidiosis Intestinal en El Perú Actualización de Su Frecuencia, Transmisión y Diagnóstico de LaboratorioAna Teresa Luna OliveraAún no hay calificaciones
- Enfoque clínico y de pruebas diagnósticas en parasitologíaDe EverandEnfoque clínico y de pruebas diagnósticas en parasitologíaCalificación: 5 de 5 estrellas5/5 (3)
- Presentacion Virus DiarreicosDocumento49 páginasPresentacion Virus DiarreicosJhovannaAún no hay calificaciones
- Informe para Trabajar en ClaseDocumento18 páginasInforme para Trabajar en ClaseEl PorteAún no hay calificaciones
- AstrovirusDocumento8 páginasAstrovirusLucía Margarita VillaAún no hay calificaciones
- Familia Reoviridae PDFDocumento26 páginasFamilia Reoviridae PDFMaria del Carmen Paniagua100% (1)
- Tarea #3 Lab - Microbiologia GDocumento9 páginasTarea #3 Lab - Microbiologia GangelyAún no hay calificaciones
- Familia ReoviridaeDocumento26 páginasFamilia Reoviridaechevoxx75% (4)
- Rotavirus y Adenovirus - MicrobiologíaDocumento14 páginasRotavirus y Adenovirus - MicrobiologíaNicöle AndradeAún no hay calificaciones
- Diagnóstico Coriza InfecciosaDocumento3 páginasDiagnóstico Coriza InfecciosaZolly Liz Isla CárdenasAún no hay calificaciones
- APLICACIONESDocumento4 páginasAPLICACIONESLenaVillarroelAún no hay calificaciones
- Reovirus, Rotavirus y Calicivirus 303Documento3 páginasReovirus, Rotavirus y Calicivirus 303DULCE MARIA HINOJOSA LARAAún no hay calificaciones
- Trabajo Practico N6 Diagnostico de ClamydiasDocumento8 páginasTrabajo Practico N6 Diagnostico de ClamydiasCamila AvilesAún no hay calificaciones
- Diarrea ViralDocumento12 páginasDiarrea ViralSandra López JiménezAún no hay calificaciones
- Infecciones de Enfermedades Parasitarias ImportadasDocumento71 páginasInfecciones de Enfermedades Parasitarias ImportadasCesar VitalAún no hay calificaciones
- 2.09.11 Nonhuman PrimatesDocumento5 páginas2.09.11 Nonhuman PrimatesJUAN RAMON RAMOS ARROYOAún no hay calificaciones
- Of - Rotavirus Lucia MarquezDocumento17 páginasOf - Rotavirus Lucia Marquezlucia marquez lopezAún no hay calificaciones
- Enter o CoccusDocumento47 páginasEnter o Coccusbilly casasAún no hay calificaciones
- 879 3195 1 PBDocumento7 páginas879 3195 1 PBBETTY YOLANDA HUAMAN PURIHUAMANAún no hay calificaciones
- Gastroenteritis BacterianasDocumento6 páginasGastroenteritis BacterianasEdgar Omar De La Garza MataAún no hay calificaciones
- INFORME #08-Candida y Criptococcus-ARAUJO, MónicaDocumento19 páginasINFORME #08-Candida y Criptococcus-ARAUJO, MónicaWILSON ARTURO RAMOS OLANOAún no hay calificaciones
- ENTEROCOCOSDocumento11 páginasENTEROCOCOSRosangel Ahynaru Rondón Lara100% (1)
- Diarrea Viral BovinaDocumento3 páginasDiarrea Viral BovinaMarcela AlexandraAún no hay calificaciones
- DETECCION VIRALDocumento33 páginasDETECCION VIRALxzero19xAún no hay calificaciones
- PIA Virologia 2Documento18 páginasPIA Virologia 2JezCovarrubiasAún no hay calificaciones
- CryptosporidiumDocumento5 páginasCryptosporidiumJeison PiñaAún no hay calificaciones
- Rotavirus Virol.Documento33 páginasRotavirus Virol.Lucho Zafra HaroAún no hay calificaciones
- Opisthorchis Spp. (O. Viverrini, O. Felineus) - Examen Microscópico de Huevos en Heces - Diagnóstico Molecular (PCR) - Identificación Molecular de Especies (Secuenciación) - IVAMIDocumento3 páginasOpisthorchis Spp. (O. Viverrini, O. Felineus) - Examen Microscópico de Huevos en Heces - Diagnóstico Molecular (PCR) - Identificación Molecular de Especies (Secuenciación) - IVAMIIsrael MateoAún no hay calificaciones
- Generalidades de VirusDocumento4 páginasGeneralidades de VirusRosa MARTINEZAún no hay calificaciones
- RABIA (WWW - Monografías.com)Documento31 páginasRABIA (WWW - Monografías.com)Victor Manuel Yore ArévaloAún no hay calificaciones
- BursitisDocumento2 páginasBursitisANGEL RODRIGO BETANCOURT MUÑOZAún no hay calificaciones
- RotavirusDocumento17 páginasRotavirusLuis Felipe MazariegosAún no hay calificaciones
- Covit 19Documento7 páginasCovit 19katerine Pacheco titoAún no hay calificaciones
- Utilidad de la prueba de antigenemia cuantitativa en el diagnóstico de CMVDocumento8 páginasUtilidad de la prueba de antigenemia cuantitativa en el diagnóstico de CMVKattia Narcetth BelfortAún no hay calificaciones
- DIAGNOSTICO VIROlDocumento23 páginasDIAGNOSTICO VIROlDoris RamzAún no hay calificaciones
- Informe 10 - Efecto CitopáticosDocumento6 páginasInforme 10 - Efecto CitopáticosWENDY ASTRID DE LA CRUZ ROJASAún no hay calificaciones
- P3 - Diagnostico VirusDocumento4 páginasP3 - Diagnostico VirusoberonsauzamedaAún no hay calificaciones
- Virus Tercer CorteDocumento46 páginasVirus Tercer CorteNini Sierra GutierrezAún no hay calificaciones
- ADENOMATOSIS PULMONAR OVINA (Jaagsiekte)Documento12 páginasADENOMATOSIS PULMONAR OVINA (Jaagsiekte)Darwin Antezana De la RosaAún no hay calificaciones
- Edinson Carrion - RESUMEN - MicrobiologiaDocumento4 páginasEdinson Carrion - RESUMEN - MicrobiologiaEdinson CarrionAún no hay calificaciones
- Parotiditis y RotavirusDocumento38 páginasParotiditis y RotavirusLidia Samaniego CazorlaAún no hay calificaciones
- Diagnóstico enfermedades colmenasDocumento11 páginasDiagnóstico enfermedades colmenasGianina SailemaAún no hay calificaciones
- Dg. Laboratorio Inf - Virales FinalDocumento59 páginasDg. Laboratorio Inf - Virales FinalAnthuan Mitreya100% (1)
- Informe s5 - Parasitologia PracticoDocumento9 páginasInforme s5 - Parasitologia PracticoHitamar Lisseth GallardoAún no hay calificaciones
- Gastroenteritis Por NorvovirusDocumento5 páginasGastroenteritis Por NorvovirusMarianaRamírezAún no hay calificaciones
- RSV PCRDocumento8 páginasRSV PCRRafael IriasAún no hay calificaciones
- Tarea 12 VirologíaDocumento22 páginasTarea 12 VirologíaBertha Felix TarazonaAún no hay calificaciones
- 2024 Marzo 06 Phe Actualizacion Oropouche Esp Final1Documento7 páginas2024 Marzo 06 Phe Actualizacion Oropouche Esp Final1crosenfe84Aún no hay calificaciones
- Bacterias RespiratoriasDocumento73 páginasBacterias Respiratoriasbilly casasAún no hay calificaciones
- Generalidades en El Estudio de Los VirusDocumento16 páginasGeneralidades en El Estudio de Los VirusNicolas ClarosAún no hay calificaciones
- Pruebas de Adn para El Virus Del Papiloma Humano. Retos en La Tamizacion Del Vph. Aurora Aznar FuenlabradaDocumento34 páginasPruebas de Adn para El Virus Del Papiloma Humano. Retos en La Tamizacion Del Vph. Aurora Aznar FuenlabradaAurora aznarAún no hay calificaciones
- Rotavirus: ActualizaciónDocumento8 páginasRotavirus: ActualizaciónLucas DuranAún no hay calificaciones
- AdenovirusDocumento33 páginasAdenovirusMelanie Betteta DíazAún no hay calificaciones
- Unidad 8 Papilomavirus - VihDocumento22 páginasUnidad 8 Papilomavirus - VihPedro Nascimento da SilvaAún no hay calificaciones
- Eeo Encefalitis Equino Del OesteDocumento6 páginasEeo Encefalitis Equino Del Oestemanuel alejandro garcia diazAún no hay calificaciones
- Deteccion de Mycoplasma SPP en Cultivos Celulares Mediante La Reaccion en Cadena de La PolimerasaDocumento23 páginasDeteccion de Mycoplasma SPP en Cultivos Celulares Mediante La Reaccion en Cadena de La Polimerasaandrea nettle bareaAún no hay calificaciones
- Sensibilidad y Especificidad Del Método Inmunocromatográfico UtilizadoDocumento6 páginasSensibilidad y Especificidad Del Método Inmunocromatográfico UtilizadofresumeAún no hay calificaciones
- Introduccion BiopatologiaDocumento13 páginasIntroduccion Biopatologiadaymari ccarolina chirino chirinoAún no hay calificaciones
- OrthomixoviridaeDocumento17 páginasOrthomixoviridaeFranche OportoAún no hay calificaciones
- VitaminasDocumento38 páginasVitaminasFranche OportoAún no hay calificaciones
- T9 Bioquimica PDFDocumento11 páginasT9 Bioquimica PDFMangupunisher CpcAún no hay calificaciones
- HerpesDocumento11 páginasHerpesFranche OportoAún no hay calificaciones
- HepatitisDocumento42 páginasHepatitisFranche OportoAún no hay calificaciones
- Aspectos actuales de las vitaminas en nutriciónDocumento3 páginasAspectos actuales de las vitaminas en nutriciónFranche OportoAún no hay calificaciones
- GiardiasisDocumento8 páginasGiardiasisFranche OportoAún no hay calificaciones
- AmebiasisDocumento9 páginasAmebiasisFranche OportoAún no hay calificaciones
- AdenovirusDocumento3 páginasAdenovirusFranche OportoAún no hay calificaciones
- CORONAVIRUS TripticoDocumento2 páginasCORONAVIRUS TripticoARIANA gabrielaAún no hay calificaciones
- Niveles de Atención A La Salud en MéxicoDocumento5 páginasNiveles de Atención A La Salud en MéxicoMalinaly Cp Peraza100% (1)
- Bitacora WordDocumento2 páginasBitacora WordELIAS ARRAZOLAAún no hay calificaciones
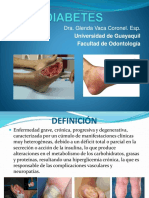
- Guía DiabetesDocumento36 páginasGuía DiabetesvasquezAún no hay calificaciones
- Salud Visual y Examen de OjosDocumento2 páginasSalud Visual y Examen de OjosDavid CroesAún no hay calificaciones
- Ejemplo Espirometrias1Documento3 páginasEjemplo Espirometrias1Vicente InostrozaAún no hay calificaciones
- Riesgo Alcoholismo Familia CaracteresDocumento3 páginasRiesgo Alcoholismo Familia CaracteresLhitusAún no hay calificaciones
- Tubo Endotraqueal Adulto - GCL 1.2 - v.4 PDFDocumento21 páginasTubo Endotraqueal Adulto - GCL 1.2 - v.4 PDFmyriamsepulvedaAún no hay calificaciones
- PRESENTACION OdpDocumento9 páginasPRESENTACION OdpNatalia Martinez SanchezAún no hay calificaciones
- Mapa Conceptual IntestinoDocumento1 páginaMapa Conceptual IntestinoRosa Pilar Mamani HilasacaAún no hay calificaciones
- Enfermedades Comunes Del NiñoDocumento12 páginasEnfermedades Comunes Del NiñoE Angel Ticona Ramos100% (1)
- Lema Leydi Valores de Los Signos VitalesDocumento5 páginasLema Leydi Valores de Los Signos VitalesLeydiLemaAún no hay calificaciones
- Modelo Historia Clinica UnfvDocumento3 páginasModelo Historia Clinica UnfvPaul Leyva TelloAún no hay calificaciones
- Tabla Tarifaria 2023Documento5 páginasTabla Tarifaria 2023Maria Alejandra Rivera ZambranoAún no hay calificaciones
- Enfermedad de Von GierkeDocumento5 páginasEnfermedad de Von GierkeMauricio Rojo LorcaAún no hay calificaciones
- NEBULIZACIONESDocumento5 páginasNEBULIZACIONESMiguel Angel Otiniano Arribasplata100% (4)
- Técnica ZDocumento1 páginaTécnica ZAriadna GarciaAún no hay calificaciones
- Fobia EspecificaDocumento14 páginasFobia EspecificaLMN214Aún no hay calificaciones
- Aparato Genital MasculinoDocumento69 páginasAparato Genital MasculinoJulian Caleb Euceda GarciaAún no hay calificaciones
- Fisioterapia en GinecologíaDocumento15 páginasFisioterapia en GinecologíaOsbelia MartinezAún no hay calificaciones
- Minociclina efectiva depresión psicótica unipolarDocumento12 páginasMinociclina efectiva depresión psicótica unipolarnatalia_AS166615Aún no hay calificaciones
- BalanitisDocumento12 páginasBalanitisJean Paul R.Aún no hay calificaciones
- HISTORIA CLÍNICA NEUROLÓGICADocumento8 páginasHISTORIA CLÍNICA NEUROLÓGICALeonardoCapuñayEffioAún no hay calificaciones
- Adenovirus Antigeno Fecal ElisaDocumento2 páginasAdenovirus Antigeno Fecal ElisaMathias Serpa ArceAún no hay calificaciones
- Historia clínica de gastroenterología con ictericiaDocumento12 páginasHistoria clínica de gastroenterología con ictericiaAlex Ivanovich ACAún no hay calificaciones
- Examen de Nutricion Modulo 12Documento6 páginasExamen de Nutricion Modulo 12Erick VidaurreAún no hay calificaciones
- Proyecto PhasaDocumento10 páginasProyecto PhasaWAGO HURAAún no hay calificaciones
- Ciclo para PrincipiantesDocumento2 páginasCiclo para PrincipiantesWalter LendorAún no hay calificaciones
- Gonzalez, K. (2021) - Nosología de Los Trastornos Mentales y de LaDocumento18 páginasGonzalez, K. (2021) - Nosología de Los Trastornos Mentales y de LaFer RamírezAún no hay calificaciones
- Encefalopatía de Wernicke: triada clásica y factores de riesgoDocumento9 páginasEncefalopatía de Wernicke: triada clásica y factores de riesgoallhasreadAún no hay calificaciones
- Póngase En Forma Sin Salir De Su CasaDe EverandPóngase En Forma Sin Salir De Su CasaCalificación: 4.5 de 5 estrellas4.5/5 (4)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Psiconeuroinmunología para la práctica clínicaDe EverandPsiconeuroinmunología para la práctica clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Ansiedad infantil. Los trastornos explicados a los padresDe EverandAnsiedad infantil. Los trastornos explicados a los padresCalificación: 4.5 de 5 estrellas4.5/5 (25)
- Muchas Vidas, Muchos Sabios (Many Lives, Many Masters): (Many Lives, Many Masters)De EverandMuchas Vidas, Muchos Sabios (Many Lives, Many Masters): (Many Lives, Many Masters)Calificación: 4 de 5 estrellas4/5 (475)
- Genética general: Libro de textoDe EverandGenética general: Libro de textoCalificación: 4.5 de 5 estrellas4.5/5 (11)
- TDAH en Adultos. Cómo Reconocer y Tratar a un Adulto con TDAH en 30 Fáciles PasosDe EverandTDAH en Adultos. Cómo Reconocer y Tratar a un Adulto con TDAH en 30 Fáciles PasosCalificación: 4 de 5 estrellas4/5 (8)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Principios básicos de bioquímica de los alimentosDe EverandPrincipios básicos de bioquímica de los alimentosCalificación: 4.5 de 5 estrellas4.5/5 (2)
- Terapia cognitiva: Conceptos básicos y profundizaciónDe EverandTerapia cognitiva: Conceptos básicos y profundizaciónCalificación: 5 de 5 estrellas5/5 (1)
- En busca de la mente: El largo camino para comprender la vida mental (y lo que aún queda por descubrir)De EverandEn busca de la mente: El largo camino para comprender la vida mental (y lo que aún queda por descubrir)Calificación: 4.5 de 5 estrellas4.5/5 (3)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Trauma, miedo y amor: Hacia una autonomía interior con la ayuda de las constelacionesDe EverandTrauma, miedo y amor: Hacia una autonomía interior con la ayuda de las constelacionesCalificación: 1 de 5 estrellas1/5 (1)
- Terapia de vidas pasadas: Un camino hacia la luz del alma. Técnica y prácticaDe EverandTerapia de vidas pasadas: Un camino hacia la luz del alma. Técnica y prácticaCalificación: 4.5 de 5 estrellas4.5/5 (11)
- El libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)De EverandEl libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)Calificación: 3 de 5 estrellas3/5 (2)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Prescripción de ejercico físico para la saludDe EverandPrescripción de ejercico físico para la saludCalificación: 5 de 5 estrellas5/5 (1)
- Puntos gatillo y cadenas musculares funcionales en osteopatía y terapia manual (Bicolor)De EverandPuntos gatillo y cadenas musculares funcionales en osteopatía y terapia manual (Bicolor)Calificación: 4.5 de 5 estrellas4.5/5 (23)
- El autismo: Reflexiones y pautas para comprenderlo y abordarloDe EverandEl autismo: Reflexiones y pautas para comprenderlo y abordarloCalificación: 4 de 5 estrellas4/5 (7)
- GuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisDe EverandGuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisCalificación: 4 de 5 estrellas4/5 (9)
- Hipnoparto Y Parto Creativo: Cómo dar a luz con confianza y sin miedo Altravez del Método LeclaireDe EverandHipnoparto Y Parto Creativo: Cómo dar a luz con confianza y sin miedo Altravez del Método LeclaireCalificación: 4 de 5 estrellas4/5 (7)