Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Diplomado 4
Cargado por
Shirley VelardeTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Diplomado 4
Cargado por
Shirley VelardeCopyright:
Formatos disponibles
DIPLOMADO
REJUVENECIMIENTO FACIAL
DURACIÓN 12 MESES (1200 HORAS)
40 CRÉDITOS
Módulo 4:
SISTEMA CARDIOVASCULAR Y SUS
ALTERACIONES METABÓLICAS
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 1
Contenido
Introducción...............................................................................................................................2
I. Sistema Cardiovascular.....................................................................................................3
II. Alteraciones Metabólicas...............................................................................................8
III. Inflamación...................................................................................................................18
IV. Disfunción Endotelial...................................................................................................26
V. Enfermedades Cardiovasculares relacionadas al envejecimiento.................................30
Bibliografía...............................................................................................................................32
Exámen......................................................................................................................................33
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 2
Introducción
La incidencia y prevalencia de enfermedades cardiovasculares se incrementa con la edad, hasta
el extremo de que se ha identificado como un factor de riesgo dominante en este tipo de
patologías.
Aunque la disfunción endotelial es un suceso clave en el desarrollo de estas enfermedades,
nuestro conocimiento de los mecanismos subyacentes se limita en gran medida a los modelos
animales.
De hecho, se ha considerado casi imposible determinar estos mecanismos en humanos, ya que
se requiere la obtención de vasos aislados de un gran número de sujetos. Actualmente se acepta
que el endotelio vascular es una delgada capa de células que tapiza la cara interior de las arterias
y tiene un papel fundamental en la regulación de la circulación sanguínea.
Entre otras cosas, es capaz de secretar sustancias, como el óxido nítrico (NO) y la prostaciclina,
que actúan sobre la pared vascular subyacente y producen vasodilatación, manteniendo los
vasos en buen estado y con una adecuada presión arterial.
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 3
I. Sistema Cardiovascular
El sistema cardiovascular está formado por el corazón y los vasos sanguíneos: arterias, venas y
capilares. Se trata de un sistema de transporte en el que una bomba muscular (el corazón)
proporciona la energía necesaria para mover el contenido (la sangre), en un circuito cerrado de
tubos elásticos (los vasos).
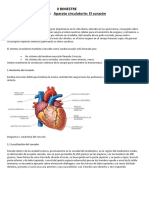
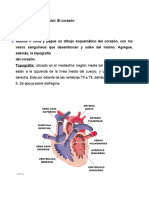
I.1. CORAZÓN ANATOMÍA MACROSCÓPICA
Localización
El corazón es un órgano musculoso formado por 4 cavidades. Su tamaño es parecido al de un
puño cerrado y tiene un peso aproximado de 250 y 300 g, en mujeres y varones adultos,
respectivamente. Está situado en el interior del tórax, por encima del diafragma, en la región
denominada mediastino, que es la parte media de la cavidad torácica localizada entre las dos
cavidades pleurales. Casi dos terceras partes del corazón se sitúan en el hemitorax izquierdo. El
corazón tiene forma de cono apoyado sobre su lado, con un extremo puntiagudo, el vértice, de
dirección anteroinferior izquierda y la porción más ancha, la base, dirigida en sentido
posterosuperior.
Pericardio
La membrana que rodea al corazón y lo protege es el pericardio, el cual impide que el corazón
se desplace de su posición en el mediastino, al mismo tiempo que permite libertad para que el
corazón se pueda contraer. El pericardio consta de dos partes principales, el pericardio fibroso y
el seroso.
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 4
El pericardio fibroso, más externo, es un saco de tejido conjuntivo fibroso duro no elástico.
Descansa sobre el diafragma y se continúa con el centro tendinoso del mismo. Las superficies
laterales se continúan con las pleuras parietales. La función del pericardio fibroso es evitar el
excesivo estiramiento del corazón durante la diástole, proporcionarle protección y fijarlo al
mediastino.
El pericardio seroso, más interno, es una fina membrana formada por dos capas:
a. la capa más interna visceral o epicardio, que está adherida al miocardio.
b. la capa más externa parietal, que se fusiona con el pericardio fibroso.
Entre las hojas parietal y visceral hay un espacio virtual, la cavidad pericárdica, que contiene
una fina capa de líquido seroso, el líquido pericárdico, que reduce la fricción entre las capas
visceral y parietal durante los movimientos del corazón. Pared La pared del corazón está
formada por tres capas:
Una capa externa, denominada epicardio, que corresponde a la capa visceral del pericardio
seroso.
Una capa intermedia, llamada miocardio, formada por tejido muscular cardíaco.
Una capa interna, denominada endocardio, la cual recubre el interior del corazón y las
válvulas cardíacas y se continúa con el endotelio de los granos vasos torácicos que llegan al
corazón o nacen de él.
Cavidades
El corazón está formato por 4 cavidades: dos superiores, las aurículas y dos inferiores, los
ventrículos. En la superficie anterior de cada aurícula se observa una estructura arrugada a
manera de bolsa, la orejuela, la cual incrementa levemente la capacidad de la aurícula.
1. Aurícula derecha: Es una cavidad estrecha, de paredes delgadas, que forma el borde derecho
del corazón y está separada de la aurícula izquierda por el tabique interauricular. Recibe sangre
de tres vasos, la vena cava superior e inferior, y el seno coronario. La sangre fluye de la aurícula
derecha al ventrículo derecho por el orificio aurícula ventricular derecho, donde se sitúa la
válvula tricúspide, que recibe este nombre porque tiene tres cúspides.
2. Ventrículo derecho: Es una cavidad alargada de paredes gruesas, que forma la cara anterior
del corazón. El tabique interventricular lo separa del ventrículo izquierdo. El interior del
ventrículo derecha presenta unas elevaciones musculares denominadas trabéculas carnosas. Las
cúspides de la válvula tricúspide están conectadas entre sí por las cuerdas tendinosas que se
unen a los músculos papilares. Las cuerdas tendinosas impiden que las valvas sean arrastradas al
interior de la aurícula cuando aumenta la presión ventricular. La sangre fluye del ventrículo
derecho a través de la válvula semilunar 4 pulmonar hacia el tronco de la arteria pulmonar. El
tronco pulmonar se divide en arteria pulmonar derecha y arteria pulmonar izquierda.
3. Aurícula izquierda: Es una cavidad rectangular de paredes delgadas, que se sitúa por detrás de
la aurícula derecha y forma la mayor parte de la base del corazón. Recibe sangre de los
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 5
pulmones a través de las cuatro venas pulmonares, que se sitúan a la cara posterior, dos a cada
lado. La cara anterior y posterior de la pared de la aurícula izquierda es lisa debido a que los
músculos pectíneos se sitúan exclusivamente en la orejuela. La sangre pasa de esta cavidad al
ventrículo izquierdo a través del orificio aurículo-ventricular izquierdo, recubierto por una
válvula que tiene dos cúspides válvula mitral (o bicúspide).
4. Ventrículo izquierdo: Esta cavidad constituye el vértice del corazón, casi toda su cara y borde
izquierdo y la cara diafragmática. Su pared es gruesa y presenta trabéculas carnosas y cuerdas
tendinosas, que fijan las cúspides de la válvula a los músculos papilares. La sangre fluye del
ventrículo izquierdo a través de la válvula semilunar aórtica hacia la arteria aorta. El grosor de
las paredes de las 4 cavidades varía en función de su acción. Las aurículas tienen unas paredes
delgadas debido a que solo transfieren la sangre a los ventrículos adyacentes. El ventrículo
derecho tiene una pared más delgada que el ventrículo izquierdo debido a que bombea la sangre
a los pulmones, mientras que el ventrículo izquierdo la bombea a todo el organismo. La pared
muscular del ventrículo izquierdo es entre 2-4 veces más gruesa que la del ventrículo derecho.
Entre el miocardio auricular y ventricular existe una capa de tejido conjuntivo denso que
constituye el esqueleto fibroso del corazón. Cuatro anillos fibrosos, donde se unen las válvulas
cardiacas, están fusionados entre si y constituyen una barrera eléctrica entre el miocardio
auricular y ventricular. Inervación El corazón está inervado por fibras nerviosas autónomas,
tanto del sistema parasimpático como del sistema simpático, que forman el plexo cardíaco. Las
ramas del plexo cardiaco inervan el tejido de conducción, los vasos sanguíneos coronarios y el
miocardio auricular y ventricular. Las fibras simpáticas proceden de los segmentos medulares
cervical y torácico. La inervación parasimpática deriva de los nervios vagos o X par craneal.
Irrigación En la parte inicial de la aorta ascendente nacen las dos arterias coronarias principales,
la arteria coronaria derecha y la arteria coronaria izquierda. Estas arterias se ramifican para
poder distribuir la sangre oxigenada a través de todo el miocardio. La sangre no oxigenada es
drenada por venas que desembocan el seno coronario, la cual desemboca en la aurícula derecha.
El seno coronario se sitúa en la parte posterior del surco auriculoventricular.
1.2. ANATOMÍA MICROSCÓPICA
Músculo cardíaco
El miocardio o músculo cardíaco está formado por fibras musculares estriadas más cortas y
menos circulares que las fibras del músculo esquelético. Presentan ramificaciones, que se
conectan con las fibras vecinas a través de engrosamientos transversales de la membrana celular
o sarcolema, denominados discos intercalares. Estos discos contienen uniones intercelulares que
permiten la conducción de potenciales de acción de una fibra muscular a las otras vecinas.
Sistema de conducción cardíaco Cada latido cardíaco se produce gracias a la actividad eléctrica
inherente y rítmica de un 1% de las fibras musculares miocárdicas, las fibras autorrítmicas o de
conducción. Estas fibras son capaces de generar impulsos de una forma repetida y rítmica, y
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 6
actúan como marcapasos estableciendo el ritmo de todo el corazón, y forman el sistema de
conducción cardíaco. El sistema de conducción garantiza la contracción coordinada de las
cavidades cardíacas y de esta forma el corazón actúa como una bomba eficaz. Los componentes
del sistema de conducción son:
1. El nódulo sinusal o nódulo sinoauricular, localizado en la pared de la aurícula derecha, por
debajo de desembocadura de la vena cava superior. Cada potencial de acción generado en este
nódulo se propaga a las fibras miocárdicas de las aurículas.
2. El nódulo auriculoventricular (AV) se localiza en el tabique interauricular. Los impulsos de
las fibras musculares cardíacas de ambas aurículas convergen en el nódulo AV, el cual los
distribuye a los ventrículos a través del
3. haz de His o fascículo auriculoventricular, que es la única conexión eléctrica entre las
aurículas y los ventrículos. En el resto del corazón el esqueleto fibroso aísla eléctricamente las
aurículas de los ventrículos.
4. El fascículo aurículoventricular se dirige hacia la porción muscular del tabique
interventricular y se divide en sus ramas derecha e izquierda del haz de His, las cuales a través
del tabique interventricular siguen en dirección hacia el vértice cardíaco y se distribuyen a lo
largo de toda la musculatura ventricular.
5. Por último, el plexo subendocárdico terminal o fibras de Purkinje conducen rápidamente el
potencial de acción a través de todo el miocardio ventricular.
VASOS SANGUÍNEOS
Los vasos sanguíneos forman una red de conductos que transportan la sangre desde el corazón a
los tejidos y desde los tejidos al corazón. Las arterias son vasos que distribuyen la sangre del
corazón a los tejidos. Las arterias se ramifican y progresivamente en cada ramificación
disminuye su calibre y se forman las arteriolas. En el interior de los tejidos las arteriolas se
ramifican en múltiples vasos microscópicos, los capilares que se distribuyen entre las células.
Los 6 capilares se unen en grupos formando venas pequeñas, llamadas vénulas, que se fusionan
para dar lugar a venas de mayor calibre. Las venas retornan la sangre al corazón. Las paredes de
los grandes vasos, arterias y venas, están constituidos por tres capas:
1. La capa interna está constituida por un endotelio (epitelio escamoso simple), su membrana
basal y una capa de fibras elásticas.
2. La capa media está compuesta por tejido muscular liso y fibras elásticas. Esta capa es la que
difiere más, en cuanto a la proporción de fibras musculares y elásticas y su grosor entre venas y
arterias.
3. La capa externa o adventicia se compone principalmente tejido conjuntivo.
ARTERIAS
Las arterias son vasos cuyas paredes están formadas por tres capas (capa interna o endotelio,
capa media y capa externa o adventicia), con un predominio de fibras musculares y fibras
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 7
elásticas en la capa media. Ello explica las principales características de las arterias: la
elasticidad y la contractilidad. Según la proporción de fibras elásticas y musculares de esta capa
se pueden diferenciar dos tipos de arterias: arterias elásticas y arterias musculares.
Las arterias elásticas son las de mayor calibre, la aorta y sus ramas, tienen una mayor
proporción de fibras elásticas en su capa media y sus paredes son relativamente delgadas en
relación con su diámetro. La principal función de estas arterias es la conducción de la sangre del
corazón a las arterias de mediano calibre.
Las arterias musculares son las de calibre intermedio y su capa media contiene más músculo
liso y menos fibras elásticas. Gracias a la contracción (vasoconstricción) o dilatación
(vasodilatación) de las fibras musculares se regula el flujo sanguíneo en las distintas partes del
cuerpo.
ARTERIOLAS
Las arteriolas son arterias de pequeño calibre cuya función es regular el flujo a los capilares. La
pared de las arteriolas tiene una gran cantidad de fibras musculares que permiten variar su
calibre y, por tanto, el aporte sanguíneo al lecho capilar.
CAPILARES
Los capilares son vasos microscópicos que comunican las arteriolas con las vénulas. Se situan
entre las células del organismo en el espacio intersticial para poder facilitar el intercambio de
sustancias entre la sangre y las células. Las paredes de los capilares son muy finas para permitir
este intercambio. Están formadas por un endotelio y una membrana basal. Los capilares forman
redes extensas y ramificadas, que incrementan el área de superficie para el intercambio rápido
de materiales. Los capilares nacen de las arteriolas terminales y en el sitio de origen presentan
un anillo de fibras de músculo liso llamado esfinter precapilar, cuya función es regular el flujo
sanguíneo hacia los capilares.
VENAS Y VÉNULAS
La unión de varios capilares forma pequeñas venas denominadas vénulas. Cuando la vénula
aumenta de calibre, se denomina vena. Las venas son estructuralmente muy similares a las
arterias aunque sus capas interna y media son más delgadas. La capa muscular y elástica es
mucho más fina que en las arterias porqué presentan una menor cantidad de fibras tanto
elásticas como musculares. La capa externa (adventicia) es más gruesa y contiene más tejido
conjuntivo. Las venas de las extremidades inferiores presentan válvulas en su pared, que es una
proyección interna del endotelio. La función de estas válvulas es impedir el reflujo de sangre y
ayudar a dirigir la sangre hacia el corazón.
ANASTOMOSIS
Se llama anastomosis a la unión de dos o más vasos. Existen distintos tipos de anastomosis:
Anastomosis arteriales: es la unión de dos ramas arteriales que irrigan una misma región. Las
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 8
anastomosis arteriales constituyen rutas alternas para que llegue sangre a un tejido u órgano.
Anastomosis arteriovenosa: es la comunicación directa entre una arteriola y una vénula de
manera que la sangre no pasa a través de la red capilar.
SISTEMA LINFÁTICO
El líquido intersticial entra en los capilares linfáticos situados en el espacio intersticial, cuyas
paredes presentan poros que permiten la entrada de líquido, pequeños solutos y grandes
partículas. Desde los capilares, el fluido llamado linfa, se dirige a las venas linfáticas a través de
las cuales llegan a dos grandes conductos donde se drena toda la linfa de nuestro organismo: el
conducto linfático derecho y el conducto torácico. De esta forma la linfa retorna al sistema
cardiovascular.
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 9
II. Alteraciones Metabólicas
A principios del siglo 20 la esperanza de vida media al nacer en los países desarrollados para los
hombres y las mujeres en conjunto se estimó en 50 años; 100 años después, la esperanza de vida
media es superior a los 77 años y se prevé que aumente a un promedio de 85 años para el año
2025 (AJ., 2011, pág. 175); incluso, la mayoría de teorías de predicción sobre la esperanza de
vida estiman que esta seguirá aumentando inclusive presentando una esperanza de vida de 105
años en el año 2065 (E., 2012, pág. 325).
Este cambio se debe principalmente a la eficiencia de nuestros sistemas de salud pública
(sistemas sanitarios: incluidos algunos países de Latinoamérica como México, Venezuela,
Brasil, Argentina, Perú, etc.) que ha dado como resultado el abatimiento de la mortalidad y por
lo tanto, el promedio de vida media de las personas que se puedan clasificar como “ancianos”
(60 años) se prolongará. (Palloni A, 2007)
El porcentaje de la población con 60 años y más, ha aumentado del 2 al 4% en 1900 a más del
13% en algunos países de Latinoamérica, el problema actual es que muchos de estos países no
poseen cobertura real y efectiva para esta población.
1. Envejecimiento y desregulación de la ingesta
La edad avanzada se asocia con alteraciones en las respuestas de la ingesta. Las fluctuaciones
del equilibrio en la sobrealimentación y la subalimentación son hoy en día un excelente objetivo
para ser estudiado en forma sistemática. (Jacobson A, 2010).
Muchas de las causas de la desregulación en la ingesta de alimentos durante el envejecimiento
se desconocen, en gran parte debido a los mecanismos subyacentes a la propia regulación
energética y esto es a cualquier edad. En el humano este, desde el punto de análisis bioquímico-
metabólico-fisiológico hoy en día no se explica completamente, por ejemplo, en los adultos
jóvenes se acepta que existen múltiples mecanismos para regular el equilibrio de energía dentro
de límites bastantes estrechos, (hambre y saciedad) y que éste está regulado tanto
periféricamente como a nivel central Hoy en día las tendencias seculares a la ganancia de peso
alrededor del mundo (durante los últimos 30 años), han demostrado la ineficacia de estos
mecanismos corporales de regulación; sin embargo, un consenso demostró que estos
mecanismos de regulación de la energía suelen proteger a los niños y adultos jóvenes; sin
embargo en la vejez, estos cambios puede tener múltiples explicaciones (anorexia del
envejecimiento), así también es importante reconocer cuales son los factores involucrados en los
mecanismos de regulación de energía (Figura 1). Esto implicará posteriormente que un número
bastante grande de estos mecanismos podría verse afectado con la edad, en especial en la
regulación de la ingesta; este aspecto es muy importante identificarlo y atenderlo
tempranamente.
Asociación entre la percepción de los alimentos y la regulación de su consumo en el adulto
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 10
mayor
Durante la vejez la sensibilidad al sabor y aroma juegan un papel importante en la
desregularización de energía; en particular, la mayoría de los estudios sugieren que la detección
y reconocimiento del umbral de la sal y otros sabores específicos se ven afectados con la edad,
en parte por el uso de medicamentos que impactan en el sabor pero también por la pérdida
funcional del olfato y el gusto. No está bien documentado si la disminución en la sensibilidad
del gusto y del olfato asociado a la edad puede desempeñar un papel en la desregulación de la
energía.
Los sentidos intactos del gusto y del olfato son necesarios para la fase cefálica de la digestión,
esto incluye los aumentos iniciales en las secreciones salivares, estomacales, pancreáticas e
intestinales que inician la digestión. La fase cefálica del metabolismo postprandial se inicia por
la estimulación olfativa, gustativa y cognitiva de los alimentos e incluye la activación de los
sistemas nerviosos simpático y parasimpático, que a su vez inicia múltiples procesos
relacionados con la digestión con el fin de la preparación del cuerpo a absorber nutrientes. (Z.,
2010)
La estimulación cognitiva, visual y olfatoria puede ocasionar un incremento de salivación que
va entre los rangos de un cuarto y un tercio de la necesaria para la masticación pero no
deglución. Debido a que la saliva contiene enzimas digestivas, estas inician el desdoblamiento
del almidón, el incremento de la producción de saliva por el consumo de la mayoría de los
alimentos, puede acelerar la digestión y absorción de los carbohidratos.
La estimulación insípida tiene efectos mínimos en la secreción de ácidos gástricos y
pancreáticos, mientras que las comidas apetitosas tienen mejores resultados en marcar la
estimulación y secreción que promueve la digestión. Relacionada a esta observación la
evidencia sugiere que lo aceptable-apetitoso puede influir en el rango de la absorción de
nutrientes y en la eficiente interacción metabólica de la glucosa: Glucólisis-Glucogenólisis.
El consumo de comida insípida reduce la respuesta glucémica en comidas apetitosas con
idéntica composición de macronutrientes, que sugiere que existe una reducción de rango de
vaciamiento gástrico y por lo tanto menos digestión en las comidas insípidas. Se ha estudiado
que hay diferencias entre la comida apetitosa y la comida insípida así como sus efectos en la
circulación de la glucosa; Las comidas liquidas tienen diferentes efectos de saciedad
comparados con los sólidos.
Si, la perdida de sabor y olor está asociada con el envejecimiento, se sabe tiene un efecto
(comúnmente se reporta el hacer las comidas más blandas) que anticipa en la reducción del
vaciado gástrico y por lo tanto el retraso en la absorción de los nutrientes, esto puede explicar el
incremento de saciedad y la consecuente pérdida de hambre en edad avanzada. Consistente con
estas situaciones los individuos en edad avanzada comen más porciones individuales (si tienen
comprometido el sabor y el olfato), esto se relacionada significativamente con el hambre y el
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 11
apetito: los individuos de edad avanzada tienen una reducida habilidad de reconocer porciones
de comida en pruebas con los ojos vendados.
Regulación hambre-saciedad durante el envejecimiento
La saciedad se define como la sensación de plenitud de comer, lo que frecuentemente se altera
en la vejez, varios estudios han documentado un hambre anormalmente baja después de la
inducción experimental de ayuno o balance energético negativo en personas ancianas. El
hambre antes de las comidas y el aumento de la saciedad postprandial son colaboradores
independientes de regulación energética en la vejez, el aumento de la saciedad se asocia con el
aumento de la superficie del antro estomacal y con una aparente distensión de este después del
consumo de las comidas. Existe una reducción en la percepción de hambre y/o un aumento de la
saciedad, lo que contribuye a la pérdida de peso en el envejecimiento.
Relación en la regulación de energía: factores asociados al envejecimiento
La pérdida de peso y grasa en el adulto mayor se ve influenciado por los cambios en la
regulación de la energía que se producen en forma normal, donde la capacidad para regular con
precisión el consumo de energía se ve afectado. Para explicarse este cambio se acepta que
influyen factores como: la tasa de retraso en la absorción de macronutrientes secundario a la
reducción de la agudeza del gusto y el olfato; mediadores hormonales y metabólicos de
regulación de la energía que cambian durante el envejecimiento, cambios en los patrones de
ingesta alimentaria y una reducción en la variedad de los alimentos consumidos en la vejez que
disminuye aun más el consumo de energía.
Una variabilidad de la alimentaciónsobrealimentación en el día a día puede ser de hasta un 20-
25%. Esta pérdida ha sido asociada también a deficiencias de micronutrientes, fragilidad,
traumatismos derivados de caídas, retraso en la recuperación de heridas y mortalidad acelerada,
esto se observa entre los 65 y 75 años, incluso en individuos sanos.
Los factores como el gasto de energía para la actividad física y la tasa metabólica basal se
modifican sustancialmente durante el envejecimiento, la variabilidad en el gasto de energía por
lo general es alrededor de un 10%; en conjunto, estos factores contribuyen con un aumento de la
susceptibilidad al desequilibrio energético tanto positivo como negativo y esto se asocia con el
deterioro de la salud.
La glucosa y la insulina como mediadores de la ingesta de alimentos
Las alteraciones en la homeostasis de la glucosa en la tercera edad pueden contribuir a alterar el
hambre y la saciedad, por una parte sabemos que la glucosa en la sangre ha sido postulada a ser
un disparador de señales de hambre en humanos, estudios recientes en adultos jóvenes y en
modelos animales vinculan transitoriamente pequeñas disminuciones de la glucosa en sangre al
inicio del consumo de alimento; los alimentos con un alto índice glucémico, como el pan
blanco, cereales y otros carbohidratos refinados (índice glucémico de 100-120) se utilizan como
referencia con un valor fijado en 100 y que inducen hipoglucemia relativa de los 90 a los 120
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 12
minutos después del consumo de estos alimentos lo que condiciona a un retorno más rápido del
hambre y un aumento en el consumo energético posterior (comer en exceso). La mayoría de los
adultos jóvenes mantienen la glucosa circulante en el rango de 80-140 mg/dl a lo largo de ciclos
de alimentación y ayuno a través de oscilaciones en las secreciones equilibradas de insulina y de
hormonas contra-reguladoras que sirven para facilitar la absorción y síntesis y liberación de
glucosa bajo diferentes condiciones metabólicas. Sin embargo, cuando se produce la
hipoglucemia esto provoca sensaciones de hambre, en contraste los adultos mayores, incluso
saludables tienen una gama más amplia sobre el cual se mantiene la glucosa circulante y además
se atenúa las respuestas contra-reguladoras y el retraso a la recuperación de la hipoglucemia.
Además de la insulina y la glucosa, el cortisol y el sulfato de dehidroepiandrosterona (DHEAS)
se han asociado con la saciedad.
La elevación de los niveles circulantes de insulina (un 8% mayor que en adultos jóvenes) es
típica de la sensibilidad a la insulina que ocurre en la vejez y que acompaña a los niveles altos
de glucosa postprandial, esto contribuye a un retorno tardío del hambre, tal vez a través de un
efecto de saciedad central y de los niveles altos de insulina o mediante la alteración de la
sensibilidad central a otros componentes de la cascada de mecanismos que regulan la ingesta de
alimentos tales como la colecistoquinina (CCK) y el neuropéptido Y (NPY); los niveles
persistentemente elevados de glucosa postprandial así como de insulina pueden ser explicados
por la reducción en el vaciado gástrico en la vejez (este es más lento), así el vaciamiento
gástrico retardado extenderá el periodo de tiempo durante el cual los nutrientes aparecen en la
circulación y esto propiciará una digestión más prolongada. Por otra parte esta no es la única
explicación detrás el consumo de comida en las personas de edad avanzada; la captación tardía
de la glucosa por el músculo y el hígado también proporcionan otra explicación. Al respecto se
ha descrito también la deficiencia de la acción de la orexina, en particular de la señalización de
su receptor 2, ya que altera los mecanismos de protección contra la resistencia a la insulina que
se asocian con el envejecimiento, por lo que se sugiere que la orexina es un factor crucial para
prevenir la resistencia a la insulina que acompaña al envejecimiento.
2. Efecto del retardo del vaciado gástrico en el envejecimiento
La mayoría de los estudios que examinan el vaciamiento gástrico en relación a la edad han
reportado alteraciones en los ancianos, el retraso en el vaciado gástrico, en general se ha
relacionado con la reducción del hambre y la saciedad mayor y por lo tanto potencialmente
pueden contribuir a aumentar la saciedad y la disminución del hambre en los ancianos. Varios
modelos de regulación de la energía postulan un papel central para la disponibilidad de sustratos
en la regulación de la energía, la glucosa en la sangre y el hambre apoyan el concepto del papel
de que la baja concentración de glucosa en la sangre inicia las señales de hambre en los adultos
jóvenes; el retardo en el vaciamiento gástrico presumiblemente se extiende desde el periodo
durante el cual no solo la glucosa si no también otros sustratos de energía se absorben, además
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 13
de influir en el hambre y la saciedad a través de la disponibilidad de nutrientes.
Las alteraciones en el vaciamiento gástrico en la tercera edad presumiblemente también dan
lugar a un prolongado periodo de distención del estómago lo que además podría prolongar la
saciedad directamente a través de señales vagales aferentes, en los ancianos se sugiere que el
aumento de la presión de las ondas fásicas pilóricas en respuesta a los nutrientes en el duodeno
en conjunto con las alteraciones de la función del sistema nervioso autónomo (que es común en
los ancianos) y una distención antral elevada son las causas subyacentes de retraso del
vaciamiento gástrico (Figura 2).
FIGURA 2 Mecanismo de regulación saciedad-hambre
Se ha sugerido que una reducción en la producción de óxido nítrico por el estómago de los
adultos mayores aumenta la saciedad por medio de un mecanismo que induce la reducción de la
relajación del fundus y acelera el movimiento de los alimentos para el antro estomacal.
Factores asociados a alteraciones en la alimentación
Muchos de los cambios en el envejecimiento (sociales y de salud) han sugerido múltiples causas
para desarrollar una pérdida de peso, tales como: la pobreza, el duelo, el aislamiento social, la
mala dentición, las enfermedades crónicas y el uso de múltiples medicamentos.
Otro factor muy importante es la depresión ya que esta se ha sugerido como una causa de
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 14
pérdida de peso entre las personas mayores. La depresión se asoció con la pérdida de peso solo
en personas mayores de 55 años de edad y se asocia actualmente con el aumento de peso en los
adultos jóvenes. Una posible explicación para este hallazgo es que los factores psicosociales son
catalizadores potenciales de la pérdida de peso solo cuando hay un deterioro subyacente en la
regulación de la ingesta de alimentos (impide comer para expresarse). En cuanto al aislamiento
social se sabe que se come menos cuando se come solo en comparación con las comidas en
compañía, la diferencia en el consumo entre las dos situaciones es un importante 30%, en estos
datos se sugieren que el consumo social es desfavorable ya que promueve la sobrealimentación
y la obesidad, todo lo contrario que al comer solo, lo que puede conducir a la pérdida de peso.
Esto es especialmente cierto cuando se considera que los seres humanos somos una especie de
animal gregario y naturalmente comemos en grupos (sociales). Este dato es relevante en cuanto
a la menor alimentación y además de baja calidad (rica en carbohidratos) en el envejecimiento,
además el luto y la discapacidad funcional (sordera, miopía o hipermetropía, aislamiento social)
limitan el contacto social. (Figura 3)
FIGURA 3 Factores asociados a la pérdida de peso durante el envejecimiento.
Reloj regulador del metabolismo
El mantenimiento del gradiente electroquímico de energía, los procesos de biosíntesis, procesos
catabólicos y el transporte de moléculas son funciones básicas en todo el organismo mediadas
por la tasa metabólica basal. Existe una estrecha relación entre una alteración en este gasto
energético y el envejecimiento, hay una desaceleración natural del metabolismo con la edad, sin
embargo, no es una sentencia de muerte para el metabolismo; por el contrario, la mayor parte
del metabolismo de una persona puede ser controlada mediante el mantenimiento de un estilo de
vida activo; una persona puede mantener un cuerpo de manera eficiente.
Los sistemas orgánicos en los mamíferos están programados (por lo general) para un reloj de 24
horas, investigaciones han demostrado que este reloj regula los niveles de energía y por lo tanto
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 15
el metabolismo. Varias proteínas que regulan el reloj y el metabolismo están relacionadas y
dependen unas de otras.
Factores involucrados en la regulación del reloj-alimenticio: metabolismo
La ingesta de alimentos, tanto en calidad como en cantidad, posee un gran peso. Actualmente,
existe una intensa investigación en el área de la restricción calórica, lo cual puede explicar el
hecho de por qué el síndrome metabólico, en presencia de una dieta hipercalórica, se asocia
fuertemente al desarrollo de enfermedades degenerativas y a una disminución en la esperanza de
vida. La restricción calórica, considerada como una disminución del 30-40% de una ingesta a
demanda libre, ha demostrado un incremento en la esperanza de vida de hasta un 50% o más
(estudio realizado en roedores); esta respuesta se ha vinculado principalmente con dos
moléculas: Las sirtuinas (particularmente, SIRT1), y la proteína TOR (“objetivo de
Rapamicina”, por sus siglas en inglés).
Otro compuesto de interés es el resveratrol, un polifenol que se encuentra en el vino tinto y que
tiene la propiedad de incrementar el AMPc y secundariamente, el NAD+, de manera tal que
contribuye a la activación de SIRT1 y consecuentemente, a sus efectos.
Una de las proteínas involucradas en la regulación del metabolismo es la leptina, esta proteína
funciona como un regulador de este reloj de 24 horas a través del control hormonal y debido a
que leptina posee un ritmo de 24 horas y es responsable de establecer el calendario de otras
hormonas, la regla N° 1 de la dieta de esta proteína es: no coma después de la cena; así mismo
uno de los temas claves de la dieta de la leptina es: "comer es tan importante como lo que se
come" (30). (Figura 4)
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 16
FIGURA 4 Factores reguladores del metabolismo basal.
Nuestros ritmos circadianos y el metabolismo están íntimamente relacionados para garantizar
que las células funcionen correctamente y así poder mantenerse saludables; esto da pauta a
nuevos estudios para entender como estos dos procesos fundamentales pueden tener un gran
impacto en los nuevos tratamientos para las enfermedades causadas por deficiencia de energía
celular (Alzheimer, Parkinson, Diabetes etc.); por lo que es de gran relevancia el investigar qué
genes modificadores se producen y como se relacionan con el metabolismo celular y la
producción de energía.
TOR
TOR (proteína diana de la rapamicina) es una proteína cinasa sensible a los nutrientes que
regula el crecimiento y metabolismo en todas las células eucariontas, se ha sugerido ser la
responsable por la mayor parte de incremento en la esperanza de vida asociada a la restricción
calórica (31-33). La influencia del subtipo de esta proteína en los mamíferos (mTOR), TORC1,
influencia procesos celulares como la traducción del ARNm, autofagia, transcripción,
metabolismo y supervivencia celular, proliferación, tamaño y crecimiento; lo cual la ha
vinculado a ejercer una gran influencia en la esperanza de vida de los organismos, desde
levaduras hasta mamíferos e incluso, humanos.
Las células eucariónticas utilizan la vía de señalización de TORC1 para adaptar la relación entre
la cantidad y calidad de nutrientes que obtiene el organismo (el tamaño y crecimiento celulares),
de manera tal que la supresión de aminoácidos actúa como un potente inhibidor de TORC1
incluso en presencia de factores de crecimiento, develando su relación con la nutrición.
El envejecimiento no se produce por acumulación de daño molecular, como antes se pensaba,
sino como continuación del desarrollo celular. Es así, que tanto el crecimiento como el
envejecimiento se ven estimulados por vías de señalización sensibles de nutrientes y mitógenos.
Entre estas vías, se encuentra mTOR, la cual se encuentra también involucrada en el desarrollo
del cáncer, puesto que su sobreactivación puede volver a las células normales en no
respondedoras a factores de crecimiento. Así, el mTOR se considera un gerosupresor (inhibe
procesos de senescencia celular).
SIRT1 (Sirtuina)
Las sirtuinas son una familia de deacetilasas dependientes de NAD+, lo cual permitió vincular
su influencia en el envejecimiento al considerarlas sensibles a la dieta y metabolismo (28).
Estudios realizados en ratones con fenotipos similares a la diabetes tipo 2, cáncer y la
enfermedad de Alzheimer, han demostrado que la expresión de SIRT1 produce un incremento
en la esperanza de vida y un envejecimiento saludable.
La proteína SIRT1 es clave en el reloj biológico (ritmos circadianos) esta se convierte en
mensajes anti-envejecimiento del metabolismo llamado SIRT1; activa los principales pasos de
la producción de energía en las células y retroalimenta directamente a este sistema de reloj
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 17
circadiano, la activación de SIRT1 es una de las claves para regular el sistema metabólico
durante el envejecimiento. (Figura 5)
FIGURA 5 Restricción calórica-envejecimiento y su relación con SIRT y TOR.
Los hidratos de carbono como combustible, inducen el metabolismo del colesterol, aumentan la
beta oxidación de las grasas y modulan a que la insulina funcione correctamente; SIRT1
estimula la secreción de insulina por las células β del páncreas. La regulación de este sistema
induce a no comer en exceso y propone en los mamíferos un patrón de ingestametabolismo-
energía lo más saludable posible.
Modulación de SIRT1 y su actividad en la regulación mitocondrial
La disfunción mitocondrial juega un papel importante en el envejecimiento y enfermedades
relacionadas al envejecimiento, por lo que el mantenimiento de su función es benéfico en la
prevención o retraso de enfermedades relacionadas.
Un regulador de la biogénesis mitocondrial, el PGC-1α (receptor co-activador proliferador de
perixosomas-α), es una molécula central, que regula la función mitocondrial e influencia
distintos aspectos del destino de las células y cuya función se encuentra afectada en el
envejecimiento. Además, promueve la expresión de barredores de especies reactivas de oxígeno
y por lo tanto previniendo neurodegeneración mediada por estrés oxidativo. La activación de
SIRT1 induce un incremento en la actividad de PGC-1α. Es por ello que su modulación también
podría ofrecer un potencial terapéutico en enfermedades relacionadas con el envejecimiento.
Además, PGC-1 α activa la factores de transcripción, entre ellos, los PPAR (receptor activado-
proliferación de peroxisomas). Uno de sus co-represores, el SMRT (receptor-silenciador
mediador de la hormona tiroidea y retinoides) es una molécula que regula muchos factores de
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 18
transcripción y que se ha visto implicada en la producción de radicales libres de oxígeno, por lo
que se vinculado con el desarrollo del envejecimiento y los trastornos metabólicos relacionados.
III. Inflamación
El sistema inmunitario está formado por dos componentes que trabajan coordinadamente para
protegernos de los patógenos -la inmunidad innata y la inmunidad adaptativa-
1. La inmunidad innata (nacemos con ella) es capaz de combatir la infección desde el inicio,
pero es inespecífica ya que no identifica patógenos concretos, sino que reconoce moléculas
conservadas en familias de patógenos, denominadas Patrones Moleculares Asociados a
Patógenos (PAMP). Las células inmunitarias innatas tienen receptores para PAMP que les
permiten reconocer y fagocitar a la mayoría de los microbios. Si la respuesta innata es incapaz
de eliminar a todos los patógenos se desencadena la inflamación, respuesta que recluta células
inmunitarias adicionales al foco infeccioso, dificulta la invasión del patógeno y favorece la
reparación de los tejidos dañados. Este proceso se inicia por el daño celular o tisular
(traumatismos, hemorragias, etc.) o lo inicia la propia respuesta innata. Los macrófagos, por
ejemplo, además de fagocitar al patógeno, secretan mediadores lipídicos (como prostaglandinas
o leucotrienos) y citocinas (como TNF-α, IL-1 o IL-6) que causan inflamación.
En una infección bacteriana o fúngica se reclutan, sobre todo, neutrófilos, que cuentan con los
mismos receptores que los macrófagos y les ayudan a fagocitar a los patógenos. En una
infección vírica se reclutan, sin embargo, células NK (del inglés Natural Killer), que son células
citotóxicas capaces de eliminar aquellas células infectadas por el virus.
La inmunidad adaptativa o adquirida está mediada por los linfocitos
1. Los linfocitos B reconocen patógenos extracelulares o sus moléculas, que llamamos
antígenos (Ag), gracias a su receptor denominado inmunoglobulina (Ig). En la medula ósea, se
genera por azar un repertorio casi ilimitado de linfocitos B, que
denominamos vírgenes (especificidades diferentes), cada uno de los cuales expresa una Ig
diferente, pudiendo así reconocer una amplia variedad de Ag. No obstante, tal variabilidad de
linfocitos B genera un problema ya que hay muy pocos específicos para cada Ag, por lo que los
linfocitos deben proliferar durante, al menos, una semana para poder eliminar al patógeno tras la
inducción de la respuesta adaptativa. Después de proliferar, los linfocitos B se transforman en
células plasmáticas que secretan la forma soluble de su Ig de membrana o anticuerpo (Ac), el
cuál favorecerá la eliminación del patógeno. Una parte de estos linfocitos que proliferan
permanecen en nuestro organismo como linfocitos B de memoria, más abundantes y eficaces
que los vírgenes, que nos protegerán de infecciones futuras por ese microbio. Esta memoria
inmunológica es una de las características que diferencia la respuesta adaptativa de la innata y
constituye la base de la vacunación.
Los patógenos intracelulares, como los virus, no pueden ser reconocidos y eliminados dentro de
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 19
nuestras células por los Ac. Por ello, a lo largo de la evolución se ha generado otro tipo de
linfocitos, denominados T, que están especializados en reconocer Ag intracelulares a través de
su receptor TCR (del inglés T Cell Receptor). El TCR reconoce péptidos derivados de las
proteínas intracelulares que son presentados por las moléculas del Complejo Mayor de
Histocompatibilidad (MHC) expresadas por nuestras células. El timo es el lugar donde maduran
los linfocitos T, y en él se forma por azar un repertorio casi ilimitado de linfocitos T
vírgenes diferentes, cada uno de los cuales expresa un TCR diferente, permitiendo el
reconocimiento de péptidos intracelulares extraños (por ejemplo, derivados de un virus). Los
linfocitos T vírgenes se activan cuando reconocen un péptido presentado por una célula
presentadora de antígeno y se dividen durante, al menos, una semana para generar un número
suficiente de linfocitos, los cuales van a eliminar al patógeno o a las células infectadas. Algunos
linfocitos T que proliferan también permanecen en nuestro organismo durante largo tiempo
(incluso toda la vida) como linfocitos T de memoria (10-100 veces más numerosos que los
vírgenes y más eficaces) que nos van a proteger de infecciones futuras por ese microbio.
Los linfocitos T pueden dividirse en dos grandes grupos según expresen las moléculas CD4 o
CD8, cada uno de los cuales se encarga de una respuesta específica para un tipo diferente de
patógeno. Los linfocitos T CD8 o citotóxicos eliminan las células infectadas con patógenos
intracelulares, fundamentalmente virus. Sin embargo, los linfocitos T CD4, también
denominados helper o cooperadores, colaboran con otros tipos de células inmunitarias para
eliminar diferentes tipos de patógenos. Dentro de ellos, los linfocitos Th1 coordinan la respuesta
contra patógenos intracelulares, los Th2 contra los helmintos y los Th17 contra micro-patógenos
extracelulares (como bacterias y hongos). Otros linfocitos T CD4 colaboran con los linfocitos B
en la producción de Ac o tienen funciones regulatorias, como los linfocitos T reguladores o
Treg.
Inmunosenescencia
Igual que el resto del organismo, el sistema inmunitario también envejece2. Se emplea el
término inmunosenescencia para designar el deterioro del sistema inmunitario provocado por el
envejecimiento. La inmunosenescencia afecta a la defensa contra las infecciones, que siguen
siendo la principal causa de muerte en los ancianos. Además, la vacunación sólo tiene un éxito
parcial en individuos de edades avanzadas. (Rich RR, 2008)
La respuesta a algunas vacunas, como la de la hepatitis B, comienza a declinar a partir de los 40
años. A los 50 comienza la reactivación de virus latentes, como el virus de varicela zoster
(VZV), y se incrementa significativamente la morbilidad y mortalidad por la gripe. A partir de
la séptima u octava década de la vida se produce un decaimiento abrupto de la inmunidad.
El envejecimiento afecta a todos los elementos de la respuesta inmunitaria, tanto innata como
adaptativa, pero hay dos características esenciales que definen la inmunosenescencia: la
reducción de los linfocitos T vírgenes y un incremento sostenido de la inflamación. En los
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 20
ancianos, se produce una disminución del número y variabilidad de los linfocitos T vírgenes,
acumulándose linfocitos T de memoria específicos de los patógenos con los que hemos entrado
en contacto previamente, por lo que la capacidad de responder a nuevos patógenos se va
reduciendo. La pandemia causada por la infección por SARS-CoV-2 nos muestra las
consecuencias de la aparición de un nuevo patógeno frente al que no tenemos memoria previa.
Los individuos ancianos que ya no dispongan de un repertorio suficientemente variado de
linfocitos T vírgenes serán menos eficaces en eliminar el virus y tendrán más riesgo de sufrir
una forma más grave de la enfermedad. La inmunosenescencia también se asocia a un
incremento sostenido de la inflamación, que actúa de acelerador de muchas patologías crónicas
asociadas al envejecimiento, como la diabetes tipo 2, las enfermedades cardiovasculares o
neurodegenerativas.
Respuesta innata
El envejecimiento reduce las barreras físicas formadas por la piel y las mucosas que nos aíslan
del exterior, incrementando el riesgo de sufrir infecciones. (De Martinis M, 2017, pág. 175)
Igualmente, decae la inmunidad innata, aunque no de forma tan pronunciada como la
adaptativa, puesto que incluso algunos elementos de la respuesta innata se pueden incrementar
con la edad. La capacidad de renovación de las células madre hematopoyéticas, así como la
hematopoyesis disminuyen con la edad. Sin embargo, existe una desviación hacia los
progenitores mieloides y hacia la producción de células mieloides encargadas de la respuesta
innata en comparación con los linajes linfoides, que decaen de una forma más pronunciada.
Como consecuencia, el número de neutrófilos y de monocitos-macrófagos no disminuye con la
edad, aunque su funcionalidad sí se ve disminuida. La capacidad quimiotáctica y fagocítica de
los neutrófilos se reduce, retrasando su infiltración del foco infeccioso6, lo que afecta
negativamente a su capacidad para controlar infecciones bacterianas y hongos extracelulares.
Igualmente, el número de monocitos-macrófagos en los ancianos es comparable a individuos
jóvenes, pero su capacidad fagocítica está disminuida, existiendo una polarización hacia la
producción de citocinas inflamatorias.
Inmunosenescencia
Disminución de la capacidad quimiotáctica y fagocítica de macrófagos y neutrófilos
Incremento crónico de la producción de citocinas y mediadores inflamatorios
Involución tímica y disminución de la linfopoyesis en la médula ósea
Disminución del número y variabilidad de linfocitos T y B vírgenes
Aumento de linfocitos T y B de memoria oligoclonales
Disminución de la producción de anticuerpos de alta afinidad
Peor respuesta a la vacunación
Pérdida de mecanismos inmunoregulatorios y desarrollo de respuestas autoinmunes
1. Principales cambios del sistema inmunitario causados por el envejecimiento.
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 21
También puede estar reducido en ancianos el número de células dendríticas, así como su
capacidad de captación y presentación de Ag a los linfocitos T, lo que va a contribuir a
deteriorar, aún más, la inmunidad adaptativa8. Por el contrario, hay un incremento de los
niveles de las células NK, aunque su actividad citotóxica puede estar mermada. Diversos
estudios proponen que una actividad de células NK preservada puede ser un factor de buena
salud y longevidad, mientras que una actividad limitada incrementa el riesgo de infección y
muerte. En individuos centenarios, el número de células NK es comparable a individuos jóvenes
(19-36 años).
Fig. 1. Inflamación crónica en ancianos.
Múltiples causas (cuadro inferior) desencadenan la producción sostenida de mediadores
inflamatorios, como el TNF-a e IL-6, por macrófagos (Mo) y otras células inmunes y no
inmunes, en ausencia de infecciones agudas. La inflamación crónica acelera numerosas
patologías crónicas que se asocian al envejecimiento como se muestra en los cuadros superiores.
Inflamación crónica sostenida
Una de las características esenciales asociadas con la inmunosenescencia es la producción
continua de mediadores inflamatorios independientemente de la existencia de enfermedades
infecciosas agudas (Fig. 1). Incluso en ancianos sanos, los niveles séricos de IL-6 y TNF-α son
2-4 veces mayores que en adultos jóvenes, lo que ha sido asociado con un incremento de su
morbilidad y mortalidad. Así, los niveles séricos de TNF-α se correlacionan con un incremento
de la mortalidad y los de IL-6 con pérdida de movilidad y discapacidad3. El aumento de IL-6,
proteína C reactiva (PCR) y del recuento leucocitario (presumiblemente por un incremento del
número de neutrófilos) predispone a la fragilidad en los ancianos. Los niveles de TNF-α e IL-6
también se correlacionan con la pérdida de masa muscular y, eventualmente, con la sarcopenia.
Cabe destacar que esta inflamación sostenida no se observa en individuos centenarios, que
tienen niveles más bajos de citocinas inflamatorias y niveles aumentados de mediadores anti-
inflamatorios, como el cortisol o la IL-10, en comparación con individuos de 70-80 años. En
conjunto, la respuesta inflamatoria sostenida que se observa en individuos ancianos es
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 22
perjudicial para la longevidad.
Las células innatas y, más concretamente, los macrófagos son las principales productoras de
mediadores inflamatorios. Las causas del aumento de su producción sostenida son múltiples y
algunas no bien conocidas3. Uno de los principales responsables de la inflamación es la
persistencia de infecciones virales crónicas por virus latentes, como el Epstein Barr Virus
(EBV) o el citomegalovirus (CMV), como explicaremos más adelante. La eliminación
incompleta e ineficiente de estos virus supone un estímulo antigénico constante que activa la
respuesta inmunológica. También contribuyen a la inflamación las alteraciones endocrinas y la
disminución del efecto barrera de la mucosa gastro-intestinal que dificulta el control de la
microbiota. Igualmente, la atenuación de la respuesta adaptativa y la disminución del número de
linfocitos reduce la homeostasis inmunológica. No obstante, las células inmunitarias no son las
únicas responsables de este fenómeno. La senescencia celular y el daño persistente al ADN,
característico de la senescencia, inicia un programa transcripcional que promueve la secreción
de numerosas citocinas inflamatorias, lo que se conoce como un fenotipo secretorio asociado a
la senescencia (senescence-associate secretory phenotype o SASP).
La inflamación crónica es un agravante de patologías asociadas con el envejecimiento, como la
arteriosclerosis, ciertas enfermedades neurodegenerativas (como la enfermedad de Alzheimer) y
autoinmunes, la osteoporosis o el cáncer (Fig. 1). Además, las enfermedades inflamatorias
crónicas provocan alteraciones en el sistema inmunitario que aceleran la inmunosenescencia en
individuos jóvenes, demostrando que no es un proceso exclusivo de los ancianos.
Fig. 2. Linfocitos T e inmunosenescencia.
Una de las consecuencias más relevantes de la inmunosenescencia es la disminución del número
y variabilidad de linfocitos T vírgenes. Esto se debe, sobre todo, a la involución tímica y a la
interacción a lo largo de nuestra vida con numerosos patógenos que van incrementando el
número de linfocitos T de memoria oligoclonales específicos de los patógenos a los que nos
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 23
hemos expuesto previamente.
Linfocitos T e inmunosenescencia
El envejecimiento afecta fundamentalmente al compartimento de los linfocitos T y se manifiesta
como la disminución progresiva del número y variabilidad de los mismos, principalmente a
costa de los linfocitos T vírgenes (CD95-). Este proceso se acelera a partir de los 70-75 años y
es especialmente marcado en la reducción de los linfocitos T CD8, lo que afecta de forma más
pronunciada a la respuesta inmune contra virus. Los linfocitos T CD4 disminuyen de forma más
moderada con la edad. De hecho, la inversión del ratio CD4:CD8 es un buen marcador de la
disfunción inmunológica del individuo y se asocia con mayor mortalidad.
La disminución de los linfocitos T se debe en gran medida a la involución tímica. En los
primeros años de vida se genera una gran cantidad de linfocitos T vírgenes. Sin embargo, el
timo comienza a atrofiarse temprano, a partir de la pubertad, frenando la producción de
linfocitos T, que llega a ser casi inexistente al final de la 6ª década de la vida (Fig. 2). La
disminución de linfocitos T vírgenes se debe también a la interacción con diversos patógenos a
lo largo de la vida. Esta exposición va incrementando el número de linfocitos T de memoria
oligoclonales específicos frente a estas infecciones (inmunobiografía). De esta manera la
población de linfocitos T vírgenes, que tienen un papel esencial en la protección contra nuevos
patógenos, es máxima en la infancia y adolescencia, mientras que los linfocitos T de memoria
para los patógenos locales tiene mayor representación en edades avanzadas. La estimulación
antigénica repetida a lo largo de la vida y la falta de recambio de linfocitos T vírgenes acaba
promoviendo en los ancianos la aparición de linfocitos T senescentes y disfuncionales, sobre
todo linfocitos T CD, caracterizados por telómeros cada vez más cortos y por la ausencia de
expresión de la molécula coestimuladora CD.
Este proceso de diferenciación terminal de los linfocitos T con la edad se acelera en aquellos
individuos que sufren infecciones crónicas por virus latentes, como el CMV. La infección por
CMV se adquiere durante toda la vida, afectando al 30% de los individuos de 20 años y al 90-
100% de los ancianos. La estimulación crónica por este virus produce una expansión de los
linfocitos T CD8+CD28- específicos que pueden incluso llegar a representar hasta el 50% del
total de linfocitos T CD8 de un individuo (los linfocitos T CD4 también se expanden, pero en
menor medida). La expansión de estos linfocitos T CD8+CD28- específicos del CMV acelera
aún más la disminución del compartimento de linfocitos T vírgenes y de memoria funcionales.
Además, estos linfocitos producen mayoritariamente citocinas inflamatorias (IL-1, IL-6, TNF-α,
IFN-γ), contribuyendo al aumento de la inflamación crónica con la edad que explicamos
anteriormente.
Los cambios que se producen en los linfocitos B con la edad son similares a los que ocurren en
los linfocitos T. Por un lado, disminuye progresivamente el número de linfocitos B,
especialmente a costa de los linfocitos B vírgenes, debido a la disminución de la linfopoyesis en
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 24
la médula ósea. Por el contrario, aumentan los linfocitos B de memoria específicos de los
patógenos con los que hemos entrado en contacto previamente. Consecuentemente, hay una
disminución de Ig producidas por los linfocitos B vírgenes, pero hay un aumento de IgG e IgA
producidas por linfocitos B efectores/memoria. No obstante, la calidad de la respuesta humoral
también se resiente debido tanto a la pérdida de capacidad de los linfocitos T CD4 de colaborar
con los linfocitos B, como al propio deterioro de los linfocitos B6. Esto limita el cambio de
isotipo y maduración de la afinidad y disminuye la producción de Ac de alta afinidad contra
nuevos patógenos. Asimismo, se observa un incremento de la producción de auto-Ac, indicando
que los mecanismos de tolerancia (eliminación o inactivación de los linfocitos B autorreactivos)
son defectuosos en ancianos.
Por tanto, los motivos principales del deterioro de la respuesta adaptativa son la involución
tímica y la disminución de la linfopoyesis en la médula ósea. Además, la edad induce la
senescencia de los linfocitos debido al acortamiento de los telómeros y a la acumulación de
daños en su ADN. La senescencia es especialmente relevante en los linfocitos debido a que la
capacidad de la telomerasa de reparar los telómeros disminuye con la edad y la diferenciación
celular. En conjunto, los cambios producidos en el compartimento de linfocitos B y T en los
ancianos dificulta la capacidad de producir una respuesta inmunitaria eficaz contra nuevas
infecciones y la capacidad de generar memoria inmunológica con las vacunas. La fragilidad en
los ancianos también puede estar asociada al descenso de la respuesta humoral.
Consecuencias clínicas de la inmunosenescencia
La consecuencia más obvia y grave de la inmunosenescencia es el incremento de la
susceptibilidad a las infecciones, siendo muy frecuentes en ancianos aquellas que afectan a las
vías respiratorias altas, causadas por bacterias extracelulares capsuladas (ej. neumococo), y las
infecciones urinarias. Como comentamos anteriormente, la inmunosenescencia también
dificulta la respuesta a nuevos virus que no nos han infectado en el pasado, como es el caso del
SARS-CoV-2, e incrementa la reactivación de infecciones por algunos virus latentes, como el
virus varicela zóster (VZV). Sin embargo, la reactivación de infecciones persistentes por CMV
son raramente observadas.
Con la edad también decae la eficacia de la vacunación y aumentan sus riesgos. Una primera
vacunación con virus vivos atenuados, como la fiebre amarilla, incrementa significativamente la
morbilidad y la mortalidad en ancianos. Aunque las vacunas contra el neumococo, gripe o VZV
están recomendadas en ancianos, su eficacia está limitada y no es satisfactoria.
La inmunosenescencia también predispone al desarrollo de diversas patologías. La disminución
de la inmunovigilancia mediada, sobre todo, por los linfocitos T incrementa el riesgo de
desarrollar un cáncer. También aumenta el riesgo de sufrir algunas manifestaciones
autoinmunes, a pesar de que los linfocitos T reguladores no parecen estar reducidos ni
llamativamente afectados con la edad. Sin embargo, en conjunto, los mecanismos de tolerancia
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 25
inmunológica decaen con el envejecimiento. Un bajo nivel de auto-Ac es común, incluso en
ancianos sanos, y predispone al desarrollo de ciertas enfermedades autoinmunes, como la artritis
reumatoide, que suele debutar en adultos de mediana edad y cuya incidencia se incrementa con
el paso de los años.
Intervenciones para retrasar o limitar la inmunosenescencia
No todos los individuos envejecen igual, ni física ni inmunológicamente. Los
individuos centenarios mantienen un buen funcionamiento de su sistema inmunitario, no
presentan una elevada inmunosenescencia, ni inflamación crónica y tienen generalmente menor
deterioro inmunitario que la población de entre 70 y 80 años. Es esencial detectar marcadores
genéticos, moleculares y/o inmunológicos que identifiquen tempranamente a individuos de
riesgo con el fin de realizar intervenciones específicamente diseñadas para retrasar la
inmunosenescencia. La inversión del ratio CD4:CD8, el incremento de linfocitos T
CD8+CD28-, el aumento de citocinas inflamatorias, como la IL-6, la disminución del número
de linfocitos B y la seropositividad para CMV son marcadores de inmunosenescencia
comúnmente aceptados en la actualidad.
La investigación de terapias encaminadas a retrasar la inmunosenescencia es un campo
creciente de interés científico. Una de las dianas más estudiadas para reducir la
inmunosenescencia es el incremento de la actividad telomerasa de los linfocitos. Los pacientes
con infección crónica por VIH acumulan linfocitos T CD8 con telómeros acortados y
constituyen un buen modelo de estudio. De hecho, muestras de sangre de estos individuos se
han empleado para determinar la eficacia del uso de terapia génica para expresar el gen de la
telomerasa (hTERT) o de activadores farmacológicos de dicha proteína (TAT2) de incrementar
la respuesta inmune. Otra alternativa terapéutica es el reemplazo de linfocitos T senescentes
mediante trasferencia adoptiva de linfocitos T efectores, una estrategia que ha demostrado su
eficacia en la eliminación de infecciones latentes por CMV. Asimismo, algunas citocinas u
hormonas, como IL-7, FGF7, GH o IGF-1, podrían rejuvenecer el timo y mejorar la producción
de linfocitos T vírgenes, aunque su administración podría incrementar el riesgo de desarrollar
enfermedades autoinmunes o cáncer. Por ello, es necesario realizar ensayos clínicos específicos
para contraponer los riesgos y beneficios que pueden producir estas terapias.
Mientras esperamos que algunos de estos posibles avances científicos puedan en el futuro
mejorar la salud inmunológica de los ancianos, hoy en día existen algunas intervenciones que
pueden ayudar a limitar estos procesos y permitir alcanzar un envejecimiento saludable.
Estrategias sencillas que se pueden implementar para reducir o retrasar la inmunosenescencia
son, en muchos casos, las mismas que nos ayudan a llevar una vida saludable y a reducir el
riesgo de las enfermedades crónicas previamente mencionadas, como las enfermedades
cardiovasculares. Por ejemplo, la restricción calórica disminuye la producción de mediadores
inflamatorios y revierte parte de los efectos de la inmunosenescencia sobre las células inmunes.
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 26
La actividad física ha demostrado efectos beneficiosos contrarrestando la pérdida de masa
muscular y favoreciendo el mantenimiento de una adecuada respuesta inmunológica. De hecho,
un amplio meta-análisis realizado recientemente muestra que la actividad física moderada o
vigorosa reduce un 37% la mortalidad causada por infecciones comunitarias, aumenta el número
de linfocitos T CD4, los niveles de IgA salival y la producción de Ac en respuesta a la
vacunación, mientras que disminuye el número de neutrófilos. Los mecanismos implicados son
desconocidos y probablemente multifactoriales, pero se ha descrito recientemente que la
estimulación mecánica de los huesos, por ejemplo, por el movimiento, activa mecanoreceptores
expresados en progenitores óseos favoreciendo la formación ósea y la liberación de stem cell
factor (SCF) que estimula la linfopoyesis. A nivel clínico, el desarrollo de medicamentos
antiinflamatorios de baja toxicidad es una idea interesante que podría reducir la inflamación
crónica en ancianos. Medicamentos con funciones antiinflamatorias, como la aspirina o las
estatinas, han sido usadas rutinariamente para prevenir enfermedades cardiovasculares. El
desarrollo de medicamentos antiinflamatorios de baja toxicidad podría ser una alternativa para
disminuir la inflamación crónica.
Mejorar la respuesta a las vacunas en ancianos es otra intervención factible y esencial, ya que, a
pesar de que ciertas vacunas, como la del neumococo, la gripe o el VZV, están recomendadas
para ancianos, su eficacia no es satisfactoria. El título de Ac contra el tétanos decae a partir de
los 50 años, por lo que dosis de refuerzo de la vacuna del tétanos deberían darse a intervalos de
10 años. De forma similar, muchos ancianos también muestran una protección incompleta
contra la difteria, por lo que una dosis de refuerzo de la vacuna acelular contra la difteria
debería ser considerada para individuos de más de 65 años. Debe también considerarse la
vacunación contra la hepatitis A y B. Además, es necesario identificar nuevas formas de
producir vacunas, así como nuevos protocolos de vacunación adaptados específicamente a las
características inmunológicas de los ancianos. Por ejemplo, las vacunas de ARN empleadas para
prevenir la COVID-19 han mostrado una alta efectividad, incluso en individuos mayores de 65
años. Pueden existir mejores adyuvantes específicos para los ancianos que las sales de aluminio.
En ensayos clínicos los agonistas de TLR9 mejoran significativamente la eficacia de la
vacunación en la hepatitis B. También se deben ajustar las dosis de las vacunas en los ancianos.
Por ejemplo, altas dosis de la vacuna de la gripe han mostrado ser más eficaces respecto a las
dosis estándar18. La dosis de la vacuna de VZV usada en ancianos es 14 veces mayor que la
que se usa en niños. La principal causa de muerte en los ancianos sigue siendo las infecciones lo
que nos indica claramente que todavía tenemos mucho camino por recorrer en este campo.
IV. Disfunción Endotelial
Deterioro de la función endotelial asociada al envejecimiento
En modelos animales hay evidencia demostrada de la presencia de disfunción endotelial
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 27
asociada al envejecimiento. En humanos, también se ha descrito una disfunción endotelial
relacionada con la edad en estudios in vivo, aunque los posibles mecanismos implicados han
sido escasamente investigados hasta ahora. Recientemente, nuestro grupo ha analizado la
capacidad vasodilatadora dependiente del endotelio vascular en sujetos de entre 18 y 91 años sin
enfermedad cardiovascular conocida ni factores de riesgo asociados (tabaquismo, diabetes,
obesidad, hipercolesterolemia, etc.). El estudio se ha realizado tanto in vivo en sujetos
conscientes (mediante una técnica denominada pletismografía del antebrazo) como in
vitro (obteniendo microvasos mesentéricos humanos de pacientes sometidos a cirugía
abdominal). En los microvasos aislados, además, se analizaron los factores pro-oxidantes y
proinflamatorios implicados.
Confirmando datos anteriores, en este trabajo se ha demostrado una disminución asociada al
envejecimiento de las respuestas vasodilatadoras dependientes del endotelio vascular. Así, la
combinación de las dos aproximaciones experimentales utilizadas (in vivo e in vitro) en una
importante muestra de sujetos con un amplio rango de edad y carentes de enfermedad
cardiovascular conocida o factores de riesgo clásicos, demostró la existencia de un deterioro
específico de la función endotelial dependiente de la edad, de acuerdo a lo previamente
publicado en pacientes in vivo. Una aportación interesante y novedosa fue que la disfunción
endotelial observada fue muy parecida con ambas aproximaciones experimentales, in vivo e in
vitro, aunque la relajación endotelio-dependiente en vasos aislados se indujo con bradicinina
(BK), mientras que la observada en los estudios de pletismografía se provocó con acetilcolina
(ACh). Esto tiene considerable relevancia, ya que nos permite postular que los mecanismos
hallados en los estudios in vitro son aplicables previsiblemente a los datos in vivo.
Por otro lado, cabe destacar que, en nuestra aproximación in vitro con BK, los vasos se pre-
contrajeron con un estímulo despolarizante (35 mmol/l de cloruro potásico [KCl]), lo que
eliminaba la participación del factor endotelial hiperpolarizante en la relajación inducida por
BK, descrita por algunos autores. Aun así, la respuesta vasodilatadora y su deterioro con la edad
observado in vitro con BK fueron análogos a los obtenidos con ACh in vivo, lo que sugiere que
el papel del factor hiperpolarizante en estos vasos es probablemente limitado. En este sentido, y
confirmando datos anteriores de nuestro laboratorio, se observó que el componente fundamental
de la relajación inducida por BK in vitro era el NO que, en el caso de sujetos menores de 60
años, estaba acompañado de un pequeño componente vasodilatador sensible al bloqueo por
indometacina, lo que sugería un papel vasodilatador secundario para un derivado de la
ciclooxigenasa.
Por el contrario, las respuestas en vasos de sujetos mayores de 60 años fueron claramente
distintas. De manera interesante, la vía del NO parecía bien conservada en estos vasos, de modo
que el único factor vasodilatador producido por el endotelio en vasos envejecidos era el NO. Por
tanto, la disfunción endotelial no es necesariamente debida a una reducción en la síntesis de NO,
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 28
como sugieren otros autores. Por otro lado, tras bloquear la síntesis de NO se abolió toda
respuesta vasodilatadora a BK, apareciendo en su lugar una respuesta vasoconstrictora mediada
por el endotelio y dependiente de la ciclooxigenasa (COX). En base a estos resultados, hemos
postulado que el endotelio vascular envejecido es todavía capaz de producir suficiente NO para
alcanzar una completa relajación del músculo liso vascular subyacente. Sin embargo, este NO es
contrarrestado por un compuesto vasoconstrictor derivado del endotelio y producido por COX,
así como por especies reactivas de oxígeno, preferentemente aniones superóxido (O–2), también
producidos por las células endoteliales
Mecanismos inflamatorios implicados en la disfunción endotelial asociada al envejecimiento
humano Papel de la COX
La existencia de un factor vasoconstrictor endotelial asociado a la edad se ha propuesto con
anterioridad en base a evidencias indirectas, pero nuestro laboratorio ha sido el primero en
demostrarlo directamente en vasos humanos. La naturaleza de este factor no se ha dilucidado
todavía, pero desaparece en presencia de bloqueantes para los receptores de
tromboxano/prostaglandina H2. Tampoco es descartable un papel para los O–2, ya que esas
especies reactivas de oxígeno se han descrito como mediadores de la vasoconstricción
endotelial dependiente de la COX.
No existe consenso sobre la isoforma de la COX implicada en la producción de factores
vasoconstrictores endoteliales. Tampoco nosotros hemos podido esclarecer este punto, ya que
no se observaron diferencias en los niveles de ARN mensajero (ARNm) para las dos isoformas
conocidas de la enzima COX-1 y COX-2. Sin embargo, existen mecanismos post-
transcripcionales que pueden modular la actividad de esta enzima. En este sentido, se ha
descrito que la actividad de COX puede estar regulada por distintos compuestos, como NO y
peroxinitrito (ONOO–). Además, se conoce una interacción fisiológica entre COX-2 e iNOS (la
isoforma inducible de la NO sintasa), que lleva al NO o al ONOO– a activar la COX-2, en una
interacción molecular sinérgica que interconecta dos enzimas inflamatorias como son COX-2 e
iNOS.
Papel del estrés oxidativo y nitrosativo
Es conocido el papel del estrés oxidativo en la disfunción endotelial asociada a la edad.
Recientemente, Donato, han encontrado una relación entre marcadores de oxidación en células
endoteliales y vasodilatación. Se acepta que el estrés oxidativo, principalmente los O–2, reducen
la disponibilidad de NO e inhiben su diana principal, la guanilato ciclasa soluble. Nuestro grupo
ha podido visualizar la presencia de niveles aumentados de O–2 en microvasos mesentéricos
humanos procedentes de sujetos mayores de 60 años, mediante la sonda fluorescente
dihidroetidio. Además, el papel funcional de los O–2 se ha comprobado mediante compuestos
barredores de los mismos, como tempol o superóxido dismutasa, capaces de mejorar la
disfunción endotelial asociada a la edad.
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 29
La generación de ONOO– emerge cada vez más como un mecanismo determinante en la
producción de daño oxidativo en la pared vascular. También se han encontrado marcadores
biológicos de este compuesto en microvasos mesentéricos de sujetos mayores de 60 años, como
el incremento de los residuos de nitrotirosina, lo que indica una mayor producción de
ONOO– vascular, análogo al descrito previamente en ratas. El papel funcional del
ONOO– como mediador de la disfunción endotelial asociada a la edad se ha confirmado con un
agente barredor de ONOO– (ácido úrico), que mejora la relajación inducida por BK tanto como
el antioxidante tempol.
La formación de ONOO– requiere la interacción química de O–2 y NO con una estequiometría
de uno a uno. La producción de ONOO– depende de la concentración disponible de NO, que a
su vez está en relación con la actividad de la sintasa de NO (NOS). Aunque la cantidad de tejido
disponible sea muy pequeña, es posible investigar la expresión de ARNm para las isoformas
constitutiva e inducible de la sintasa de NO (eNOS e iNOS, respectivamente) en la pared
vascular de microvasos mesentéricos procedentes de sujetos menores y mayores de 60 años.
Datos previos en rata sugieren un aumento de la iNOS vascular dependiente de la edad,
mientras que los datos sobre la expresión de eNOS son controvertidos. En nuestro laboratorio se
ha observado que la expresión de ARNm para eNOS no se modifica con la edad, mientras que
la isoforma iNOS se incrementa significativamente en la pared vascular de los sujetos mayores
de 60 años. La mejoría de la disfunción endotelial asociada a la edad producida por un inhibidor
específico de la iNOS (1.400W) sugiere además de forma clara que la iNOS es la fuente
principal de NO para formar ONOO– en la pared de los vasos envejecidos. Aunque existe algún
dato previo en cultivos de mesotelio humano, ésta ha sido la primera demostración en la pared
vascular humana de la implicación de la isoforma inflamatoria iNOS en la disfunción endotelial
asociada a la edad.
Respecto del origen de los O–2 detectados en la pared vascular, se ha obtenido evidencia de la
posible participación del complejo enzimático NADPH oxidasa. Así, el ARNm de la isoforma
nox-4 de la NADPH oxidasa, cuya expresión ha sido demostrada en la pared vascular humana,
está incrementado en microvasos mesentéricos de sujetos mayores de 60 años, mientras que el
inhibidor de esta enzima apocinina mejora la disfunción endotelial asociada a la edad. Por el
contrario, no hay evidencia alguna que apoye el papel de la enzima xantinooxidasa como fuente
de O–2, lo que sugiere que la fuente principal de estrés oxidativo en el envejecimiento vascular
no patológico es la NADPH oxidasa, de acuerdo a lo indicado por otros autores.
Otra posible fuente de O–2 en el envejecimiento vascular puede ser el desacoplamiento de la
NOS. Se sabe que el ONOO– desacopla la isoforma endotelial de la NOS, que también puede
producirse por una disminución de la biodisponiblidad del cofactor tetrahidrobiopterina (BH4),
como consecuencia de su oxidación a BH2 por O–2 o ONOO–. Así, algunos datos en humanos
indican que la administración del cofactor de NOS BH4 mejora claramente la disfunción
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 30
endotelial asociada a la edad medida por técnicas pletismográficas in vivo. En nuestro modelo
de microvasos mesentéricos humanos aislados se ha observado un efecto similar, ya que la
administración de BH4 mejora la disfunción endotelial asociada a la edad de manera similar a la
observada en presencia de agentes barredores de O–2. Aunque muchos trabajos mencionan la
eNOS como la principal isoforma de NOS desacoplada capaz de producir O–2, la isoforma
inflamatoria inducible iNOS es mucho más activa catalíticamente, consumiendo cantidades
mayores de sustrato y cofactores, por lo que puede constituir una importante fuente de O–2 en
situaciones de carencia de sustrato o de BH4.
Inflamación vascular y disfunción endotelial asociada a la edad
Hay cada vez más evidencia obtenida en modelos experimentales de que el envejecimiento
vascular está asociado a procesos de inflamación vascular. En humanos, existen datos
epidemiológicos que sugieren una asociación entre citocinas inflamatorias circulantes y
mortalidad en sujetos ancianos. Más recientemente, Wang, han descrito un perfil pro-
inflamatorio en la pared aórtica de sujetos sin engrosamiento patológico. Por su parte,
Donato, han observado en células endoteliales una regulación al alza del factor de transcripción
nuclear κB (NF-κB), fuertemente implicado en los fenómenos inflamatorios, que parece
asociarse con la disfunción endotelial. Nuestro laboratorio ha descrito asimismo un aumento de
la expresión y actividad de NF-κB con la edad en células mesoteliales peritoneales humanas en
cultivo, en ausencia de estímulos inflamatorios. En microvasos mesentéricos humanos, hemos
utilizado técnicas histoquímicas de Southwestern para demostrar de modo directo in situ la
activación de NF-κB en función de la edad. Además, hemos encontrado una correlación
significativa entre la edad y el número de células vasculares con activación nuclear de NF-κB,
lo que sugiere claramente un entorno inflamatorio en la pared vascular de los sujetos
envejecidos. También se ha encontrado una clara correlación entre la presencia de disfunción
endotelial asociada a la edad y la activación de NF-κB in situ. Hasta lo que sabemos, ésta es la
primera demostración en la pared vascular humana de una relación entre la disfunción endotelial
dependiente de la edad y el desarrollo de un entorno proinflamatorio en la pared vascular
V. Enfermedades Cardiovasculares relacionadas al envejecimiento
Las enfermedades cardiovasculares (ECV) son un conjunto de trastornos del corazón y de los
vasos sanguíneos que generan diferentes condiciones ligadas a la reducción de sangre a los
distintos órganos del cuerpo. Se consideran un grave problema de salud, ya que son la principal
causa de muerte en todo el mundo. Algunos datos señalan que el número de muertes derivadas
de esas afecciones alcanzó el 29,6% en el año de 2010, en ámbito mundial. Entre las principales
ECV, las enfermedades coronarias merecen destacar por ser la principal causa de muerte de la
población mundial, seguido de las enfermedades cerebrovasculares.
Brasil acompaña esa realidad mundial, ya que presentó un total de 963 931 fallecimientos por
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 31
ECV en personas mayores de 30 años en 20093. En las regiones norte y nordeste existe un
considerable aumento de la mortalidad por ECV cuando se comprara con las demás regiones del
país. Esta diferencia puede explicarse por las acciones preventivas más apropiadas en las
regiones más desarrolladas, que colaboran en el control de los factores de riesgo de las ECV.
Con el proceso de envejecimiento se tiende a la aparición y agravamiento de los problemas de
salud debido a factores ambientales, de transición epidemiológica, demográficos y
socioeconómicos5. Así, la población anciana está en la franja de riesgo para las ECV, y se
produce un aumento significativo del número de casos después de los 60 años. Además de la
edad, el sexo femenino presenta mayor incidencia de esas enfermedades. Otros factores de
riesgo que destacan en la aparición de las ECV son: el tabaquismo, la hipertensión arterial, la
dislipidemia, la diabetes, el sedentarismo y la obesidad.
En ese sentido, cabe destacar que los malos hábitos de vida se consideran importantes factores
de riesgo para la aparición de ECV. El tabaquismo, el alcoholismo y el sedentarismo merecen
destacar por ser características modificables mediante acciones de salud que promuevan la
calidad de vida de la persona anciana.
Por tanto, acciones de prevención de la ECV y promoción de la salud deben considerarse
prioritarias, en especial respecto a la atención prima ria de salud y al contexto social del
anciano, una vez que esas afecciones se presentan principalmente en la población anciana
menos favorecida socioeconómicamente.
La literatura especializada señala desigualdades sociodemográficas en la salud, al mostrar
diferencias en cuanto a la aparición de factores de riesgo modificables para las ECV entre
grupos sociales y clínicos distintos. De esa forma, se destaca la importancia de comprender la
asociación existente entre los factores sociodemográficos, clínicos y los hábitos de vida del
anciano relacionados con el riesgo de ECV, para dirigir las acciones de salud a la realidad de
esos pacientes y la promoción de la salud cardiovascular.
De este modo, el presente estudio tiene como objetivo analizar la asociación entre los hábitos de
vida relacionados con el riesgo de ECV y los factores sociodemográficos y clínicos en ancianos.
Las enfermedades cardiovasculares más frecuentes en personas mayores son:
Cardiopatía coronaria: actualmente es la principal causa de pérdida funcional en hombres y se
trata de una enfermedad que afecta a los vasos sanguíneos del corazón, haciendo que no reciba
la suficiente cantidad de sangre para su funcionamiento. Dentro de esta enfermedad, las
complicaciones más frecuentes son el infarto agudo de miocardio y la angina de pecho.
Enfermedad cerebrovascular: las venas y arterias que irrigan el cerebro se ven afectadas
impidiendo que la sangre circule correctamente. Afecta en mayor medida a mujeres, sobre todo
durante la tercera edad. Entre sus efectos se encuentran el ictus y problemas de vista o
coordinación de movimientos.
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 32
Hipertensión arterial: consiste en el aumento de la presión arterial que hace que las arterias se
hagan más gruesas dificultando el paso de la sangre. Esta enfermedad no presenta síntomas
claros por lo que se recomienda llevar un control exhaustivo y periódico de la presión arterial de
las personas mayores para detectarla a tiempo.
Bibliografía
AJ., I. (2011). Physical environment and life expectancy at birth in Mexico: an eco-
epidemiological study. Mexico: Cad Saude Publica.
Alvarado-García AM, S.-M. A. (2014). Análisis del concepto de envejecimiento. . España:
Gerokomos.
Caino MC, M. E. (2009). Hallmarks for senescence in carcinogenesis: novel signaling
players. . Estados Unidos: Apoptosis.
De Martinis M, S. M. (2017). Allergy and Aging: An Old/New Emerging Health Issue. . Estados
Unidos: Aging Dis. .
E., L. B. (2012). Forecasting continuously increasing life expectancy: what implications? .
España: Ageing Res Rev.
Gems D, P. L. (2013). Genetics of longevity in model organisms: debates and paradigm shifts. .
Inglaterra: Annu Rev Physiol.
Jacob KD, N. H. (2013). Markers of oxidant stress that are clinically relevant in aging and age
related disease. . California: Mech Aging .
Jacobson A, G. E. (2010). Age-related functional changes in gustatory and reward processing
regions: . Mexico: An fMRI study. .
Palloni A, M. M. (2007). Aging and health status of elderly in Latin America and the
Caribbean: preliminary findings. Estados Unidos: J Cross Cult Gerontol.
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 33
Rich RR. (2008). Clinical immunology : principles and practice. 3rd ed. . Philadelphia: Mosby
Elsevier.
Wheeler HE, K. S. (2011). Genetics and genomics of human aging. . Estados Unidos: Philos
Trans R Soc Lond B Biol Sci.
Z., K. (2010). Central control of food intake in aging. Mexico: Interdiscip Top Gerontol.
Exámen
NOMBRE Y APELLIDOS: …………………………………………………...........
PROGRAMA: ……………………………………………………………………….
MÓDULO: ………. MATRÍCULA: ……………. CIUDAD: ……………………...
1. ¿Explique que entiende por Sistema cardiovascular?
……………………………………………………………………………………….
……………………………………………………………………..…………………...
………………………………………………………………………………………………
………………………………………………………………………..
2. ¿Qué órganos comprenden el Sistema Cardiovascular?
………………………………………………………………………………………….
………………………………………………………………………………………………
………………………………………………………………………………………………
………………………………………………………………………………………………
…………………………………………………………
3. ¿Explique porque el sistema cardiovascular se deteriora con el envejecimiento?
………………………………………………………………………………………..
……………………………………………………………………………….……..
…………………………………………………………………………….………..
……………….……………………………………………………………………
4. ¿Detalle en qué consiste las alteraciones metabólicas?
……………………………………………………………………………………………
………………………………………………………………………………….
……………………………………………………………………………………………
…..…………………………………………………………………………….
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 34
5. ¿Señale cuáles son los efectos de las alteraciones metabólicas en el cuerpo?
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
…………………………………………………..…………………
6. ¿Detalle porque un cuerpo inflamado es un cuerpo que está enfermo?
…………………………………………………………………………………….….
……………………………………………………………………………………..….
…………………………………………………………………………….……..…….
……………………………………………………………………………………………
………………………………………………………………
7. ¿Explique que es la disfunción endotelial?
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………
8. ¿Explique porque la disfunción endotelial afecta el organismo de las personas que están
envejeciendo?
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………………………………………
……………………………………………………………
9. ¿Cuáles son las enfermedades cardiovasculares más frecuentes?
…………………………………………………………………………………….….
…………………………………………………………………………………..….
……………………………………………………………………………………………
………………………………………………………………………
10. ¿En el Perú, que enfermedades cardiovasculares son mas recurrentes en los adultos
mayores?
…………………………………………………………………………………….….
……………………………………………………………………………………..….
……………………………………………………………………………………………
…………………………………………………………………………………
Importante: Desarrolle cada una de las preguntas escribiendo en las líneas punteadas, escanee
ambas hojas y envié al correo electrónico que le proporcionará nuestro(a) representante para ser
calificado inmediatamente. Gracias.
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 35
Módulo 4: Sistema Cardiovascular y sus Alteraciones Metabólicas – Pág. 36
También podría gustarte
- Sistema CardiovascularDocumento21 páginasSistema CardiovascularEVELYN DEL ROCIO MARTINEZ HEREDIAAún no hay calificaciones
- Anatomía y Fisiología CardiacaDocumento13 páginasAnatomía y Fisiología CardiacaFernando Miguel Calderon CabreraAún no hay calificaciones
- Sistema Cardiovascular PediatricoDocumento45 páginasSistema Cardiovascular PediatricoStefany FreitezAún no hay calificaciones
- Bienvenidos A La Clase de Repaso de Sistema Cardiovascular. Sistema CardiovascularDocumento31 páginasBienvenidos A La Clase de Repaso de Sistema Cardiovascular. Sistema CardiovascularJesica MachadoAún no hay calificaciones
- Electrocardiograma para EnfermeriaDocumento65 páginasElectrocardiograma para Enfermeriapaola allisette fernandezAún no hay calificaciones
- Tecnica Quirurgica de Revascularizacion CardiacaDocumento38 páginasTecnica Quirurgica de Revascularizacion CardiacaCesar Osbaldo Rangel100% (1)
- El CorazónDocumento5 páginasEl CorazónLucianaAún no hay calificaciones
- Cuidado Del Sistema CardiovascularDocumento29 páginasCuidado Del Sistema CardiovascularJefferson Roa SantaAún no hay calificaciones
- Informe de Practica Del CorazónDocumento17 páginasInforme de Practica Del CorazónStefany FandiñoAún no hay calificaciones
- CardiovascularDocumento30 páginasCardiovascularCarlos AlvaradoAún no hay calificaciones
- Sistema CIRCULATORIO CARDIOVASCULARDocumento19 páginasSistema CIRCULATORIO CARDIOVASCULARBorjas JesusAún no hay calificaciones
- Anatomia 05 CardiovascularDocumento52 páginasAnatomia 05 CardiovascularAlexis SccAún no hay calificaciones
- Ecc AdultosDocumento120 páginasEcc AdultosNelson JaldinAún no hay calificaciones
- Anatomia 2Documento7 páginasAnatomia 2Janeth Cordova ArevaloAún no hay calificaciones
- Informe Aparato CardiovascularDocumento10 páginasInforme Aparato CardiovascularClaudia ZamoraAún no hay calificaciones
- El Sistema CardiovascularDocumento22 páginasEl Sistema CardiovascularEstefanny ForeroAún no hay calificaciones
- Alumna Heidi Maca Ricse (Corazón)Documento17 páginasAlumna Heidi Maca Ricse (Corazón)Greth settaAún no hay calificaciones
- Info Sistema CardiovasculrDocumento5 páginasInfo Sistema Cardiovasculrsebastiantell3zAún no hay calificaciones
- Sistema CardiovascularDocumento23 páginasSistema CardiovascularJuli TomasiniAún no hay calificaciones
- Mod 1Documento21 páginasMod 1miguelo.vkAún no hay calificaciones
- Sistema Circulatorio y CorazónDocumento11 páginasSistema Circulatorio y CorazónKatherine De LeónAún no hay calificaciones
- Aanato y Fisio Cardio y RespDocumento12 páginasAanato y Fisio Cardio y RespRebeca Sofía Colunga RamírezAún no hay calificaciones
- Corazón HumanoDocumento9 páginasCorazón HumanoSarahi GuillenAún no hay calificaciones
- Anatomía Del CorazónDocumento5 páginasAnatomía Del CorazónVeronica perezAún no hay calificaciones
- Anatomía y fisiología cardiaca y pulmonarDocumento42 páginasAnatomía y fisiología cardiaca y pulmonarPamelaAún no hay calificaciones
- Sistema CardiovascularDocumento7 páginasSistema Cardiovascularyarith paola hernandez marrugoAún no hay calificaciones
- Anatomía del corazón: ubicación, estructuras y funciones de las aurículas y ventrículosDocumento4 páginasAnatomía del corazón: ubicación, estructuras y funciones de las aurículas y ventrículosAndres SantacruzAún no hay calificaciones
- UNIDAD 2. Estructura y Funciones General Del Sistema CirculatorioDocumento49 páginasUNIDAD 2. Estructura y Funciones General Del Sistema CirculatorioDanae PérezAún no hay calificaciones
- Informe CorazónDocumento6 páginasInforme CorazónDiego Veloz MerinoAún no hay calificaciones
- Corazon DefinicionDocumento6 páginasCorazon DefinicionJoseph MostaceroAún no hay calificaciones
- Cuidado Del Sistema Cardiovascular KGDocumento2 páginasCuidado Del Sistema Cardiovascular KGkatherin2603.gAún no hay calificaciones
- Sistema Cardiovascular PDFDocumento15 páginasSistema Cardiovascular PDFJulia AlfonsinAún no hay calificaciones
- Sistema CardiovascularDocumento22 páginasSistema CardiovascularvxnheAún no hay calificaciones
- Resumen de Cardiologia-1Documento5 páginasResumen de Cardiologia-1jennifer garciaAún no hay calificaciones
- Trabajo Del Sistema Cardio VascularDocumento14 páginasTrabajo Del Sistema Cardio Vascularjesús jáureguiAún no hay calificaciones
- Fisiología Del Sistema Cardiovascular: Licda. Estefany SilvaDocumento10 páginasFisiología Del Sistema Cardiovascular: Licda. Estefany SilvaJean PantojaAún no hay calificaciones
- U.D. 4. Sistema CirculatorioDocumento24 páginasU.D. 4. Sistema CirculatoriojusreadAún no hay calificaciones
- Actividad Numero 8, Herminda Gabriela DiazDocumento9 páginasActividad Numero 8, Herminda Gabriela DiazGabu SamaluAún no hay calificaciones
- ZULMA Carcio PulmonarDocumento14 páginasZULMA Carcio PulmonarOSCAR LEONARDO TORRES MONTA�EZAún no hay calificaciones
- El Corazon Imagenes 4Documento12 páginasEl Corazon Imagenes 4Ransel RodriguezAún no hay calificaciones
- Aparato CardiovascularDocumento49 páginasAparato CardiovascularWILSON RODRIGO RUIZ DIAZ100% (1)
- 8 Cuidados Del Sistema CardiovascularDocumento6 páginas8 Cuidados Del Sistema Cardiovascularlucila lucilaAún no hay calificaciones
- Aparato CardiovascularDocumento7 páginasAparato CardiovascularRuth Abigail SilvaAún no hay calificaciones
- Copia de GUIA APRENDIZAJES No 1 sistema cardiovascularDocumento15 páginasCopia de GUIA APRENDIZAJES No 1 sistema cardiovascularCareling GonzalezcascoAún no hay calificaciones
- Ud5 AnattomíaDocumento31 páginasUd5 AnattomíaALEJANDRA DE LA CUESTAAún no hay calificaciones
- Curso de Accesos Vasculares y Terapia IntravenosaDocumento81 páginasCurso de Accesos Vasculares y Terapia IntravenosaOfelia Cruz LaraAún no hay calificaciones
- Cardiovascular y RespiratorioDocumento73 páginasCardiovascular y RespiratorioCRISTINA PAULINA PENA CONTRERASAún no hay calificaciones
- Anatomía Aparato CardiovascularDocumento9 páginasAnatomía Aparato CardiovascularJavier FelipeAún no hay calificaciones
- Act 4 Sist Circulatorio CorazonDocumento17 páginasAct 4 Sist Circulatorio Corazoningrid gomezAún no hay calificaciones
- Anatomia Del CorazonDocumento38 páginasAnatomia Del Corazonclaudia marquez100% (1)
- Corazon Humano.Documento10 páginasCorazon Humano.Maryam CareagaAún no hay calificaciones
- Anatomia Sistema CirculatorioDocumento14 páginasAnatomia Sistema Circulatoriomaria julissa sanchez cotrinaAún no hay calificaciones
- Corazón HumanoDocumento11 páginasCorazón HumanoYaretzy HernándezAún no hay calificaciones
- CorazonDocumento9 páginasCorazonalexandra leivaAún no hay calificaciones
- CorazónDocumento19 páginasCorazónPaloma PajaroAún no hay calificaciones
- Sesion 11Documento2 páginasSesion 11AnaAún no hay calificaciones
- Taller Anatomorfo 2020BDocumento13 páginasTaller Anatomorfo 2020BEdna Patricia Parra50% (2)
- VISCERAS Trabajo FinalDocumento28 páginasVISCERAS Trabajo FinalGilbert Guerra RojanoAún no hay calificaciones
- Mejorar la Circulación Sanguínea de Forma Natural: Sanar el Sistema Circulatorio y inmunológico para Prevenir Enfermedades, Aumentar la Energía, Aliviar el Estrés y Sentirte Mejor que NuncaDe EverandMejorar la Circulación Sanguínea de Forma Natural: Sanar el Sistema Circulatorio y inmunológico para Prevenir Enfermedades, Aumentar la Energía, Aliviar el Estrés y Sentirte Mejor que NuncaCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Presentación para El 03 de JunioDocumento10 páginasPresentación para El 03 de JunioShirley VelardeAún no hay calificaciones
- Cronograma de ExamenesDocumento5 páginasCronograma de ExamenesShirley VelardeAún no hay calificaciones
- Proyecto de Tesis 2022Documento29 páginasProyecto de Tesis 2022Shirley VelardeAún no hay calificaciones
- Julio Agustin Monteneggro CabreraDocumento4 páginasJulio Agustin Monteneggro CabreraShirley VelardeAún no hay calificaciones
- Diplomado IvDocumento7 páginasDiplomado IvShirley VelardeAún no hay calificaciones
- Presentación para El 27Documento20 páginasPresentación para El 27Shirley VelardeAún no hay calificaciones
- TRABAJO ACADÉMICO D C para El 3Documento19 páginasTRABAJO ACADÉMICO D C para El 3Shirley VelardeAún no hay calificaciones
- Horarios de Clase AlejandroDocumento1 páginaHorarios de Clase AlejandroShirley VelardeAún no hay calificaciones
- Presentación para El 28Documento25 páginasPresentación para El 28Shirley VelardeAún no hay calificaciones
- Comercio InternacionalDocumento9 páginasComercio InternacionalShirley VelardeAún no hay calificaciones
- Practica de Abelardo de MetodosDocumento2 páginasPractica de Abelardo de MetodosShirley VelardeAún no hay calificaciones
- Segunda Práctica de Derecho Procesal CivilDocumento12 páginasSegunda Práctica de Derecho Procesal CivilShirley VelardeAún no hay calificaciones
- T.A - Administracion Financiera 2Documento17 páginasT.A - Administracion Financiera 2Shirley VelardeAún no hay calificaciones
- Autorizacion de MenorDocumento1 páginaAutorizacion de MenorShirley VelardeAún no hay calificaciones
- Compromiso Notarial de PagoDocumento1 páginaCompromiso Notarial de PagoShirley VelardeAún no hay calificaciones
- Horarios UAPDocumento1 páginaHorarios UAPShirley VelardeAún no hay calificaciones
- Derecho Procesal LaboralDocumento2 páginasDerecho Procesal LaboralShirley VelardeAún no hay calificaciones
- 029f4d10589680b02da23e2829121ae2Documento4 páginas029f4d10589680b02da23e2829121ae2Shirley VelardeAún no hay calificaciones
- Afiche JesuscitoDocumento1 páginaAfiche JesuscitoShirley VelardeAún no hay calificaciones
- Matematica Gonzalo Semana 20-01Documento13 páginasMatematica Gonzalo Semana 20-01Shirley VelardeAún no hay calificaciones
- Solicitud de copias de denuncias e informes para defensa legalDocumento1 páginaSolicitud de copias de denuncias e informes para defensa legalShirley VelardeAún no hay calificaciones
- Fut Educacion DevolucionDocumento1 páginaFut Educacion DevolucionShirley VelardeAún no hay calificaciones
- Matriz de Consistencia - para Proyecto de InvestigaciónDocumento1 páginaMatriz de Consistencia - para Proyecto de InvestigaciónShirley VelardeAún no hay calificaciones
- PeriódicoDE HOY VIERNESDocumento1 páginaPeriódicoDE HOY VIERNESShirley VelardeAún no hay calificaciones
- Sgdi 230Documento27 páginasSgdi 230omaromarAún no hay calificaciones
- Alejandrillo - NegrilloDocumento1 páginaAlejandrillo - NegrilloShirley VelardeAún no hay calificaciones
- Inta PG 06 V4 2009Documento49 páginasInta PG 06 V4 2009Isabel Huaman LopezAún no hay calificaciones
- Espinoza Tania Reserva Ley AplicacionDocumento415 páginasEspinoza Tania Reserva Ley Aplicacionsetty1000Aún no hay calificaciones
- Mercancia AutorizadaDocumento7 páginasMercancia AutorizadaRichard Francisco Mendoza BravoAún no hay calificaciones
- Plan de Ordenamiento Territorial de La Zona Metropolitana Tepc-XaliscoDocumento378 páginasPlan de Ordenamiento Territorial de La Zona Metropolitana Tepc-XaliscoErick LoeraAún no hay calificaciones
- Etica Del Cuerpo y Cuerpo Del AnálisisDocumento8 páginasEtica Del Cuerpo y Cuerpo Del AnálisisSil RoccAún no hay calificaciones
- Entrenamiento Funcional ANALISIS-DeMANDASDocumento94 páginasEntrenamiento Funcional ANALISIS-DeMANDASNoselodireAnadieAún no hay calificaciones
- Iberdrola Oferta 1035800410100000Documento20 páginasIberdrola Oferta 1035800410100000JcAún no hay calificaciones
- Matriz Fifo (En Curso) 2022-2023Documento1 páginaMatriz Fifo (En Curso) 2022-2023KENIA LISSETTE QUI�ONEZ GARCIAAún no hay calificaciones
- Puentes Losa PretensadoDocumento328 páginasPuentes Losa Pretensadocarito 01Aún no hay calificaciones
- Biografía de Rafael RangelDocumento11 páginasBiografía de Rafael RangelGabriel TorresAún no hay calificaciones
- Trabalenguas 1Documento2 páginasTrabalenguas 1Piter CapiaAún no hay calificaciones
- FILOSOFÍA GENERAL - Tarea 7 RDocumento7 páginasFILOSOFÍA GENERAL - Tarea 7 RAgustina MercadoAún no hay calificaciones
- Ficha Socioambiental SSJN 3-1 Ronda Colombia 2021Documento10 páginasFicha Socioambiental SSJN 3-1 Ronda Colombia 2021renewcol sasAún no hay calificaciones
- La Normalidad y Anormalidad PsíquicaDocumento3 páginasLa Normalidad y Anormalidad PsíquicaDanielAún no hay calificaciones
- Trabajo Fósiles OviedoDocumento7 páginasTrabajo Fósiles OviedoNerea Cascon DiazAún no hay calificaciones
- La Funcion de Perdida de TaguchiDocumento4 páginasLa Funcion de Perdida de TaguchiElisha Carter100% (2)
- La filosofía de Bruce Lee en 40 palabras o menosDocumento167 páginasLa filosofía de Bruce Lee en 40 palabras o menosAlex PBX cg100% (1)
- Ficha Tecnica Del Cilantro Santo (Materia Prima)Documento2 páginasFicha Tecnica Del Cilantro Santo (Materia Prima)Leidy Johana Gomez GomezAún no hay calificaciones
- Laboratorio 4 de Circuitos Electricos 2Documento18 páginasLaboratorio 4 de Circuitos Electricos 2Briner Tintaya VargasAún no hay calificaciones
- Cultura ChavínDocumento5 páginasCultura ChavínAndré Gustavo Cabezudo GalvánAún no hay calificaciones
- 2 Investigacion 2semana RealidadDocumento22 páginas2 Investigacion 2semana RealidadJENKA ALVAREZ MORENOAún no hay calificaciones
- Método dual-simplex para resolver problemas de optimización linealDocumento6 páginasMétodo dual-simplex para resolver problemas de optimización linealUsuario 22Aún no hay calificaciones
- PeligroDocumento1 páginaPeligroAlexander NavarroAún no hay calificaciones
- Broca Del Cafe y BetilidosDocumento24 páginasBroca Del Cafe y BetilidosDAYANA BOLAÑOSAún no hay calificaciones
- Problemas ResueltosDocumento52 páginasProblemas Resueltossandy rosmeri zavala escalanteAún no hay calificaciones
- Electricidad Del AutomóvilDocumento86 páginasElectricidad Del Automóviljonny david martinez perez100% (1)
- Proyecto 4 - Semana 1 - EgbDocumento7 páginasProyecto 4 - Semana 1 - EgbSissi DelgadoAún no hay calificaciones
- Acuerdo MDT-2015-0262 Ecuador - TransportistasDocumento7 páginasAcuerdo MDT-2015-0262 Ecuador - TransportistasStefany RodriguezAún no hay calificaciones
- Taller # 2 El Hombre Un Ser en Relacion - Religion 8Documento1 páginaTaller # 2 El Hombre Un Ser en Relacion - Religion 8Juande RamirezAún no hay calificaciones
- Trabajo de SensoresDocumento4 páginasTrabajo de SensoresSebastian Rojas GuzmanAún no hay calificaciones
- IBAU GeneralDocumento24 páginasIBAU GeneralJulio MongeAún no hay calificaciones
- AnaMaria Gallardo Valdivia Infografia Semana1Documento13 páginasAnaMaria Gallardo Valdivia Infografia Semana1Ana Maria Gallardo ValdiviaAún no hay calificaciones
- LAMATRIZDOFADocumento4 páginasLAMATRIZDOFAluisAún no hay calificaciones