Documentos de Académico
Documentos de Profesional
Documentos de Cultura
TP Asma y Epoc
Cargado por
Tiziana RodriguezDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
TP Asma y Epoc
Cargado por
Tiziana RodriguezCopyright:
Formatos disponibles
TP ASMA Y EPOC
1. ¿QUÉ ES EL ASMA? ¿CUÁLES SON SUS CARACTERÍSTICAS MAS
IMPORTANTES? ¿CUALES SON SUS MANIFESTACIONES (SÍNTOMAS
FRECUENTES) Y CUÁLES SUS EXACERBACIONES?
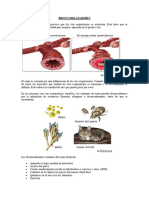
• El ASMA es una afección en la que las vías respiratorias de una
persona se inflaman, estrechan y producen mayores cantidades de
mucosa de lo normal, lo que dificulta la respiración.
• El asma puede ser leve o puede interferir en las actividades diarias.
En algunos casos, puede conducir a ataques mortales.
• El asma puede causar dificultad para respirar, dolor de pecho, tos o
sibilancia. En algunos casos, los síntomas pueden exacerbarse.
• Las exacerbaciones del asma, son episodios caracterizados por un
aumento progresivo de la dificultad para respirar, sensación de falta
de aire, sibilancias, tos y opresión torácica, o una combinación de
estos síntomas.
2. EN BASE A QUÉ PODEMOS CLASIFICAR AL ASMA
Intermitente:
• Los síntomas (dificultad para respirar, sibilancias [respirar con silbidos],
opresión en el pecho y tos): Ocurren con una frecuencia menor a 2
días a la semana.
• No interfieren en las actividades normales.
• Los síntomas nocturnos ocurren menos de 2 días al mes.
• Las pruebas de funcionamiento pulmonar (espirometría y flujo
espiratorio máximo) son normales cuando la persona no está sufriendo
un ataque de asma. Los resultados de estas pruebas son el 80% o más
del valor esperado y varían poco (el PEF varía menos del 20%) de la
mañana a la tarde.
Persistente leve:
• Los síntomas ocurren más de 2 días a la semana, pero no se presentan
todos los días.
• Los ataques interfieren en las actividades diarias.
• Los síntomas nocturnos ocurren 3 o 4 veces al mes.
• Las pruebas de funcionamiento pulmonar son normales cuando la
persona no está sufriendo un ataque de asma. Los resultados de estas
pruebas son el 80% o más del valor esperado y pueden variar en una
cifra pequeña (el PEF varía del 20% al 30%) de la mañana a la tarde.
Persistente moderada:
• Los síntomas ocurren diariamente. El medicamento inhalable de
acción rápida para el asma se usa todos los días.
• Los síntomas interfieren en las actividades diarias.
• Los síntomas nocturnos se presentan más de 1 vez a la semana, pero
no suceden todos los días.
• Las pruebas de funcionamiento pulmonar son anormales (de más del
60% a menos del 80% del valor esperado), y el PEF varía más del 30%
de la mañana a la tarde.
Persistente grave:
• Ocurren a lo largo de cada día.
• Limitan seriamente las actividades físicas diarias.
• Los síntomas nocturnos ocurren a menudo, a veces todas las noches.
• Las pruebas de funcionamiento pulmonar son anormales (el 60% o
menos del valor esperado), y el PEF varía más del 30% de la mañana a
la tarde.
Estas clasificaciones se basan en la gravedad, la cual está determinada por
los síntomas y las pruebas de funcionamiento pulmonar.
3. ¿QUE MEDICACIÓN PODEMOS UTILIZAR COMO CONTROLADORA
DE LA ENFERMEDAD?
• Albuterol (ProAir HFA, Proventil HFA, Ventolin HFA)
• Levalbuterol (Xopenex HFA)
• Metaproterenol
• Terbutalina
Las clases principales de fármacos utilizados en el tratamiento del asma y las
exacerbaciones del asma son
• Broncodilatadores (agonistas beta-2 adrenérgicos, anticolinérgicos)
• Corticosteroides
• Modificadores de los leucotrienos
• Estabilizadores de los mastocitos
• Metilxantinas
• Inmunomoduladores
4. ¿QUE MEDICACIÓN PODEMOS UTILIZAR COMO RESCATADORA
EN LAS EXACERBACIONES?
Los broncodilatadores inhalados (agonistas beta-2-adrenérgicosy
anticolinérgicos) son el pilar del tratamiento del asma en el departamento
de urgencia. En los adultos y los niños mayores, el salbutamol administrado
mediante un inhalador de dosis medida (IDM) y espaciador es tan eficaz
como el administrado por nebulizador. El tratamiento nebulizado es preferido
para los niños más pequeños por las dificultades para coordinar los IDM y los
espaciadores. Debe enfatizarse que, contrariamente a la creencia popular,
no hay datos que favorezcan la nebulización continua con agonistas beta-2
adrenérgicos sobre la administración intermitente. La evidencia sugiere que
la respuesta al broncodilatador mejora cuando el nebulizador es accionado
con una mezcla de helio y oxígeno (heliox) en lugar de oxígeno. Dada su
menor densidad, se cree que el helio ayuda al suministro de
broncodilatadores a las vías aéreas distales. Sin embargo, los aspectos
técnicos del uso de helio para la nebulización (disponibilidad, calibración de
la concentración de helio, necesidad de máscaras personalizadas para
evitar la dilución con aire ambiente) han limitado su aceptación
generalizada.
La solución de adrenalina 1:1.000 subcutánea o la terbutalina es una
alternativa para los niños. La terbutalina puede ser preferible a la adrenalina
debido a sus menores efectos cardiovasculares y a la duración de la acción
más prolongada, pero ya no se produce en grandes cantidades y es
costosa.
La administración subcutánea de agonistas beta-2-adrenérgicos en adultos
crea problemas por los efectos adversos cardioestimuladores. Sin embargo,
son pocos los efectos adversos clínicamente importantes y la administración
subcutánea puede beneficiar a los pacientes que no responden al
tratamiento inhalado máximo o a los que no pueden recibir tratamiento
nebulizado eficaz (p. ej., a los que presentan excesiva tos, mala ventilación o
no son cooperadores).
El ipratropio nebulizado puede administrarse en forma conjunta con el
salbutamol nebulizado en los pacientes que no responden de manera
óptima al salbutamol solo; algunos datos favorecen el tratamiento
simultáneo de dosis altas de agonistas beta-2-adrenérgicos e ipratropio
como tratamiento de primera línea.
Los corticoides sistémicos (prednisona, prednisolona, metilprednisolona)
deben ser administrados en todas las formas de exacerbación aguda, salvo
en la más débil; son innecesarios en los pacientes en quienes el FEM se
normaliza después de 1 o 2 dosis del broncodilatador. Las vías de
administración IV y oral son tal vez igual de eficaces. La metilprednisolona IV
puede administrarse si ya está colocado un catéter IV y cambiarse a la
administración oral cuando se considere necesario o conveniente. En
general, se recomiendan dosis más altas (prednisona 50 a 60 mg 1 vez al día)
para el tratamiento de las exacerbaciones más graves que requieren
atención hospitalaria, mientras que dosis más bajas (40 mg 1 vez al día) se
reservan para el tratamiento ambulatorio de las exacerbaciones más leves.
Aunque la evidencia sobre la dosis óptima y la duración es débil, la mayoría
de las guías recomiendan una duración del tratamiento de 3 a 5 días en
niños y de 5 a 7 días en adultos, y deben adaptarse a la gravedad y la
duración de una exacerbación.
La teofilina tiene poca acción en el tratamiento de una exacerbación
aguda del asma.
El sulfato de magnesio relaja el músculo liso, pero se debate su eficacia en el
tratamiento de la exacerbación del asma en el departamento de urgencias.
Los antibióticos se indican sólo cuando los antecedentes, el examen físico o
la radiografía de tórax sugiere una infección bacteriana subyacente; casi
todas las infecciones que subyacen a las exacerbaciones del asma son tal
vez de origen viral.
El oxígeno suplementario está indicado en caso de hipoxemia y debe
administrarse mediante cánula nasal o mascarilla facial a una velocidad de
flujo o concentración suficiente para mantener la saturación de oxígeno >
90%.
Tratar de tranquilizar al paciente es el mejor método cuando la ansiedad es
la causa de la exacerbación del asma. Los ansiolíticos y la morfina están
relativamente contraindicados debido a que estos fármacos se asocian con
depresión respiratoria, y la morfina puede causar reacciones anafilactoides
como resultado de la liberación de histamina por los mastocitos; estos
fármacos pueden aumentar la mortalidad y la necesidad de ventilación
mecánica.
5. ¿CUAL ES SU TRATAMIENTO SEGÚN EL ESTADIO?
CATEGORÍA FIN TIPOS
Medicamentos para el Se toman en forma • Corticoesteroides
control del asma a largo regular para controlar los inhalados
plazo síntomas crónicos y • Modificadores de
prevenir los ataques de leucotrienos
asma; son el tipo de • Agonistas beta de
tratamiento más acción prolongada
importante para la (LABA)
mayoría de las personas • Teofilina
con asma • Inhaladores
combinados que
contienen tanto un
corticosteroide
como un LABA
Medicamentos de alivio Se toma según sea • Agonistas beta de
rápido (medicamentos necesario para el alivio acción corta como
de rescate) rápido y a corto plazo de el albuterol
los síntomas; usado para • Ipratropio
prevenir o tratar un (Atrovent)
ataque de asma • Corticoesteroides
orales e
intravenosos (para
ataques de asma
graves)
Medicamentos para el Se toman regularmente o • Vacunas
asma inducida por según sea necesario para antialérgicas
alergias reducir la sensibilidad del (inmunoterapia)
cuerpo a una sustancia • Antialérgicos
particular causante de
alergia (alérgeno)
Biológicos Se toman con • Omalizumab
medicamentos de control (Xolair)
para detener las • Mepolizumab
respuestas biológicas (Nucala)
subyacentes que causan • Benralizumab
inflamación en los (Fasenra)
pulmones; se utilizan para • Reslizumab
controlar mejor los (Cinqair)
síntomas graves del
asma
6. AGONISTAS B2: CUALES SON DE CORTA DURACIÓN Y CUALES, DE
LARGA DURACIÓN, MECANISMO DE ACCIÓN, EFECTOS ADVERSOS,
¿CONTRAINDICACIONES E INTERACCIONES?
AGONISTAS B2 ACCIÓN PROLONGADA: Estos medicamentos
broncodilatadores abren las vías respiratorias y reducen la inflamación
durante al menos 12 horas. Se usan en un horario regular para controlar el
asma moderada a grave y para prevenir los síntomas nocturnos. Aunque son
eficaces, se han relacionado con ataques de asma graves. Los agonistas
beta de acción prolongada incluyen:
• Salmeterol (Serevent Diskus)
• Formoterol (Perforomista)
ACCIÓN CORTA: Estos agentes son el salbutamol, la terbutalina y el fenoterol.
Los agonistas β2 adrenérgicos de acción corta se usan como medicación de
rescate para aliviar síntomas de asma que aparecen aun cuando el
paciente esté cumpliendo con la medicación de mantenimiento indicada
por el médico. Existe la preocupación de que el uso excesivo e incontrolado
de los agonistas beta-2 pueda haber contribuido al aumento de la
mortalidad por asma observado en algunos países.
• Los efectos secundarios de los agonistas β2 de larga duración (long-
acting β2-agonists, LABA) son similares a los de acción corta. Entre los
más frecuentes están el temblor muscular, derivado de la activación
del músculo esquelético, la taquicardia y las palpitaciones.
Interacción entre receptores adrenérgicos y colinérgicos
El mecanismo de acción de los β2 agonistas es conocido y ha sido revisado
recientemente13. Brevemente, la estimulación de estos receptores produce la
activación de proteínas G acopladas al receptor β2, las cuales a su vez
regulan la acción de un adenilato ciclasa. Esta enzima media la
transformación de adenosín trifosfato en adenosín monofostato cíclico
(AMPc). El AMPc regula la expresión de diversas proteínas celulares, entre las
que se encuentra el canal de calcio, lo que a su vez permite la relajación de
la musculatura bronquial. Por tanto, el adenilato ciclasa y los niveles
intracelulares de AMPc desempeñan un papel crucial en el mecanismo de
acción de los receptores ß2.
7. CORTICOIDES INHALADOS: CUALES PODEMOS UTILIZAR
INHALADOS, MECANISMO DE ACCIÓN, ¿EFECTOS ADVERSOS DE
LOS INHALADOS?
Los corticoides inhalados han sido reconocidos como la medicación
antiinflamatoria más efectiva para el tratamiento del asma; estudios dosis-
respuesta han demostrado su eficacia en mejorar la función pulmonar,
disminuir la reactividad de la vía aérea, reducir la sintomatología, reducir la
frecuencia y severidad de las exacerbaciones, y mejorar la calidad de vida,
con relativas bajas dosis de corticosteroide (e.g., 100 ug/día de budesonida).
Sin embargo, la aparición de efectos adversos tales como: disminución de la
velocidad de crecimiento, pérdida de peso, hipoglicemia, convulsiones,
coma y la insidiosa presentación de insuficiencia suprarrenal, subrayan la
necesidad de actuar con sumo cuidado al momento de "etiquetar" al
paciente como asmático persistente.
ACCIONES DE LOS CORTICOIDES
Mecanismo molecular
Los glucocorticoides ejercen la mayoría de sus efectos mediante la
interacción con su receptor localizado en el citoplasma celular. El receptor
de glucocorticoide (RG) inactivo se encuentra asociado con varias
proteínas; entre ellas, dos proteínas de shock por calor (hsp90). Al unirse el
glucocorticoide, el receptor cambia su forma y se combina con otro para
formar un homodímero y de esta manera translocarse al núcleo. Una vez en
el núcleo, el receptor se une a la secuencia de ADN conocida como
"elementos de respuesta glucocorticoide" (ERG) y activa la transcripción de
genes (transactivación), responsable del inicio y mantenimiento de la
respuesta anti-inflamatoria, así como de la up-regulation de los receptores
b2 adrenérgicos. No obstante, es causa de los principales efectos
metabólicos indeseables de los glucocorticoides, como intolerancia a la
glucosa e hipertensión arterial.
Los glucocorticoides también pueden inhibir la transcripción de genes
(transrepresión). La transrepresión ocurre por unión del RG a la secuencia de
ADN llamada "elementos de respuesta glucocorticoide negativa" (ERGn), o
por interacción directa de este receptor con factores de transcripción
nuclear como el factor nuclear kb, el factor nuclear activador de células T y
la proteína activadora (AP-1). Muchas de las acciones anti-inflamatorias de
los glucocorticoides son mediadas a través de la interacción con estos
factores de transcripción nuclear.
Farmacocinética
La transactivación es responsable de los principales efectos atribuidos a los
glucocorticoides; a tal punto que, se considera la potencia de
transactivación como una medida útil de la capacidad de inducir efectos
secundarios. Estudios in vitro han demostrado que una transactivación
óptima ocurre luego de 24 horas de la estimulación con glucocorticoides, en
el siguiente orden de potencia: propionato de fluticasona >budesonide
>beclometasona. Para la capacidad de transrepresión el orden de potencia
es el mismo. Por consiguiente, el desarrollo de glucocorticoides con mayores
propiedades transrepresivas y propiedades de transactivación disminuidas,
proveerá potentes glucocorticoides inhalados con menos efectos adversos.
La potencia terapéutica de los glucocorticoides inhalados esta determinada
por varios factores. Solo la porción libre es capaz de interaccionar con el
receptor; la proporción de unión a proteínas se da en el siguiente orden:
propionato de fluticasona (90%) >budesonida (88%) >beclometasona (87%).
De esta manera, el propionato de fluticasona altamente lipofílico y con una
gran afinidad por el RG tendrá una buena distribución y larga vida media.
Debido a que una importante cantidad de medicamento es absorbida en la
mucosa oral, la biodisponibilidad del glucocorticoide estará determinada
por el grado de metabolismo hepático. El propionato de fluticasona es casi
completamente metabolizado (99%) en los hepatocitos, por lo que cualquier
efecto sistémico estará determinado por la absorción pulmonar. La
beclometasona es rápidamente hidrolizada en hígado y pulmón a
monopropionato de beclometasona, el cual conserva el 72% de potencia
de la molécula inicial y tiene mayor vida media (6,5 vs 0,5 horas). La
budesonida prácticamente no sufre transformación en el nivel alveolar,
siendo inactivada en el hígado.
La eficacia del tratamiento está directamente relacionada con el grado de
absorción pulmonar, y ésta es directamente dependiente del grado de
inflamación de las vías aéreas. Por consiguiente, el sobretratamiento del
asma intermitente es factible que produzca mayores efectos secundarios.
8. ANTI IgE MECANISMO DE ACCIÓN
El asma frecuentemente conlleva un componente alérgico que induce una
excesiva producción de IgE en respuesta a los alergenos medioambientales.
La IgE se une a los receptores de la membrana celular provocando la
liberación de mediadores de la inflamación. La alergia se desarrolla en parte
debido a factores genéticos que el paciente hereda de sus progenitores, así
como también debido a factores ambientales, y su tratamiento se basa en
evitar los factores desencadenantes (alergenos), uso de medicamentos y
vacunas de alergia (inmunoterapia). Los medicamentos consiguen cada vez
mejores efectos con menores reacciones adversas, pero presentan el
problema de que al retirárselos, una vez que su nivel sérico ha disminuido, la
protección al paciente también lo hace. Las vacunas de alergia son en la
actualidad una excelente alternativa de tratamiento, y debe hacerse
únicamente con extractos alergénicos estandarizados y en manos de un
médico alergólogo exclusivamente. Las bases moleculares de su efecto
benéfico se conocen ya desde hace tiempo atrás y se resumen en una
disminución de la IgE específica para el alergeno contra el que se está
vacunando, disminución de la reactividad de mastocitos y basófilos.
9. METILZANTINAS: MECANISMO DE ACCIÓN EFECTOS ADVERSOS
CONTRAINDICACIONES
Las metilxantinas relajan el músculo liso bronquial (tal vez al inhibir la
fosfodiesterasa) y pueden mejorar la contractilidad miocárdica y
diafragmática a través de mecanismos desconocidos. Las metilxantinas
parecen inhibir la liberación de calcio intracelular, disminuir la fuga
microvascular en la mucosa de las vías aéreas e inhibir la respuesta tardía a
los alérgenos. Asimismo, disminuyen la infiltración de eosinófilos en la mucosa
bronquial y de células T en el epitelio.
La metilxantina teofilina se utiliza para el control a largo plazo como un
auxiliar de los agonistas beta-2-adrenérgicos. La teofilina de liberación
extendida ayuda a tratar el asma nocturna. La teofilina ha caído en desuso
por sus muchos efectos adversos e interacciones en comparación con otros
fármacos. Los efectos adversos incluyen dolor de cabeza, vómitos, arritmias
cardíacas, convulsiones y agravamiento del reflujo gastroesofágico (al
reducir la presión del esfínter esofágico inferior).
Las metilxantinas tienen un índice terapéutico estrecho; varios fármacos
(cualquiera metabolizado por la vía del citocromo P-450, como los
antibióticos macrólidos) y enfermedades (p. ej., fiebre, hepatopatía,
insuficiencia cardíaca) alteran el metabolismo y la eliminación del fármaco.
La concentración de teofilina sérica debe ser monitorizada en forma
periódica y mantenida entre 5 y 15 mcg/mL (28 y 83 micromol/L).
10. ANTICOLINERGOCOS: MECANISMO DE ACCIÓN EFECTOS
ADVERSOS
Anticolinérgicos
Los anticolinérgicos relajan el músculo liso bronquial a través de la inhibición
competitiva de los receptores colinérgicos muscarínicos (M3). El ipratropio
puede tener un efecto aditivo cuando se combina con agonistas beta-2-
adrenérgicos de acción rápida. Los efectos adversos incluyen la dilatación
pupilar, la visión borrosa y la sequedad de la boca. El inhalador SMI de
tiotropio (1,25 mcg/aerosol) es un anticolinérgico inhalatorio de 24 horas de
duración que puede utilizarse para pacientes con asma. En pacientes con
asma, los ensayos clínicos con tiotropio añadido a cualquiera de los
corticosteroides inhalados o a una combinación de agonista beta-2-
adrenérgico inhalado de acción prolongada más un corticosteroide han
demostrado la mejora de la función pulmonar y la disminución de las
exacerbaciones del asma.
EPOC
1. QUÉ ES EL EPOC
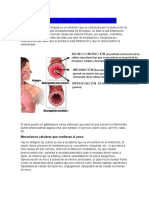
La enfermedad pulmonar obstructiva crónica (EPOC) es una enfermedad
pulmonar inflamatoria crónica que causa la obstrucción del flujo de aire de
los pulmones.
2. QUE CARACTERÍSTICAS TIENE LA BRONQUITIS CRÓNICA
Tos frecuente o tos que produce mucha mucosidad. Sibilancias. Un silbido o
chirrido cuando respira. Falta de aliento, especialmente si hace actividad
física.
3. QUE CARACTERÍSTICAS TIENE EN ENFISEMA
El enfisema y la bronquitis crónica son las dos afecciones más comunes que
contribuyen a la enfermedad pulmonar obstructiva crónica. Estas dos
afecciones suelen ocurrir juntas y su gravedad puede variar entre los
individuos con enfermedad pulmonar obstructiva crónica.
El enfisema es una afección en la que los alvéolos al final de los pasajes de
aire más pequeños (bronquiolos) de los pulmones se destruyen como
resultado de una exposición perjudicial al humo de cigarrillo y otros gases y
partículas irritantes.
4. CAUSAS DE EPOC
Típicamente es causado por la exposición a largo plazo a gases irritantes o
partículas de materia, más a menudo por el humo del cigarrillo. Las personas
con enfermedad pulmonar obstructiva crónica tienen un mayor riesgo de
desarrollar enfermedades cardíacas, cáncer de pulmón y varias otras
afecciones.
5. TRATAMIENTO NO FARMACOLÓGICO
La piedra angular del tratamiento de la enfermedad pulmonar obstructiva
crónica (EPOC) es el abandono del hábito tabáquico y la adopción de
hábitos saludables generales como seguir una alimentación equilibrada y
realizar de manera regular actividad física.
6. TRATAMIENTO FARMACOLÓGICO.
Los objetivos generales del tratamiento de la EPOC se resumen
en:
• Reducir los síntomas crónicos de la enfermedad;
• Disminuir la frecuencia y gravedad de las agudizaciones;
• Mejorar el pronóstico.
Se deben alcanzar tanto los beneficios a corto plazo; control de la
enfermedad, como los de medio y a largo plazo; reducción del riesgo de
agudizaciones, caída acelerada de la función pulmonar o muerte.
Terapia inhalada:
La administración de fármacos por vía inhalatoria va en aumento. La
posibilidad de utilizar fármacos en dosis muy pequeñas y hacerlos llegar al
aparato respiratorio (órgano diana), lugar donde van a desarrollar su acción,
proporcionan tranquilidad al paciente y al médico prescriptor. Lo efectos
positivos son rápidos y eficaces y presentan escasos efectos indeseables.
Los dispositivos comerciales utilizados para la administración del fármaco son
múltiples, lo que permite una atención más personalizada a la hora de
proponer el dispositivo que mejor se adapte a las necesidades del paciente,
junto a una adecuada instrucción de la técnica.
Además, cada dispositivo de inhalación dispone en su interior de uno o varios
fármacos. La duración de la toma de cada fármaco es diferente, por lo
tanto, conocer los diferentes sistemas de inhalación y las diferentes
posibilidades de fármaco disponibles son aspectos importantes a tener en
cuenta.
• Broncodilatadores. Aumentan el diámetro de los bronquios cuando
estos se han estrechado. Los de acción corta se toman cada cuatro o
seis horas y los de acción prolongada, cada doce horas.
• Anticolinérgicos. Actúan como los broncodilatadores de acción corta
(cada 4 o 6 horas) o bien de acción larga (cada 24 horas).
• Antiinflamatorios.
• Corticoides. Desinflaman la mucosa bronquial. No se nota el efecto de
estos medicamentos hasta pasados varios días y tienen una duración
de 12 horas.
En el caso de las enfermedades respiratorias crónicas, es importante tomarse
la medicación prescrita, evitar automedicarse y no abandonar el
tratamiento, así como tampoco aumentar o disminuir las dosis. El equipo
médico le indicará cuándo debe tomárselos.
Un aspecto importante es que se debe tomar la medicación cada día, pero
además de una manera correcta. Muchos pacientes creen que como hace
muchos años que toman espráis ya saben cómo se hace. Pero eso no es
cierto. Solo un grupo pequeño de pacientes sabe realizar de manera
correcta la técnica de los inhaladores.
También podría gustarte
- Farmacologia Medicamentos Más UtilizadosDocumento23 páginasFarmacologia Medicamentos Más UtilizadosEddie LopezAún no hay calificaciones
- Caso Clínico AsmaDocumento20 páginasCaso Clínico AsmaCamilaDiazMejia100% (1)
- 16 TEMA 16.farmacologia Del A.resp KFDocumento11 páginas16 TEMA 16.farmacologia Del A.resp KFPolo Orellana Jheny AraceliAún no hay calificaciones
- Fisiopatología BroncoespasmoDocumento42 páginasFisiopatología BroncoespasmoEligio Gallegos MartinezAún no hay calificaciones
- Aerosolterapia Curso 2020Documento84 páginasAerosolterapia Curso 2020Eduardo Tognarelli GuzmánAún no hay calificaciones
- BroncodilatadoresDocumento21 páginasBroncodilatadoresfernanda esparza morinAún no hay calificaciones
- Expo BroncodilatadoresDocumento49 páginasExpo BroncodilatadoresCristian Andres Guerrero Andi100% (3)
- Fármacos Utilizados en El Tratamiento Del Asma by LizDocumento24 páginasFármacos Utilizados en El Tratamiento Del Asma by LizLiz LizAún no hay calificaciones
- Crisis AsmáticaDocumento34 páginasCrisis AsmáticaYonatan Gómez100% (1)
- AnticolinérgicosDocumento24 páginasAnticolinérgicosAlexandra SáenzAún no hay calificaciones
- Tratamiento Del Asma Con BiomagnetismoDocumento15 páginasTratamiento Del Asma Con BiomagnetismoTerapiaDeBiomagnetismoSalta100% (11)
- Farmacologia Respiratoria Generalidades, ResumenDocumento10 páginasFarmacologia Respiratoria Generalidades, ResumenFranco DanielAún no hay calificaciones
- Medicamentos en NeumologiaDocumento17 páginasMedicamentos en NeumologiaYoossi Pertuz Manga100% (2)
- Exposiciòn Patologìas RespiratoriasDocumento12 páginasExposiciòn Patologìas RespiratoriasAngie GonzalezAún no hay calificaciones
- Manejo de Los Sintomas Del AsmaDocumento2 páginasManejo de Los Sintomas Del AsmaWinter FlowerAún no hay calificaciones
- Cuadro Clínico AsmaDocumento29 páginasCuadro Clínico AsmaDiana OrihuelaAún no hay calificaciones
- Tratamiento Inhalado Del AsmaDocumento9 páginasTratamiento Inhalado Del AsmaHilari BolivarAún no hay calificaciones
- TIPOS DE MEDICAMENTOS FarmacológicosDocumento6 páginasTIPOS DE MEDICAMENTOS Farmacológicosmartha tapiaAún no hay calificaciones
- Asma BronquialDocumento5 páginasAsma BronquialManuelrojasAún no hay calificaciones
- Tratamiento Del Asma Cronica en Fase EstableDocumento25 páginasTratamiento Del Asma Cronica en Fase EstableJose Calla TorresAún no hay calificaciones
- Guía Segundo ParcialDocumento33 páginasGuía Segundo ParcialAshley Merillen DominguezAún no hay calificaciones
- Asma UPE (Autosaved)Documento21 páginasAsma UPE (Autosaved)izaias FilhoAún no hay calificaciones
- Farmacoterap Asma Bron 20-IiDocumento59 páginasFarmacoterap Asma Bron 20-Iithalia troncos100% (1)
- 2 Vade 5Documento14 páginas2 Vade 5Almendra Nicolle Cid AscencioAún no hay calificaciones
- BroncodilatadoresDocumento2 páginasBroncodilatadoresDe Leon BederAún no hay calificaciones
- Broncodilatadores y Antiinflamatorios BronquialesDocumento9 páginasBroncodilatadores y Antiinflamatorios Bronquialestono.serna.ramirezAún no hay calificaciones
- Terapéutica FarmacológicaDocumento3 páginasTerapéutica FarmacológicaNickol Daneira Cadima JustinianoAún no hay calificaciones
- AsmaDocumento23 páginasAsmaJoaquin GarridoAún no hay calificaciones
- Asma, Tuberculosis, NeumoniaDocumento32 páginasAsma, Tuberculosis, NeumoniaJuan Carlos RoaAún no hay calificaciones
- Bronco Dilat AdoresDocumento15 páginasBronco Dilat AdoresIngeniero GregoryAún no hay calificaciones
- Caso ClínicoDocumento3 páginasCaso ClínicoBibiana Maria Zapata VelasquezAún no hay calificaciones
- Asma Upsjb DR Paz 2021Documento54 páginasAsma Upsjb DR Paz 2021Ingrid BGAún no hay calificaciones
- Farmacología RespiratoriaDocumento28 páginasFarmacología RespiratoriaPaula VideauAún no hay calificaciones
- D 1Documento12 páginasD 1dalia fimbresAún no hay calificaciones
- Broncodilatadores Farmacologia .....Documento10 páginasBroncodilatadores Farmacologia .....Esmeralda GordilloMateoAún no hay calificaciones
- 1 Farmacos Utilizados para El Asma 352976 Downloable 866279Documento11 páginas1 Farmacos Utilizados para El Asma 352976 Downloable 866279MARGARET VALERY ORE CRUZAún no hay calificaciones
- Farmacos AntiasmaticosDocumento10 páginasFarmacos AntiasmaticosDaniel Mendoza BravoAún no hay calificaciones
- Farmacos para El Tratamiento Del AsmaDocumento13 páginasFarmacos para El Tratamiento Del AsmaKelly Sahonero HinojosaAún no hay calificaciones
- Asma y Tos 2023Documento39 páginasAsma y Tos 2023stefany guerreroAún no hay calificaciones
- AntiasmáticosDocumento59 páginasAntiasmáticosgaiborcarlos50% (2)
- Urgencias en Pacientes Con Asma y EpocDocumento59 páginasUrgencias en Pacientes Con Asma y EpocLeonardo CofréAún no hay calificaciones
- AsmaDocumento3 páginasAsmajuanAún no hay calificaciones
- Exacerbaciones de ASMADocumento21 páginasExacerbaciones de ASMAAlejandra BucioAún no hay calificaciones
- El Aparato Respiratorio 09Documento15 páginasEl Aparato Respiratorio 09Lilibeth GranobleAún no hay calificaciones
- AsmaDocumento9 páginasAsmaCarmen Mendoza GabrielAún no hay calificaciones
- AsmaDocumento10 páginasAsmaJM AmanAún no hay calificaciones
- Casos Clinicos Respiratorios PDFDocumento3 páginasCasos Clinicos Respiratorios PDFDania VillalpandoAún no hay calificaciones
- EPOC2Documento47 páginasEPOC2Paula Andrea Barrera GrandaAún no hay calificaciones
- AsmaDocumento19 páginasAsmaERPalermoAún no hay calificaciones
- Asma Bronquial - Fisiopatología, Tipos y CaracterísticasDocumento45 páginasAsma Bronquial - Fisiopatología, Tipos y CaracterísticasCesarA.ARAún no hay calificaciones
- AntiasmaticosDocumento9 páginasAntiasmaticosJuan GabrielAún no hay calificaciones
- Enfermedad Pulmonar Obstructiva CrónicaDocumento31 páginasEnfermedad Pulmonar Obstructiva CrónicaDulce Carolina Ruvalcaba GonzalezAún no hay calificaciones
- Farmaco RespiDocumento18 páginasFarmaco RespiGuadalupe LebusAún no hay calificaciones
- ASMAaaaDocumento5 páginasASMAaaaCarlos Alonso Ugarte RiosAún no hay calificaciones
- Medicamentos Del Aparato RespiratorioDocumento9 páginasMedicamentos Del Aparato RespiratorioGonzalo Escobar Martínez100% (2)
- Fármacos Del Sistema Respiratorio Farmacologia IIDocumento36 páginasFármacos Del Sistema Respiratorio Farmacologia IIeduardo valdiviezo galvezAún no hay calificaciones
- Apuntes Sobre AntiasmáticosDocumento2 páginasApuntes Sobre AntiasmáticosGabriel Alejandro Rodríguez GuerreroAún no hay calificaciones
- Presentacion Crisis Asma o BroncoespasmosDocumento28 páginasPresentacion Crisis Asma o BroncoespasmosSamuel VasquezAún no hay calificaciones
- 11-Farmacos RespiratoriosDocumento48 páginas11-Farmacos RespiratoriosNatu SBerriosAún no hay calificaciones
- Capítulo 20 FarmaPulmonar FármacosDocumento2 páginasCapítulo 20 FarmaPulmonar FármacosJannely Nava MejíaAún no hay calificaciones
- Farmacos Que Actuan Sobre El Sistema RespiratorioDocumento15 páginasFarmacos Que Actuan Sobre El Sistema RespiratorioWilhelm Camargo ChauxtreauAún no hay calificaciones
- Asma y Medicamentos AntiasmaticosDocumento31 páginasAsma y Medicamentos AntiasmaticosLeo MontañezAún no hay calificaciones
- Crisis AsmaticaDocumento28 páginasCrisis AsmaticaIribrenAún no hay calificaciones
- GuíaDocumento9 páginasGuíaSamuel RiosAún no hay calificaciones
- ¿Cómo Se Vive Con El Asma?: Recomendaciones para el día a día, el ejercicio, el viaje y las situaciones de emergenciaDe Everand¿Cómo Se Vive Con El Asma?: Recomendaciones para el día a día, el ejercicio, el viaje y las situaciones de emergenciaCalificación: 5 de 5 estrellas5/5 (1)
- Fármacos ColinérgicosDocumento12 páginasFármacos ColinérgicosANGELA LINARESAún no hay calificaciones
- Tarea BroncodilatadoresDocumento10 páginasTarea BroncodilatadoresJohana MarinAún no hay calificaciones
- Cuestionario Examen FármacoDocumento33 páginasCuestionario Examen FármacoStalin MirandaAún no hay calificaciones
- Asma y BroncodilatadoresDocumento11 páginasAsma y BroncodilatadoresAline AranedaAún no hay calificaciones
- Farmaco RespiDocumento18 páginasFarmaco RespiGuadalupe LebusAún no hay calificaciones
- G13 NeumologiaDocumento17 páginasG13 NeumologiaCentro de Salud Zacatelco CSZAún no hay calificaciones
- Gestión Del Cuidado en El Usuario Con EPOCDocumento38 páginasGestión Del Cuidado en El Usuario Con EPOCAlejandro NuñezAún no hay calificaciones
- Sist. Provision de Gases, Humidificadores y AerosolterapiaDocumento17 páginasSist. Provision de Gases, Humidificadores y AerosolterapiaErika Vanessa Castrillon HolguinAún no hay calificaciones
- Pruebita GeriaDocumento160 páginasPruebita Geriagordo crisAún no hay calificaciones
- Trabjo 2Documento14 páginasTrabjo 2Rodrigo Adrián Bautista CazorlaAún no hay calificaciones
- Farmacologia RespiratoriaDocumento21 páginasFarmacologia RespiratoriaLucia OrtegaAún no hay calificaciones
- Ruta EPOC OSI Goierri-Alto Urola 2012-3Documento17 páginasRuta EPOC OSI Goierri-Alto Urola 2012-3goierritaldeklinikoaAún no hay calificaciones
- ¿Cómo Se Utilizan Los Dispositivos de Inahalacion PDFDocumento7 páginas¿Cómo Se Utilizan Los Dispositivos de Inahalacion PDFrobayeraAún no hay calificaciones
- Farmacoterapia de La EPOCDocumento16 páginasFarmacoterapia de La EPOCNicole Vargas MarínAún no hay calificaciones
- EPOCDocumento5 páginasEPOCNadiaAún no hay calificaciones
- 1 Farmacos Utilizados para El Asma 352976 Downloable 866279Documento11 páginas1 Farmacos Utilizados para El Asma 352976 Downloable 866279MARGARET VALERY ORE CRUZAún no hay calificaciones
- Manual para El Cuidado Integral de Personas AdultasDocumento142 páginasManual para El Cuidado Integral de Personas Adultasmaidecuzzi743100% (1)
- Farmacología 2021Documento57 páginasFarmacología 2021Jessica SuarezAún no hay calificaciones
- EPOC y BroncodilataciónDocumento50 páginasEPOC y BroncodilataciónGeorg HeberleinAún no hay calificaciones
- Farmacología Del Sistema Respiratorio-FichasDocumento13 páginasFarmacología Del Sistema Respiratorio-FichasYair CrooZzAún no hay calificaciones
- Tratamiento Actual de EPOCDocumento14 páginasTratamiento Actual de EPOCCésar A H. SalinasAún no hay calificaciones
- InhalantesDocumento25 páginasInhalantesSÁNCHEZ ACOSTA ALEXIS URIELAún no hay calificaciones
- Clase 12 - Patología RespiratoriaDocumento6 páginasClase 12 - Patología RespiratoriaJose SantanaAún no hay calificaciones
- Tratamiento Farmacologico de La Obstruccion Bronquial-JuniorDocumento9 páginasTratamiento Farmacologico de La Obstruccion Bronquial-JuniorJr CastroAún no hay calificaciones
- Articulo Español Tiotropio en El AsmaDocumento22 páginasArticulo Español Tiotropio en El AsmaDiego VasquezAún no hay calificaciones