Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Permanganimetria
Cargado por
José MariaDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Permanganimetria
Cargado por
José MariaCopyright:
Formatos disponibles
Titulación de KMnO4 con Na2C2O3 Faculta de estudios superiores Zaragoza
Resumen.
En esta práctica se realizó una titulación oxido reducción de KMno4 con oxalato de sodio como patrón
primario basándonos en la permanganimetria la volumetría redox consistió en la medición del volumen
necesario de una sustancia oxidante o reductora para determinar el punto final de una disolución
redox para calcular el peso equivalente de una sustancia oxidante o reductora se debe dividir el peso
molecular de la misma con respecto al cambio de numero de oxidación.
Las soluciones de los oxidantes más comunes en la titulación de los reductores son los que usamos
como el KMno4 aparte esta también el KCr2O7 mientras que los reductores más comunes son el
utilizado Na2C2O4 y otro muy común que no usamos es el Cl-.
Una vez que se disolvió el KMnO4 se calentó la solución para acelerar la oxidación de la materia
orgánica, con la consiguiente precipitación de MnO2 y posteriormente se enfrió para que se coagulase
el MnO2, inicialmente coloidal. A continuación, se separó el MnO2 para evitar que catalice la
descomposición del KMnO4. Dicha separación se realizó por filtración con papel de filtro.
No fue necesario almacenar la solución en frascos ámbar ya que a pesar de ser fotosensible el tiempo
de la operación no fue el suficientemente largo como para llegar a ese punto.
Y finalmente ya preparada la disolución de oxalato de sodio con ácido sulfúrico igualmente calentada a
70 °C se tituló el KMno4 hasta un viraje de color rosa claro, cabe señalar que el KMno4 no necesita un
indicador ya que el permanganato tiene auto indicador.
Objetivos.
El objetivo principal que se pretende lograr en éste experimento es determinar experimentalmente la
normalidad de una disolución de permanganato de potasio, KMnO4, para conocer su verdadera
concentración.
Identificar el agente reductor y oxidante
Así como el manejo e interpretación de los conceptos propios de la permanganimetría. Empleando
para este fin soluciones de oxalato de sodio y permanganato de potasio preparadas por ellos mismos y
llevando a cabo las reacciones que le permitan determinar la normalidad de las misma.
Alumno: Rojas Vázquez José maría 07/11/2018
Grupo 1355 laboratorio L-1413
Firma
Titulación de KMnO4 con Na2C2O3 Faculta de estudios superiores Zaragoza
Método.
Valoración del permanganato de potasio
Se prepararon las disoluciones en primer lugar se preparó la disolución de permanganato de potasio
primeramente pesando el vaso de precipitado en una balanza granataria y se pesaron 0.316 g de
permanganato de potasio y se le agregaron 100 ml de agua destilada y se procedió a calentar 10
minutos a ebullición para seguidamente enfriar en baño de hielo, dejar diluir por 15 minutos y filtrar
con embudo tallo corto y papel filtro, simultáneamente a la preparación del permanganato de potasio
se preparó la disoluciones del patrón primero el oxalato de sodio se hicieron 3 alícuotas previamente
pesando en papel glacis el oxalato de sodio el peso ideal sería de 0.067 g y pero el peso de primer
matraz fue de 0.071 g el segundo matraz fue de 0.068 y el tercero de 0.069 y en cada matraz se agregó
50 ml de agua destilada y se agito hasta que se disolviera el oxalato de sodio, para posteriormente
agregar 3 ml de H2SO4 concentrado en cada matraz una vez concluido este paso se procedió a
calentar a ebullición la disolución de oxalato de sodio seguido de esto se procedió finalmente a titular
el permanganato depositando el permanganato de potasio en la bureta y titulando con agitación las
tres alícuotas hasta obtener un viraje rosa claro ahí acabo la práctica.
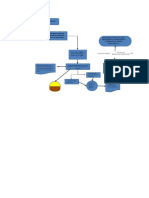
Diagrama de flujo
Pesar 0.0316 g de Calentar a ebullicion por 10
Disolver en 100 ml de agua
KMno4 minutos, poner a baño de
destiala
hielo, Filtrar y etiquetar
Agregar 50 ml de agua
Calentar a ebullicion y Pesar tres veces 0.067 g
destilada y agitar
finalmente titular el de oxalato de sodio y
después Agregar tres ml
KMno4 depositarlo en tres
de H2SO4 y calentar
matraces
Alumno: Rojas Vázquez José maría 07/11/2018
Grupo 1355 laboratorio L-1413
Firma
Titulación de KMnO4 con Na2C2O3 Faculta de estudios superiores Zaragoza
Cálculos.
Preparación del KMnO4 al 0.1 N Preparación de Na2C2O4 al 0.1 N
C= 0.1 N C= 0.1
V= 100 ml 0.1 L M= (0.1)(0.010)(134/2)= 0.067g
PM = 158.03 g/mol
Peq = 158.03 g/mol /5.04 g/mol= 31.606
N=eq/v Eq=Nv=(0.1 N)(0.1L)
Eq= 0.01 eq Eq= m/Eq
Xy=(0.01eq)(31.606)= 0.316 g
2 KMnO4 + 5 Na2C2O4 + 8 H2SO4 → 2 MnSO4 + K2SO4 + 5 Na2SO4 + 10 CO2 + 8 H2O
con un cambio en el número de oxidación de: Mn7+ + 5e− → Mn++
por lo que el peso equivalente de permanganato de potasio resulta = 158 g mol de KMnO4
5.0 g mol / eq. g. de cargas electrónicas =31.6 eq. g.
Resultados
Matraz (g) patrón Ml gastados Normalidad X Sx Cv
primario KMnO4 KMnO4
Na2C2O4
1 0.071 7.2 0.1465
2 0.068 6.4 0.1578 0.151316 0.005918 3.86
3 0.070 6.7 0.1552
Estandarización
NKMnO4 = mNa2C2O4 /(vKMnO4)(PeqNa2C2O4) = (0.071 g)/(0.0072 L)(67.305 g/eq) = 0.1465 N
NKMnO4 = (0.068 g)/(0.0064 L)(67.305 g/eq) = 0.1578 N
NKMnO4 = (0.070 g)/(0.0067 L)(67.305 g/eq) = 0.1552 N
Discusión de resultados
Alumno: Rojas Vázquez José maría 07/11/2018
Grupo 1355 laboratorio L-1413
Firma
Titulación de KMnO4 con Na2C2O3 Faculta de estudios superiores Zaragoza
En esta práctica obtuvimos un gasto bastante apegado a lo esperado en la vista previa teórica en la
cual establecíamos un gasto de una media aritmética de aproximado de 7 ml pudimos observar que en
efecto el manganeso se oxida y pierde dos electrones que son adquiridos por el oxalato que es el
elemento reductor ya que gana esos 2 electrones de esta manera se cumple con la regla de
desplazamiento de electrones por oxido reducción llegando a obtener de esta manera un promedio
esperado de la normalidad del permanganato de potasio de promedio de 0.02 que era la esperada en
el método de la feum así que al final el resultado es muy similar al teórico
La apreciación del punto final depende particularmente de la apercepción del analista de cuál es el
volumen donde ocurre el cambio de coloración. En la medida en que se realizan las titulaciones, el
analista podrá afinar aún más dónde se encontrará el valor correcto del punto de equivalencia. Esta
apreciación es fundamental en el resultado final de la experiencia, desviando en cierto grado el
resultado de valor verdadero.
Conclusiones
1. Los datos experimentales recogidos durante la práctica son bastante preciso.
2. No se puede afirmar y asegurar de que los valores obtenidos de concentración de las soluciones
estén cercano al valor real.
3. La inestabilidad del Permanganato de Potasio pudo haber sido una fuente de desviación en valores.
4. La coloración del permanganato de potasio permite la determinación del punto final de una
titulación redox, sin la necesidad de utilizar otro reactivo auxiliar, lo que quiere decir, no se requiere de
una solución muy concentrada de Permanganato de Potasio para realizar la titulación sin indicador,
pero al mismo tiempo no debe ser muy diluida.
Bibliografía:
-Química Analítica, D.A. Skoog, D.M. West, y F.J. Heller. 6ta Edición, Mc. Graw Hill, 1995
-Química Analítica Cuantitativa, R.A. Day y A.L. Underwood, 5ta Edición, Prentice Hall, 1995
-Principios de Química Aanalítica, M. Valcarcel, Springer, 1999
Alumno: Rojas Vázquez José maría 07/11/2018
Grupo 1355 laboratorio L-1413
Firma
También podría gustarte
- Descomposición Del Peróxido de Hidrogeno N°6Documento13 páginasDescomposición Del Peróxido de Hidrogeno N°6Danilo Arias RojasAún no hay calificaciones
- Calor Especifico de Los MetalesDocumento14 páginasCalor Especifico de Los MetalesHibarixHotaroAún no hay calificaciones
- LabN° 8 PermanganimetríaDocumento10 páginasLabN° 8 PermanganimetríaAna Soffia Gómez AriasAún no hay calificaciones
- Práctica 4 FISICOQUIMICA ING AMBIENTAL IPNDocumento17 páginasPráctica 4 FISICOQUIMICA ING AMBIENTAL IPNGaby GonzalezAún no hay calificaciones
- Solución Al Ejercicio 11 Del Libro de TextoDocumento2 páginasSolución Al Ejercicio 11 Del Libro de Textojvc19536361Aún no hay calificaciones
- Practica 10 QuimicaDocumento7 páginasPractica 10 QuimicaedwinAún no hay calificaciones
- Manual de PryIÂActicas de QuyIÂmica OrgyIÂAnica 2Documento33 páginasManual de PryIÂActicas de QuyIÂmica OrgyIÂAnica 2Yessica leyvaAún no hay calificaciones
- Taller Complementario - 2parcialDocumento4 páginasTaller Complementario - 2parcialjenrygiraldoAún no hay calificaciones
- Calif:9.0: Benemérita Universidad Autónoma de PueblaDocumento12 páginasCalif:9.0: Benemérita Universidad Autónoma de PueblaMonserrat HernandezAún no hay calificaciones
- Momento1 Grupo 12Documento25 páginasMomento1 Grupo 12TCOAndres15 xAún no hay calificaciones
- Práctica 4 - Reduccón Por NaBH4Documento5 páginasPráctica 4 - Reduccón Por NaBH4Humberto Flores LealAún no hay calificaciones
- Conservacion de La MasaDocumento5 páginasConservacion de La MasaArmando Covarrubias BalderramaAún no hay calificaciones
- Práctica de Laboratorio N°3 de Fisicoquimica IiDocumento13 páginasPráctica de Laboratorio N°3 de Fisicoquimica IiLuis Angel GomezAún no hay calificaciones
- Práctica: Reacción Del Haloformo Sobre La AcetofenonaDocumento7 páginasPráctica: Reacción Del Haloformo Sobre La AcetofenonaMaria Gabriela Martinez GonzalezAún no hay calificaciones
- Reducción de Ácidos CarboxílicosDocumento17 páginasReducción de Ácidos CarboxílicosJorge Mario Fernandez PeñaAún no hay calificaciones
- Clase Propiedades ColigativasDocumento33 páginasClase Propiedades ColigativasDiego ArriagadaAún no hay calificaciones
- Informe Fisicoquímica-Laboratorio 2Documento7 páginasInforme Fisicoquímica-Laboratorio 2Heidy Montes GalarzaAún no hay calificaciones
- Lab 6Documento17 páginasLab 6Ayrton Jimenez InfantesAún no hay calificaciones
- Reporte Fuerzas Intermoleculares2Documento14 páginasReporte Fuerzas Intermoleculares2Juana CruzAún no hay calificaciones
- Determinacion de Grupos FuncionalesDocumento4 páginasDeterminacion de Grupos Funcionalesandres guerreroAún no hay calificaciones
- Lab Oratorio 8Documento18 páginasLab Oratorio 8erickasegoviacaceresAún no hay calificaciones
- CompletoDocumento439 páginasCompletoJuan Carlos Vazquez80% (5)
- Problemas A Resolver PDFDocumento41 páginasProblemas A Resolver PDFAda ArenasAún no hay calificaciones
- Practica 7 Quimica UAEH IMMDocumento7 páginasPractica 7 Quimica UAEH IMMZuͥriͣeͫl Meyer100% (1)
- Taller Teoria de Lewis, Cargas Formales y ResonanciaDocumento1 páginaTaller Teoria de Lewis, Cargas Formales y ResonanciaCristian Sair Garcés NaranjoAún no hay calificaciones
- Informe Calor Integral de SoluciónDocumento16 páginasInforme Calor Integral de SoluciónSergio Daniel Lopez GalvisAún no hay calificaciones
- Informe Práctica 8. Obtención de M-Dinitrobenzoato de MetiloDocumento4 páginasInforme Práctica 8. Obtención de M-Dinitrobenzoato de Metilo319281857Aún no hay calificaciones
- Informe PracticaDocumento8 páginasInforme PracticaRoberto Sánchez100% (1)
- Ley de Hess Informe #5Documento5 páginasLey de Hess Informe #5julia elena perez pelaezAún no hay calificaciones
- Clase 3-IndicadoresDocumento24 páginasClase 3-IndicadoresAntonio José González ParejaAún no hay calificaciones
- Palmer Capitulo VDocumento10 páginasPalmer Capitulo VDiego Morales MataAún no hay calificaciones
- Guión Ley de Enfriamiento de NewtonDocumento4 páginasGuión Ley de Enfriamiento de NewtonFrida Arroyo ChavarriaAún no hay calificaciones
- Informe 1 SintesisDocumento3 páginasInforme 1 SintesisBryan BautistaAún no hay calificaciones
- Valoración Potenciometrica ACOHDocumento9 páginasValoración Potenciometrica ACOHGabriel lugoAún no hay calificaciones
- Analisis Quimico - Tercera SemanaDocumento18 páginasAnalisis Quimico - Tercera SemanaYudithMontalvoRamirezAún no hay calificaciones
- Un Experimento Colorimétrico de Cinética QuímicaDocumento2 páginasUn Experimento Colorimétrico de Cinética Químicajulian David PatiñoAún no hay calificaciones
- Taller Equilibrio QuimicoDocumento18 páginasTaller Equilibrio QuimicoLaura DanielaAún no hay calificaciones
- PermanganimetriaDocumento24 páginasPermanganimetriaMatute Nuñez100% (1)
- QA Inf. 1 - Determinacion de PH en Una Mezcla Acido-BaseDocumento7 páginasQA Inf. 1 - Determinacion de PH en Una Mezcla Acido-BaseJacqueline Velázquez JuarezAún no hay calificaciones
- Reporte 5Documento10 páginasReporte 5Zaida SuniAún no hay calificaciones
- Práctica Sal de Mohr 1Documento9 páginasPráctica Sal de Mohr 1Luis CampuzanoAún no hay calificaciones
- Practica 6 Preparacion Del Ciclohexeno Laboratorio de Quimica de Los HidrocarburosDocumento5 páginasPractica 6 Preparacion Del Ciclohexeno Laboratorio de Quimica de Los HidrocarburosJAVIER GutierrezAún no hay calificaciones
- FQ-A 1-2 - Lab 05 Determinación Del Calor Diferencial de Solución y Solubilidad Del Ácido BenzoicoDocumento13 páginasFQ-A 1-2 - Lab 05 Determinación Del Calor Diferencial de Solución y Solubilidad Del Ácido BenzoicoKEYNER RAMIREZAún no hay calificaciones
- Serie 3 Equilibrio Quimico 4540Documento2 páginasSerie 3 Equilibrio Quimico 4540Yassel4Aún no hay calificaciones
- PROBLEMARIO DE PERMANGANIMETRIA Mayo21 APLICACIONESDocumento2 páginasPROBLEMARIO DE PERMANGANIMETRIA Mayo21 APLICACIONESNadia Montero GonzálezAún no hay calificaciones
- Características de Los ColoidesDocumento2 páginasCaracterísticas de Los ColoidesAlejandro JiménezAún no hay calificaciones
- Qui Ana Gui1Documento24 páginasQui Ana Gui1Oswaldo MoralesAún no hay calificaciones
- Constante de Equilibrio para La Cristalizacion Del Kno3Documento5 páginasConstante de Equilibrio para La Cristalizacion Del Kno3mateoAún no hay calificaciones
- Obtención de DibenzalacetonaDocumento8 páginasObtención de DibenzalacetonaIram Alejandro Parra ZavaletaAún no hay calificaciones
- ALCANOSDocumento27 páginasALCANOSEdimaceAún no hay calificaciones
- Luis Miguel Martínez MoralesDocumento124 páginasLuis Miguel Martínez MoralesSaul Obando0% (1)
- Agua GlicerinaDocumento10 páginasAgua GlicerinaAlexis SanchezAún no hay calificaciones
- Celdas GalvanicasDocumento14 páginasCeldas GalvanicasMontserrat Concepción Portilla MarínAún no hay calificaciones
- Titulacion RedoxDocumento12 páginasTitulacion RedoxJeannette GonzalesAún no hay calificaciones
- Determinación de Volumenes de Oxígeno en El Peróxido de HidrógenoDocumento11 páginasDeterminación de Volumenes de Oxígeno en El Peróxido de HidrógenopaulinaAún no hay calificaciones
- Determinacion de CalcioDocumento10 páginasDeterminacion de CalcioAnonymous JHU0OjLOdAún no hay calificaciones
- Informe 8 Cuanti 2Documento7 páginasInforme 8 Cuanti 2Less ÁvilaAún no hay calificaciones
- Sintesis y Caracterizacion N - (Morfolina-4-Carbotiol) BenzamidaDocumento14 páginasSintesis y Caracterizacion N - (Morfolina-4-Carbotiol) BenzamidaCarmen RosaAún no hay calificaciones
- Facultad de Farmacia Y Bioquímica Reacciones de Caracterización de Alcaloides Practica N°Documento17 páginasFacultad de Farmacia Y Bioquímica Reacciones de Caracterización de Alcaloides Practica N°anali veneroAún no hay calificaciones
- Lab DQODocumento4 páginasLab DQOCarlos PedrazaAún no hay calificaciones
- Extraccion Liquido LiquidoDocumento14 páginasExtraccion Liquido LiquidoJosé MariaAún no hay calificaciones
- Informe de Proteinas PlasmaticasDocumento8 páginasInforme de Proteinas PlasmaticasJosé MariaAún no hay calificaciones
- Reporte de Valoracion EDTADocumento5 páginasReporte de Valoracion EDTAJosé MariaAún no hay calificaciones
- Destilacion A Presion ReducidaDocumento4 páginasDestilacion A Presion ReducidaJosé MariaAún no hay calificaciones
- Anteproyecto 1 Lab AnaliticaDocumento9 páginasAnteproyecto 1 Lab AnaliticaJosé MariaAún no hay calificaciones
- ExtraccionDocumento8 páginasExtraccionJosé MariaAún no hay calificaciones
- Informe de CarbohidratosDocumento7 páginasInforme de CarbohidratosJosé MariaAún no hay calificaciones
- Destilacion Por Arrastre de VaporDocumento5 páginasDestilacion Por Arrastre de VaporJosé MariaAún no hay calificaciones
- Titulacion Acido BaseDocumento15 páginasTitulacion Acido BaseJosé MariaAún no hay calificaciones
- Sintesis de Salicilato de MetiloDocumento18 páginasSintesis de Salicilato de MetiloJosé MariaAún no hay calificaciones
- CristalizacionDocumento8 páginasCristalizacionJosé MariaAún no hay calificaciones
- Valoracion de AspirinaDocumento6 páginasValoracion de AspirinaJosé MariaAún no hay calificaciones
- Titulacion ComplejometricaDocumento21 páginasTitulacion ComplejometricaJosé Maria100% (1)
- Ley de Accion de MasasDocumento2 páginasLey de Accion de MasasJosé MariaAún no hay calificaciones
- Investigación Documental USDocumento5 páginasInvestigación Documental USJosé MariaAún no hay calificaciones
- Velocidad de Crecimiento de Zea Mayz (Maíz)Documento1 páginaVelocidad de Crecimiento de Zea Mayz (Maíz)José MariaAún no hay calificaciones
- Christian Lastra Control1Documento4 páginasChristian Lastra Control1Christian Lastra MoralesAún no hay calificaciones
- Curso Cromatografía de Gases IQDocumento82 páginasCurso Cromatografía de Gases IQMiguel Saucedo Mora100% (2)
- Generalidades de La EtoxicologiaDocumento51 páginasGeneralidades de La EtoxicologiaValeria Medali Fajardo RamosAún no hay calificaciones
- Diagrama de Flujo-Limite LiquidoDocumento1 páginaDiagrama de Flujo-Limite LiquidoJhonny Orjuela HernanDezAún no hay calificaciones
- Bonnie - Catálogo Al Por MayorDocumento85 páginasBonnie - Catálogo Al Por MayorYesenia AguirreAún no hay calificaciones
- Practica 4 QuimicaDocumento3 páginasPractica 4 QuimicaEric VillanuevaAún no hay calificaciones
- Lodos Con Inhibicion QuimicaDocumento29 páginasLodos Con Inhibicion QuimicaDiego100% (1)
- 6-Tabla Periodica - Formato - NuevoDocumento6 páginas6-Tabla Periodica - Formato - NuevoVictor LeonAún no hay calificaciones
- Universidad Nacional "Santiago Antunez de Mayolo": Escuela de Ingeniería CivilDocumento95 páginasUniversidad Nacional "Santiago Antunez de Mayolo": Escuela de Ingeniería CivilCarlos FigueroaAún no hay calificaciones
- Aceite MineralDocumento1 páginaAceite Mineralclemente esquiviasAún no hay calificaciones
- Alcaloides Tema 1Documento11 páginasAlcaloides Tema 1Luismar ReyesAún no hay calificaciones
- Recuperación Mejorada de PetróleoDocumento19 páginasRecuperación Mejorada de Petróleoyanireth vizcainoAún no hay calificaciones
- Formulacion InorganicaDocumento55 páginasFormulacion InorganicaJavier MejiaAún no hay calificaciones
- MARCO TEÓRICO para Enviar Sol-LiqDocumento5 páginasMARCO TEÓRICO para Enviar Sol-LiqafsasfAún no hay calificaciones
- CalculosqumicosDocumento24 páginasCalculosqumicosRobin Leon BeltranAún no hay calificaciones
- Hoja de Seguridad Sulfhidrato de Sodio (Solido)Documento8 páginasHoja de Seguridad Sulfhidrato de Sodio (Solido)Rocio Dalila Quispe QuispeAún no hay calificaciones
- AislamientoDocumento6 páginasAislamiento.:("*"BLacK BuLLeT"*"):.100% (6)
- Mecanismos de FosfolambanDocumento25 páginasMecanismos de FosfolambanHelyPadilla0% (1)
- Guía EstereoquimicaDocumento10 páginasGuía Estereoquimicaa01784056Aún no hay calificaciones
- La Aprobación de Un Nuevo Medicamento Por La FDA (Recuperado Automáticamente)Documento3 páginasLa Aprobación de Un Nuevo Medicamento Por La FDA (Recuperado Automáticamente)Oscar UrielAún no hay calificaciones
- Metrados Carretera TablachacaDocumento28 páginasMetrados Carretera TablachacaCESARLLLAún no hay calificaciones
- EstuuuuuuuuuuuuuuuuuuuuuDocumento16 páginasEstuuuuuuuuuuuuuuuuuuuuuJessica Asitimbay ZuritaAún no hay calificaciones
- Alcalimetria Parte (1) CompletoDocumento6 páginasAlcalimetria Parte (1) CompletoJUAN MIGUEL VELEZ GARCIAAún no hay calificaciones
- Fasproblemas de AnalisisDocumento21 páginasFasproblemas de AnalisisGracePostigoTheranAún no hay calificaciones
- Semana 2 - Sesion 1.1Documento24 páginasSemana 2 - Sesion 1.1Kayko CcosccoAún no hay calificaciones
- Cap 04 - Estructuras Concreto - Metalicas PDFDocumento46 páginasCap 04 - Estructuras Concreto - Metalicas PDFDavid MendezAún no hay calificaciones
- RR Oleofugante eDocumento1 páginaRR Oleofugante eJorge ortiz tinocoAún no hay calificaciones
- Trabajo Exposición. Estudio y Ensayo de Los MaterialesDocumento10 páginasTrabajo Exposición. Estudio y Ensayo de Los MaterialesDavid Sebastian VegasAún no hay calificaciones
- Introducción A La Química Orgánica SARA PEREZ 100358708Documento5 páginasIntroducción A La Química Orgánica SARA PEREZ 100358708Sara Anllelina Perez RosarioAún no hay calificaciones
- ATP Sintasa-1Documento15 páginasATP Sintasa-1Omar BojorquezAún no hay calificaciones