Documentos de Académico
Documentos de Profesional
Documentos de Cultura
PROTEINAS
Cargado por
Wilmer Bobadilla CruzTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
PROTEINAS
Cargado por
Wilmer Bobadilla CruzCopyright:
Formatos disponibles
FACULTAD DE CIENCIAS
AGRARIAS
PROTEINAS
. Aminoácidos
. Péptidos
Yadira Ortecho Aguirre
DEFINICIÓN
• Todas las proteínas contienen C, H, O y N y casi todas poseen S.
• Son compuestos orgánicos más abundantes, en animales superiores
representan aproximadamente el 50% del peso seco de los tejidos.
• Son moléculas poliméricas de gran Peso Molecular; están
constituidas por gran número de unidades estructurales que forman
largas cadenas.
AMINOACIDOS
GLICINA
Yadira Ortecho Aguirre
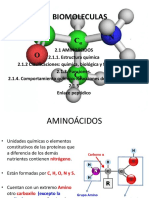
1. AMINOACIDOS
• Son unidades estructurales básicas de las proteínas. Los alfa-aminoácidos se caracterizan por
tener un grupo amino y un grupo carboxilo unidos al carbono alfa. Además un átomo de
hidrógeno y una cadena lateral R, que distingue a los diferentes aminoácidos:
•
Yadira Ortecho Aguirre
Estructura de un aminoácido
H
H H -
+
H H3 C COO
C COOH + -
H2N H3 C COO
H2N C COOH R
R R
R Grupo acido sal interna
Grupo amino sal interna
Grupo acido ZWITTERION
Grupo amino Carboxilico
Carboxilico ZWITTERION
Cadena lateral
Cadena lateral
variable
variable
Yadira Ortecho Aguirre
• En la glicina, el aminoácido más simple, la cadena R es un átomo de
hidrógeno.
• PROPIEDADES QUÍMICAS
• Debido a que tienen un grupo acido (donador de H+) y grupo básico (aceptor
de H+) presentan propiedades anfotéricas.
• Sustancia anfotérica: presentan dualidad: puede aceptar o donar un H+.
• Los aminoácidos existen como iones dipolares, se les conoce como
zwitteriones
Yadira Ortecho Aguirre
Clasificación de aminoácidos
. Sólo 20 aminoácidos constituyen las unidades monoméricas a partir
de las cuales se sintetizan las cadenas polipetídicas.
Aminoácidos Esenciales:
No pueden ser sintetizados en el organismo, y deben necesariamente ser
incorporados en la dieta mediante ingesta.
(Histidina, Isoleucina, Leucina, Lisina, Metionina, Fenilalanina, Treonina,
Triptófano y Valina )
Yadira Ortecho Aguirre
• Aminoácidos No esenciales:
• Aquellos que son sintetizados en el organismo. (Alanina, Arginina, Asparragina,
Aspártico, Cisteína, Cistina, Glutámico, Glutamina, Glicina, Hidroxiprolina, Prolina,
Serina y Tirosina. )
Yadira Ortecho Aguirre
LOS 20 AMINOACIDOS
• aminoácidos
hidrófobos
• aminoácidos
polares
• aminoácidos
ácidos
• aminoácidos
básicos
Yadira Ortecho Aguirre
PEPTIDOS
• DEFINICION:
• Los péptidos están formados por la unión de aminoácidos mediante un enlace peptídico.
• Enlace peptídico: Es un enlace covalente que se establece entre el grupo carboxilo de
un aminoácido y el grupo amino, dando lugar al desprendimiento de una molécula de
agua.
Yadira Ortecho Aguirre
FORMACION DE ENLACE PEPTIDICO
Yadira Ortecho Aguirre
Yadira Ortecho Aguirre
POLIPEPTIDOS
• Oligopéptidos.- si el n º de aminoácidos es menor de 10.
• Dipéptidos.- si el n º de aminoácidos es 2.
• Tripéptidos.- si el n º de aminoácidos es 3.
• Tetrapéptidos.- si el n º de aminoácidos es 4.
• Polipéptidos o cadenas polipeptídicas.- si el n º de aminoácidos es
mayor de 10, esta cadenas tienen pesos moleculares elevados
(>10,000)
Yadira Ortecho Aguirre
Insulina
Yadira Ortecho Aguirre
Cadena polipeptídica indicando la cadena
lateral de un aminoácido
Yadira Ortecho Aguirre
ESTRUCTURA DE LAS PROTEINAS
1) La estructura primaria: Estructura Primaria
Disposición lineal o secuencia de
aminoácidos en la cadena polipeptídica.
Es decir, el número de
aminoácidos presentes y el orden en que
están enlazados.
Una alteración en el ordenamiento de los
aminoácidos puede afectar la capacidad
funcional de la proteína.
Yadira Ortecho Aguirre
Estructura primaria
Yadira Ortecho Aguirre
2) Estructura secundaria:
Es la disposición espacial que adopta la cadena
polipeptídica, generalmente por enlaces de hidrógeno.
Existen ciertas estructuras repetitivas encontradas en
las proteínas que permiten clasificarlas en dos tipos:
hélice alfa y lámina beta.
Yadira Ortecho Aguirre
Alfa hélice
Vista perpendicular Vista lateral
Yadira Ortecho Aguirre
• 3) Estructura terciaria: es la estructura plegada y
completa en tres dimensiones de la cadena
polipeptídica.
• La conformación globular se mantiene estable gracias a la
existencia de enlaces entre los radicales R de los aminoácidos.
Aparecen varios tipos de enlaces
• puente disulfuro entre los radicales de aminoácidos que tiene
azufre.
• puentes de hidrógeno.
• puentes eléctricos.
• interacciones hidrófobas
Yadira Ortecho Aguirre
Existen, sin embargo dos tipos de estructuras terciarias
básicas:
• proteínas fibrosas, insolubles en agua, como la alfa
queratina o el colágeno y
• proteínas globulares, solubles en agua.
Yadira Ortecho Aguirre
Yadira Ortecho Aguirre
Puentes de hidrogeno
Yadira Ortecho Aguirre
colágeno
Yadira Ortecho Aguirre
Estructura cuaternaria
Yadira Ortecho Aguirre
• La estructura cuaternaria hace referencia a la disposición espacial adoptada por una proteína que
contiene mas de una cadena polipeptídica. Varias proteínas biológicamente importantes son
dímeros, trímeros, etc.
Yadira Ortecho Aguirre
Hemoglobina COLAGENO
Yadira Ortecho Aguirre
Yadira Ortecho Aguirre
CLASIFICACION
• Punto de vista químico: dos grupos de proteínas:
• A) proteínas simples: formadas exclusivamente por a-aminoácidos, como la
ubiquitina, una proteasa intracelular formada por 53 AA.
• B) proteínas conjugadas: que contienen además de la cadena polipeptídica un
componente no aminoacídico llamado grupo prostético, que puede ser: un
azúcar, lípido, ácido nucleico o simplemente un ion inorgánico.
Yadira Ortecho Aguirre
PROPIEDADES DE PROTEINAS
• 1. Especificidad. cada proteína lleva a cabo una determinada
función y lo realiza porque posee una determinada estructura
primaria y una conformación espacial propia; por lo que un
cambio en la estructura de la proteína puede significar una
pérdida de la función.
Yadira Ortecho Aguirre
2. Desnaturalización
• Alteración o perturbación de la estructura de una
proteína(secundaria, terciaria y cuaternaria), perdiendo su
actividad biológica.
• Todas las proteínas desnaturalizadas tienen la misma
conformación, muy abierta y con una interacción máxima con el
disolvente, por lo que una proteína soluble en agua cuando se
desnaturaliza se hace insoluble en agua y precipita.
Yadira Ortecho Aguirre
Desnaturalización
ESTADO NATIVO ESTADO DESNATURALIZADO
Yadira Ortecho Aguirre
Agentes desnaturalizantes
• La desnaturalización se puede producir por:
• cambios de temperatura
• Agitación mecánica
• Ácidos o bases variaciones del pH.
• sales de metales pesados.
• Solventes orgánicos
Yadira Ortecho Aguirre
También podría gustarte
- Cronograma de Capacitacion Brigada de EmergenciasDocumento2 páginasCronograma de Capacitacion Brigada de EmergenciasFelipe Pinto100% (1)
- Triptico de TermometroDocumento2 páginasTriptico de TermometroWilmer Bobadilla Cruz80% (5)
- Espectrofotometría UVDocumento40 páginasEspectrofotometría UVWilmer Bobadilla Cruz100% (1)
- Cenízaro (Samanea Saman (Jacq) Merril.) PDFDocumento3 páginasCenízaro (Samanea Saman (Jacq) Merril.) PDFAlison FlorezAún no hay calificaciones
- Aminoácidos y ProteínasDocumento98 páginasAminoácidos y ProteínasAndrea Trujillo CardosoAún no hay calificaciones
- AMINOACIDOSDocumento29 páginasAMINOACIDOSKarla G. Hiller CervantesAún no hay calificaciones
- Aa y ProteinasDocumento56 páginasAa y ProteinasOscar Daniel Ramirez MercadoAún no hay calificaciones
- T3. Aminoácidos, Péptidos y ProteínasDocumento82 páginasT3. Aminoácidos, Péptidos y ProteínasderenifAún no hay calificaciones
- Proteinas PresentacionDocumento79 páginasProteinas PresentacionTrai TraiAún no hay calificaciones
- ProteínasDocumento50 páginasProteínasIsabella Agnello De GraziaAún no hay calificaciones
- Acidos NucleicosDocumento52 páginasAcidos NucleicosRocio VillegasAún no hay calificaciones
- Proteinas - Acidos NucleicosDocumento171 páginasProteinas - Acidos NucleicosJose LuisAún no hay calificaciones
- Bloque 1 - Parte 1!Documento20 páginasBloque 1 - Parte 1!sandra garciAún no hay calificaciones
- #4 A MINOACIDOSDocumento44 páginas#4 A MINOACIDOSJosé Antonio GuzmánAún no hay calificaciones
- 4.1 AminoacidosDocumento51 páginas4.1 AminoacidosDarifori100% (1)
- Protein AsDocumento75 páginasProtein AsElizabeth Vargas LezamaAún no hay calificaciones
- PROTEINASDocumento30 páginasPROTEINASFrancy Julieth Triviño BohorquezAún no hay calificaciones
- Proteínas IDocumento29 páginasProteínas IFatima Paola MoreiraAún no hay calificaciones
- TEMA 7 PROTEINAS-MamaINSTITUTODocumento55 páginasTEMA 7 PROTEINAS-MamaINSTITUTOSilvia JiménezAún no hay calificaciones
- Conceptos Básicos de Aminoácidos Y ProteínasDocumento117 páginasConceptos Básicos de Aminoácidos Y ProteínasErik Raul Miranda LazaroAún no hay calificaciones
- Proteinas 2022Documento82 páginasProteinas 2022Mario Miguel Limón CabreraAún no hay calificaciones
- Proteinas-Aminoacidos 2022-1Documento61 páginasProteinas-Aminoacidos 2022-1Diego AramburoAún no hay calificaciones
- Aminoácidos - Péptidos ProteínasDocumento62 páginasAminoácidos - Péptidos ProteínasMaria Claudia Soto PrudencioAún no hay calificaciones
- Unidad 5 Proteinas2Documento84 páginasUnidad 5 Proteinas2xyynjs2tydAún no hay calificaciones
- Presentación Aminoacidos Grupo 1Documento21 páginasPresentación Aminoacidos Grupo 1danielAún no hay calificaciones
- Clase 3 Aminoacidos - ProteinasDocumento21 páginasClase 3 Aminoacidos - Proteinasjoseph31tvAún no hay calificaciones
- 2clase AminoácidosDocumento37 páginas2clase Aminoácidosfrank ganz bravoAún no hay calificaciones
- Aa 2023Documento38 páginasAa 2023Frans oAún no hay calificaciones
- Las ProteínasDocumento54 páginasLas ProteínasalfonsoAún no hay calificaciones
- PROTEÍNASDocumento57 páginasPROTEÍNASBlanca Ponz herreraAún no hay calificaciones
- Clase 2 Bioquimica. Aminoacidos y Proteinas Propiedad. PH.Documento35 páginasClase 2 Bioquimica. Aminoacidos y Proteinas Propiedad. PH.Rosa JayoAún no hay calificaciones
- Clase de Proteà NasDocumento41 páginasClase de Proteà NasCintia DEramoAún no hay calificaciones
- Aminoacidos, Enlace Peptidico y Proteinas.Documento63 páginasAminoacidos, Enlace Peptidico y Proteinas.Xiomara Ramos NolascoAún no hay calificaciones
- Captura de Pantalla 2024-02-28 A La(s) 19.06.52Documento81 páginasCaptura de Pantalla 2024-02-28 A La(s) 19.06.52anaAún no hay calificaciones
- Moléculas Orgánicas ExpoDocumento33 páginasMoléculas Orgánicas ExpoJose Luis MoralesAún no hay calificaciones
- AminoacidosDocumento7 páginasAminoacidosKarla AyalaAún no hay calificaciones
- Aminoacidos y ProteinasDocumento20 páginasAminoacidos y ProteinasFran SolisAún no hay calificaciones
- Proteínas-Enzimas Ácidos Nucleicos: Dr. Blgo. Jeisson David Cabos SánchezDocumento34 páginasProteínas-Enzimas Ácidos Nucleicos: Dr. Blgo. Jeisson David Cabos SánchezJEISSON DAVID CABOS SANCHEZAún no hay calificaciones
- Bioquimica Estructural y MetabólicaDocumento158 páginasBioquimica Estructural y MetabólicaBryanLuzón100% (1)
- Bioquimica de Las Proteinas y Aminoacido BioqDocumento44 páginasBioquimica de Las Proteinas y Aminoacido Bioqjessica benitez duarteAún no hay calificaciones
- 1 Aminoacidos y Metabolismo de Proteinas PDFDocumento69 páginas1 Aminoacidos y Metabolismo de Proteinas PDFcrt20003100% (1)
- Aminoacidos y ProteinasDocumento46 páginasAminoacidos y ProteinasNelson Choque MamaniAún no hay calificaciones
- Crecimiento y Desarrollo - UP 2 (Proteínas)Documento53 páginasCrecimiento y Desarrollo - UP 2 (Proteínas)MedicinaUNRAún no hay calificaciones
- Aminoácidos y ProteínasDocumento116 páginasAminoácidos y ProteínasCarolina QuinteroAún no hay calificaciones
- Clase 3Documento29 páginasClase 3catymareco6Aún no hay calificaciones
- ProteinasDocumento135 páginasProteinasVivian BarretoAún no hay calificaciones
- Aminoacidos ProteinasDocumento66 páginasAminoacidos ProteinasFany Lu HuancachoqueAún no hay calificaciones
- Apuntes de Bioquimica (IIAS - Unidad II - Proteínas)Documento3 páginasApuntes de Bioquimica (IIAS - Unidad II - Proteínas)cneyoysiari2344Aún no hay calificaciones
- T 5 ProteinasDocumento19 páginasT 5 ProteinasAlejandro AlemanAún no hay calificaciones
- Reforzamiento Día 1Documento26 páginasReforzamiento Día 1Carla GonzalezAún no hay calificaciones
- Aminoacidos PPT - 031314Documento26 páginasAminoacidos PPT - 031314Ania MagaluAún no hay calificaciones
- Compuestos Organico-Pa18Documento24 páginasCompuestos Organico-Pa18Gabriel H. GarciaAún no hay calificaciones
- Tema 4. Proteinas 2023Documento88 páginasTema 4. Proteinas 2023Jin-KyongAún no hay calificaciones
- AminoacidosDocumento45 páginasAminoacidosDavid ocampoAún no hay calificaciones
- AminoácidosDocumento11 páginasAminoácidosVeronica NepoAún no hay calificaciones
- Aminoacidos PDFDocumento138 páginasAminoacidos PDFfernanda peñaAún no hay calificaciones
- Proteinas Diapositiva PDFDocumento45 páginasProteinas Diapositiva PDFMayra Milagros Hernandez RamosAún no hay calificaciones
- BCN2 Tema 4 PrótidosDocumento25 páginasBCN2 Tema 4 PrótidosCarmen GAún no hay calificaciones
- Aminoacidos, PeptidosDocumento48 páginasAminoacidos, PeptidosMARIAN LISSETH BONIFACIO VEGAAún no hay calificaciones
- Taller N.5 Aminoacidos y ProteinasDocumento11 páginasTaller N.5 Aminoacidos y ProteinasKEVIN SANTIAGO VARGAS LEALAún no hay calificaciones
- Clase de Proteinas PDFDocumento67 páginasClase de Proteinas PDFLuis BarbosaAún no hay calificaciones
- 14 Aminoácidos, Péptidos y ProteinasDocumento69 páginas14 Aminoácidos, Péptidos y ProteinasJesus Garcia PatiñoAún no hay calificaciones
- Preguntas UnidasDocumento103 páginasPreguntas UnidasWilmer Bobadilla CruzAún no hay calificaciones
- Flujo de Una Pelicula DescendenteDocumento5 páginasFlujo de Una Pelicula DescendenteWilmer Bobadilla CruzAún no hay calificaciones
- Isomeria Estructural y Conformacional 2021Documento19 páginasIsomeria Estructural y Conformacional 2021Wilmer Bobadilla CruzAún no hay calificaciones
- Ubicacion de El Colegio EfebvreDocumento5 páginasUbicacion de El Colegio EfebvreWilmer Bobadilla CruzAún no hay calificaciones
- AdecuaciónDocumento2 páginasAdecuaciónWilmer Bobadilla CruzAún no hay calificaciones
- Proyecto Fisica SiDocumento14 páginasProyecto Fisica SiWilmer Bobadilla CruzAún no hay calificaciones
- Mode LosDocumento5 páginasMode LosWilmer Bobadilla CruzAún no hay calificaciones
- Materiales, Procedimiento ElectrodeposiciónDocumento5 páginasMateriales, Procedimiento ElectrodeposiciónWilmer Bobadilla CruzAún no hay calificaciones
- Historia de Los Radicales LibresDocumento5 páginasHistoria de Los Radicales LibresWilmer Bobadilla CruzAún no hay calificaciones
- Poema YoselinDocumento2 páginasPoema YoselinWilmer Bobadilla CruzAún no hay calificaciones
- El Análisis de Semi-MicroDocumento9 páginasEl Análisis de Semi-MicroWilmer Bobadilla CruzAún no hay calificaciones
- MEMORIA DESCRIPTIVA-Casa ShancayanDocumento2 páginasMEMORIA DESCRIPTIVA-Casa Shancayansergio aparicioAún no hay calificaciones
- Cultivo Hidropónico NFTDocumento43 páginasCultivo Hidropónico NFTIvanTutor75% (4)
- Apuntes de Exploración en Suelos (Exploración en Cielo Abierto)Documento3 páginasApuntes de Exploración en Suelos (Exploración en Cielo Abierto)Marco Antonio Cabrera PenicheAún no hay calificaciones
- Abrir Huecos para Pernos de AnclajeDocumento3 páginasAbrir Huecos para Pernos de Anclajejuan velasquezAún no hay calificaciones
- Publicar Un EstadoDocumento5 páginasPublicar Un EstadoRamona CortezAún no hay calificaciones
- FechaDocumento146 páginasFechaPako AguilarAún no hay calificaciones
- 2do. EXAMEN PARCIAL PRACTICO PGP 232 2-2021Documento1 página2do. EXAMEN PARCIAL PRACTICO PGP 232 2-2021Edgar CruzAún no hay calificaciones
- Ejemplos de Paradigmas Cientificos en La Vida CotidianaDocumento5 páginasEjemplos de Paradigmas Cientificos en La Vida CotidianaDiana Lizzett Villalpando DominguezAún no hay calificaciones
- Insanity Audio LatinoDocumento4 páginasInsanity Audio Latinobiscocho02Aún no hay calificaciones
- Albun Estudios SocialesDocumento6 páginasAlbun Estudios SocialesritaAún no hay calificaciones
- El Cambio Climatico .Documento4 páginasEl Cambio Climatico .Melvyn Janet Gutierrez ÑañezAún no hay calificaciones
- Mapa Mental de La EconomiaDocumento1 páginaMapa Mental de La EconomiaLeidy lorena Ruiz sepulvedaAún no hay calificaciones
- Articulo Español Clima y HombreDocumento12 páginasArticulo Español Clima y HombreJose Carlos Hernandez OsorioAún no hay calificaciones
- Ficha Tecnica de MobiliarioDocumento2 páginasFicha Tecnica de MobiliarioYailin Huamani TorresAún no hay calificaciones
- Resalto HidráulicoDocumento13 páginasResalto HidráulicoMayra Conde CespedesAún no hay calificaciones
- Fisiología de Los Puntos GatilloDocumento10 páginasFisiología de Los Puntos GatilloRamiro ApliqueFireAún no hay calificaciones
- Guia Bombillos Ahorradores Parte1Documento8 páginasGuia Bombillos Ahorradores Parte1Jose Alejandro PlazaAún no hay calificaciones
- 1 - Guía N°1 Teoría Musical Básica 7° Básico - Parte 1Documento19 páginas1 - Guía N°1 Teoría Musical Básica 7° Básico - Parte 1Jorge CamposAún no hay calificaciones
- Ejercicios ModeloDocumento3 páginasEjercicios ModeloCristina IsabelAún no hay calificaciones
- Río SalweenDocumento26 páginasRío Salweenchivo76Aún no hay calificaciones
- Analiza El Siguiente Video y Responde Las Siguientes Preguntas Indicando en El Minuto Que Fue Desglosada en El Video PDFDocumento2 páginasAnaliza El Siguiente Video y Responde Las Siguientes Preguntas Indicando en El Minuto Que Fue Desglosada en El Video PDFj mbAún no hay calificaciones
- Tesis 2012 Evaluacion de Tres Niveles de Enzima Allzyme SSF en Dietas para Pollos Cobb500 y Ros 308Documento175 páginasTesis 2012 Evaluacion de Tres Niveles de Enzima Allzyme SSF en Dietas para Pollos Cobb500 y Ros 308Noemi HildaAún no hay calificaciones
- Absorvedor de Impactos 2014Documento4 páginasAbsorvedor de Impactos 2014Irmis MHAún no hay calificaciones
- BarcelonaDocumento4 páginasBarcelonaIceSoulAún no hay calificaciones
- 1°reforzamiento de BiologíaDocumento3 páginas1°reforzamiento de Biologíakevin riveracastroAún no hay calificaciones
- Palabras HomografasDocumento13 páginasPalabras HomografasJuan Jordan castañedaAún no hay calificaciones
- Montacargas de HorquillasDocumento14 páginasMontacargas de HorquillasOsscar Claro0% (1)
- Manual Presupuesto 1249422680Documento33 páginasManual Presupuesto 1249422680Adrián Ruiz AlvarezAún no hay calificaciones