Documentos de Académico
Documentos de Profesional
Documentos de Cultura
La modulación de la hematopoyesis en contextos inflamatorios
Cargado por
Karen TellezDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
La modulación de la hematopoyesis en contextos inflamatorios
Cargado por
Karen TellezCopyright:
Formatos disponibles
www.medigraphic.org.
mx
El Residente
REVISÓN - ENSAYO
La modulación de la hematopoyesis
en el contexto inflamatorio
Eduardo Vadillo,* Rosana Pelayo*
RESUMEN. De los tejidos con más alta tasa de recambio, el sanguíneo constituye uno de los más estudia-
dos en la actualidad. Se estima que un adulto genera alrededor de 3 x 105 eritrocitos y 3 x 104 leucocitos por
segundo; sin embargo, en situaciones de inflamación y estrés, esta tasa de producción a menudo se ve modi-
ficada. Para que este fenómeno se lleve a cabo, las células más primitivas del sistema hematopoyético deben
reconocer citocinas proinflamatorias y factores de crecimiento, moléculas evolutivamente conservadas propias
de los agentes infecciosos y sus productos, así como moléculas endógenas asociadas a daño. Además de las
interacciones estrechas con los componentes del microambiente hematopoyético, estos eventos modulan espe-
cíficamente la producción de los linajes mieloide y linfoide con el fin de producir las células necesarias para
el combate y eliminación de los agentes infecciosos o las células dañadas. En esta revisión, nos enfocaremos
en los mecanismos a través de los cuales los agentes patógenos, sus productos y algunas moléculas endógenas
asociadas a daño regulan la producción de células sanguíneas tanto en humanos como en ratones en el con-
texto de inflamación.
Palabras clave: Hematopoyesis, inflamación, citocinas proinflamatorias, receptores tipo Toll (TLR).
ABSTRACT. Among the tissues with highest turnover rate, the blood is one of the most studied nowadays. It is
estimated that an adult person produces about 3 x 105 erythrocytes and 3 x 104 leukocytes per second. However,
under inflammation and stress conditions, such production rate is often modulated. In order to achieve this
phenomenon, the most primitive cells of the hematopoietic system must recognize pro-inflammatory cytokines
and growth factors, evolutionally conserved pathogen components and their products, as well as damage-
associated endogenous molecules. All these factors, in addition to close interactions with components of the
hematopoietic microenvironment, specifically modulate the production of myeloid and lymphoid lineages to
generate the cells needed for elimination of noxious agents. In this review, we will focus on mechanisms by
which pathogens, their products and some damage-associated molecules modulate blood cell production in
both humans and mice in the context of inflammation.
Key words: Hematopoiesis, inflammation, proinflammatory cytokines, Toll-like receptors (TLR).
ABREVIATURAS
CLP: Progenitor linfoide común, del inglés common lymphoid progenitor. DAMPS: Patrones moleculares asociados a daño, del inglés damage-associa-
CMP: Progenitor mieloide común, del inglés common myeloid progenitor. ted molecular patterns.
www.medigraphic.org.mx
* Unidad de Investigación Médica en Enfermedades Oncológicas, UMAE. Hospital de Oncología del Centro Médico Nacional Siglo
XXI, Instituto Mexicano del Seguro Social.
Correspondencia:
Dra. Rosana Pelayo
Av. Cuauhtémoc No. 330, Col. Doctores, CP. 06720, Delegación Cuauhtémoc, México, D.F.
Teléfono: 5627-6900, ext. 22705, 22710. E-mail: rosanapelayo@gmail.com rosana.pelayo@imss.gob.mx
Recibido: 21 de abril del 2014. Aceptado con modificaciones: 18 de agosto del 2014.
Este artículo puede ser consultado en versión completa en: www.medigraphic.com/elresidente
Mayo-Agosto 2014 / Volumen 9, Número 2. p. 51-58
La modulación de la hematopoyesis en el contexto inflamatorio
DC: Célula dendrítica, del inglés dendritic cell. MLP: Progenitor multi-linfoide, del inglés multi-lymphoid progenitor.
ELP: Progenitor linfoide temprano, del inglés early lymphoid progenitor. LMPP: Progenitor multipotente comprometido al linaje linfoide, del inglés lym-
HSC: Célula troncal hematopoyética, del inglés hematopoietic stem cell. phoid-primed multipotent progenitor.
HSPC: Células troncales y progenitoras, del inglés hematopoietic stem and LT-HSC: Célula troncal hematopoyética reconstituyente a largo plazo, del in-
progenitor cells. glés long term-hematopoietic stem cell.
IFN: Interferón. ST-HSC: Célula troncal hematopoyética reconstituyente a corto plazo, del in-
IKDC: Célula dendrítica asesina productora de interferón, del inglés interferon glés short-term hematopoetic stem cell.
killer dendritic cell. NK: Célula asesina natural, del inglés natural killer cell.
GMP: Progenitor de granulocitos y monocitos, del inglés granulocyte-monocyte PAMPS: Patrones moleculares asociados a patógenos, del inglés pathogen
progenitor. associated molecular patterns.
LPS: Lipopolisacárido. pDC: Célula dendrítica plasmacitoide, del inglés plasmacytoid dendritic cell.
MDP: Progenitor de células dendríticas y monocitos, del inglés myeloid dendri- PRR: Receptores que reconocen patrones, del inglés pattern-recognition re-
tic progenitor. ceptors.
MEP: Progenitor de megacariocitos y eritrocitos, del inglés megakaryocyte- TLR: Receptor tipo Toll, del inglés Toll-like receptor.
erythrocyte progenitor. TNFα: Factor de necrosis tumoral α, del inglés tumour necrosis factor α.
INTRODUCCIÓN ferar y diferenciarse en respuesta a estímu-
los generados en el proceso. Además, existen
El componente celular de la sangre está con- evidencias de que las células troncales y pro-
formado por los eritrocitos, trombocitos, gra- genitores hematopoyéticos (HSPC) expresan
nulocitos, neutrófilos, eosinófilos y basófilos, receptores tipo Toll (TLR) funcionales, y que
linfocitos T, linfocitos B, células asesinas en respuesta a su estimulación, inducen la
naturales (NK) y células dendríticas (DC). proliferación y diferenciación de linajes defi-
Se estima que para que un adulto de 70 kg nidos de manera estímulo dependiente. 2 Los
pueda satisfacer sus requerimientos sanguí- mecanismos biológicos responsables apenas
neos, debe producir alrededor de 3 x 10 5 eri- comienzan a ser descifrados, pero los hallaz-
trocitos y 3 x 104 leucocitos por segundo.1 Sin gos a la fecha sugieren fuertemente que cuan-
embargo, en procesos infecciosos causados por do un individuo cursa con infección e infla-
virus, bacterias, hongos o parásitos, esta pro- mación, la hematopoyesis y las consecuencias
ducción a menudo se ve perturbada. Sorpren- de su alteración transitoria o crónica por los
dentemente, los agentes microbianos alertan agentes detonantes deben constituir un ele-
a las células más primitivas del sistema he- mento más del interés clínico.
matopoyético, que en respuesta, incrementan
o disminuyen la producción de ciertos linajes HEMATOPOYESIS
con el fin de proveer de las células necesarias
para montar una respuesta inmune efectiva. El microambiente de la médula ósea está
La finalidad de esta respuesta es eliminar la constituido de células estromales, hematopo-
infección y mantener el estado de salud del yéticas, mesenquimales, endoteliales, osteo-
individuo. El combate a agentes patógenos no blastos, adipocitos y neuronas, y sus produc-
puede ser concebido en ausencia de un proce- tos de secreción, entre los que se encuentran
so inflamatorio, que tiene como característi- citocinas, quimiocinas, factores de crecimien-
cas principales el aumento del flujo sanguí- to y diferenciación, así como proteínas de la
sación leucocitaria.
www.medigraphic.org.mx
neo, la permeabilidad vascular y la extrava- matriz extracelular. Todos estos componentes
conforman una intrincada red de interaccio-
Hallazgos recientes indican que la produc- nes y nichos especializados que permiten el
ción de las células del sistema inmune se ve desarrollo de progenitores y el mantenimiento
influenciada por diversas moléculas produ- de la quiescencia de las HSC.3 Es en los espa-
cidas durante procesos inflamatorios y que cios intersinusoidales de la médula ósea don-
las células troncales hematopoyéticas (HSC), de se lleva a cabo la hematopoyesis, proceso
residentes en la médula ósea, pueden proli- por el cual las HSC dan origen a células ma-
52 El Residente. 2014; 9 (2): 51-58
Vadillo E y col.
duras (Figura 1), y es altamente regulado por (MPP), los cuales han perdido la capacidad de
factores extrínsecos e intrínsecos que juntos autorrenovarse pero retienen su multipotencia-
determinan la pérdida gradual de opciones de lidad. En ratón, estas células se distinguen por
diferenciación y la ganancia de funciones es- el fenotipo Lin– Sca1hi c-Kithi Flt3low/+ Thy1.1–
pecíficas. CD27+ IL-7Rα–, mientras que en humanos son
Las HSC tienen potencial de autorrenova- Lin- CD34+ CD38- CD45RA- Thy-1- Flt3+ CD7-
ción y originan todos los linajes sanguíneos.4 CD10-.6-8
Gran parte del conocimiento de los mapas de di- En humanos, el progenitor linfoide más tem-
ferenciación hematopoyética y de la biología de prano del que tenemos conocimiento es el pro-
las células que constituyen el sistema provienen genitor multilinfoide (MLP) (Lin- CD34+ CD38-
de modelos de ratón. En éstos, las HSC recons- CD45RA+ Thy.1neg/low Flt3+ CD7+/- CD10+). Esta
tituyentes a largo plazo (LT-HSC) residen en célula ha despertado gran interés porque ade-
la fracción Lin- (nula expresión de marcadores más de ser progenitora de células B, T y NK,
de madurez) Sca-1+ c-Kit+ (LSK) Flk2- CD34-, y también origina DC y monocitos, que se creían
pueden ser halladas ciclando o en quiescencia.5 exclusivos del linaje mieloide. Sin embargo, el
Éstas se diferencian a HSC reconstituyentes a MLP no tiene potencial granulocítico, eritroide
corto plazo (ST-HSC), que tienen menor poten- o megacariocítico. Su contraparte en el ratón
cial de reconstitución en modelos de trasplan- es el MLPP (Lin – Sca1 + c-Kit hi Flt3 hi Thy1.1 –
te seriado y se caracterizan por ser Lin- Sca- VCAM–), denominado así porque esta fracción
1+ c-Kit+ (LSK) Flk2- CD34+. En humanos, las reduce la expresión de transcritos involucrados
HSC se caracterizan por el fenotipo Lin- CD34+ en el desarrollo megacariocítico/eritroide y co-
CD38- CD45RA- Thy-1+ Flt3+ CD7- CD10-, son mienzan a aparecer transcritos linfoides.9 En el
multipotentes y representan el 0.04% del total ratón, el progenitor linfoide temprano origina
de células mononucleares (CMN) de la médula al progenitor linfoide común (CLP), que expre-
ósea. Tanto en ratones como en humanos, las sa la cadena del receptor de IL-7 (IL-7Rα); es
HSC producen a los progenitores multipotentes considerado el principal productor de células B
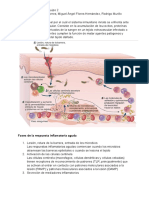
Figura 1.
Sangre periférica Timo Hematopoyesis humana normal.
Las HSC residentes de la médula
T ósea se diferencian para dar ori-
Linaje linfoide
Pro gen a los MPP. De éstos derivan
B B los MLP, que posteriormente se
HSC MPP MLP B/NK diferencian a progenitor de células
Pro NK
NK B/NK. A su vez, los MPP producen
a los CMP, y éstos, a los GMP y a
DC los MEP. Todos estos progenitores
MDP en su momento pierden gradual-
Mon mente la multipotencialidad u oligo-
www.medigraphic.org.mx
www.
.mediigrraphicc.org. potencialidad, según sea el caso, y
Linaje mieloide
P.
Gra
dan origen a los precursores, que a
Médula ósea GMP Miel
su vez, producen células maduras
CMP con funciones altamente especiali-
MEP zadas. Las HSC, los MPP, MLP y
Plaq B/NK pueden ser exportados vía
Función sangre periférica al timo para colo-
Opciones de diferenciación Eb nizarlo y producir, tras un complejo
Eritr
proceso de selección, células T.
El Residente. 2014; 9 (2): 51-58 53
La modulación de la hematopoyesis en el contexto inflamatorio
y retiene potencial para generar células NK y HEMATOPOYESIS MURINA E
T.9 Su contraparte humana fue descrita como INFLAMACIÓN
una población Lin- CD34+ CD45RA+ CD10+ con
capacidad de producir células B, NK y DC.8 La inflamación puede diferir por su causa,
Sólo recientemente esta definición ha sido mecanismo, pronóstico e intensidad14 y puede
refinada y se ha descrito al progenitor de célu- tener un impacto definitivo en la hematopoye-
las B/NK, que se caracteriza por ser Lin- CD34+ sis.15 Un claro ejemplo de la hematopoyesis de
Este documento
CD38 + es elaborado
CD45RA + por Medigraphic
Thy-1 -
Flt3 + CD7 - CD10 + . 6 emergencia es la inducción de la mielopoyesis
Estos progenitores eventualmente originan a por una infección bacteriana sistémica. A pesar
precursores comprometidos hacia linajes espe- de que en la clínica, la presencia o ausencia de
cíficos. En general, los estadios de precursores los distintos leucocitos forman parte de un cri-
de células B y NK proliferan para después di- terio diagnóstico, y de que se reconoce razona-
ferenciarse a una célula madura con funciones blemente que algunas infecciones exhiben un
específicas. patrón en la modulación hematopoyética, sólo
Las células T se producen en el timo, órga- recientemente los mecanismos de estos proce-
no linfoide que importa periódicamente pro- sos comienzan a ser descifrados.
genitores hematopoyéticos de la médula ósea El modelo clásico de la inducción de mielopo-
para su colonización. Las HSC y progenitores yesis por infección o inflamación implica la ac-
hematopoyéticos del ratón tienen la capacidad tivación de receptores que reconocen patrones
de producir células T en condiciones experi- (PRR), entre los que se encuentran los recep-
mentales; sin embargo, no todas tienen la ca- tores tipo Toll (TLR). Éstos reconocen patrones
pacidad de colonizar este órgano. Los LMPP y moleculares asociados a patógenos (PAMP), en
ELP expresan el receptor de quimiocina CCR9, el caso de un evento infeccioso, o patrones mole-
lo que les confiere alta capacidad de colonizar culares asociados a daño (DAMP), que son mo-
este órgano. En humanos, esta célula ha sido léculas endógenas intracelulares liberadas al
denominada progenitor tímico temprano (ETP) medio a consecuencia de la lesión a algún teji-
y reside en la población CD34+ CD1a- CD38low do.16 El ratón ha constituido un excelente mode-
CD44+ IL7-Rα+.8 lo para el estudio. En éste, las primeras obser-
El progenitor mieloide común (CMP) del ra- vaciones que sugirieron que la hematopoyesis
tón da origen al progenitor de granulocitos y puede ser modulada por componentes bacteria-
monocitos (GMP) y al de megacariocitos y eri- nos derivaron de la estimulación de progenito-
trocitos (MEP). 10-12 Todos estos progenitores res hematopoyéticos murinos con ligandos de
eventualmente producen unidades formadoras TLR2 y TLR4, en donde se observó la inducción
de colonias (CFU) y subsecuentemente, células de proliferación y diferenciación hacia el linaje
que ya pueden ser reconocidas al microscopio mieloide, obviando los requerimientos de facto-
óptico por sus características morfológicas como res de crecimiento y diferenciación. Asimismo,
blastos, promielocitos, mielocitos, metamieloci- al estimular a los CLP con ligandos de TLR2
tos, neutrófilos en banda y segmentados, y en y 4, se promovió sustancialmente la producción
el caso de los monocitos, monoblastos, promono- de DC (Figura 2).17
www.medigraphic.org.mx
citos y monocitos.7 En general, es asumido que
las DC pueden derivar tanto del linaje linfoide
Hallazgos posteriores de nuestro grupo de
investigación mostraron que los progenitores
como del mieloide. Los hallazgos actuales su- linfoides expresan TLR9 (que reconoce DNA
gieren que existe en el ratón un progenitor de con motivos de citidina fosfato guanosina CpG)
monocitos y DC (MDP) que subsecuentemente y que al estimularlo con ligandos sintéticos o
origina precursores de monocitos y de DC y que virus de herpes simple I, se bloquea la produc-
no tiene potencial de producir granulocitos u ción de células B por parte de las mismas y se
otro tipo de célula mieloide.13 induce la producción de DC, células dendríti-
54 El Residente. 2014; 9 (2): 51-58
Vadillo E y col.
IKDC
CCR9+ pDC
MPP
E. Coli DC
Pneumocystis CpG
Mycobacterium IL-1β
HSV-1
Pam3CSK4 TNFα
LPS CpG IFNα
Periferia
IFN HSV-1
HSC MPP LMPP ELP CLP B
LPS Pam3CSK4 LPS
Pam3CSK4 LPS
Listeria Pam3CSK4
Listeria N
Candida DC B DC
CMP
Mon
Figura 2. Hematopoyesis murina e inflamación. Las HSC se expanden por infecciones causadas por E. coli y Mycobacterium, y tam-
bién en presencia de ligandos como Pam3CSK4, LPS o IFN. Pneumocystis aumenta la frecuencia de MPP CCR9+, con potencial
de colonizar el timo. Ligandos como PamCSK4 y LPS aumentan la frecuencia de CMP y aceleran la diferenciación hacia monocitos
y granulocitos. Microorganismos como Listeria y Candida también pueden promover este fenómeno. El ELP se diferencia a CLP,
mismo que al ser estimulado con CpG o HSV-1 (ligandos de TLR9) bloquea la producción de células B y, a cambio, robustece la di-
ferenciación de diferentes subpoblaciones de células dendríticas. Asimismo, cuando el CLP es estimulado con LPS o Pam3CSK4, se
promueve la generación de DC. Pam3CSK4 no bloquea completamente la producción de células B. Citocinas proinflamatorias como
IL-1, TNF e IFN promueven la movilización de células B a la periferia.
cas plasmacitoides (pDC) y células dendríticas mitivas. De especial interés ha sido el efecto
asesinas productoras de IFN (IKDC). Estos ha- de los interferones sobre la hematopoyesis. El
llazgos mostraron que este fenómeno es depen- IFNγ, que se produce por células infectadas
diente de la estimulación del TLR9.18 Microor- por virus o Mycobacterium, estimula la pro-
ganismos como E. coli inducen la expansión y liferación de las HSC y —de ser persistente
movilización de la HSC, mientras que otros, este estímulo— puede inducir el agotamiento
como la Pseudomonas aeruginosa, provocan el de las mismas. Por otro lado, el IFNγ puede
bloqueo de la diferenciación mieloide y la neu- inducir la aparición de poblaciones emergen-
tropenia. Asimismo, Mycobacterium, Candida tes IL7-Rα+ con la función de producir células
y Listeria son capaces de promover la prolife- específicas para la destrucción de eritrocitos
ración y diferenciación hacia el linaje mieloide infestados por Plasmodium.19
por parte de las HSPC. En concordancia, la in- Otros inductores, como el factor de necrosis
fección por Pneumocystis en un modelo de ratón tumoral (TNFα), en sinergia con la IL-1β, pro-
timectomizado promueve el incremento de los mueven la movilización de HSPC y la reducción
MPP CCR9+ y las células T CD4+.2 Adicional- de CXCL12 en conjunción con la inhibición del
www.medigraphic.org.mx
mente, los ligandos de TLR2 y 4 inducen a los
CMP y su progenie a la diferenciación del linaje
desarrollo linfoide.20,21 No sólo la hematopoyesis
temprana se ve perturbada por estos estímulos;
mieloide.17 hallazgos recientes sugieren que los macrófagos
Los patrones de producción de citocinas producidos por células primitivas estimuladas
pueden variar dependiendo del tipo de estí- con ligandos de TLR2 producen menos citocinas
mulo enfrentado, y en este contexto, las ci- proinflamatorias y especies reactivas de oxíge-
tocinas proinflamatorias tienen diferentes no,22 lo que puede tener algún impacto funcio-
funciones en las células hematopoyéticas pri- nal, dependiendo del contexto inflamatorio.
El Residente. 2014; 9 (2): 51-58 55
La modulación de la hematopoyesis en el contexto inflamatorio
HEMATOPOYESIS HUMANA EN seleccionados y, paralelamente, aumentan la ex-
CONDICIONES DE EMERGENCIA presión del IL15-Rβ (Vadillo et al, enviado). De
forma similar, el CpG, LPS, Poly I:C e imiquimod
El conocimiento de la influencia de la hemato- inducen la producción de DC a partir de MLP.6
poyesis por la inflamación en humanos es más En enfermedades hematológicas como la leu-
limitado que en los modelos murinos descritos cemia, los microambientes proinflamatorios, así
anteriormente. Esto es debido, en parte, a las como las anormalidades intrínsecas de la enfer-
limitaciones éticas y al escaso número de mode- medad, inducen a los progenitores a modificar
los que se tienen para el desarrollo del conoci- sus patrones de diferenciación. Así, la constan-
miento en este campo. Sin embargo, las investi- te producción de factores proinflamatorios po-
gaciones relacionadas son sugerentes de que los dría jugar un papel crucial en el desarrollo de
fenómenos observados en ratón pueden ser, en la enfermedad, involucrando aspectos como la
general, extrapolados al humano. Parvovirus iniciación, promoción, transformación maligna,
B19 o Epstein-Barr pueden inducir la movili- invasión y metástasis celulares.3,14,27
zación de HSPC. En concordancia, cuando las
células CD34+ son estimuladas con E. coli, CpG CONCLUSIONES
DNA o ligandos sintéticos de TLR7/8 inducen
la producción de citocinas proinflamatorias.23-25 Los agentes patógenos, a través de sus molé-
Pocos han sido los estudios en humanos que culas estructurales y productos, aunados a la
han utilizado subpoblaciones celulares purifica- producción de citocinas proinflamatorias, mo-
das para evaluar los patrones de diferenciación delan la diferenciación hematopoyética con el
in vivo o in vitro. En uno de ellos, las HSC es- fin de producir de novo las células necesarias
timuladas con Pam3CSK4 (ligando de TLR2) se para el combate del agente infeccioso. Nunca
diferencian hacia progenitores mieloides, con un antes imaginado, las células más primitivas del
aumento en su frecuencia y la consecuente di- sistema hematopoyético —incluyendo a las cé-
ferenciación en cultivo hacia el linaje mieloide lulas troncales y progenitores tempranos— son
(Figura 3).26 Interesantemente, nuestros estu- sensibles a la estimulación por PAMP. El co-
dios indican que los MPP, MLP y progenitores de nocimiento emergente comienza a ilustrar que
B/NK de médula ósea adulta y de la sangre de tanto en ratones como humanos, los eventos de
cordón umbilical proliferan en respuesta a CpG diferenciación en inflamación son equiparables.
DNA y son inducidos a diferenciarse hacia cé- La inflamación crónica puede tener severas re-
lulas NK, en donde los precursores de éstas son percusiones a largo plazo, como el agotamien-
NK DC Figura 3.
CpG
CpG Hematopoyesis humana e inflama-
HSV-1
HSV-1 ción. En humanos, los MLP y los
MLP B/NK NK DC progenitores de B/NK estimulados
con CpG o HSV-1 inducen la pro-
Pam3CSK4
www.medigraphic.org.mx
www.medig
graphic.org.mx
LPS
CpG
Poly I:C
ducción de células NK y DC. Éstos
mismos, cuando son estimulados
HSC MPP Imiquimod DC con LPS, CpG, Poly I:C o imiquimod,
promueven la producción de DC.
Pam3CSK4 LPS Pam3CSK4 induce el aumento en el
CpG
Poly I:C número de CMP y la diferenciación
CMP GMP DC mieloide, mientras que los GMP es-
timulados con LPS, CpG y Poly I:C
inducen la diferenciación hacia DC.
56 El Residente. 2014; 9 (2): 51-58
Vadillo E y col.
to del acervo de las HSC, lo que puede llevar AGRADECIMIENTOS
a desórdenes en etapas posteriores al reto. In-
vestigaciones de mayor profundidad en el tema La investigación en el laboratorio de R.P. es fi-
serán necesarias para aprender cómo la infla- nanciada por Fondos del Consejo Nacional de
mación puede remodelar al microambiente de Ciencia y Tecnología CONACYT y del Instituto
la médula ósea y su trascendencia en los even- Mexicano del Seguro Social, IMSS. E.V es beca-
tos tempranos de la producción sanguínea. rio CONACYT para sus estudios de doctorado.
BIBLIOGRAFÍA
1. Takizawa H, Boettcher S, Manz MG. Demand-adapted progenitors. Proceedings of the National Academy of
regulation of early hematopoiesis in infection and in- Sciences of the United States of America. 2002; 99 (18):
flammation. Blood. 2012; 119 (13): 2991-3002. Epub 11872-11877. Epub 2002/08/24.
2012/01/17. 13. Geissmann F, Manz MG, Jung S, Sieweke MH, Merad
2. Vadillo E, Pelayo R. Toll-like receptors in development M, Ley K. Development of monocytes, macrophages, and
and function of the hematopoietic system. [Los receptores dendritic cells. Science. 2010; 327 (5966): 656-661. Epub
tipo Toll en el desarrollo y función del sistema hemato- 2010/02/06.
poyético]. Revista de Investigación Clínica; Órgano del 14. Grivennikov SI, Greten FR, Karin M. Immunity, inflam-
Hospital de Enfermedades de la Nutrición. 2012; 64 (5): mation, and cancer. Cell. 2010; 140 (6): 883-899. Epub
461-476. Epub 2013/04/03. 2010/03/23.
3. Purizaca J, Meza I, Pelayo R. Early lymphoid develop- 15. Welner RS, Pelayo R, Kincade PW. Evolving views on the
ment and microenvironmental cues in B-cell acute lym- genealogy of B cells. Nature Reviews Immunology. 2008;
phoblastic leukemia. Archives of Medical Research. 2012; 8 (2): 95-106. Epub 2008/01/22.
43 (2): 89-101. Epub 2012/04/07. 16. Piccinini AM, Midwood KS. DAMPening inflammation by
4. Baba Y, Pelayo R, Kincade PW. Relationships between he- modulating TLR signalling. Mediators of Inflammation.
matopoietic stem cells and lymphocyte progenitors. Trends 2010; 2010. Epub 2010/08/14.
in Immunology. 2004; 25 (12): 645-649. Epub 2004/11/09. 17. Nagai Y, Garrett KP, Ohta S, Bahrun U, Kouro T, Akira
5. Takizawa H, Regoes RR, Boddupalli CS, Bonhoeffer S, S et al. Toll-like receptors on hematopoietic progenitor
Manz MG. Dynamic variation in cycling of hematopoietic cells stimulate innate immune system replenishment.
stem cells in steady state and inflammation. The Journal Immunity. 2006; 24 (6): 801-812. Epub 2006/06/20.
of Experimental Medicine. 2011; 208 (2): 273-284. Epub 18. Welner RS, Pelayo R, Nagai Y, Garrett KP, Wuest TR,
2011/02/09. Carr DJ et al. Lymphoid precursors are directed to pro-
6. Doulatov S, Notta F, Eppert K, Nguyen LT, Ohashi PS, duce dendritic cells as a result of TLR9 ligation during
Dick JE. Revised map of the human progenitor hierarchy herpes infection. Blood. 2008; 112 (9): 3753-3761. Epub
shows the origin of macrophages and dendritic cells in 2008/06/17.
early lymphoid development. Nature Immunology. 2010; 19. Belyaev NN, Brown DE, Díaz AI, Rae A, Jarra W, Thomp-
11 (7): 585-593. Epub 2010/06/15. son J et al. Induction of an IL7-R(+)c-Kit(hi) myelolym-
7. Vadillo E, Pelayo R. El sistema hematopoyético a partir phoid progenitor critically dependent on IFN-gamma sig-
de células troncales. En: Pelayo R (ed.). Células troncales naling during acute malaria. Nature Immunology. 2010;
y medicina regenerativa. Mexico: Ed. PUIS; 2011. pp. 11 (6): 477-485. Epub 2010/05/01.
143-171. 20. Cain D, Kondo M, Chen H, Kelsoe G. Effects of acute and
8. Blom B, Spits H. Development of human lymphoid cells. chronic inflammation on B-cell development and differen-
Annual Review of Immunology. 2006; 24: 287-320. Epub tiation. The Journal of Investigative Dermatology. 2009;
2006/03/23. 129 (2): 266-277. Epub 2009/01/17.
9. Welner RS, Kincade PW, Pelayo R. Linfopoyesis temprana 21. Ueda Y, Yang K, Foster SJ, Kondo M, Kelsoe G. Inflam-
www.medigraphic.org.mx
en médula ósea adulta. Inmunología. 2007; 26 (3): 135-144.
10. Akashi K, Traver D, Miyamoto T, Weissman IL. A clo-
nogenic common myeloid progenitor that gives rise to
mation controls B lymphopoiesis by regulating chemokine
CXCL12 expression. The Journal of Experimental Medi-
cine. 2004; 199 (1): 47-58. Epub 2004/01/07.
all myeloid lineages. Nature. 2000; 404 (6774): 193-197. 22. Yáñez A, Hassanzadeh-Kiabi N, Ng MY, Megías J, Sub-
Epub 2000/03/21. ramanian A, Liu GY et al. Detection of a TLR2 agonist by
11. Iwasaki H, Akashi K. Myeloid lineage commitment from hematopoietic stem and progenitor cells impacts the func-
the hematopoietic stem cell. Immunity. 2007; 26 (6): 726- tion of the macrophages they produce. Eur J Immunol.
740. Epub 2007/06/22. 2013; 43 (8): 2114-2125. Epub 2013/05/11.
12. Manz MG, Miyamoto T, Akashi K, Weissman IL. Pro- 23. Kim JM, Oh YK, Kim YJ, Youn J, Ahn MJ. Escherichia
spective isolation of human clonogenic common myeloid coli up-regulates proinflammatory cytokine expression in
El Residente. 2014; 9 (2): 51-58 57
La modulación de la hematopoyesis en el contexto inflamatorio
granulocyte/macrophage lineages of CD34 stem cells via sponse. European Journal of Immunology. 2007; 37 (10):
p50 homodimeric NF-kappaB. Clinical and Experimental 2834-2846. Epub 2007/09/14.
Immunology. 2004; 137 (2): 341-350. Epub 2004/07/24. 26. De Luca K, Frances-Duvert V, Asensio MJ, Ihsani R, De-
24. Kim JM, Kim NI, Oh YK, Kim YJ, Youn J, Ahn MJ. bien E, Taillardet M et al. The TLR1/2 agonist PAM(3)
CpG oligodeoxynucleotides induce IL-8 expression in CSK(4) instructs commitment of human hematopoi-
CD34+ cells via mitogen-activated protein kinase-de- etic stem cells to a myeloid cell fate. Leukemia: Official
pendent and NF-kappaB-independent pathways. Inter- Journal of the Leukemia Society of America, Leukemia
national Immunology. 2005; 17 (12): 1525-1531. Epub Research Fund, UK. 2009; 23 (11): 2063-2074. Epub
2005/11/03. 2009/07/31.
25. Sioud M, Floisand Y. TLR agonists induce the differen- 27. Dorantes-Acosta E, Pelayo R. Lineage switching in acute
tiation of human bone marrow CD34+ progenitors into leukemias: a consequence of stem cell plasticity? Bone
CD11c+ CD80/86+ DC capable of inducing a Th1-type re- Marrow Research. 2012; 2012: 406796. Epub 2012/08/02.
www.medigraphic.org.mx
58 El Residente. 2014; 9 (2): 51-58
También podría gustarte
- Fundamentos Del DiagnosticoDocumento1113 páginasFundamentos Del DiagnosticoFátima Dueñas88% (42)
- Fundamentos del diagnóstico y tratamiento del cáncer en adultos: Una aproximación inicial para el médico no especialista en cáncerDe EverandFundamentos del diagnóstico y tratamiento del cáncer en adultos: Una aproximación inicial para el médico no especialista en cáncerAún no hay calificaciones
- Hematopoyesis ArticuloDocumento13 páginasHematopoyesis ArticuloMarlene Sinai Melo100% (1)
- Interleukinas y Reguladores de La Hematopoyesis PDFDocumento13 páginasInterleukinas y Reguladores de La Hematopoyesis PDFJose Antonio de la CalAún no hay calificaciones
- Capitulo 2 - Patogenia Del CancerDocumento7 páginasCapitulo 2 - Patogenia Del Cancerariadna_maciasAún no hay calificaciones
- Ensayo Decreto Ejecutivo 2393Documento7 páginasEnsayo Decreto Ejecutivo 2393Benjamin Fuller0% (3)
- Agentes Locales en La Consolidación Ósea: Realidades ActualesDocumento9 páginasAgentes Locales en La Consolidación Ósea: Realidades ActualesRaul CastilloAún no hay calificaciones
- Tratamiento de La Leucemia Mieloide Crónica: Avances FarmacológicosDocumento3 páginasTratamiento de La Leucemia Mieloide Crónica: Avances FarmacológicosJOS LUIS ALANOCA QUISPEAún no hay calificaciones
- Inflamación y tormenta de citoquinas en sepsis y COVID-19Documento7 páginasInflamación y tormenta de citoquinas en sepsis y COVID-19Yussi SaabAún no hay calificaciones
- Interleukinas y reguladores de la hematopoyesis: un análisis de menos deDocumento13 páginasInterleukinas y reguladores de la hematopoyesis: un análisis de menos deJessie CanAún no hay calificaciones
- Parte 2 de MarcadoresDocumento21 páginasParte 2 de MarcadoresDayana PaolaAún no hay calificaciones
- Clase 1. Hematopoyesis - UnicoDocumento69 páginasClase 1. Hematopoyesis - UnicoKarla Heaton QuintanaAún no hay calificaciones
- Celulas Dendriticas PDFDocumento10 páginasCelulas Dendriticas PDFNaomiiAún no hay calificaciones
- Linfopoyesis Temprana en Médula Ósea Adulta: RevisiónDocumento10 páginasLinfopoyesis Temprana en Médula Ósea Adulta: RevisiónDuarte Garnica Fatima DayanaAún no hay calificaciones
- Protocolo de InvestigacionDocumento7 páginasProtocolo de InvestigacionAlexis Andre Rojas vazquezAún no hay calificaciones
- Sistema InmunitarioDocumento23 páginasSistema InmunitarioluisAún no hay calificaciones
- Anestésicos en Sepsis. Conceptos ActualesDocumento8 páginasAnestésicos en Sepsis. Conceptos Actualesvelovi29103977Aún no hay calificaciones
- LEUCOCITOSDocumento6 páginasLEUCOCITOSBrayan BarajasAún no hay calificaciones
- Inmunobiología del trasplante.Documento14 páginasInmunobiología del trasplante.Ruby Dayanna Colorado CastroAún no hay calificaciones
- 01-Celulas y Organos Del Sistema Inmune PDFDocumento27 páginas01-Celulas y Organos Del Sistema Inmune PDFisabellaAún no hay calificaciones
- HemapotoyesisDocumento19 páginasHemapotoyesisLaura LargoAún no hay calificaciones
- Prueba HistologíaDocumento15 páginasPrueba HistologíaAcademia para el éxito educativoAún no hay calificaciones
- Equipo 3 Células Del Sistema Inmune PDFDocumento20 páginasEquipo 3 Células Del Sistema Inmune PDFRuth Cobo RosalesAún no hay calificaciones
- 30-Linfocitos Reactivos - Emilio Gabriel Giménez OcamposDocumento19 páginas30-Linfocitos Reactivos - Emilio Gabriel Giménez Ocamposbadermelanie1Aún no hay calificaciones
- Información Del Subgrupo 2 InmunologiaDocumento10 páginasInformación Del Subgrupo 2 Inmunologiadiana ordoñezAún no hay calificaciones
- Caracterìsticas y Funciones de Las Células Del SIDocumento107 páginasCaracterìsticas y Funciones de Las Células Del SISara Elizabeth CisnerosAún no hay calificaciones
- Leucocitos - 08Documento39 páginasLeucocitos - 08Cecilia Rodríguez CámaraAún no hay calificaciones
- Resumen SangreDocumento29 páginasResumen SangreHugo olivares cabelloAún no hay calificaciones
- Inmunología 12121212Documento7 páginasInmunología 12121212Arnaldo Serna17Aún no hay calificaciones
- Sistema inmune células órganosDocumento17 páginasSistema inmune células órganosNiponis ChunchunAún no hay calificaciones
- Células, Órganos Y Microambientes Del Sistema InmuneDocumento11 páginasCélulas, Órganos Y Microambientes Del Sistema InmuneJose Fernando Ortiz CarrilloAún no hay calificaciones
- Apuntes Inmuno 2.0Documento53 páginasApuntes Inmuno 2.0Mareny MayagoitiaAún no hay calificaciones
- InflamaciónDocumento9 páginasInflamaciónIGNACIO SALVADOR FERNANDEZ GIRONAún no hay calificaciones
- Capítulo 02 - Inmunidad Innata HumoralDocumento14 páginasCapítulo 02 - Inmunidad Innata HumoralestefaniaAún no hay calificaciones
- El Sistema InmuneDocumento17 páginasEl Sistema InmunemelissaAún no hay calificaciones
- Inmunología - Semana 2Documento18 páginasInmunología - Semana 2NahomiAún no hay calificaciones
- Día 1Documento44 páginasDía 1Sara Soria EstrugoAún no hay calificaciones
- Guia de InmunologiaDocumento15 páginasGuia de InmunologialitorAún no hay calificaciones
- Funciones Efectoras de Las CitoquinasDocumento31 páginasFunciones Efectoras de Las Citoquinaskaterin maiguaAún no hay calificaciones
- T.I. Parásito U1Documento21 páginasT.I. Parásito U1Brayan PérezAún no hay calificaciones
- Capitulo 53Documento31 páginasCapitulo 53apuntesmedicos2Aún no hay calificaciones
- Trabajo LinfoproliferativoDocumento41 páginasTrabajo LinfoproliferativoEgly TuarezAún no hay calificaciones
- Inmunidad HumoralDocumento16 páginasInmunidad HumoralOscar Miguel Hernandez CastilloAún no hay calificaciones
- Conteo de LeucocitosDocumento7 páginasConteo de LeucocitosEvelyn J. HernandezAún no hay calificaciones
- CancerDocumento6 páginasCancergeobannys cedeñoAún no hay calificaciones
- Mecanismos Del Proceso InflamatorioDocumento10 páginasMecanismos Del Proceso InflamatoriolabavillaAún no hay calificaciones
- Vasculitis Leucocitoclástica y Procesos LinfoproliferativosDocumento5 páginasVasculitis Leucocitoclástica y Procesos LinfoproliferativosPatlan Arredondo Melanie AriatnaAún no hay calificaciones
- LinfoproliferativoDocumento25 páginasLinfoproliferativoarios_409594Aún no hay calificaciones
- 0016 3813 GMM 157 Supl2 S1Documento18 páginas0016 3813 GMM 157 Supl2 S1Monserrat AreloAún no hay calificaciones
- Clase Complementaria Sangre 2021Documento10 páginasClase Complementaria Sangre 2021caceres cristianAún no hay calificaciones
- Células y Moléculas Del Sistema Inmune InnatoDocumento20 páginasCélulas y Moléculas Del Sistema Inmune InnatoFernando Aponte R.Aún no hay calificaciones
- Introduccion - Sistema InmuneDocumento6 páginasIntroduccion - Sistema InmuneEunice CatarinoAún no hay calificaciones
- Recuento de leucocitos: guía paso a pasoDocumento7 páginasRecuento de leucocitos: guía paso a pasoBreidy SamboniAún no hay calificaciones
- CarcinogénesisDocumento8 páginasCarcinogénesisAna LopezAún no hay calificaciones
- Examen InmunoDocumento9 páginasExamen InmunoFer MertellAún no hay calificaciones
- Protooncogenes y OncogenesDocumento6 páginasProtooncogenes y OncogenessanchezcoronaAún no hay calificaciones
- BasófilosDocumento6 páginasBasófilosAnonymous r3g12RBR2ZAún no hay calificaciones
- Uso de Derivados del Cannabis en Pacientes con CáncerDe EverandUso de Derivados del Cannabis en Pacientes con CáncerAún no hay calificaciones
- Rejuvenecer Con El Plasma Sanguíneo De Los JóvenesDe EverandRejuvenecer Con El Plasma Sanguíneo De Los JóvenesCalificación: 5 de 5 estrellas5/5 (1)
- 767 1911 2 PBDocumento3 páginas767 1911 2 PBKaren TellezAún no hay calificaciones
- Puncion Arterial para Extracci-N de SangreDocumento5 páginasPuncion Arterial para Extracci-N de SangreEduardo EscobarAún no hay calificaciones
- Sonda Foley PDFDocumento12 páginasSonda Foley PDFAudiel Gomez LaraAún no hay calificaciones
- Puncion Arterial para Extracci-N de SangreDocumento5 páginasPuncion Arterial para Extracci-N de SangreEduardo EscobarAún no hay calificaciones
- GASES EN SANGRE CRÍTICODocumento80 páginasGASES EN SANGRE CRÍTICOOrfa Azucena CorleoneAún no hay calificaciones
- Patologias Frecuentes Reumatologia IIDocumento4 páginasPatologias Frecuentes Reumatologia IIKaren TellezAún no hay calificaciones
- La modulación de la hematopoyesis en contextos inflamatoriosDocumento8 páginasLa modulación de la hematopoyesis en contextos inflamatoriosKaren TellezAún no hay calificaciones
- Exploracion Del Recien NacidoDocumento39 páginasExploracion Del Recien NacidoKaren TellezAún no hay calificaciones
- Balance de MateriaDocumento14 páginasBalance de Materiajdsd_unpAún no hay calificaciones
- 2015-08-14Documento128 páginas2015-08-14Libertad de Expresión YucatánAún no hay calificaciones
- Acta Asamblea Inv Kelcal 2022Documento4 páginasActa Asamblea Inv Kelcal 2022adrianAún no hay calificaciones
- Pruebas de Laboratorio de EmergenciaDocumento21 páginasPruebas de Laboratorio de Emergencianaldycita67% (3)
- Informe Técnico EvaluaciónDocumento16 páginasInforme Técnico EvaluaciónCRISTINA . ELGUETA ALVAREZAún no hay calificaciones
- Catalogo Tropicalia de Plantas - Tropicalia EstudioDocumento16 páginasCatalogo Tropicalia de Plantas - Tropicalia EstudioHuitzin López ReyesAún no hay calificaciones
- Formación microbiológica de la biopelícula dentalDocumento77 páginasFormación microbiológica de la biopelícula dentalLuNa LyzanDer Black100% (1)
- Tampones FisiologicosDocumento6 páginasTampones Fisiologicosapi-372036485% (13)
- Transformaciones lineales integrales doblesDocumento15 páginasTransformaciones lineales integrales doblesJean Villa SkAún no hay calificaciones
- Alineamientos Con W y J y Mediciones Con Wincha-Agosto2019 PDFDocumento6 páginasAlineamientos Con W y J y Mediciones Con Wincha-Agosto2019 PDFMarianaAún no hay calificaciones
- Cotizacion Gestion CorponariñoDocumento1 páginaCotizacion Gestion CorponariñoChristian David Tapia LeonAún no hay calificaciones
- Metales Pesados y Sus Daños en La SaludDocumento33 páginasMetales Pesados y Sus Daños en La SaludJessica CordovaAún no hay calificaciones
- Tarea Semana 5Documento3 páginasTarea Semana 5robertoAún no hay calificaciones
- Ciencias Naturales y Importancia de La BiologiaDocumento20 páginasCiencias Naturales y Importancia de La Biologialues enrique BERROTERANAún no hay calificaciones
- 6TO Sumamos y Restamos Fracciones HomogéneasDocumento6 páginas6TO Sumamos y Restamos Fracciones HomogéneasJhonAún no hay calificaciones
- Teorías EconómicasDocumento13 páginasTeorías EconómicasAbraham Alexis Bueno cisnerosAún no hay calificaciones
- Montaje de sistema electrohidráulico para prensa de construcción de tolvasDocumento78 páginasMontaje de sistema electrohidráulico para prensa de construcción de tolvasAlberto OrihuelaAún no hay calificaciones
- Actividad de MruDocumento2 páginasActividad de MruErick Gamarra ZevallosAún no hay calificaciones
- RVM N 075 2015 Norma para El Proceso de Contratacion de Personal Docente en Ies EscuelasDocumento2 páginasRVM N 075 2015 Norma para El Proceso de Contratacion de Personal Docente en Ies EscuelasRosaRomoQuispeAún no hay calificaciones
- Mod. Informe de Auditoria Por No Determinar La Estimacion de Cuentas Por Cobrar en LitigioDocumento5 páginasMod. Informe de Auditoria Por No Determinar La Estimacion de Cuentas Por Cobrar en LitigioKevin VillarAún no hay calificaciones
- Ensayo de AnaversaDocumento2 páginasEnsayo de AnaversaNorma Torres100% (1)
- Vocabulario Del TrabajoDocumento5 páginasVocabulario Del TrabajoRuben OrtegaAún no hay calificaciones
- Mod.2 Parametric ProgramingDocumento44 páginasMod.2 Parametric ProgramingPabloLozanoSalazarAún no hay calificaciones
- Proyecto DeportivoDocumento15 páginasProyecto DeportivoGustavo PinedaAún no hay calificaciones
- Terra GolfDocumento2 páginasTerra GolfJaviera SantisAún no hay calificaciones
- Von Hase, Erwin - Con Los Gauchos de La PampaDocumento11 páginasVon Hase, Erwin - Con Los Gauchos de La PampaFernando PereyraAún no hay calificaciones
- Evaluación Diagnóstica 4º Sec - FinalDocumento6 páginasEvaluación Diagnóstica 4º Sec - Finalvictor castillaAún no hay calificaciones
- Autoevaluación Semana 6Documento1 páginaAutoevaluación Semana 6Hector Chirhuana CarbajalAún no hay calificaciones
- Cálculo de La EvapotranspiraciónDocumento6 páginasCálculo de La Evapotranspiraciónhalbornoz86Aún no hay calificaciones