Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Metodo de Mohr
Cargado por
Josue CarmonaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Metodo de Mohr
Cargado por
Josue CarmonaCopyright:
Formatos disponibles
lOMoARcPSD|2347842
Método de mohr
Principios De Análisis Cuantitativo (Instituto Politécnico Nacional)
StuDocu no está patrocinado ni avalado por ningún colegio o universidad.
Descargado por Joshua Carm (joscarflo@hotmail.com)
lOMoARcPSD|2347842
INSTITUTO POLITÉCNICO NACIONAL
ESCUELA SUPERIOR DE INGENIERÍA QUÍMICA
E INDUSTRIAS EXTRACTIVAS
LABORATORIO PRINCIPIOS DE ANÁLISIS CUANTITATIVO
Práctica No. 4
“determinación cuantitativa de cloruros por
método de Mohr”
NOMBRE: CASTILLO DE LA CRUZ BWNJAMIN
PROFESOR: ANDREA MARMOL SALAZAR
GRUPO: 2IM41
FECHA DE ENTREGA: 05/03/2019
PERIODO: 19/2
Descargado por Joshua Carm (joscarflo@hotmail.com)
lOMoARcPSD|2347842
Método de Mohr
Este método se utiliza para determinar iones cloruro mediante una valoración de
precipitación, donde el ión cloruro precipita como AgCl (cloruro de plata), utilizando
como patrón una solución de AgNO3 (nitrato de plata) de concentración conocida
y como indicador el K2CrO4 (cromato de potasio) que comunica a la solución en el
punto inicial una coloración amarilla y forma en el punto final un precipitado rojo
ladrillo de Ag2CrO4 (cromato de plata) observable a simple vista.
La solución problema (contenida en el Erlenmeyer) debe tener un pH neutro o
cercano a la neutralidad, ya que si el pH<< 7 se disolvería el Ag2CrO4 y
dificultaría la detección del punto final de la valoración y un pH >> 7 provocaría la
precipitación del catión Ag+ como AgOH (hidróxido de plata) de color pardo y
cometeríamos error.
Como la solubilidad del Ag2CrO4(s) es mayor que la del AgCl (s), este último
precipita primero. Frente al primer exceso de AgNO3 añadido, el catión Ag+
reacciona con el K2CrO4
(No hay Cl‾ libre en solución) precipitando así el Ag2CrO4 y marcando el punto
final de la valoración por la aparición del precipitado de color rojo ladrillo producido
por él.
Descargado por Joshua Carm (joscarflo@hotmail.com)
lOMoARcPSD|2347842
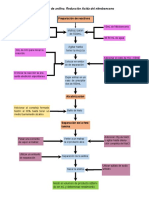
Diagrama de flujo
Valoración del AgNO3 0.02 N
Titular con la solución
Pesar los mg de NaCl Agregar 2 a 3
de AgNO3 hasta el vire
y disolver en 50 mL gotas de K2CrO4
a color rosa salmón
de agua destilada
Repetir el proceso por triplicado y realizar
cálculos
Descargado por Joshua Carm (joscarflo@hotmail.com)
lOMoARcPSD|2347842
Contenido de cloruros en la muestra problema
Agregar una Titular con la solución
Agregar 2 a 3 gotas
alícuota de 10 mL de AgNO3 hasta el vire
de K2CrO4
de la nuestra a color rosa salmón
Repetir el proceso por
triplicado y realizar
cálculos
Descargado por Joshua Carm (joscarflo@hotmail.com)
lOMoARcPSD|2347842
Cálculos de valoración
a NaCl
N=
V AgN O ∗EqNaCl
3
1. Masa en miligramos = 6.3 mg y Volumen de titulación = 5.7 mL
6.3 mg NaCl
N= =0.01889 meq/mL
5.7 mL AgN O ∗58.5 mg/meq NaCl
3
2. Masa en miligramos = 6.8 mg y Volumen de titulación = 6 mL
6.8 mg NaCl
N= =0.01937 meq /mL
6 mL AgN O ∗58.5 mg/ meq NaCl
3
3. Masa en miligramos = 6 mg y Volumen de titulación = 5.4 mL
6 mg NaCl
N= =0.01899 meq/mL
5.4 mL AgN O ∗58.5 mg/meq NaCl
3
4. Masa en miligramos = 5.8 mg y Volumen de titulación = 4.4 mL
Descargado por Joshua Carm (joscarflo@hotmail.com)
lOMoARcPSD|2347842
5.8 mg NaCl
N= =0.02253 meq/mL
4.4 mL AgN O ∗58.5 mg/meqNaCl
3
Tabla de valoración del AgNO3
a (mg) NaCl V(mL) AgNO3 a NaCl
N=
V AgN O ∗EqNaCl
3
6.3 5.7 0.01889
6.8 6 0.01937
6 5.4 0.01899
5.8 4.4 0.02253
0.01995
Calculo del contenido de cloruros
VAgNO3 (mL) NAgNO3 (meq/mL) EqNaCl (mg/eq)
5.77 0.01995 58.5
El contenido de cloruros como % NaCl se calcula como:
a NaCl =N AgN O ∗V AgNO ∗Eq NaCl
3 3
meq mg
a NaCl =( 0.01995 ) ∗(5.77 mL ¿ ¿ AgN O 3)∗(58.5 ) ¿
mL AgN O 3
eq NaCl
Descargado por Joshua Carm (joscarflo@hotmail.com)
lOMoARcPSD|2347842
a NaCl =6.73 mg
b m=300 mg
−¿
Cl
−¿=6.73 mg NaCl∗35.5 mg =4.080 mg Cl−¿ ¿ ¿¿
58.5 mg NaCl
Cl
a NaCl
%a NaCl = x 100
bm
6.73mg
%a NaCl = x 100=2.243 %
300 mg
%a −¿ aCl −¿
Cl = x 100¿¿
aNaCl
%a 4.080 mg
Cl−¿ = x 100=60.62 % ¿
6.73 mg
Tabla de resultados
a NaCl a Cl ¿
−¿ % Cl−¿ ¿ %NaCl
6.73 mg 4.080 mg 60.62 2.243
Conclusión
Aprendimos que no solamente preparando una solución podemos decir que tiene
una normalidad precisa, ya que podemos tener errores al momento de pesar, lavar
o aforar, para ello utilizamos o valoramos la solución que utilizamos con un
estándar primario, el cual debe tener ciertas características para que cumpla este
criterio y nos pueda dar o decir si nuestra solución está a la concentración que
nosotros queremos o suponemos.
Después de saber cómo valorar una solución aprendimos a determinar la cantidad
ce cloruros que hay en una solución de manera directa utilizando la solución que
previamente valoramos, para así saber la cantidad de sal en un inicio agregamos
Descargado por Joshua Carm (joscarflo@hotmail.com)
lOMoARcPSD|2347842
o la que titulamos, debemos tener en cuenta que cuando se titula llegamos a un
punto donde tenemos la misma cantidad de equivalentes químicos y para poder
observar esta igualdad o una aproximación a ella, se debe observar un cambio de
color con un indicador que también previamente se prepara.
Descargado por Joshua Carm (joscarflo@hotmail.com)
También podría gustarte
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Metodo de MohrDocumento9 páginasMetodo de MohrKevin Alvarado GómezAún no hay calificaciones
- CLORUROSDocumento6 páginasCLORUROSAndrea RodriguezAún no hay calificaciones
- FACULTAD DE FARMACIA Y BIOQUÍMICA UnidoDocumento11 páginasFACULTAD DE FARMACIA Y BIOQUÍMICA UnidoFrancesca RojasAún no hay calificaciones
- Metodo MohrDocumento7 páginasMetodo MohrKrlos Dvd AlvarezAún no hay calificaciones
- Práctica N.3-Cloruros-Alcalinidad-Dureza-Total Belen Quillupangui NRC 3175Documento10 páginasPráctica N.3-Cloruros-Alcalinidad-Dureza-Total Belen Quillupangui NRC 3175BelenAún no hay calificaciones
- Practca #6Documento9 páginasPractca #6RAUL ROJAS RAMOSAún no hay calificaciones
- Informe #2 Determinación de ClorurosDocumento7 páginasInforme #2 Determinación de ClorurosYeimy LunaAún no hay calificaciones
- Practica 4 Analisis MODIFICADADocumento8 páginasPractica 4 Analisis MODIFICADATzitzi Alvarez MendozaAún no hay calificaciones
- Cloruro 1Documento7 páginasCloruro 1Gladys Salazar FuentesAún no hay calificaciones
- Practica 4-ArgentometriaDocumento7 páginasPractica 4-ArgentometriaMari Belen MorilloAún no hay calificaciones
- Informe AnalisisDocumento8 páginasInforme AnalisisAngelica Ortiz MAún no hay calificaciones
- Métodos volumétricos por precipitaciónDocumento27 páginasMétodos volumétricos por precipitaciónHerwin MoraAún no hay calificaciones
- Determinacion de ClorurosDocumento9 páginasDeterminacion de ClorurosKarla Vanessa Contreras LopezAún no hay calificaciones
- Problemas Resueltos 05 Volumet PrecipitaciónDocumento13 páginasProblemas Resueltos 05 Volumet PrecipitaciónMar YAún no hay calificaciones
- Determinacion de Cloruro1Documento7 páginasDeterminacion de Cloruro1Gladys Salazar FuentesAún no hay calificaciones
- Análisis de ClorurosDocumento14 páginasAnálisis de ClorurosGabriela CoyAún no hay calificaciones
- 4campos Caldera 2IM40Documento8 páginas4campos Caldera 2IM40Pedro Ariel Campos CalderaAún no hay calificaciones
- Laboratorio de Química Analítica ClorurosDocumento5 páginasLaboratorio de Química Analítica ClorurosKatherine CendalesAún no hay calificaciones
- Trabajo Practico de Laboratorio 4Documento9 páginasTrabajo Practico de Laboratorio 4ornella rossettoAún no hay calificaciones
- Reporte N°3Documento5 páginasReporte N°3Michel CristianAún no hay calificaciones
- Informe n04 Analitica Determinacion Argentometrica de Cloruros en Suero FisiologicoDocumento15 páginasInforme n04 Analitica Determinacion Argentometrica de Cloruros en Suero FisiologicoErick NeyraAún no hay calificaciones
- Gravimetria3 PDFDocumento39 páginasGravimetria3 PDFJoseph ChitanAún no hay calificaciones
- Practica No 4 PACDocumento4 páginasPractica No 4 PACSuleymi MurrietaAún no hay calificaciones
- Informe 5Documento17 páginasInforme 5paula salamancaAún no hay calificaciones
- WWWDocumento4 páginasWWWAlessandra Malca ValdezAún no hay calificaciones
- Determinación gravimétrica de cloro en un cloruro solubleDocumento11 páginasDeterminación gravimétrica de cloro en un cloruro solubleDavid QuirozAún no hay calificaciones
- Informe. Volumetria Por PrecipitacionDocumento6 páginasInforme. Volumetria Por PrecipitacionGabriela OrellanaAún no hay calificaciones
- Practica 4 Analisis CuantitativoDocumento8 páginasPractica 4 Analisis CuantitativoMariano CastilloAún no hay calificaciones
- 9 Informe de Análisis Químico FIGMMDocumento19 páginas9 Informe de Análisis Químico FIGMMPatricio Alarcón100% (3)
- Estandarizacion Del Nitrato de Plata Lab6Documento3 páginasEstandarizacion Del Nitrato de Plata Lab6Rt JimAún no hay calificaciones
- Determinación de cloruros mediante valoración de MohrDocumento3 páginasDeterminación de cloruros mediante valoración de MohrAlvaro CalderonAún no hay calificaciones
- Informe de Practica-Argentometria. Semana 10Documento5 páginasInforme de Practica-Argentometria. Semana 10LEONARDO ALCIDES ROMERO ZAPANAAún no hay calificaciones
- Volumetría de ClorurosDocumento4 páginasVolumetría de ClorurosCamilaFernandaGonzalezCurinaoAún no hay calificaciones
- Principios 4Documento8 páginasPrincipios 4Aylin Portillo OliveraAún no hay calificaciones
- Informe 04 - G2 - Argentometría Parte 1.Documento10 páginasInforme 04 - G2 - Argentometría Parte 1.Kevin AndrésAún no hay calificaciones
- Análisis de Cloruros por Métodos ArgentométricosDocumento9 páginasAnálisis de Cloruros por Métodos ArgentométricosMaria MosqueraAún no hay calificaciones
- Volumetría de precipitación de clorurosDocumento9 páginasVolumetría de precipitación de clorurosAnonymous DVQUhsLWPsAún no hay calificaciones
- Laboraotrio 2 AnaliticaDocumento9 páginasLaboraotrio 2 AnaliticaNoelia RoblesAún no hay calificaciones
- Informe 2Documento15 páginasInforme 2Melaida Gozalvez CarvajalAún no hay calificaciones
- Informe BiologiaDocumento6 páginasInforme Biologiajuan diegoAún no hay calificaciones
- Estequiometría de Una Reacción QuímicaDocumento5 páginasEstequiometría de Una Reacción QuímicaJesus GonzaloAún no hay calificaciones
- MetodologíaDocumento2 páginasMetodologíaCristinaAún no hay calificaciones
- Metodo MohrDocumento3 páginasMetodo MohrIan marinAún no hay calificaciones
- Determinación del peso molecular de un líquidoDocumento5 páginasDeterminación del peso molecular de un líquidoAnne SophiaAún no hay calificaciones
- Porcentaje de ClorurosDocumento8 páginasPorcentaje de ClorurosjyanAún no hay calificaciones
- cuantitativa2.5 Argentometría método de MohorDocumento4 páginascuantitativa2.5 Argentometría método de MohorPablo VelásquezAún no hay calificaciones
- Informe #2Documento13 páginasInforme #2daniel felipe sandoval solanoAún no hay calificaciones
- Reporte de Práctica T3 Equipo 4Documento19 páginasReporte de Práctica T3 Equipo 4Medina valdivia IsamarAún no hay calificaciones
- Cálculos químicos precipitados gasesDocumento3 páginasCálculos químicos precipitados gasesMiguel AngelAún no hay calificaciones
- Determinación de cloruros mediante el método de MohrDocumento7 páginasDeterminación de cloruros mediante el método de MohrEIMYE ANGELY ZEGARRA MEDRANOAún no hay calificaciones
- Parcial de Laboratorio AnaliticaDocumento3 páginasParcial de Laboratorio AnaliticaElvis RosiAún no hay calificaciones
- Informe 3 (Estequiometria Obtención de Carbonato de Calcio: Química General (Universidad Surcolombiana)Documento7 páginasInforme 3 (Estequiometria Obtención de Carbonato de Calcio: Química General (Universidad Surcolombiana)JUAN SEBASTIAN TORRES SILVAAún no hay calificaciones
- laboratorio 2.2022Documento12 páginaslaboratorio 2.2022gkghostkillers20Aún no hay calificaciones
- Práctica 6-Determinación Volumétrica de Cloruros Por El Metodo de Mohr-Aguilar M-Pinargote TDocumento5 páginasPráctica 6-Determinación Volumétrica de Cloruros Por El Metodo de Mohr-Aguilar M-Pinargote Ttania pinargoteAún no hay calificaciones
- Determinación de Cloruros en Agua de MarDocumento7 páginasDeterminación de Cloruros en Agua de MarEdiurnel Antequera100% (1)
- Informe 2...Documento10 páginasInforme 2...Isabella Alvarez PelaezAún no hay calificaciones
- Determinación de cloruros en aguas naturales mediante volumetría por precipitaciónDocumento13 páginasDeterminación de cloruros en aguas naturales mediante volumetría por precipitaciónRaymond ArbietoAún no hay calificaciones
- Lab 3Documento6 páginasLab 3juanjose78sAún no hay calificaciones
- Aplicación de Volumetría Precipitación Determinación de Cloruros en LecheDocumento4 páginasAplicación de Volumetría Precipitación Determinación de Cloruros en LecheLansf SotomayorAún no hay calificaciones
- Con Dens AdoresDocumento17 páginasCon Dens AdoresJosue CarmonaAún no hay calificaciones
- Actividad 3 Funciones Del Gerente de ProduccionDocumento6 páginasActividad 3 Funciones Del Gerente de ProduccionJosue CarmonaAún no hay calificaciones
- Proceso de fabricación jabón masaDocumento11 páginasProceso de fabricación jabón masaJosue CarmonaAún no hay calificaciones
- Sistemas productivos y evaluación de inversionesDocumento4 páginasSistemas productivos y evaluación de inversionesJosue CarmonaAún no hay calificaciones
- Degradación fotoquímica del anaranjado de metilo con óxido de titanioDocumento1 páginaDegradación fotoquímica del anaranjado de metilo con óxido de titanioJosue CarmonaAún no hay calificaciones
- Informe de Analisis Prac 3 CorrDocumento4 páginasInforme de Analisis Prac 3 CorrJosue CarmonaAún no hay calificaciones
- Con Dens AdoresDocumento17 páginasCon Dens AdoresJosue CarmonaAún no hay calificaciones
- Relacion de La Entropía y La Transferencia de CalorDocumento8 páginasRelacion de La Entropía y La Transferencia de CalorJosue Carmona50% (2)
- 8388 11890 1 PBDocumento14 páginas8388 11890 1 PBDaniel Pulido RojasAún no hay calificaciones
- Ajuste MultivariableDocumento2 páginasAjuste MultivariableJosue CarmonaAún no hay calificaciones
- Minimos CuadradosDocumento6 páginasMinimos CuadradosJosue CarmonaAún no hay calificaciones
- Exponencial Minimos Cuadrados Univariable 1Documento4 páginasExponencial Minimos Cuadrados Univariable 1Josue CarmonaAún no hay calificaciones
- Tarea 8 Minimos Cuadrados MultivariableDocumento7 páginasTarea 8 Minimos Cuadrados MultivariableJosue CarmonaAún no hay calificaciones
- Minimos Cuadrados Multivariable Ejercicios ResueltosDocumento7 páginasMinimos Cuadrados Multivariable Ejercicios ResueltosJosue Carmona100% (1)
- Minimos CuadradosDocumento6 páginasMinimos CuadradosJosue CarmonaAún no hay calificaciones
- TAREA 7 Exponencial Minimos Cuadrados Univariable 1Documento4 páginasTAREA 7 Exponencial Minimos Cuadrados Univariable 1Josue CarmonaAún no hay calificaciones
- Minimos CuadradosDocumento7 páginasMinimos CuadradosJosue CarmonaAún no hay calificaciones
- ESTUDIO DE CARBANIONES: ESTRUCTURA, PROPIEDADES Y REACCIONES DE ADICIÓNDocumento3 páginasESTUDIO DE CARBANIONES: ESTRUCTURA, PROPIEDADES Y REACCIONES DE ADICIÓNJosue CarmonaAún no hay calificaciones
- Fórmulas de Simpson 1Documento1 páginaFórmulas de Simpson 1Josue CarmonaAún no hay calificaciones
- Vertedor Parshall CalculosDocumento2 páginasVertedor Parshall CalculosJosue CarmonaAún no hay calificaciones
- PracticaDocumento10 páginasPracticaMariana Luna HdezAún no hay calificaciones
- Diagrama de Bloques Practica 4Documento1 páginaDiagrama de Bloques Practica 4Josue CarmonaAún no hay calificaciones
- Practica 1 Lab PAC PDFDocumento7 páginasPractica 1 Lab PAC PDFJosue CarmonaAún no hay calificaciones
- Practica 7 Determinacion de La Curva de TitulacionDocumento9 páginasPractica 7 Determinacion de La Curva de TitulacionJosue CarmonaAún no hay calificaciones
- ESTUDIO DE CARBANIONES: ESTRUCTURA, PROPIEDADES Y REACCIONES DE ADICIÓNDocumento3 páginasESTUDIO DE CARBANIONES: ESTRUCTURA, PROPIEDADES Y REACCIONES DE ADICIÓNJosue CarmonaAún no hay calificaciones
- FactibilidadDocumento1 páginaFactibilidadJosue CarmonaAún no hay calificaciones
- Diagrama Industrial Practica 3 Diels AlderDocumento1 páginaDiagrama Industrial Practica 3 Diels AlderJosue CarmonaAún no hay calificaciones
- Obtención de anilina por reducción ácida del nitrobencenoDocumento1 páginaObtención de anilina por reducción ácida del nitrobencenoJosue CarmonaAún no hay calificaciones
- Diagrama Industrial AnilinaDocumento1 páginaDiagrama Industrial AnilinaJosue CarmonaAún no hay calificaciones
- Antecedentes de Fibras Del Polietileno de Alta DensidadDocumento6 páginasAntecedentes de Fibras Del Polietileno de Alta DensidadAlexis Branlí Abad Dominguez RivadeneyraAún no hay calificaciones
- Actividad 2 MatrizDocumento5 páginasActividad 2 Matrizdaney hernandezAún no hay calificaciones
- Ficha de SeguridadDocumento6 páginasFicha de SeguridadVanessa HernandezAún no hay calificaciones
- 3 TemaDocumento30 páginas3 TemaOier Jurado MartinAún no hay calificaciones
- Acabados en TechosDocumento15 páginasAcabados en TechosAstrid Alexandra ZeaAún no hay calificaciones
- 005 HDS Beta Off SPDocumento4 páginas005 HDS Beta Off SPLiliana BeruAún no hay calificaciones
- Manual UFHDocumento112 páginasManual UFHValentín GómezAún no hay calificaciones
- Ideas Experimentos - BiologíaDocumento1 páginaIdeas Experimentos - BiologíaEnith Auri Casariego RuizAún no hay calificaciones
- Varillas de fibra de carbono para refuerzo sísmicoDocumento5 páginasVarillas de fibra de carbono para refuerzo sísmicoLINA MAYERLY HOYOS NOVOA100% (1)
- (ACV-S05) Autoevaluación 5 - FISICOQUIMICA (24735) GRDocumento5 páginas(ACV-S05) Autoevaluación 5 - FISICOQUIMICA (24735) GRGustavo RiquelmeAún no hay calificaciones
- Triptico Ester ATOMODocumento2 páginasTriptico Ester ATOMOyefraina2407Aún no hay calificaciones
- Nte Inen 2034-1995 EsponjasDocumento8 páginasNte Inen 2034-1995 EsponjasPaola Andrea Contreras MartinezAún no hay calificaciones
- Alternativas de Solución Tecnológica 30Documento5 páginasAlternativas de Solución Tecnológica 30nicolasAún no hay calificaciones
- Práctica 9B - AqDocumento16 páginasPráctica 9B - AqEzequiel BarrientosAún no hay calificaciones
- Modelo de Poe-T-Guia de Practica Quimica Analitica I Practica 7Documento9 páginasModelo de Poe-T-Guia de Practica Quimica Analitica I Practica 7Enrique Gabriel Pongo MendoAún no hay calificaciones
- Laboratorio N°8 Quimica IiDocumento21 páginasLaboratorio N°8 Quimica IiJunior VasquezAún no hay calificaciones
- HEA Clase 1 NovDocumento15 páginasHEA Clase 1 NovEdgar Salazar0% (1)
- ANEXOSDocumento17 páginasANEXOSAlexander Salas MedinaAún no hay calificaciones
- Unidad 5. Fases de Dos y Tres ComponentesDocumento25 páginasUnidad 5. Fases de Dos y Tres ComponentesKade CadeAún no hay calificaciones
- Soprador Termico BLACK DECKER hg1500Documento22 páginasSoprador Termico BLACK DECKER hg1500Betun EngenhariaAún no hay calificaciones
- Informe Silla de RuedasDocumento7 páginasInforme Silla de RuedasCristian Alexis Valiente BautistaAún no hay calificaciones
- Practica #5 Normalidad PDFDocumento6 páginasPractica #5 Normalidad PDFAarón Ruiz CampoverdeAún no hay calificaciones
- Alcaloides Practica LaboratorioDocumento17 páginasAlcaloides Practica LaboratorioCarmen Marisol Rufino Segovia100% (2)
- Sika-Plast RM 100Documento3 páginasSika-Plast RM 100Giuseppe CervantesAún no hay calificaciones
- Taller Quimica Ciclo VDocumento4 páginasTaller Quimica Ciclo VMarinelly SánchezAún no hay calificaciones
- Nº01. Agua para El Concreto NTP 339.088Documento10 páginasNº01. Agua para El Concreto NTP 339.088Andrea Maria Diaz MoranAún no hay calificaciones
- MAVAGUAMDT228 - Tabla Periódica de Los Elementos - Memorama de Los MetalesDocumento9 páginasMAVAGUAMDT228 - Tabla Periódica de Los Elementos - Memorama de Los MetalesGerardo Collado SanchezAún no hay calificaciones
- Evaluacion Final - Escenario 8 - QuimicaDocumento6 páginasEvaluacion Final - Escenario 8 - QuimicaDiego Cardozo Moreno50% (2)
- Kit de Emergencia para Contenedores de CloroDocumento15 páginasKit de Emergencia para Contenedores de CloroJOSE TORINAún no hay calificaciones
- Compuestos InorganicosDocumento1 páginaCompuestos InorganicosMauricio GonzalezAún no hay calificaciones
- Influencia. La psicología de la persuasiónDe EverandInfluencia. La psicología de la persuasiónCalificación: 4.5 de 5 estrellas4.5/5 (14)
- Cómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaDe EverandCómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaCalificación: 5 de 5 estrellas5/5 (1867)
- Resetea tu mente. Descubre de lo que eres capazDe EverandResetea tu mente. Descubre de lo que eres capazCalificación: 5 de 5 estrellas5/5 (196)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (200)
- Disciplina con amor para adolescentes (Discipline With Love for Adolescents): Guía para llevarte bien con tu adolescente (A Guide for Getting Along Well With Your Adolescent)De EverandDisciplina con amor para adolescentes (Discipline With Love for Adolescents): Guía para llevarte bien con tu adolescente (A Guide for Getting Along Well With Your Adolescent)Calificación: 5 de 5 estrellas5/5 (10)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- El poder del optimismo: Herramientas para vivir de forma más positivaDe EverandEl poder del optimismo: Herramientas para vivir de forma más positivaCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Terapia cognitivo-conductual (TCC) y terapia dialéctico-conductual (TDC): Cómo la TCC, la TDC y la ACT pueden ayudarle a superar la ansiedad, la depresión, y los TOCSDe EverandTerapia cognitivo-conductual (TCC) y terapia dialéctico-conductual (TDC): Cómo la TCC, la TDC y la ACT pueden ayudarle a superar la ansiedad, la depresión, y los TOCSCalificación: 5 de 5 estrellas5/5 (1)
- Tu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaDe EverandTu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaCalificación: 5 de 5 estrellas5/5 (2)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- No desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaDe EverandNo desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Pensamiento Crítico: Utiliza modelos mentales para desarrollar tomas de decisiones efectivas y habilidades de resolución de problemas. Supera los obstáculos cognitivos y las falacias en los sistemas para pensar con claridad en tu vida cotidiana.De EverandPensamiento Crítico: Utiliza modelos mentales para desarrollar tomas de decisiones efectivas y habilidades de resolución de problemas. Supera los obstáculos cognitivos y las falacias en los sistemas para pensar con claridad en tu vida cotidiana.Calificación: 4.5 de 5 estrellas4.5/5 (33)
- La conciencia en el cerebro: Descifrando el enigma de cómo el cerebro elabora nuestros pensamientosDe EverandLa conciencia en el cerebro: Descifrando el enigma de cómo el cerebro elabora nuestros pensamientosCalificación: 2.5 de 5 estrellas2.5/5 (3)
- Psicogenealogía: Sanar las heridas del alma y encontrarse a uno mismoDe EverandPsicogenealogía: Sanar las heridas del alma y encontrarse a uno mismoCalificación: 5 de 5 estrellas5/5 (5)
- Cómo Conversar Con Cualquier Persona: Mejora tus habilidades sociales, desarrolla tu carisma, domina las conversaciones triviales y conviértete en una persona sociable para hacer verdaderos amigos y construir relaciones significativas.De EverandCómo Conversar Con Cualquier Persona: Mejora tus habilidades sociales, desarrolla tu carisma, domina las conversaciones triviales y conviértete en una persona sociable para hacer verdaderos amigos y construir relaciones significativas.Calificación: 5 de 5 estrellas5/5 (54)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Psiconeuroinmunología para la práctica clínicaDe EverandPsiconeuroinmunología para la práctica clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Maneja tus emociones: Curso intensivo de mindfulness y regulación emocionalDe EverandManeja tus emociones: Curso intensivo de mindfulness y regulación emocionalCalificación: 4.5 de 5 estrellas4.5/5 (140)
- ¿Por qué mis padres no me aman?: Empezando a sanarDe Everand¿Por qué mis padres no me aman?: Empezando a sanarCalificación: 4.5 de 5 estrellas4.5/5 (33)
- Terapia cognitiva: Conceptos básicos y profundizaciónDe EverandTerapia cognitiva: Conceptos básicos y profundizaciónCalificación: 5 de 5 estrellas5/5 (1)
- Libro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRADe EverandLibro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRACalificación: 4 de 5 estrellas4/5 (26)
- El lenguaje del cuerpo: Una guía para conocer los sentimientos y las emociones de quienes nos rodeanDe EverandEl lenguaje del cuerpo: Una guía para conocer los sentimientos y las emociones de quienes nos rodeanCalificación: 4 de 5 estrellas4/5 (49)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Ansiedad infantil. Los trastornos explicados a los padresDe EverandAnsiedad infantil. Los trastornos explicados a los padresCalificación: 4.5 de 5 estrellas4.5/5 (25)