Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Práctica No. 8 y 9 Cuestionario
Cargado por
Luis Arroyo100%(1)100% encontró este documento útil (1 voto)
139 vistas3 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
100%(1)100% encontró este documento útil (1 voto)
139 vistas3 páginasPráctica No. 8 y 9 Cuestionario
Cargado por
Luis ArroyoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
PRÁCTICA NO.
8 y 9 “CUESTIONARIO”
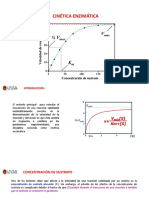
¿Qué es la velocidad de una reacción enzimática?
La velocidad de reacción se define como la cantidad de sustancia que se transforma en una
determinada reacción por unidad de volumen y tiempo.
¿Cómo se define la constantes de Michaelis (KM ) de una reacción enzimática?
Aunque es imposible medir exactamente la concentración de sustrato que da Vmax, las
enzimas pueden caracterizarse mediante la concentración de sustrato a la cual la velocidad
de reacción es la mitad de la velocidad máxima. Esta concentración de sustrato se conoce
como constante de Michaelis-Menten (KM).
Para enzimas que exhiben una cinética de Michaelis-Menten simple esta constante
representa la constante de disociación del complejo enzima-sustrato (ES) (o la inversa de la
afinidad entre enzima y sustrato). Valores bajos indican que el complejo ES está unido muy
fuertemente y raramente se disocia sin que el sustrato reaccione para dar producto.
En estos casos se obtendrá una KM diferente según el sustrato específico sobre el que actúe
la enzima (como sucede en el caso de enzimas que actúan sobre sustratos análogos) y según
las condiciones de reacción en que se realicen las mediciones.
¿Cómo se define la velocidad máxima (Vmax) de una reacción?
La Vmax corresponde al valor máximo al que tiende la curva experimental, y la KM
corresponde a la concentración de sustrato a la cual la velocidad de la reacción es la mitad
de la Vmax.
¿Qué parámetros fundamentales influyen en la constante de velocidad de una
reacción enzimática?
Incremento de la velocidad con la temperatura: En general, la velocidad de la reacción se
incrementa con la temperatura hasta que un punto máximo es alcanzado. Este incremento se
debe a que aumenta el número de moléculas ricas en energía que pueden pasar la barrera
energética de estado de transición, para formar a los productos.
Decremento de la velocidad con la temperatura: la elevación excesiva de la temperatura
del medio que contiene a las enzimas, resulta en un decremento de la velocidad como
resultado de la desnaturalización, es decir, la pérdida de la estructura tridimensional de las
enzimas.
Efecto del pH en la ionización del sitio activo: la concentración de H+ afecta la velocidad
de la reacción en muchas formas. Primero el proceso catalítico usualmente requiere que la
enzima y el substrato tengan grupos químicos en una forma iónica particular para poder
interactuar. Por ejemplo, la actividad catalítica puede necesitar a un grupo amino, por
ejemplo, de una lisina en estado protonado (-NH3+) o no (-NH2+), el pH modifica este estado
y por tanto a la velocidad de la reacción.
Efecto del pH para la desnaturalización de la enzima: pH extremos pueden ocasionar la
desnaturalización de las enzimas, debido a que la estructura con estos cambios es posible
modificar las interacciones ionicas que intervienen en la estabilidad de la enzima en su
estado nativo
¿Cuáles son las enzimas cuya determinación tiene valor diagnóstico?
Lactato Deshidrogenasa (LDH), Alanina Aminotransferasa (ALT), Creatina Fosfocinasa
(CPK), Fosfatasa Alcalina (FA), Apartato Aminotransferasa (AST), g-glutamil
transpeptidasa (GGT).
Bibliografía:
Nelson, DL., Cox, MM. (2000) Lehninger Principles of Biochemistry, 3rd Ed., Worth
Publishers, USA
Juan Manuel González Mañas, Curso de Biomoléculas, Universidad del país Vasco.
Recuperado de http://www.ehu.eus/biomoleculas/enzimas/enz3.htm
María Concepción Ruiz Cruz, Factores que afectan la velocidad de las reacciones
enzimáticas, Instituto Tecnológico de Tijuana, 2014 Recuperado de:
https://sites.google.com/site/bq2014iruizcruzmariaconcepcion/iii-enzimas/3-4-factores-que-
afectan-la-velocidad-de-las-reacciones-enzimaticas
También podría gustarte
- Cuestionario ENZIMASDocumento18 páginasCuestionario ENZIMASCristina Russell100% (1)
- Estrategia Catalítica de La LisozimaDocumento17 páginasEstrategia Catalítica de La LisozimaLudwig Omar Julca Salazar100% (4)
- Ing. EnzimáticaDocumento46 páginasIng. EnzimáticaArmando Montoya García100% (1)
- RibozimasDocumento3 páginasRibozimasSalvador Salcedo67% (3)
- Sistemas PolipróticosDocumento5 páginasSistemas PolipróticosBenito CameloAún no hay calificaciones
- Cinética Química y Le ChatelierDocumento2 páginasCinética Química y Le ChatelierChema ToledoAún no hay calificaciones
- Tema 8 - Cinetica Enzimatica Farmacia PDFDocumento12 páginasTema 8 - Cinetica Enzimatica Farmacia PDFMariciell Larissa Gonzales TiconaAún no hay calificaciones
- Determinación de Proteinas-TeoriaDocumento7 páginasDeterminación de Proteinas-Teoriathe_CarthoAún no hay calificaciones
- Practica . - 12 Síntesis Del ParacetamolDocumento1 páginaPractica . - 12 Síntesis Del ParacetamolLuis Alberto GallegosAún no hay calificaciones
- 03estereoquimica 12827Documento18 páginas03estereoquimica 12827Javier GómezAún no hay calificaciones
- Acción de la amilasa sobre el almidónDocumento4 páginasAcción de la amilasa sobre el almidónhubertAún no hay calificaciones
- Prueba de La OptoquinaDocumento1 páginaPrueba de La OptoquinaOscar Chuquiyauri PomacinoAún no hay calificaciones
- Capitulos OrganicaDocumento22 páginasCapitulos OrganicaAlonsoAguasZuñigaAún no hay calificaciones
- Desarrollo de La Guia 5 Carbohidratos y ...Documento5 páginasDesarrollo de La Guia 5 Carbohidratos y ...David DueñasAún no hay calificaciones
- CUESTIONARIODocumento7 páginasCUESTIONARIOCht DenisseAún no hay calificaciones
- CuestionarioDocumento4 páginasCuestionarioyandra Salas AlemánAún no hay calificaciones
- PRÁCTICA #08 EnzimasDocumento6 páginasPRÁCTICA #08 Enzimasjimmy gomezAún no hay calificaciones
- Prueba Del IndolDocumento4 páginasPrueba Del IndolEddy Castellon RodriguezAún no hay calificaciones
- Guía N°4 - LípidosDocumento3 páginasGuía N°4 - LípidosANA LAURAAún no hay calificaciones
- Presentacion 6 Cinetica EnzimaticaDocumento46 páginasPresentacion 6 Cinetica EnzimaticaE Clinton LMAún no hay calificaciones
- Lab 1 Bioquimica Convertido FirmadoDocumento14 páginasLab 1 Bioquimica Convertido Firmadoantonio vAún no hay calificaciones
- Actividad EnzimaticaDocumento8 páginasActividad EnzimaticaLaura Franco SalazarAún no hay calificaciones
- Chaperonas y ChaperoninasDocumento26 páginasChaperonas y ChaperoninasaarongondraAún no hay calificaciones
- Actividad EnzimáticaDocumento13 páginasActividad EnzimáticaAlêe JimênezAún no hay calificaciones
- Factores de La CoagulaciónDocumento18 páginasFactores de La CoagulaciónEudo Velsquez100% (1)
- Aminoacidos y ProteinasDocumento36 páginasAminoacidos y ProteinasmanzanitapAún no hay calificaciones
- Cuadro Características EnterobacteriasDocumento3 páginasCuadro Características EnterobacteriasCesar Nicolas SosaAún no hay calificaciones
- Clase Practica 26Documento5 páginasClase Practica 26Kenya SantacruzAún no hay calificaciones
- Práctica 1 TincionesDocumento10 páginasPráctica 1 TincionesAna Gabriela Fernandez MontenegroAún no hay calificaciones
- La EntalpíaDocumento6 páginasLa EntalpíaStefaniaAún no hay calificaciones
- Modificacion de La Grafica McCabe-Thaile Etanol AguaDocumento9 páginasModificacion de La Grafica McCabe-Thaile Etanol AguaAgathe AmerissisAún no hay calificaciones
- Fermentacion 3Documento10 páginasFermentacion 3rocioAún no hay calificaciones
- Ejercicio 1 EnzimologiaDocumento15 páginasEjercicio 1 EnzimologiaAndrea ChavarroAún no hay calificaciones
- Tipos de Reacciones Quimicas InformeDocumento4 páginasTipos de Reacciones Quimicas InformeAngiee Biirof BassiAún no hay calificaciones
- Tensoactivos interfase sólido-líquidoDocumento11 páginasTensoactivos interfase sólido-líquidoJanai ArriagaAún no hay calificaciones
- Ciclo de La Urea, BioquimicaDocumento5 páginasCiclo de La Urea, Bioquimicamaytee19Aún no hay calificaciones
- Sintesis PabaDocumento9 páginasSintesis PabaEduarddo Ravelo NietoAún no hay calificaciones
- Practica No 3 LBMDocumento3 páginasPractica No 3 LBMAna PadillaAún no hay calificaciones
- Introduccion y Descripción Del Proceso de CiclohexanonaDocumento3 páginasIntroduccion y Descripción Del Proceso de CiclohexanonaYiris V. Gómez Bastidas0% (1)
- Los AlcaloidesDocumento2 páginasLos AlcaloidesJean camilo PorrasAún no hay calificaciones
- Practica Ciclo de CrebsDocumento3 páginasPractica Ciclo de CrebsHueso-saurio BlancoAún no hay calificaciones
- Laboratorio Virtual IIIIDocumento10 páginasLaboratorio Virtual IIIISamuel Berrios CidAún no hay calificaciones
- MitocondriasDocumento6 páginasMitocondriasDianaBGAún no hay calificaciones
- Bioenergética y MetabolismoDocumento13 páginasBioenergética y MetabolismoBerta González GómezAún no hay calificaciones
- Cuestionario AspirinaDocumento3 páginasCuestionario AspirinaXavier Munayco Ortiz100% (1)
- Cuestionario EnzimasDocumento7 páginasCuestionario EnzimasJames ChAún no hay calificaciones
- 26436.cuestionario Preparacion de Agares 2-2021Documento2 páginas26436.cuestionario Preparacion de Agares 2-2021Camila Córdova LópezAún no hay calificaciones
- Discusion Nº3Documento22 páginasDiscusion Nº3christian8diaz-59207Aún no hay calificaciones
- Renocimiento de ProteinaDocumento7 páginasRenocimiento de ProteinaSamir Enrique Pernett OquendoAún no hay calificaciones
- Práctica No. 7 Síntesis de AspirinaDocumento3 páginasPráctica No. 7 Síntesis de AspirinaMaria Fernanda Albarran OrtizAún no hay calificaciones
- Farmacos Como Mezclas RacemicasDocumento31 páginasFarmacos Como Mezclas RacemicasIrvin Ramirez SalazarAún no hay calificaciones
- Farmacologia I Vida Media de Un FarmacoDocumento4 páginasFarmacologia I Vida Media de Un FarmacoMariasenia CrossAún no hay calificaciones
- Importancia de Las Enzimas en MedicinaDocumento10 páginasImportancia de Las Enzimas en MedicinaAngel CornejoAún no hay calificaciones
- PRACTICA N 5 BCI 2020 Aminoácidos y ProteínasDocumento13 páginasPRACTICA N 5 BCI 2020 Aminoácidos y ProteínasDavid Carlos Bertolotto Huamaní100% (1)
- Metabolismo de Purinas y Pirimidinas (14!09!11)Documento65 páginasMetabolismo de Purinas y Pirimidinas (14!09!11)Cristabel VázquezAún no hay calificaciones
- Determinación de EnzimasDocumento95 páginasDeterminación de EnzimasStela MarisAún no hay calificaciones
- Factores que influyen en la velocidad de reacciones enzimáticasDocumento21 páginasFactores que influyen en la velocidad de reacciones enzimáticasVero Claros TapiaAún no hay calificaciones
- BIOQUIMICA2Documento21 páginasBIOQUIMICA2Lolhy Burga Hernández100% (1)
- En ZimasDocumento71 páginasEn ZimasLeidy ItzelAún no hay calificaciones
- Factores EnzimasDocumento4 páginasFactores EnzimasMatiasHerreraAún no hay calificaciones
- Preguntas de RepasoDocumento3 páginasPreguntas de RepasoLuis ArroyoAún no hay calificaciones
- P25 - Determinacion Del Tiempo de Coagulacion y SangradoDocumento5 páginasP25 - Determinacion Del Tiempo de Coagulacion y SangradoLuis ArroyoAún no hay calificaciones
- P24 - Retracción de CóaguloDocumento3 páginasP24 - Retracción de CóaguloLuis ArroyoAún no hay calificaciones
- Guia de EstudioDocumento1 páginaGuia de EstudioLuis ArroyoAún no hay calificaciones
- Examen A Casa Unidad 2 Metabolismo de CarbohidratosDocumento6 páginasExamen A Casa Unidad 2 Metabolismo de CarbohidratosLuis ArroyoAún no hay calificaciones
- Prueba VDRL sífilisDocumento6 páginasPrueba VDRL sífilisLuis ArroyoAún no hay calificaciones
- Marcha Analítica E.L.Documento1 páginaMarcha Analítica E.L.Luis ArroyoAún no hay calificaciones
- Guía para El Cuidado y Uso de Los Animales de LaboratorioDocumento129 páginasGuía para El Cuidado y Uso de Los Animales de Laboratoriorayo_xl2843Aún no hay calificaciones
- Agentes etiológicos de enfermedades infecciosasDocumento5 páginasAgentes etiológicos de enfermedades infecciosasLuis ArroyoAún no hay calificaciones
- Identificacion de CarbohidratosDocumento3 páginasIdentificacion de CarbohidratosLuis ArroyoAún no hay calificaciones
- Actividad BioquímicaDocumento4 páginasActividad BioquímicaLuis ArroyoAún no hay calificaciones
- Examen Ordinario MicroDocumento6 páginasExamen Ordinario MicroLuis ArroyoAún no hay calificaciones
- Docit - Tips - Reacciones de Sustitucian Electrofalica Aromaticadocx PDFDocumento9 páginasDocit - Tips - Reacciones de Sustitucian Electrofalica Aromaticadocx PDFLuis ArroyoAún no hay calificaciones
- Cuestionario OrganicaDocumento2 páginasCuestionario OrganicaLuis ArroyoAún no hay calificaciones
- Análisis carbohidratos laboratorioDocumento6 páginasAnálisis carbohidratos laboratorioLuis ArroyoAún no hay calificaciones
- Análisis carbohidratos laboratorioDocumento6 páginasAnálisis carbohidratos laboratorioLuis ArroyoAún no hay calificaciones
- Soluciones AmortiguadorasDocumento33 páginasSoluciones AmortiguadorasMaxi Gonzalez94% (18)
- 00552Documento19 páginas00552Kely Diaz RomeroAún no hay calificaciones
- Disolución, extracción, tamizado y lixiviación procesos separaciónDocumento2 páginasDisolución, extracción, tamizado y lixiviación procesos separaciónLuis ArroyoAún no hay calificaciones
- Actividad ProteinasDocumento8 páginasActividad ProteinasLuis ArroyoAún no hay calificaciones
- Cuestionario Practica 6Documento2 páginasCuestionario Practica 6Luis ArroyoAún no hay calificaciones
- CuestionarioDocumento2 páginasCuestionarioLuis ArroyoAún no hay calificaciones
- Datos Billonarias-2Documento5 páginasDatos Billonarias-2Luis ArroyoAún no hay calificaciones
- CONCEPTOSDocumento4 páginasCONCEPTOSLuis ArroyoAún no hay calificaciones
- Actividad 1 QO3 2020-MVHDocumento3 páginasActividad 1 QO3 2020-MVHLuis ArroyoAún no hay calificaciones
- Actividad CarbohidratosDocumento9 páginasActividad CarbohidratosLuis Arroyo100% (2)
- Manualqorg1 PDFDocumento73 páginasManualqorg1 PDFLuis ArroyoAún no hay calificaciones
- Manual de QFB 17022020 PDFDocumento97 páginasManual de QFB 17022020 PDFLuis ArroyoAún no hay calificaciones
- Manualqorg1 PDFDocumento73 páginasManualqorg1 PDFLuis ArroyoAún no hay calificaciones
- PROTEÍNASDocumento6 páginasPROTEÍNASLizeth SánchezAún no hay calificaciones
- InformeDocumento8 páginasInformeDomenica OrtízAún no hay calificaciones
- Orientaciones y RecomendacionDocumento7 páginasOrientaciones y RecomendacionMónica OrtízAún no hay calificaciones
- Informe de Laboratorio de Quimica Nº 7 de Cambios Fisicos y QuimicosDocumento21 páginasInforme de Laboratorio de Quimica Nº 7 de Cambios Fisicos y QuimicosMaya SanchezAún no hay calificaciones
- QUÍMICA ORGÁNICA: IDENTIFICACIÓN DE AMINASDocumento6 páginasQUÍMICA ORGÁNICA: IDENTIFICACIÓN DE AMINASJos Luis Huaman LauraAún no hay calificaciones
- Fichas de Seguridad Preparacion de SolucionesDocumento14 páginasFichas de Seguridad Preparacion de SolucionesXimena Plata HernandezAún no hay calificaciones
- 1 Informe El Crisol Nom 017 Stps 2008Documento60 páginas1 Informe El Crisol Nom 017 Stps 2008Global DaechangAún no hay calificaciones
- Operaciones Básicas Tecno - FarmacéuticasDocumento2 páginasOperaciones Básicas Tecno - FarmacéuticasAnahi GlezAún no hay calificaciones
- Procedimiento de Colocación FRPArequipaDocumento5 páginasProcedimiento de Colocación FRPArequipaALMA ESTEBAN100% (1)
- Mass and Volume in Analytical Chemistry (IUPAC Technical Report) .En - EsDocumento47 páginasMass and Volume in Analytical Chemistry (IUPAC Technical Report) .En - EsDaviid ZapataAún no hay calificaciones
- Nomenclaturas Metales y No MetalesDocumento5 páginasNomenclaturas Metales y No MetalesAlisson LeitonAún no hay calificaciones
- Gasificacion de Residuos Plasticos para La Produccion de Electricidad en Regimen EspecialDocumento125 páginasGasificacion de Residuos Plasticos para La Produccion de Electricidad en Regimen EspecialVicente TiconaAún no hay calificaciones
- MSDS Desinfectante PinoDocumento4 páginasMSDS Desinfectante PinoJerry William Leon CrisostomoAún no hay calificaciones
- Química IngenioDocumento791 páginasQuímica IngenioBrayan Gonzales V.Aún no hay calificaciones
- Laboratorio Separacion de MezclasDocumento6 páginasLaboratorio Separacion de Mezclasmarcega14100% (3)
- Nomenclatura N2 Lathiel CorroDocumento6 páginasNomenclatura N2 Lathiel CorroLathiel CorroAún no hay calificaciones
- Lipidos 2daDocumento34 páginasLipidos 2daMichelle HuitzAún no hay calificaciones
- Guia de Practica Quimica General II 2023-ADocumento65 páginasGuia de Practica Quimica General II 2023-AFernando DiazAún no hay calificaciones
- 0026250Documento70 páginas0026250Daniel Enrique Romero CaballeroAún no hay calificaciones
- Ludico - Cientifico - Septimo Taller ComplementarioDocumento2 páginasLudico - Cientifico - Septimo Taller Complementariovanessa carmonaAún no hay calificaciones
- Leyes Ponderales EstequiometriaDocumento23 páginasLeyes Ponderales EstequiometriajuanAún no hay calificaciones
- Question - 2021 - 05 - 03 - 19 - 49 - QZ - EXAMEN PILOTO THINKERS CIENCIAS DE LA SALUDDocumento20 páginasQuestion - 2021 - 05 - 03 - 19 - 49 - QZ - EXAMEN PILOTO THINKERS CIENCIAS DE LA SALUDJose Ignacio Lopez GarciaAún no hay calificaciones
- Hidrocarburos Cíclicos: Curso: QuímicaDocumento4 páginasHidrocarburos Cíclicos: Curso: Químicabrawl starsAún no hay calificaciones
- Resumen de QuimicaDocumento71 páginasResumen de QuimicaKIMBERLY RASHEL MEDRANO AGUIRREAún no hay calificaciones
- AsdasdsaxDocumento7 páginasAsdasdsaxDai DomAún no hay calificaciones
- Reglas NOx DeterminaciónDocumento4 páginasReglas NOx DeterminaciónSalvador Aguilar Robles100% (1)
- Acabados en TechosDocumento15 páginasAcabados en TechosAstrid Alexandra ZeaAún no hay calificaciones
- Materiales Compositos y Su Uso en La IndustriaDocumento9 páginasMateriales Compositos y Su Uso en La IndustriaValdez Garibo Grecia sinaiAún no hay calificaciones
- Nº01. Agua para El Concreto NTP 339.088Documento10 páginasNº01. Agua para El Concreto NTP 339.088Andrea Maria Diaz MoranAún no hay calificaciones
- Anexo VII Proteccion Contra IncendioDocumento16 páginasAnexo VII Proteccion Contra IncendioJeni BulatovichAún no hay calificaciones