Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cuestionario 1
Cargado por
Rodrigo RuedaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cuestionario 1
Cargado por
Rodrigo RuedaCopyright:
Formatos disponibles
De ejemplos de sustancias inmiscibles
Son líquidos de naturaleza orgánica y que tras un periodo de reposo del agua residual, flotan
en el agua o decantan. Ejemplos: Gotas de aceite, grasas, etc.
Un líquido inmiscible es incapaz de ser mezclado sin la separación de fases. El aceite de
petróleo y el agua son inmiscibles en el mayor número de condiciones, aunque se pueden
convertir en miscibles añadiéndole un agente emulsivo
De acuerdo con las pruebas de solubilidad, ¿Cuál es el grado de polaridad de los compuestos
ensayados?, Fundamente su respuesta
La solubilidad depende de la polaridad. Generalmente los compuestos ionicos son polares
mientras que los compuestos orgánicos son no polares.
Polar:
NaCl se disolvió en compuesto polares como el H2O y Etanol 70, ya que las moléculas polares
tienen interacciones electrostáticas soluto-disolvente en las moléculas polares, estas
interacciones electrostáticas con dipolo-dipolo, puentes de hidrógeno son las que provocan
el fenómeno de la solvatación proceso de asociación de moléculas de un disolvente con
moléculas o iones de un soluto)
No polar:
El ácido benzoico es un grupo carbonilo conectado a un anillo bencénico. la parte polar de la
molécula, o la que es soluble en agua, es el grupo carbonilo, que es muy pequeño en
comparación al anillo bencénico. debido a que el anillo bencénico es insoluble en agua y ocupa
la mayor parte de la molécula no deja que el agua disuelva la molécula que encuentra
dificultades de llegar al grupo carbonilo.
El ácido benzoico es un ácido débil que tiene mucha diferencia de solubilidad en agua fría y en
agua caliente. La razón tiene que ver con el cuerpo hidrocarbonado grande de la molécula.
El ácido benzoico tiene un anillo bencénico grande y no-polar que conforma la mayor parte de
su cuerpo, unido a un grupo polar ácido más pequeño. Por lo tanto, debería disolverse tanto
en solventes polares como no polares. Aunque esto es una verdad parcial, en realidad no se
disuelve demasiado bien en ninguno de los dos. Resiste la disolución en agua porque el cuerpo
grande y no polar es atraído por otros anillos bencénicos en lugar de las moléculas de agua, a
pesar de la unión ácida.
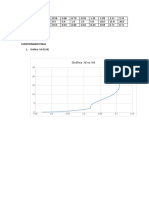
Presente la escala ascendente de los solventes de acuerdo a la constante dieléctrica
Comparando las constantes dieléctricas obtenemos en forma ascendente:
La constante dieléctrica o permisividad relativa de un medio continuo es una propiedad
macroscópica de un medio dieléctrico relacionado con la permisividad eléctrica del medio. En
comparación con la velocidad de la luz, la rapidez de las ondas electromagnéticas en un
dieléctrico es:
𝐶
𝑣=
√𝐸𝑟
Donde c es la velocidad de la luz en el vacío y v es la velocidad de la onda electromagnética en
el medio con permisividad relativa. La constante dieléctrica es una medida de la permisividad
estática relativa de un material, que se define como la permisividad absoluta dividida por la
constante dieléctrica. La escala ascendente de los solventes se presenta a continuación:
Butanol Etanol 70° Etanol 96° Agua Benceno
Constante 18 24 24 86 2.2
Diélectrica:
¿Qué relación tiene la polaridad del soluto y solvente en la solubilidad?
Para que un soluto se disuelva en un solvente ambos deben poseer la misma solubilidad, es
decir ambos son polares o no polares. Los Polares son sustancias en cuyas moléculas la
distribución de la nube electrónica es asimétrica; por lo tanto, la molécula presenta un polo
positivo y otro negativo separados por una cierta distancia. Hay un dipolo permanente. El
ejemplo clásico de solvente polar es el agua. Los alcoholes de baja masa molecular también
pertenecen a este tipo. Los no polares son sustancias de tipo orgánico y en cuyas moléculas la
distribución de la nube electrónica es simétrica; por lo tanto, estas sustancias carecen de polo
positivo y negativo en sus moléculas. No pueden considerarse dipolos permanentes. Esto no
implica que algunos de sus enlaces sean polares. Todo dependerá de la geometría de sus
moléculas. La solubilidad se iniciara gracias a que para que la disolución ocurra primero se
tiene que establecer interacciones entre soluto y solvente. Por ejemplo, el el aceite no se
disuelve en agua debido a que este es polar, y el aceite es una sustancia apolar.
¿Qué relación tiene la estructura molecular con la solubilidad de los compuestos
participantes?
La solubilidad y la estructura molecular van ligadas porque la estructura molecular es lo que
permite o no a las sustancias disolverse o disolver, es decir, la polaridad y las fuerzas entre
moléculas están en función de la forma en que se acomodan los átomos y las cargas en una
molécula.
También podría gustarte
- Fuerzas IntermolecularesDocumento5 páginasFuerzas IntermolecularesRonald SalasAún no hay calificaciones
- Práctica 03. Cristalización Por Par de DisolventesDocumento3 páginasPráctica 03. Cristalización Por Par de DisolventesAgamAún no hay calificaciones
- Laboratorio 3 Quimica (Enlaces Quimicos)Documento15 páginasLaboratorio 3 Quimica (Enlaces Quimicos)Antony Quispe AlvaresAún no hay calificaciones
- UntitledDocumento3 páginasUntitledTatiana Delesma100% (1)
- Quimica Organica - Informe3.gonzalesDocumento6 páginasQuimica Organica - Informe3.gonzalesFabiana Gonzales JaureguiAún no hay calificaciones
- Práctica N°4 - Sintesis de La Anilina A Partir de La AcetanilidaDocumento4 páginasPráctica N°4 - Sintesis de La Anilina A Partir de La AcetanilidaMian Susan CpAún no hay calificaciones
- 2.8.-FB5032 - QUIMICA INORGANICA 2019-Informe 1Documento48 páginas2.8.-FB5032 - QUIMICA INORGANICA 2019-Informe 1Cristel Galvan ArquiñegoAún no hay calificaciones
- Química BachilleratoDocumento43 páginasQuímica BachilleratoElena0% (1)
- Analisis de Series de Tiempo U ChileDocumento52 páginasAnalisis de Series de Tiempo U ChilePedro Mauricio Fajardo AyalaAún no hay calificaciones
- Metales de TransicionDocumento32 páginasMetales de Transicionvale8100% (4)
- LAB SEM2 - Solubilidad y Miscibilidad de Compuestos OrganicosDocumento26 páginasLAB SEM2 - Solubilidad y Miscibilidad de Compuestos OrganicosANDREA JOSEFINA MOQUILLAZA GONZAAún no hay calificaciones
- V y VI Práctica #5 y 6 Curva de Neutralización o Curva de Titulación AcidoDocumento16 páginasV y VI Práctica #5 y 6 Curva de Neutralización o Curva de Titulación Acidocrls_marcos50% (2)
- Informe 5 de Practica F.quimicaDocumento18 páginasInforme 5 de Practica F.quimicaJennifer Sarai Gutierrez Orellana100% (1)
- Anica GonzalesDocumento7 páginasAnica GonzalesFabiana Gonzales JaureguiAún no hay calificaciones
- Practica Quimica Organica HidrocarburosDocumento3 páginasPractica Quimica Organica HidrocarburosPedro Alejandro Mesias Sanchez100% (1)
- Química General - Práctica CalificadaDocumento3 páginasQuímica General - Práctica Calificadapierop cuadrosAún no hay calificaciones
- Qo - UltimoDocumento3 páginasQo - UltimoRenzo CcopaAún no hay calificaciones
- Tarea Quimica Inorganica Takeshi Raez Yseki REACCIONES PRACTICA REDOXDocumento4 páginasTarea Quimica Inorganica Takeshi Raez Yseki REACCIONES PRACTICA REDOXTakeshi Diego Raez YsekiAún no hay calificaciones
- Ácido BenzoicoDocumento8 páginasÁcido BenzoicoMoises EstradaAún no hay calificaciones
- Practica 10Documento4 páginasPractica 10Liliana Tello PortillaAún no hay calificaciones
- Informe Numero 9Documento7 páginasInforme Numero 9Franklin Aliaga GonzálezAún no hay calificaciones
- Informe 4Documento6 páginasInforme 4angieAún no hay calificaciones
- PRACTICA #10 ChanzapaDocumento9 páginasPRACTICA #10 ChanzapaGABY GAMES YTAún no hay calificaciones
- Practica de LaboratorioDocumento11 páginasPractica de LaboratorioCristhian Pablo Carpio BanegasAún no hay calificaciones
- Informe de Lab. n2 Purificacion de Sólidos Cristalización Ver.2Documento22 páginasInforme de Lab. n2 Purificacion de Sólidos Cristalización Ver.2Renzo Miguel Alcántara67% (3)
- Semana 12-1Documento15 páginasSemana 12-1Tatiana DelesmaAún no hay calificaciones
- Practica #3 - "Titulación Yodométrica de Vitamina C"Documento36 páginasPractica #3 - "Titulación Yodométrica de Vitamina C"ISABEL CINTHIA BUSTOS PEÑAAún no hay calificaciones
- Informe de Práctica Nro 10 Quimica Orgánica IiDocumento11 páginasInforme de Práctica Nro 10 Quimica Orgánica IiKaroline FloriánAún no hay calificaciones
- Clase Grupos Vecinos IDocumento21 páginasClase Grupos Vecinos Iantony1falconAún no hay calificaciones
- Informe 2 Quimica Organica 3Documento17 páginasInforme 2 Quimica Organica 3carlos19895Aún no hay calificaciones
- Informe de Practica #2Documento13 páginasInforme de Practica #2karenAún no hay calificaciones
- Guia Quimica Inorganic A 2009 IIDocumento57 páginasGuia Quimica Inorganic A 2009 IIelenamaria7818100% (1)
- Análisis funcional de alcoholes SECDocumento9 páginasAnálisis funcional de alcoholes SECYube LlyAún no hay calificaciones
- Taller 6 L Elementos de TransiciónDocumento8 páginasTaller 6 L Elementos de TransiciónJAIDER STIVEN CORDOBA CASTELLANOSAún no hay calificaciones
- Analitica - Ejercicios-1Documento4 páginasAnalitica - Ejercicios-1Jorge Luis LudeñaAún no hay calificaciones
- DocxDocumento13 páginasDocxkathyAún no hay calificaciones
- Informe 13 - QO1Documento9 páginasInforme 13 - QO1Renzo TrujilloAún no hay calificaciones
- Sintesis de La P-NitroacetanilidaDocumento8 páginasSintesis de La P-NitroacetanilidaDj GamerPlays YTAún no hay calificaciones
- Práctica 5 BiofarmaciaDocumento5 páginasPráctica 5 BiofarmaciaSandra SarmientoAún no hay calificaciones
- XIIIDocumento3 páginasXIIIIram EiramAún no hay calificaciones
- Informe N°11 Química InorgánicaDocumento11 páginasInforme N°11 Química InorgánicaDey Rafael PortuguezAún no hay calificaciones
- Informe 1 - Fisico Quimica ModificadoDocumento16 páginasInforme 1 - Fisico Quimica ModificadoTeves Rober PkmAún no hay calificaciones
- Informe Nitrogenoides - Grupo 5Documento9 páginasInforme Nitrogenoides - Grupo 5DANIELA VANESSA HERMOZA SAAZAún no hay calificaciones
- Práctica 7 Funcionales.Documento8 páginasPráctica 7 Funcionales.Chantal Abigail Reséndiz GómezAún no hay calificaciones
- Informe de Quimica InorganicaDocumento13 páginasInforme de Quimica InorganicaMaria Soledad Ataypoma FernandezAún no hay calificaciones
- Purificacion de Los Sólidos Por CristalizacionDocumento4 páginasPurificacion de Los Sólidos Por CristalizacionFernanda HerediaAún no hay calificaciones
- Química GeneralDocumento15 páginasQuímica GeneralAlejandra Gutierrez ʚïɞ100% (1)
- CCF Separación Mezclas CompuestosDocumento7 páginasCCF Separación Mezclas CompuestosZubii “Zubii”100% (1)
- Tarea Quimica Inorganica Takeshi Raez Yseki FUNCIONES REDOXDocumento7 páginasTarea Quimica Inorganica Takeshi Raez Yseki FUNCIONES REDOXTakeshi Diego Raez YsekiAún no hay calificaciones
- Práctica 09 - HalogenosDocumento3 páginasPráctica 09 - HalogenosfranklinAún no hay calificaciones
- Reacciones de aldehídos y cetonasDocumento4 páginasReacciones de aldehídos y cetonasAndrea GuerraAún no hay calificaciones
- CUESTIONARIO Fisico QuimicaDocumento1 páginaCUESTIONARIO Fisico QuimicaStacy RiveraAún no hay calificaciones
- PDF Practica 11 CompressDocumento4 páginasPDF Practica 11 CompressRodolfo Mayo Quispe100% (1)
- Sintesis de Cloruro de Terbutilo. #9Documento3 páginasSintesis de Cloruro de Terbutilo. #9rubenAún no hay calificaciones
- PRÁCTICA Lab. N°01Documento9 páginasPRÁCTICA Lab. N°01Nicole Angie JaureguiAún no hay calificaciones
- PR+üCTICA 6 ACIDOS CARBOXILICOS-SINTESIS DE ASPIRINADocumento8 páginasPR+üCTICA 6 ACIDOS CARBOXILICOS-SINTESIS DE ASPIRINAJuan V RamirezAún no hay calificaciones
- Practica 9Documento10 páginasPractica 9anton salaAún no hay calificaciones
- Pruebas Generales de Alcoholes Fenoles y EteresDocumento8 páginasPruebas Generales de Alcoholes Fenoles y EteresJeison DavidAún no hay calificaciones
- Practica 8 QuimicaDocumento9 páginasPractica 8 QuimicaCesar SuarezAún no hay calificaciones
- Morfología raízDocumento2 páginasMorfología raízGaby JacomeAún no hay calificaciones
- Practica INORGANICA 3Documento9 páginasPractica INORGANICA 3betsy cadena tenorioAún no hay calificaciones
- Quìmica Inorganica Practica Nº10 - NitrogenoidesDocumento4 páginasQuìmica Inorganica Practica Nº10 - NitrogenoidesEsther Quispe100% (1)
- Tre Q 3Documento57 páginasTre Q 3Edson LaricoAún no hay calificaciones
- Por Qué La Naftalina No Es Soluble en AguaDocumento17 páginasPor Qué La Naftalina No Es Soluble en Aguajorgito1720090% (1)
- La Polaridad Química o Sólo PolaridadDocumento5 páginasLa Polaridad Química o Sólo PolaridadEduardo Barragán100% (1)
- Solubilidad de Líquidos y SólidosDocumento4 páginasSolubilidad de Líquidos y SólidosAlvaro Jhoel Quinteros RAún no hay calificaciones
- Cuestionario Macroeconomía PIBDocumento6 páginasCuestionario Macroeconomía PIBRodrigo RuedaAún no hay calificaciones
- PartedispojohnDocumento1 páginaPartedispojohnRodrigo RuedaAún no hay calificaciones
- Unidad Temática IDocumento1 páginaUnidad Temática IRodrigo RuedaAún no hay calificaciones
- Reloj solar con fibra óptica: una innovación didácticaDocumento7 páginasReloj solar con fibra óptica: una innovación didácticaRodrigo RuedaAún no hay calificaciones
- Análisis Del Presupuesto Público Nacional 2020Documento3 páginasAnálisis Del Presupuesto Público Nacional 2020Rodrigo RuedaAún no hay calificaciones
- Ejercicios AlDocumento3 páginasEjercicios AlRodrigo RuedaAún no hay calificaciones
- Metodos NumericosDocumento1 páginaMetodos NumericosRodrigo RuedaAún no hay calificaciones
- Algoritmos 2005Documento83 páginasAlgoritmos 2005coro2009Aún no hay calificaciones
- Cuestionario 1Documento2 páginasCuestionario 1Rodrigo Rueda100% (1)
- La Atmósfera de Los Planetas y El Gas IdealDocumento7 páginasLa Atmósfera de Los Planetas y El Gas IdealFlores Mamani JordanAún no hay calificaciones
- Ejercicios AlquilosDocumento11 páginasEjercicios AlquilosRodrigo RuedaAún no hay calificaciones
- Ejercicios AlquilosDocumento11 páginasEjercicios AlquilosRodrigo RuedaAún no hay calificaciones
- Definición de RSN y pH-DESMULSIFICANTEDocumento5 páginasDefinición de RSN y pH-DESMULSIFICANTEmilser roelAún no hay calificaciones
- Fuerzas intermoleculares y cambios de fase en sustanciasDocumento6 páginasFuerzas intermoleculares y cambios de fase en sustanciasJosué ChimarroAún no hay calificaciones
- Practica de Laboratorio Numero 7 Algunas Pruebas de Ácidos Carboxilicos y Sus DerivadosDocumento16 páginasPractica de Laboratorio Numero 7 Algunas Pruebas de Ácidos Carboxilicos y Sus DerivadosKriistianSmithMartiinez100% (1)
- EJERCICIOS Tema II EnlaceDocumento2 páginasEJERCICIOS Tema II EnlaceFabio PadillaAún no hay calificaciones
- Basicidad de OxoanionesDocumento8 páginasBasicidad de OxoanionesAbisai Fuentz AguilarAún no hay calificaciones
- Informe #1 Química OrgánicaDocumento7 páginasInforme #1 Química OrgánicaChristian Torres BautistaAún no hay calificaciones
- Ejercicios 2021Documento1 páginaEjercicios 2021kko-hector SilveroAún no hay calificaciones
- 2 4 ProteinasDocumento44 páginas2 4 ProteinasCORDOVA VERA DENILSONAún no hay calificaciones
- Conferencia 1 Unidad 1 Química Orgánica 2020Documento40 páginasConferencia 1 Unidad 1 Química Orgánica 2020Jossenka Lisbeth Pin TomaloAún no hay calificaciones
- Solubilidad y Recristalizacion ListoDocumento5 páginasSolubilidad y Recristalizacion ListoStefany CorreaAún no hay calificaciones
- Química Orgánica FundamentosDocumento24 páginasQuímica Orgánica FundamentosAiser BezaAún no hay calificaciones
- Quimica-In-5: Exámenes Unsaac, San Marcos, Uni Y OtrosDocumento2 páginasQuimica-In-5: Exámenes Unsaac, San Marcos, Uni Y OtrosJohan Huaicho QuispeAún no hay calificaciones
- Trabajo de QuimicaDocumento4 páginasTrabajo de QuimicaVane Alcantara67% (12)
- Enlace 4ESODocumento26 páginasEnlace 4ESODouaa AjoulasAún no hay calificaciones
- Permebilida y Transporte-Nijenda Carrillo-20M2Documento5 páginasPermebilida y Transporte-Nijenda Carrillo-20M2FeerAún no hay calificaciones
- Informe 8Documento8 páginasInforme 8Valentina Rodriguez SuarezAún no hay calificaciones
- Informe de LaboratorioDocumento13 páginasInforme de Laboratoriolaura vanessa Lozano GomezAún no hay calificaciones
- Taller Química 10° OK PDFDocumento7 páginasTaller Química 10° OK PDFJonathan Perez VeranoAún no hay calificaciones
- Guía 7.grado 9°Documento5 páginasGuía 7.grado 9°Omar caicedo carvajalAún no hay calificaciones
- Wuolah Free Tema 2Documento6 páginasWuolah Free Tema 2najnjaAún no hay calificaciones
- Resultados 6Documento3 páginasResultados 6Karla VásquezAún no hay calificaciones
- Enlaces químicos y fuerzas intermolecularesDocumento3 páginasEnlaces químicos y fuerzas intermolecularesAriadnaAún no hay calificaciones
- Tipos de Enlaces QuímicaDocumento15 páginasTipos de Enlaces QuímicaGamejorchi Retro GamesAún no hay calificaciones
- Triptico DosDocumento3 páginasTriptico DosInga De La Cruz YussaraAún no hay calificaciones
- Taller de Quimica No. 3 I P 2010-ResueltoDocumento4 páginasTaller de Quimica No. 3 I P 2010-ResueltoManuel ZuñiigaAún no hay calificaciones