Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Investigacion Maquinas de Fluidos Compresibles
Cargado por
Alejandro Figueroa MorenoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Investigacion Maquinas de Fluidos Compresibles
Cargado por
Alejandro Figueroa MorenoCopyright:
Formatos disponibles
2.3 Estequiometria de la combustión.
El comburente normal en la combustión industrial es el oxígeno del aire. El
nitrógeno y los restantes componentes (del aire) permanecen inalterados y
acompañan a los productos de combustión en los humos de salida o gases de
chimenea.
Para que la combustión sea completa, es necesario poner en contacto con el
combustible una cantidad de oxígeno (y por consiguiente de aire) netamente
superior a aquella que ha de reaccionar. El exceso de aire, ha de ser tanto mayor
cuanto más imperfectas sean las condiciones de mezcla entre los reactivos, este
exceso de aire se define en función del aire teórico (cantidad de aire teórico).
Si la combustión es completa el carbono presente inicialmente en el combustible
pasa a dióxido de carbono, y el hidrógeno a agua, acompañando a estos
productos de reacción el nitrógeno que estaba presente en el aire introducido, y
el oxígeno en exceso y que por tanto no ha reaccionado.
Se va a considerar que el combustible responde a una formulación general tal
como C α H β O, de forma que al reaccionar con el oxígeno del aire según una
reacción estequiometria, los únicos productos de la reacción serán el CO 2, H2
γ O, y N. Se supone que el aire tiene una composición en volumen de 21% de
oxígeno y 79% de nitrógeno, despreciándose el argón y el vapor de agua por
simplicidad en el planteamiento:
Estableciendo las ecuaciones de balance de número de átomos para cada uno
de los cuatro elementos, por mol de combustible, se pueden obtener las cuatro
incógnitas que aparecen en la reacción anterior (va, σ), en función de: α, β y γ.1,
σ2, σ3.
Se denomina dosado estequiométrico al cociente entre la masa de combustible
y la masa de aire en una reacción en la que los reactantes están en la proporción
justa o estequiometrica. Dicho parámetro se puede calcular teniendo en cuenta
la ecuación y los pesos moleculares de los reactantes:
2.4 primera ley de la termodinámica y la combustión
Hasta el momento se han considerado por separado varias formas de energía
como el calor Q, el trabajo W y la energía total E, y no se ha hecho ningún intento
para relacionarlas entre sí durante un proceso. La primera ley de la
termodinámica, conocida también como el principio de conservación de la
energía, brinda una base sólida para estudiar las relaciones entre las diversas
formas de interacción de energía. A partir de observaciones experimentales, la
primera ley de la termodinámica establece que la energía no se puede crear ni
destruir durante un proceso; sólo puede cambiar de forma. Por lo tanto, cada
cantidad de energía por pequeña que sea debe justificarse durante un proceso.
Considere un sistema que experimenta una serie de procesos adiabáticos desde
un estado especificado 1 a otro estado 2. Al ser adiabáticos, es evidente que
estos procesos no tienen que ver con transferencia de calor, pero sí con varias
clases de interacción de trabajo. Las mediciones cuidadosas durante estos
experimentos indican lo siguiente: para todos los procesos adiabáticos entre dos
estados determinados de un sistema cerrado, el trabajo neto realizado es el
mismo sin importar la naturaleza del sistema cerrado ni los detalles del proceso.
Considerando que existe un número infinito de maneras para llevar a cabo
interacciones de trabajo en condiciones adiabáticas, el enunciado anterior
parece ser muy poderoso para tener implicaciones trascendentes. Este
enunciado, basado en gran medida en los experimentos hechos por Joule en la
primera mitad del siglo XIX, no se puede extraer de ningún otro principio físico
conocido y se reconoce como principio fundamental o primera ley de la
termodinámica o sólo primera ley.
En las siguientes secciones nos dedicamos a describir los fundamentos de varias
máquinas térmicas. Una máquina térmica es un dispositivo que utiliza calor para
producir trabajo, o bien, utiliza trabajo para remover calor de un espacio a otro.
Los refrigeradores, los motores de combustión interna (los de automóvil), y los
motores de jet son todas máquinas térmicas. Modelaremos estas máquinas
térmicas como ciclos termodinámicos y aplicaremos la primera ley de la
termodinámica para estimar la eficiencia térmica y el trabajo realizado en función
de las presiones y temperaturas en diferentes puntos del ciclo. A esto se le
denomina análisis del ciclo ideal. Las estimaciones que obtenemos de dicho
análisis representan el mejor funcionamiento realizable y que se puede obtener
de una máquina térmica. En máquinas reales el funcionamiento será menor que
las estimaciones obtenidas bajo el análisis del ciclo ideal.
Nuestros análisis utilizarán el ``ciclo aire-estándar,'' que es una aproximación al
comportamiento real del ciclo. Específicamente, hacemos las simplificaciones
siguientes:
El aire es el fluido de funcionamiento (la presencia de los productos de la
combustión y el combustible son despreciables) La combustión se representa
por la transferencia de calor de una fuente de calor externa El ciclo se completa
por la transferencia de calor hacia los alrededores. Todos los procesos son
internamente reversibles (descrito más adelante en capítulos posteriores). El
aire es un gas perfecto con calor específico constante.
Antes de que examinemos las máquinas térmicas individuales, observamos que
todas las máquinas térmicas se pueden representar generalmente como la
transferencia del calor desde un depósito de alta temperatura hacia un
dispositivo que realiza trabajo sobre los alrededores, seguido por una expelida o
emanación de calor del dispositivo hacia un depósito de baja temperatura como
se indica en la figura.
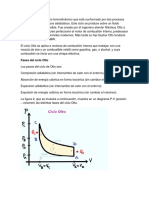
2.7 Ciclos Otto, diésel, Brayton y Stirling.
2.7.1. Ciclo Otto.
El ciclo Otto es el modelo ideal que se emplea para describir los motores de
combustión interna en los cuales la combustión se inicia por una chispa. Esto
ocurre en los motores de cuatro tiempos de los vehículos de gasolina y en los de
dos tiempos de ciclomotores, segadoras y similares.
En un motor de este tipo, en un cilindro se produce una compresión muy rápida
de una mezcla de aire en el que se ha inyectado gasolina. Cuando el émbolo
llega a su punto más alto, salta una chispa de una bujía que hace explotar la
gasolina y empuja al pistón hacia abajo.
En el modelo matemático de este ciclo se supone que la compresión y la
expansión son tan rápidas que a la mezcla no le da tiempo a intercambiar calor
con el ambiente y por tanto son procesos adiabáticos. La explosión se modela
como un calentamiento a volumen constante, ya que al estar el pistón en su
punto más alto, su velocidad se anula justo en ese instante y el volumen cambia
poco durante la explosión.
En el escape, los cases son expulsados de la cámara y sustituidos por mezcla
nueva. Realmente, se trata de un sistema abierto, pero se modela como si fuera
el mismo aire que se ha enfriado cuando el émbolo estaba en su punto más bajo,
lo que corresponde a otros procesos a volumen constante.
El ciclo Otto ideal, por tanto, está formado por dos adiabáticas y dos isócoras.
El rendimiento de este ciclo es igual a:
Con γ = cp / cv = 1.4 y r = Vmax / Vmin la relación de compresión. Para un motor
de automóvil típico, esta relación de compresión puede valer 8, lo que da un
rendimiento del 56.5%.
2.7.2. Ciclo diésel.
Un ciclo Diésel ideal es un modelo simplificado de lo que ocurre en un motor
diésel. En un motor de esta clase, a diferencia de lo que ocurre en un motor de
gasolina la combustión no se produce por la ignición de una chispa en el interior
de la cámara. En su lugar, aprovechando las propiedades químicas del gasóleo,
el aire es comprimido hasta una temperatura superior a la de auto ignición del
gasóleo y el combustible es inyectado a presión en este aire caliente,
produciéndose la combustión de la mezcla.
Puesto que sólo se comprime aire, la relación de compresión (cociente entre el
volumen en el punto más bajo y el más alto del pistón) puede ser mucho más
alta que la de un motor de gasolina (que tiene un límite, por ser indeseable la
auto ignición de la mezcla). La relación de compresión de un motor diésel puede
oscilar entre 12 y 24, mientras que el de gasolina puede rondar un valor de 8.
En el modelo de un ciclo Diésel ideal, la única diferencia con el ciclo Otto ideal
es que el calentamiento por la combustión no se produce a volumen constante,
sino a presión constante. La razón es que en ese momento la cámara está
abierta, puesto que se está inyectando el combustible, aunque su presión es por
supuesto muy superior a la atmosférica.
El rendimiento de un ciclo Diésel ideal es
Al tener una relación de compresión mayor, los motores diésel deben soportar
presiones mucho mayores que los de gasolina (basados en el ciclo Otto). Por
ello, son más pesados y robustos, lo que los encarece y limita su aplicabilidad a
su uso en automóviles (aunque hoy día ya son de uso común). Por ello,
tradicionalmente los motores diésel se han usado en sistemas donde su mayor
peso no es determinante. En el sector del transporte se usan en barcos y trenes,
y en la generación de energía se emplean en centrales de turbina de gas. Un
motor diésel de un barco o central, puede ser gigantesco.
2.7.3. Ciclo Brayton.
El ciclo Brayton describe el comportamiento ideal de un motor de turbina de gas,
como los utilizados en las aeronaves.
En este proceso se produce una admisión de aire frío desde el exterior Este aire
es conducido hacia la cámara de combustión, donde se inyecta combustible, que
calienta el aire de la cámara. Al expandirse, mueve la turbina y finalmente es
expulsado al exterior. Dado que la compresión y la expansión son procesos muy
rápidos, se modelan como adiabáticas, ya que el aire no tiene tiempo de
intercambiar calor. La combustión, como en el caso del ciclo Diésel, se produce
por inyección desde el exterior, lo que se modela como un proceso a presión
constante.
En el escape, el aire enfriado (pero a una temperatura mayor que la inicial) sale
al exterior, situado a la presión atmosférica, como el de la entrada.
Técnicamente, este es un ciclo abierto ya que el aire que escapa no es el mismo
que entra por la boca de la turbina, pero dado que sí entra en la misma cantidad
y a la misma presión, se hace la aproximación de suponer una recirculación. En
este modelo el aire de salida simplemente cede calor al ambiente y vuelve a
entrar por la boca ya frío. En el diagrama pV esto corresponde a un enfriamiento
a presión constante.
Existen de hecho motores de turbina de gas en los que el fluido efectivamente
recircula y solo el calor es cedido al ambiente. Para estos motores, el modelo del
ciclo de Brayton ideal es más aproximado que para los de ciclo abierto.
El rendimiento de un ciclo Brayton ideal es
2.7.4. Ciclo Stirling.
Un ciclo de Stirling es una versión idealizada de lo que ocurre en un motor de
Stirling.
En su versión más simple, este ciclo está formado por cuatro pasos:
A→B Se comprime el gas de forma isoterma. Esto corresponde a un tramo de
hipérbola correspondiente a la temperatura indicada.
B→C Se calienta el gas manteniendo fijado su volumen. Gráficamente, es una
línea vertical entre las dos isotermas.
C→D Se expande el gas a temperatura constante hasta que vuelve a su volumen
inicial. Otro arco de hipérbola ahora recorrido hacia volúmenes crecientes.
D→A Se enfría el gas manteniendo constante su volumen hasta que su
temperatura vuelve a ser la inicial. Es un tramo vertical hacia abajo, cerrando el
ciclo.
En este proceso se absorbe calor en el calentamiento a volumen constante y en
la expansión isoterma, y se absorbe en los otros dos.
Un refinamiento del ciclo de Stirling es el siguiente. El calor que es liberado en el
foco frío no puede reutilizarse para calentar el gas en el foco caliente, ya que ello
supondría un flujo de calor del foco frío al caliente, lo que va en contra
del segundo principio de la termodinámica. Sin embargo, no ocurre lo mismo con
el gas liberado en el enfriamiento isócoro. En este caso, el gas pasa por todas
las temperaturas entre digamos 1200 K y 300 K, cediendo calor gradualmente.
En el calentamiento isócoro ocurre el proceso inverso: el gas pasa gradualmente
desde los 300 K a los 1200 K, absorbiendo calor. En principio, el calor liberado
en el enfriamiento puede reutilizarse en el calentamiento. El calor liberado
cuando el gas pasa por 500 K en la bajada se entrega a otra cámara en la cual
hay gas a 500 K en la subida. Puesto que las dos temperaturas son iguales, no
se viola el segundo principio de la termodinámica. Este proceso se denomina
regeneración y se consigue mediante un intercambiador de calor.
En un ciclo de Stirling con regeneración, todo el calor se absorbe a la
temperatura del foco caliente, TC, y todo el calor se cede a la temperatura del
foco frío, TF. Por ello, su rendimiento es el mismo que el de una máquina de
Carnot que opere entre las temperaturas extremas.
Un ciclo de Stirling real dista mucho de este modelo. Una medida de la evolución
de la presión y la temperatura en un motor de Stirling produce figuras mucho más
suavizadas en las que la forma del ciclo es aproximadamente elíptica.
2.8. Comparación de los ciclos ideales con los ciclos reales.
Entre el ciclo indicado y el ciclo teórico correspondiente existen diferencias
sustanciales tanto en la forma del diagrama como en los valores de temperaturas
y presiones.
La diferencia de forma consiste en un perfil distinto en las curvas de expansión
y compresión, en la sustitución de los trazos rectilíneos de introducción y
sustracción del calor por trazos curvos y el redondeamiento de los ángulos
agudo. Las causas de tales diferencias se fundan en las siguientes razones:
Perdidas de calor. En el ciclo teórico son nulas, pero bastante sensibles,
por el contrario, en el ciclo real. Como el cilindro esta refrigerado para
asegurar el buen funcionamiento del pistón, una cierta parte de calor del
fluido se transmite a las paredes. Las líneas de compresión y expansión
no son, por consiguiente, adiabáticas, sino poli trópicas, con exponente n,
diferente de k. Como el fluido experimenta una pérdida de calor se tiene
evidentemente: para la expansión, n>k, y para la compresión.
Combustión no instantánea. En el ciclo teórico, se supone que la
combustión se realiza a volumen constante; es, por tanto, instantánea; en
el ciclo real, por el contrario, la combustión dura un cierto tiempo. Si el
encendido tuviese lugar justamente en el P.M.S., la combustión ocurriría
mientras el pistón se aleja de dicho punto, y el valor de la presión sería
inferior al previsto, con la correspondiente perdida de trabajo útil.Por ello
es necesario anticipar el encendido de forma que la combustión pueda
tener lugar, en su mayor parte, cuando el pistón se encuentra en la
proximidad del P.M.S. Esto produce un redondeamiento de la línea teórica
2-3 de introducción del calor y, por tanto, una perdida de trabajo útil
representada por el área B. Pero esta perdida resulta de cuantía bastante
menor de la que se tendría sin adelantar el encendido.
Tiempo de abertura de la válvula de escape. En el ciclo teórico también
habíamos supuesto que la sustracción de calor ocurría instantáneamente
Tiempo de apertura de la válvula de escapeen el P.M.I En el ciclo real la
sustracción de calor tiene lugar en un tiempo a que una parte de los gases
salgan del cilindro antes de que el pistón alcance el P.M.I. de manera que
su presión descienda cerca del valor de la presión exterior al comienzo de
la carrera de expulsión. Este hecho provoca una perdida de trabajo útil
representada por el arrea C, perdida que es, sin embargo, menor que la
que se tendría sin el adelanto de la abertura de la válvula de escape.
Las causas de las diferencias en los valores de la presión y temperatura máxima
son:
Aumento de los calores específicos del fluido con la temperatura. Como
ya sabemos, tanto el calor especifico a presión constante cp como el
correspondiente a volumen constante cv, de un gas real, crecen con la
temperatura, pero de tal forma que su diferencia permanece constante, es
decir, cp - cv = AR; por consiguiente, al aumentar la temperatura
dismunuye el valor de la relación k = cp / cv. De lo cual se infiere que los
valores de la presión y la temperatura máximas resultan siempre inferiores
a las que se alcanzarían en el caso en que los calores específicos
permanecieron constantes al variar la temperatura. Este hecho se toma
en consideración también al trazar el ciclo teórico del aire; pero, en el caso
real, los productos de la combustión tienen calores específicos mayores
que el aire, y, por tanto, los valores de la presión y de la temperatura
máxima son, en el ciclo real, inferiores a los correspondientes al ciclo
teórico. Por esta razón, la superficie y el rendimiento térmico resultan
disminuidos.
Disociación en la combustión. Los productos de la combustión son
esencialmente CO2 y H2O, además de otros compuestos, tales como CO,
H2 y O2. La disociación de estos productos es una reacción que se lleva
a cabo con la absorción de calor, la temperatura máxima alcanzable es
menor y se pierde una cierta cantidad de trabajo. Pero dado que la
temperatura disminuye durante la expansión, se produce un retroceso en
la reacción de disociación. En consecuencia, sobreviene en esta fase una
parcial reasociacion con desarrollo de calor. Desciende el valor del
exponente de la poli trópica de expansión -el cual debería ser mayo que
k por las pérdidas de calor a través de las paredes del cilindro- y se
aproxima al de la poli trópica de compresión; por ello, se consigue una
parcial recuperación del trabajo antes perdido. El ciclo real presenta, por
último, otra diferencia importante al compararlo con el ciclo teórico;
durante la carrera de aspiración, la presión en el cilindro es inferior a la
que se tiene durante la carrera de escape. Salvo casos particulares, en el
decurso de la aspiración, la presión resulta inferior a la atmosférica,
mientras que durante el escape es superior. Se crea, por tanto, en el
diagrama indicado una superficie negativa (D, en la figura), que
corresponde al trabajo perdido. El esfuerzo realizado por el motor para
efectuar la aspiración y el escape se llama trabajo de bombeo y esta, por
lo general, comprendido en el trabajo perdido por rozamientos.
Bibliografía
Cengel, Y. A. (2012,2009). termodinamica. Mexico D.F.: McGrawHill.
Inmaculada Fernandez Diego, A. R. (2008). centrales de generacion de energia
electrica. Cantabria, España: Universidad de Cantabria.
Jaramillo, O. (03 de 05 de 2007). CIE. Obtenido de
http://www.cie.unam.mx/~ojs/pub/Termodinamica/node41.html
Marta Muñoz Dominguez, A. J. (2014). Maquinas Termicas. Madrid, España:
Universidad nacional de educacion a distancia.
sevilla, U. d. (02 de 03 de 2017). Maquinas termicas. Obtenido de Laplace web
site :
http://laplace.us.es/wiki/index.php/M%C3%A1quinas_t%C3%A9rmicas_(
GIE)#Ciclo_Otto
También podría gustarte
- Amef CalderaDocumento7 páginasAmef CalderaKevin FloresAún no hay calificaciones
- Sistemas Egr y SCR en Motor Scania DieselDocumento25 páginasSistemas Egr y SCR en Motor Scania DieselJob Esp100% (1)
- Ejemplo de Reglamento Interior de TrabajoDocumento9 páginasEjemplo de Reglamento Interior de TrabajostereofishAún no hay calificaciones
- Samuel Campusanotarea5Documento8 páginasSamuel Campusanotarea5Aileen N. HenríquezAún no hay calificaciones
- CiclosDocumento9 páginasCiclosatilio martinez0% (1)
- Trabajo Termo IIDocumento9 páginasTrabajo Termo IIjorgeAún no hay calificaciones
- Ciclo de BraytonDocumento7 páginasCiclo de BraytonAlex LumbardoAún no hay calificaciones
- Ciclo OttoDocumento16 páginasCiclo OttoEDSON JOAO MARTINEZ CARVAJAL100% (1)
- Ciclo Otto y DieselDocumento8 páginasCiclo Otto y DieselErick Gregorio Colina MarinAún no hay calificaciones
- Ejercicios Dinamica de Maquinaria Unidad 1Documento7 páginasEjercicios Dinamica de Maquinaria Unidad 1Alejandro Figueroa MorenoAún no hay calificaciones
- Resumen Cap 9 CengelDocumento9 páginasResumen Cap 9 CengelEduardo de la Rosa100% (1)
- Lista Cotejo - Areas Funcionales EmpresaDocumento1 páginaLista Cotejo - Areas Funcionales EmpresaAlejandro Figueroa Moreno100% (1)
- Lista Cotejo - Areas Funcionales EmpresaDocumento1 páginaLista Cotejo - Areas Funcionales EmpresaAlejandro Figueroa Moreno100% (1)
- Implosión de Las CalderasDocumento9 páginasImplosión de Las Calderasfranshesca100% (2)
- Resumen Capítulo 9 - Termodinámica de CegelDocumento14 páginasResumen Capítulo 9 - Termodinámica de CegelXimena Campos100% (1)
- Folleto Lofis + Econ.Documento39 páginasFolleto Lofis + Econ.Roy Perez-AcuñaAún no hay calificaciones
- Informe 1 Codigo HuffmanDocumento11 páginasInforme 1 Codigo HuffmanMiguel RodriguezAún no hay calificaciones
- Portafolio Termodinamica (II Parcial)Documento22 páginasPortafolio Termodinamica (II Parcial)Roger ChavezAún no hay calificaciones
- Pia - Termodinamica FinalDocumento10 páginasPia - Termodinamica FinalAmabely CisnerosAún no hay calificaciones
- Informe Cliclo OttoDocumento14 páginasInforme Cliclo OttoJoseph Heras100% (2)
- Ciclos TermodinamicosDocumento22 páginasCiclos TermodinamicosJuan Carlos LiñanAún no hay calificaciones
- Ciclo DualDocumento7 páginasCiclo DualALEXIS OMAR GRIJALVA NACEVILLAAún no hay calificaciones
- Motores de Combustión InternaDocumento4 páginasMotores de Combustión InternaDiegoAún no hay calificaciones
- 1.4 Tema Ciclos Termodinamicos OkDocumento16 páginas1.4 Tema Ciclos Termodinamicos OkJuanAún no hay calificaciones
- Ciclo de OttoDocumento19 páginasCiclo de OttoPepeAún no hay calificaciones
- Ciclo OttoDocumento5 páginasCiclo OttoJulio CesarAún no hay calificaciones
- Ciclo de BraytonDocumento11 páginasCiclo de BraytonMartin José DiazAún no hay calificaciones
- Mi Parte de Trabajo Termico InacapDocumento6 páginasMi Parte de Trabajo Termico InacapJose Miguel Bastias AlvarezAún no hay calificaciones
- Ciclo DieselDocumento12 páginasCiclo Dieselyussif el khechenAún no hay calificaciones
- Trabajo Taller DieselDocumento24 páginasTrabajo Taller DieselAndreiita HernandezAún no hay calificaciones
- 2.7 y 2.8Documento9 páginas2.7 y 2.8Sergio ElizaldeAún no hay calificaciones
- Ciclo TermodinamicoDocumento7 páginasCiclo TermodinamicoAlex LumbardoAún no hay calificaciones
- Ciclo de OttoDocumento22 páginasCiclo de OttoJOSELYN AVILA GARCIAAún no hay calificaciones
- Ciclo OttoDocumento11 páginasCiclo OttoRuben LunaAún no hay calificaciones
- Practica Equipos TermicosDocumento7 páginasPractica Equipos TermicosRaul CarbajalAún no hay calificaciones
- Trabajo Grupal de TermodinamicaDocumento11 páginasTrabajo Grupal de Termodinamicaluis sandovalAún no hay calificaciones
- 2do Cuestionario TermoDocumento7 páginas2do Cuestionario TermoMiguel JiménezAún no hay calificaciones
- Plantas AgasDocumento11 páginasPlantas AgasPedro CollanteAún no hay calificaciones
- ForoDocumento7 páginasForoDaniel Valdespino DiazAún no hay calificaciones
- Ciclo de Aire NormalDocumento12 páginasCiclo de Aire NormalHernando Garcia100% (2)
- Ciclo de Motores de CombustiónDocumento8 páginasCiclo de Motores de Combustiónjezmar lamontAún no hay calificaciones
- Valeria Jaramillo-Tomas Pastor TermodinamicaDocumento7 páginasValeria Jaramillo-Tomas Pastor TermodinamicaDaniela GrandaAún no hay calificaciones
- 3.motores de Combustion InternaDocumento19 páginas3.motores de Combustion Internajosue maldonadoAún no hay calificaciones
- 1.4 Ciclo CombinadoDocumento10 páginas1.4 Ciclo CombinadoEnrique FanesAún no hay calificaciones
- Ciclo Otto - Ciclo Diesel - Trujillo Jara Denny - TermodinamicaDocumento11 páginasCiclo Otto - Ciclo Diesel - Trujillo Jara Denny - TermodinamicaDENNYAún no hay calificaciones
- Asignación 2Documento24 páginasAsignación 2Eliana pico100% (1)
- Ciclo JouleDocumento9 páginasCiclo JouleRusbel SantesAún no hay calificaciones
- Tarea Ciclos Stirling, Ericsson y DieselDocumento30 páginasTarea Ciclos Stirling, Ericsson y DieselMario O. M. Ordaz83% (6)
- 3.2 Motor OttoDocumento11 páginas3.2 Motor OttoAngel Lopes cupilAún no hay calificaciones
- Ciclo BraytonDocumento11 páginasCiclo BraytonDany EmersonAún no hay calificaciones
- El Ciclo BraytonDocumento21 páginasEl Ciclo BraytonLeonel Suarez AlejandroAún no hay calificaciones
- 1.-Maquinas Termicas de PotenciaDocumento18 páginas1.-Maquinas Termicas de PotenciaDIEGO PEREZAún no hay calificaciones
- Proyecto Motores de Combustion Interna y Ciclo OttoDocumento25 páginasProyecto Motores de Combustion Interna y Ciclo OttoFran RuizAún no hay calificaciones
- Avance Del Trabajo Diego Uribe Ciclo Otto - Ciclo DieselDocumento4 páginasAvance Del Trabajo Diego Uribe Ciclo Otto - Ciclo DieselDiego UribeAún no hay calificaciones
- Ciclo OttoDocumento4 páginasCiclo OttoMaFAún no hay calificaciones
- Ciclo de OttoDocumento10 páginasCiclo de OttoLeiton Alvin Ramos VillenaAún no hay calificaciones
- Algunos Ciclos TermodinámicasDocumento5 páginasAlgunos Ciclos TermodinámicasJoséHernándezAún no hay calificaciones
- Proceso CíclicoDocumento4 páginasProceso CíclicoMarií JhosepAún no hay calificaciones
- Ciclo TermodinámicoDocumento17 páginasCiclo TermodinámicoPaola GutierrezAún no hay calificaciones
- Ciclos Sistema de BombeoDocumento7 páginasCiclos Sistema de BombeoDaniel MolinaAún no hay calificaciones
- Unidad 3 Fisica - CiclosDocumento19 páginasUnidad 3 Fisica - CiclosjoeelAún no hay calificaciones
- Ciclos Termodinamicos de PotenciaDocumento19 páginasCiclos Termodinamicos de Potenciayoselyn bruzualAún no hay calificaciones
- Ciclos de PotenciaDocumento35 páginasCiclos de Potenciafidias ramirezAún no hay calificaciones
- Ciclo TermodinámicoDocumento3 páginasCiclo TermodinámicoVincent EscalaAún no hay calificaciones
- Ciclos TermodinamicosDocumento12 páginasCiclos TermodinamicosJade ChuiAún no hay calificaciones
- Actividad 5 Analizando Otros Ciclos TermodinámicosDocumento20 páginasActividad 5 Analizando Otros Ciclos TermodinámicosYovany CastilloAún no hay calificaciones
- Bitacora de MantenimientoDocumento12 páginasBitacora de MantenimientoAlejandro Figueroa MorenoAún no hay calificaciones
- Manual Termografo EspañolDocumento274 páginasManual Termografo EspañolAlejandro Figueroa MorenoAún no hay calificaciones
- Control Sistema de Cintas TransportadorasDocumento2 páginasControl Sistema de Cintas TransportadorasAlejandro Figueroa MorenoAún no hay calificaciones
- Control Sistema de Cintas TransportadorasDocumento2 páginasControl Sistema de Cintas TransportadorasAlejandro Figueroa MorenoAún no hay calificaciones
- Terre NoDocumento2 páginasTerre NoAlejandro Figueroa MorenoAún no hay calificaciones
- Modelo CanvasDocumento1 páginaModelo CanvasAlejandro Figueroa MorenoAún no hay calificaciones
- Expo-1 2Documento4 páginasExpo-1 2Alejandro Figueroa MorenoAún no hay calificaciones
- LUBRICACIONDocumento23 páginasLUBRICACIONAlejandro Figueroa MorenoAún no hay calificaciones
- Sin Anuario PDFDocumento478 páginasSin Anuario PDFAlejandro Figueroa MorenoAún no hay calificaciones
- Cap2 PLCDocumento29 páginasCap2 PLCMarco SingañaAún no hay calificaciones
- Puntos Estudio Tecnico B Plan de NegociosDocumento5 páginasPuntos Estudio Tecnico B Plan de NegociosAlejandro Figueroa MorenoAún no hay calificaciones
- Mercado Potencial y MetaDocumento1 páginaMercado Potencial y MetaAlejandro Figueroa MorenoAún no hay calificaciones
- Manual de Operación ENEIT 2017Documento33 páginasManual de Operación ENEIT 2017Alejandro Figueroa MorenoAún no hay calificaciones
- Representación de Un AutomatismoDocumento6 páginasRepresentación de Un AutomatismoAlejandro Figueroa MorenoAún no hay calificaciones
- Presentación VentiladoresDocumento10 páginasPresentación VentiladoresAlejandro Figueroa MorenoAún no hay calificaciones
- Vicente Del Angel Alfredo: 2.1. Condensadores y Sistemas de AlimentaciónDocumento6 páginasVicente Del Angel Alfredo: 2.1. Condensadores y Sistemas de AlimentaciónAlejandro Figueroa MorenoAún no hay calificaciones
- Diagrama Motor 2 GirosDocumento1 páginaDiagrama Motor 2 GirosAlejandro Figueroa MorenoAún no hay calificaciones
- Evolución y Taxonomía Del MantenimientoDocumento13 páginasEvolución y Taxonomía Del MantenimientoAlejandro Figueroa MorenoAún no hay calificaciones
- Reporte de LecturaDocumento2 páginasReporte de LecturaAlejandro Figueroa MorenoAún no hay calificaciones
- Visita Industrial Termoeléctrica Juan de Dios BatízDocumento1 páginaVisita Industrial Termoeléctrica Juan de Dios BatízAlejandro Figueroa MorenoAún no hay calificaciones
- Reporte de LecturaDocumento2 páginasReporte de LecturaAlejandro Figueroa MorenoAún no hay calificaciones
- Calculo de AcuadoresDocumento29 páginasCalculo de AcuadoresDiogenes Manuel Bustan JaramilloAún no hay calificaciones
- Control de NivelDocumento8 páginasControl de NivelAlejandro Figueroa MorenoAún no hay calificaciones
- Problema de Fluidos IncompresiblesDocumento2 páginasProblema de Fluidos IncompresiblesAlejandro Figueroa MorenoAún no hay calificaciones
- Problemas de Conservación Del Momento AngularDocumento5 páginasProblemas de Conservación Del Momento AngularPedro Antonio NeiraAún no hay calificaciones
- 5º Cartilla - MatemáticaDocumento26 páginas5º Cartilla - MatemáticaCesar MamaniAún no hay calificaciones
- Clase 6 Tecins 21Documento24 páginasClase 6 Tecins 21Walter GuadronAún no hay calificaciones
- Tesis Jairo WilliansDocumento111 páginasTesis Jairo WilliansLuisJoseAmundarayAún no hay calificaciones
- Desarrolo y Analis Tecnico de Un Nuevo Fluidi de Perforacion Base Agua de Mar UNIVERSIDAD - NACIONAL - AUTONOMA - DE - MEXICO PDFDocumento124 páginasDesarrolo y Analis Tecnico de Un Nuevo Fluidi de Perforacion Base Agua de Mar UNIVERSIDAD - NACIONAL - AUTONOMA - DE - MEXICO PDFWilliam RocaAún no hay calificaciones
- A PDFDocumento34 páginasA PDFYUBEL NUMAN LOPEZ VASQUEZAún no hay calificaciones
- Formato Hoja de Vida PC PDFDocumento12 páginasFormato Hoja de Vida PC PDFRafael Mauricio Pérez CamposAún no hay calificaciones
- Revit Clase 1 24.02.20Documento19 páginasRevit Clase 1 24.02.20Jose Carlos0% (2)
- Movimiento Circular Uniforme para El AlumnoDocumento6 páginasMovimiento Circular Uniforme para El AlumnoMendel CcdAún no hay calificaciones
- Proyecto Final Operativa 2Documento29 páginasProyecto Final Operativa 2Jorge MirandaAún no hay calificaciones
- Diseño Por FlexionDocumento24 páginasDiseño Por FlexionMigue Gomez VazquezAún no hay calificaciones
- 1ºeso AlumnoDocumento100 páginas1ºeso AlumnoAlejandro vaquerizoAún no hay calificaciones
- "Power Drive Xceed" para Optimizar La Velocidad de Penetración en El Tramo 9 5/8 Del Pozo Surubí C-8Documento146 páginas"Power Drive Xceed" para Optimizar La Velocidad de Penetración en El Tramo 9 5/8 Del Pozo Surubí C-8Carmen Teresa Medrano100% (1)
- WinFlume Manual en EspanolDocumento49 páginasWinFlume Manual en Espanolindap2009Aún no hay calificaciones
- Radiofonía, Por Jacques Lacan, París, 1970, en Psicoanálisis, Radiofonía & Televisión, Por Jacques Lacan, Ed. Anagrama, 1977Documento73 páginasRadiofonía, Por Jacques Lacan, París, 1970, en Psicoanálisis, Radiofonía & Televisión, Por Jacques Lacan, Ed. Anagrama, 1977urpian publiAún no hay calificaciones
- Biomecánica Del Músculo Esquelético: Alejandro Gómez RodasDocumento53 páginasBiomecánica Del Músculo Esquelético: Alejandro Gómez RodasortegapaulaAún no hay calificaciones
- Problema Conversiones de InterésDocumento7 páginasProblema Conversiones de InterésSandra Ximena Solarte Lasso100% (1)
- I-Masas, Rigidez y Periodos de EdificiosDocumento47 páginasI-Masas, Rigidez y Periodos de EdificiosRicardo antonioAún no hay calificaciones
- PRACTICA N PLATEL Y ASQUELMINTOSDocumento54 páginasPRACTICA N PLATEL Y ASQUELMINTOSJUAN SANDOVAL FLORESAún no hay calificaciones
- Laberito HidraulicoDocumento5 páginasLaberito Hidraulicosanlorenita-18Aún no hay calificaciones
- NCh-ISO 22117-2013-043 PDFDocumento41 páginasNCh-ISO 22117-2013-043 PDFSandra RamirezAún no hay calificaciones
- Línea Del TiempoDocumento3 páginasLínea Del TiempoNeirovis TejadaAún no hay calificaciones
- EstabilidadtaludDocumento85 páginasEstabilidadtaludRiickardo SkateAún no hay calificaciones
- Actividad Del AguaDocumento11 páginasActividad Del AguaALMA PAULINA BARAJAS CASTAÑEDAAún no hay calificaciones
- Taller No 3Documento9 páginasTaller No 3Camilo Ochoa OrtizAún no hay calificaciones
- Anexos de CálculosDocumento49 páginasAnexos de CálculosMaria ElenaAún no hay calificaciones