Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Producto de Solubilidad
Cargado por
Carolina Acevedo CordobaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Producto de Solubilidad
Cargado por
Carolina Acevedo CordobaCopyright:
Formatos disponibles
PRODUCTO DE SOLUBILIDAD
Los sistemas en equilibrio se pueden dividir en dos categoras: equilibrio homogneo, donde los
reaccionantes y productos estn en la misma fase y equilibrio heterogneo, donde esta presente
ms de una fase (slido, lquido o gas), por ejemplo, una solucin saturada de cloruro de plata que
contiene AgCl slido. En este caso, el precipitado de AgCl est en contacto con el lquido flotante el
cual est saturado con los iones del precipitado, Ag
+
y Cl
-
. La ecuacin de equilibrio es:
AgCl
(s)
=Ag
+
(en solucin)+Cl
-
(en solucin)
El smbolo (s) designa a un slido. En la superficie del precipitado, lo iones Ag
+
y Cl
-
estn
constantemente viajando hacia la solucin y volvindose a precipitar. Puesto que este es un
proceso de equilibrio, se puede aplicar la expresin de equilibrio.
A diferencia del equilibrio homogneo, la adicin de ms AgCl slido no causa cambio alguno en la
concentracin de iones plata en solucin.
En las soluciones saturadas existen equilibrios dinmicos siempre que est presente algo de
soluto no disuelto. Las velocidades de disolucin y precipitacin son iguales. Cuando transcurre
tiempo suficiente para que se alcance el equilibrio, y no se ha modificado la temperatura, las
concentraciones permanecen constantes, las ecuaciones para equilibrios entre slidos ligeramente
solubles e iones en solucin acuosa usualmente se escriben indicando el slido ligeramente
soluble a la izquierda y los iones en el lado derecho de la ecuacin:
CaF
2
(s)Ca
+2
(ac)+(2F)
-1
(ac)
La expresin para la constante de equilibrio para la anterior ecuacin es:
K
c
=(C
a
+2
)(F
-1
)
-2
Como se incluye la concentracin constante del slido puro en el valor de K, esta ltima es igual al
producto de las concentraciones de los iones en solucin (elevado cada uno a la potencia del
coeficiente en la ecuacin balanceada) y se llama constante del producto de solubilidad o
producto de solubilidad y se representa por el smbolo K
PS
.
Con lo anterior se puede pensar que la interrelacin de la solubilidad y el producto de solubilidad
permite calcular ambos parmetros a partir de los datos de alguno de ellos.
Hidrlisis de Sales
En trminos bien amplios, hidrlisis significa la reaccin qumica de cualquier especie con el agua.
Los cidos y las bases no son las nicas sustancias que alteran el equilibrio de los iones OH
-
y H
+
en el agua. Se ha encontrado que cuando ciertas sales se colocan en el agua la disolucin puede
volverse cida o bsica. Especficamente este proceso se llama hidrlisis y generalmente se
aplica a la reaccin entre el agua y las bases conjugadas (iones negativos) de los cidos dbiles o
los cidos conjugados (iones positivos) de las bases dbiles.
También podría gustarte
- Los Monstruos y El Gimnasio - Alberto GalganoDocumento86 páginasLos Monstruos y El Gimnasio - Alberto GalganoAida RubyAún no hay calificaciones
- Equilibrio HomogéneoDocumento9 páginasEquilibrio HomogéneoyeimiAún no hay calificaciones
- Catalogo Motoniveladora 140m CaterpillarDocumento24 páginasCatalogo Motoniveladora 140m CaterpillarRuben Chugnas Morales71% (7)
- Factor ReumatoideoDocumento2 páginasFactor ReumatoideoJazmin Magaña100% (1)
- Historia de La CalidadDocumento63 páginasHistoria de La CalidadAdrian CZAún no hay calificaciones
- Evaluación de Entrada - S5 - Aplicaciones Del Cálculo y Estadística - C21 2do E-A - C21 2do F-A-ADocumento3 páginasEvaluación de Entrada - S5 - Aplicaciones Del Cálculo y Estadística - C21 2do E-A - C21 2do F-A-Aeduardo lopezAún no hay calificaciones
- Simulador GasesDocumento4 páginasSimulador GasesNoah MarcosAún no hay calificaciones
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- Problemas de Instrumentacion Y Control de Procesos - Oswaldo D MontbrunDocumento32 páginasProblemas de Instrumentacion Y Control de Procesos - Oswaldo D MontbrunEdilberto MJ100% (1)
- Laboratorio de Ciencias Experimentales-Pearson PDFDocumento56 páginasLaboratorio de Ciencias Experimentales-Pearson PDFLuis Alberto Rodríguez PeinadoAún no hay calificaciones
- Leonardo Polo - La Existencia CristianaDocumento323 páginasLeonardo Polo - La Existencia CristianaJuan Pablo 54100% (1)
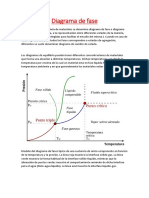
- Diagrama de FaseDocumento5 páginasDiagrama de FaseKevin Perez YalleAún no hay calificaciones
- CAMBIO DE DPS EN MEDIA TENSIÓN - EstudianteDocumento7 páginasCAMBIO DE DPS EN MEDIA TENSIÓN - EstudianteKamilo Aguirre100% (1)
- Reacciones Acuosas y EstequiometríaDocumento2 páginasReacciones Acuosas y EstequiometríaCarolina Acevedo CordobaAún no hay calificaciones
- Lengua Castellana y Literatura SintasisDocumento18 páginasLengua Castellana y Literatura SintasisdepasotraAún no hay calificaciones
- Equilibrio Quimico en Sistemas HeterogeneosDocumento3 páginasEquilibrio Quimico en Sistemas HeterogeneosFernanda DíazAún no hay calificaciones
- Acidez y BasicidadDocumento18 páginasAcidez y BasicidadClaudiaAún no hay calificaciones
- 0.TGL UD4 Tecnicas PotenciometricasDocumento15 páginas0.TGL UD4 Tecnicas PotenciometricasalejandragarciagmmAún no hay calificaciones
- "PRACTICA 13 - GAV17 - 2015Abril28.PDF" (2) .CompressedDocumento15 páginas"PRACTICA 13 - GAV17 - 2015Abril28.PDF" (2) .CompressedJimenez Mancilla DanteAún no hay calificaciones
- Equilibrio Solubilidad PrecipitacionDocumento13 páginasEquilibrio Solubilidad PrecipitacionVivianaPerdomoAún no hay calificaciones
- Producto de SolubilidadANNIEDocumento53 páginasProducto de SolubilidadANNIERicardo SevillanoAún no hay calificaciones
- Sistemas AmortiguadoresDocumento7 páginasSistemas AmortiguadoresGaby NavidadAún no hay calificaciones
- Equilibrio de SolubilidadDocumento3 páginasEquilibrio de SolubilidadEldon MataAún no hay calificaciones
- Guia EquilibrioDocumento6 páginasGuia EquilibrioDaniela Cardenas HigueraAún no hay calificaciones
- Equilibrio QuimicoDocumento5 páginasEquilibrio QuimicoJanis Nair Cutimbo guzmanAún no hay calificaciones
- Equilibrio QuímicoDocumento27 páginasEquilibrio QuímicoDenizithaAún no hay calificaciones
- Producto de solubilidadANNIEeeeDocumento19 páginasProducto de solubilidadANNIEeeeRicardo SevillanoAún no hay calificaciones
- Ion Comun InformeDocumento5 páginasIon Comun InformeMalu AisneAún no hay calificaciones
- AaaaaaguiaDocumento9 páginasAaaaaaguiawandaAún no hay calificaciones
- Equilibrio de Disoluciones 2Documento7 páginasEquilibrio de Disoluciones 2carlos mauricio pinzon suarezAún no hay calificaciones
- Equilibrio QuímicoDocumento14 páginasEquilibrio QuímicoCarlos Portilla ArciniegasAún no hay calificaciones
- 1.1 Equilibrio QuimicoDocumento37 páginas1.1 Equilibrio QuimicoLópez DiegoAún no hay calificaciones
- Equilibrio QuimicoDocumento53 páginasEquilibrio Quimicolaurabalady0% (1)
- Marco Teórico 4 To LABDocumento5 páginasMarco Teórico 4 To LABBruno GonzálezAún no hay calificaciones
- Capitulo Vi - Equilibrio Heterogeneo - S2022-IiDocumento7 páginasCapitulo Vi - Equilibrio Heterogeneo - S2022-IiWiller Manuel Aricari IbericoAún no hay calificaciones
- Equilibrio QuímicoDocumento6 páginasEquilibrio QuímicorodrigoAún no hay calificaciones
- Presentacion de Quimica Analitica - Equilibrio IonicoDocumento31 páginasPresentacion de Quimica Analitica - Equilibrio IonicoCris Rojas100% (1)
- Diagrama de Fases L-L-Parc Miscibles Fico Ii (27-10-22)Documento5 páginasDiagrama de Fases L-L-Parc Miscibles Fico Ii (27-10-22)DJ79Aún no hay calificaciones
- Capitulo Viii - Equilibrio Heterogeneo - S2023iDocumento7 páginasCapitulo Viii - Equilibrio Heterogeneo - S2023iAlessandra AspajoAún no hay calificaciones
- Constante de Disociacion H20Documento7 páginasConstante de Disociacion H20luceroAún no hay calificaciones
- Constante de Disociacion h20Documento7 páginasConstante de Disociacion h20MichaelAún no hay calificaciones
- Clasificacion de Reacciones QuimicasDocumento10 páginasClasificacion de Reacciones QuimicasClaudia Lucero PastorAún no hay calificaciones
- Reacciónes Quimica. Reacciónes HeterogeneasDocumento11 páginasReacciónes Quimica. Reacciónes HeterogeneasLeonel LopzAún no hay calificaciones
- Marco Teorico Constante Prodcuto de SolubiludadDocumento3 páginasMarco Teorico Constante Prodcuto de SolubiludadGuistin RomeroAún no hay calificaciones
- Teoría de La Disociación ElectrolíticaDocumento30 páginasTeoría de La Disociación Electrolíticanoel0% (1)
- Diagrama de Fase PuraDocumento6 páginasDiagrama de Fase Purajesus machinAún no hay calificaciones
- Marco Teorico Constante Prodcuto de SolubiludadDocumento4 páginasMarco Teorico Constante Prodcuto de SolubiludadGuistin RomeroAún no hay calificaciones
- Clase 7. El Equilibrio TermodinámicoDocumento16 páginasClase 7. El Equilibrio TermodinámicoAndres Felipe Prieto AlarconAún no hay calificaciones
- Practica Nc2ba 7 I 2014Documento8 páginasPractica Nc2ba 7 I 2014Brayan GuttierrezAún no hay calificaciones
- Clase 8 y 9 Unidad IV SolucionesDocumento33 páginasClase 8 y 9 Unidad IV SolucionesanaAún no hay calificaciones
- U11 - 2023-1C - Equilibrio de Solubilidad - BAtAlPOFDocumento22 páginasU11 - 2023-1C - Equilibrio de Solubilidad - BAtAlPOFmelulacontentaAún no hay calificaciones
- Guia Coloquios QGI 2019Documento90 páginasGuia Coloquios QGI 2019marcelo tu marceloAún no hay calificaciones
- Fuerza de Los Ácidos y de Las BasesDocumento7 páginasFuerza de Los Ácidos y de Las BasesdolorsAún no hay calificaciones
- Amortiguadores Ac PoliDocumento11 páginasAmortiguadores Ac PoliBRenyaz PanIbaAún no hay calificaciones
- CLase Equilibrio Acido-Base - pHIDocumento44 páginasCLase Equilibrio Acido-Base - pHIversion3Aún no hay calificaciones
- Clase Semana 2Documento41 páginasClase Semana 2Isaac JacomeAún no hay calificaciones
- Diagrama de FloodDocumento47 páginasDiagrama de FloodDilan Zamora100% (1)
- Equilibrio Químico 2018-2SDocumento41 páginasEquilibrio Químico 2018-2SNicholl Julieth Cortes CardonaAún no hay calificaciones
- Formulario Equilibrio y Acido - BaseDocumento4 páginasFormulario Equilibrio y Acido - BaseLuis VacaAún no hay calificaciones
- Guía Labotatorio 8-Titulaciones Acido Base y Mediciones Del PHDocumento11 páginasGuía Labotatorio 8-Titulaciones Acido Base y Mediciones Del PHPaula Nicole Aguilar FuqueneAún no hay calificaciones
- Guía Titulación Acido-BaseDocumento8 páginasGuía Titulación Acido-BaseSofia Ruiz RodríguezAún no hay calificaciones
- Apuntes de Fisicoquimica IIDocumento110 páginasApuntes de Fisicoquimica IIMary Espinosa100% (3)
- Diagrama de Fase y FisicoquimicaDocumento4 páginasDiagrama de Fase y FisicoquimicaRonal Vásquez BautistaAún no hay calificaciones
- Equilibrio Ionico1Documento54 páginasEquilibrio Ionico1panteraggAún no hay calificaciones
- Clase 15Documento2 páginasClase 15Daiana AlessiAún no hay calificaciones
- 4Documento51 páginas4alex210490Aún no hay calificaciones
- Práctica Nro 09.Documento14 páginasPráctica Nro 09.Luis Alberto Pacheco MarronAún no hay calificaciones
- Resumen Equilibrio QuimicoDocumento7 páginasResumen Equilibrio QuimicoJ Daniel YañezAún no hay calificaciones
- Taller 3 FisicoquimicaDocumento12 páginasTaller 3 Fisicoquimicaalf_1987Aún no hay calificaciones
- Hidrolisis SalesDocumento7 páginasHidrolisis Salesfrankys200Aún no hay calificaciones
- Unidad 7 Equilibrio QuímicoDocumento32 páginasUnidad 7 Equilibrio Químicofabian marzoliAún no hay calificaciones
- Capitulo 03Documento19 páginasCapitulo 03Carolina Acevedo CordobaAún no hay calificaciones
- Capitulo 05Documento21 páginasCapitulo 05Carolina Acevedo CordobaAún no hay calificaciones
- Capitulo 06Documento75 páginasCapitulo 06Carolina Acevedo CordobaAún no hay calificaciones
- Capitulo 04Documento29 páginasCapitulo 04Carolina Acevedo CordobaAún no hay calificaciones
- Capitulo 01Documento19 páginasCapitulo 01JORGE SILVAAún no hay calificaciones
- Capitulo 02Documento27 páginasCapitulo 02Carolina Acevedo CordobaAún no hay calificaciones
- Flujo de EgresosDocumento4 páginasFlujo de EgresosCarolina Acevedo CordobaAún no hay calificaciones
- Trabajo Grupal N 3 Semestre I 2014Documento3 páginasTrabajo Grupal N 3 Semestre I 2014Edrians CharmeloAún no hay calificaciones
- Presupuesto InicialDocumento1 páginaPresupuesto InicialCarolina Acevedo CordobaAún no hay calificaciones
- Presupuesto General TotalDocumento2 páginasPresupuesto General TotalCarolina Acevedo CordobaAún no hay calificaciones
- Presupuesto General UnitarioDocumento1 páginaPresupuesto General UnitarioCarolina Acevedo CordobaAún no hay calificaciones
- Presupuesto Por CapítulosDocumento1 páginaPresupuesto Por CapítulosCarolina Acevedo CordobaAún no hay calificaciones
- Los Costos FinancierosDocumento1 páginaLos Costos FinancierosCarolina Acevedo CordobaAún no hay calificaciones
- Presupuesto DetalladoDocumento1 páginaPresupuesto DetalladoCarolina Acevedo CordobaAún no hay calificaciones
- Elaboración de Presupuestos DetalladosDocumento1 páginaElaboración de Presupuestos DetalladosCarolina Acevedo CordobaAún no hay calificaciones
- Flujo de Caja y Costos FinancierosDocumento3 páginasFlujo de Caja y Costos FinancierosCarolina Acevedo CordobaAún no hay calificaciones
- Agrupación Del PresupuestoDocumento1 páginaAgrupación Del PresupuestoCarolina Acevedo CordobaAún no hay calificaciones
- El Presupuesto General TotalDocumento1 páginaEl Presupuesto General TotalCarolina Acevedo CordobaAún no hay calificaciones
- Teoría de ArrheniusDocumento1 páginaTeoría de ArrheniusCarolina Acevedo CordobaAún no hay calificaciones
- Ecuaciones de Nernst y Constante de EquilibrioDocumento1 páginaEcuaciones de Nernst y Constante de EquilibrioCarolina Acevedo CordobaAún no hay calificaciones
- Desagregación Del PresupuestoDocumento2 páginasDesagregación Del PresupuestoCarolina Acevedo CordobaAún no hay calificaciones
- TermoquímicaDocumento1 páginaTermoquímicaCarolina Acevedo CordobaAún no hay calificaciones
- Reacción QuímicaDocumento1 páginaReacción QuímicaCarolina Acevedo CordobaAún no hay calificaciones
- Se Pueden CalcularDocumento1 páginaSe Pueden CalcularCarolina Acevedo CordobaAún no hay calificaciones
- Sistemas de EquilibrioDocumento1 páginaSistemas de EquilibrioCarolina Acevedo CordobaAún no hay calificaciones
- SalesDocumento1 páginaSalesCarolina Acevedo CordobaAún no hay calificaciones
- Reacciones de Oxico ReducciónDocumento1 páginaReacciones de Oxico ReducciónCarolina Acevedo CordobaAún no hay calificaciones
- Propiedades de Las SolucionesDocumento4 páginasPropiedades de Las SolucionesCarolina Acevedo CordobaAún no hay calificaciones
- 6 Energias RenovablesDocumento21 páginas6 Energias RenovablesEric Aroldo CojulumAún no hay calificaciones
- Hans Georg GadamerDocumento1 páginaHans Georg Gadamerpatriciampro18Aún no hay calificaciones
- SMA SMC Corriente Inversa ESDocumento3 páginasSMA SMC Corriente Inversa ESEdgarAún no hay calificaciones
- Originalidad de Las Huellas DactilaresDocumento26 páginasOriginalidad de Las Huellas Dactilares899160Aún no hay calificaciones
- Prueba de LeveneDocumento2 páginasPrueba de LevenejulioAún no hay calificaciones
- Gestión de Talento Humano InvimaDocumento10 páginasGestión de Talento Humano InvimaAndrés SarmientoAún no hay calificaciones
- Taller N°1Documento3 páginasTaller N°1Fiorella Mendez MendozaAún no hay calificaciones
- CINTIA Inferencia ProbabilidadDocumento16 páginasCINTIA Inferencia ProbabilidadPablo AntinoriAún no hay calificaciones
- NMX J 308 1983Documento39 páginasNMX J 308 1983Moisés QuirozAún no hay calificaciones
- Planeación y Control de Inventarios de Una EmpresaDocumento11 páginasPlaneación y Control de Inventarios de Una EmpresaerickAún no hay calificaciones
- 2do Trabajo de BiofisicaDocumento6 páginas2do Trabajo de BiofisicaLyco Ceykhann Ramos67% (3)
- Procesos de Integración FronterizaDocumento12 páginasProcesos de Integración FronterizaAngie MoraAún no hay calificaciones
- Algoritmo de LevenshteinDocumento6 páginasAlgoritmo de LevenshteinDemian HiddenAún no hay calificaciones
- Desarrollo Epistemológico de EnfermeriaDocumento5 páginasDesarrollo Epistemológico de EnfermeriaMilly Lopez100% (1)
- 5 Historia en La Educación Básica Modelo EducativoDocumento38 páginas5 Historia en La Educación Básica Modelo EducativoEva Xochitl Corona LopezAún no hay calificaciones
- Deporte Selecciòn IvDocumento12 páginasDeporte Selecciòn Ivyamileth maschioAún no hay calificaciones
- Medicion de Ruido Con OsciloscopioDocumento3 páginasMedicion de Ruido Con OsciloscopioLolo fernandezAún no hay calificaciones
- Analisis LEGO SDocumento8 páginasAnalisis LEGO ScarlosAún no hay calificaciones
- Consolidado - ConcretoDocumento76 páginasConsolidado - ConcretoFabian FarfanAún no hay calificaciones
- Los Sistemas de Gestión Como Soporte de La EcoeficienciaDocumento2 páginasLos Sistemas de Gestión Como Soporte de La EcoeficienciaRoger Osorio GuillenAún no hay calificaciones