Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Análisis Gravimetrico Equipo7
Cargado por
Alexia Yazbetk Mejía CruzTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Análisis Gravimetrico Equipo7
Cargado por
Alexia Yazbetk Mejía CruzCopyright:
Formatos disponibles
INSTITUTO TECNOLÓGICO DE
CIUDAD MADERO
* por mi patria y por mi bien *
Quimica Analítica Equipo 7
2535 C • Beatriz
ANÁLISIS Medina
• Braulio
GRAVIMETRICO Morales
Profa: Amanda Jimenez Torres • Yazbetk
Mejía
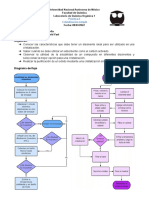
Método de precipitación química
◇ Pesada de la muestra o bien obtención de la solución
problema.
Etapas
◇ Disolución de la muestra.
◇ Búsqueda de un reactivo que haga precipitar el analito
apareciendo una sustancia poco soluble en el seno de la
disolución que contiene la muestra.
◇ Aislamiento de la sustancia insoluble mediante la
filtración.
◇ Determinación del peso de la sustancia aislada a través
de la balanza analítica.
Cálculo:
G. DE SUSTANCIA = FACTOR GRAVIMÉTRICO (F.G.) x PESO DEL PRECIPITADO (p.p)
Lo ideal es que el reactivo reaccione sólo con el analito para dar un sólido que
presente las siguientes propiedades:
solubilidad baja
No debe reaccionar con
(pérdidas por
los componentes de la
solubilidad sea
atmósfera
mínimas)
Fácilmente filtrable y Su composición ha de
lavable hasta la ser conocida después
eliminación de de la calcinación o
contaminantes desecación
Tamaño de las partículas de los
precipitados.
Es la facilidad para filtrar.
Depende de la composición del precipitado y de la composición
existente durante su formación, a mayor tamaño de partículas mejor
filtrado, cuando el tamaño de la partícula es pequeño presenta
velocidad de filtración baja.
Clasificación de suspensiones
Coloidal: (10-6 a 104 mm) Cristalina:
imposible de filtrar. varias décimas de milímetro.
Viene influenciado por la temperatura (a mayor temperatura
mayorsolubilidad), solubilidad del precipitado en medio en que se
forma, concentración delos reaccionantes, velocidad a la que se
mezcla.
Destruccion de materia Vía seca.
• Introducir la muestra en una cápsula de porcelana y se calienta
progresivamentehasta que desaparece el residuo carbonoso.
• Horno de mufla: la materia orgánica arde originándose las
orgánica
cenizas negra, sesigue calentando hasta que se transforma en
blanca (significa que se destruyó) nosuperar la temperatura de
rojo sombra (500 - 550 °C).
• Existen reactivos que fijan a los productos para que si se
calienta a más de 500°C no se volatilizara: X, As, Sb, Hg, S,
etc.
• Se pueden utilizar oxidantes.
• Con las cenizas se prepara una disolución con HCl.
Destruccion de materia Vía húmeda.
• Es la cocción. En un recipiente abierto (matráz Kendal) se
introduce la muestra sólida y se utilizan ácidos (H2SO4, HNO3,
HF, HCIO4, H3PO4) fuertes y concentrados,el poder oxidante de
los ácidos es cuando son concentrados, se utiliza mezclando.
orgánica
• Cuando una muestra tiene un tipo de materia orgánica fácil de
oxidar se utiliza una mezcla sulfonítrica de reductores fuertes
origina explosiones violentas, se utiliza primero un ácido menos
oxidante y se deja digerir la muestra poco a poco elevando
latemperatura en el ácido menos oxidante y si con eso no se
consigue la destrucción dela materia orgánica no se puede
utilizar HCIO4, sólo se puede utilizar para terminar la
disolución (de color amarilla).
• En recipiente cerrado, en un reactor a presión de teflón con
carcasa de acero ydespués se lleva al horno, la digestión es más
rápida y con menos reactivos. También se emplean microondas,
admite cantidades pequeñas de muestras y de volúmenes de
disolvente.
Tipos de materia orgánica.
• Hidrátos de carbono, arden al aire y a baja temperatura.
• Grasas, arden a una temperatura de 350 °C, son difíciles de
destruir. Se evaporan, se filtran y se destruyen por vía seca.
• Proteínas, a 350 °C se descomponen quedando un residuo negro
carbonoso ypara destruirlas se eleva la temperatura. Con ácidos
oxidantes se puede llegar a hervirpara destruir al baño de agua o
de arena.
• Fosfátidos, ureas, ácidos biliales, ceras.
• Método intermedio: con H2SO4 se forma una masa porosa que se
utiliza comofundente.
• Desecación de la muestra.
Proceso general del Retirar por medio de estufas de
análisis cuantitativo. laboratorioa 110 °C. Introducirlo en
un desecador (cantidad de vapor de
agua constante, utilizandoreactivos
• Preparación previa. desecantes, como el CaSO4, CaCl2, sal
de sílice).
• Toma de muestra.
• Pesada. Con una exactitud de ± 0.1
• Examen de la muestra. miligramo en una balanza
deprecisión.
• División de la muestra.
• Disolver o disgregar.
• Ensayos vía seca. • Elección del método analítico a
utilizar.
• Análisis cualitativo (de • Cálculo y resultado final.
cationes, de aniones).
También podría gustarte
- Reporte 2. RecristalizacionDocumento13 páginasReporte 2. RecristalizacionGael VizcainoAún no hay calificaciones
- Recristalizacion PurificacionDocumento10 páginasRecristalizacion PurificacionAlexisBernalAún no hay calificaciones
- Laboratorio Recristalizacion UnmsmDocumento8 páginasLaboratorio Recristalizacion UnmsmElizabethVargasAún no hay calificaciones
- 2018 ASHRAE Handbook - Refrigeration SI PDF 51-75Documento25 páginas2018 ASHRAE Handbook - Refrigeration SI PDF 51-75Adrian Rentfleich100% (1)
- Investigacion 4Documento42 páginasInvestigacion 4JulioCesarLunaIbañezAún no hay calificaciones
- Problemas de Volumetría Por NeutralizaciónDocumento10 páginasProblemas de Volumetría Por NeutralizaciónAlexia Yazbetk Mejía Cruz50% (2)
- Lab 3 RecristalizacionDocumento8 páginasLab 3 RecristalizacionDavid AriasAún no hay calificaciones
- Practica 3 RecristalizacionDocumento14 páginasPractica 3 RecristalizacionNoly Alfaro100% (1)
- Cuestionario Práctica 2. Síntesis de 2,4-Dietoxicarbonil-3,5-DimetilpirrolDocumento2 páginasCuestionario Práctica 2. Síntesis de 2,4-Dietoxicarbonil-3,5-DimetilpirrolKaren SalasAún no hay calificaciones
- Aislamiento de CloroplastosDocumento8 páginasAislamiento de CloroplastosAngelica RestrepoAún no hay calificaciones
- GravimetriaDocumento30 páginasGravimetrianintai100% (2)
- Practica RecristalizacionDocumento10 páginasPractica RecristalizacionSantiago Sanchez0% (1)
- Inf.2 Purificación de Compuestos OrgánicosDocumento9 páginasInf.2 Purificación de Compuestos OrgánicosADRIANA ZAMBRANA SEMPERTEGUIAún no hay calificaciones
- Tipos de Tratamientos para Muestras Sólidas y LíquidasDocumento5 páginasTipos de Tratamientos para Muestras Sólidas y LíquidasFernando GonzálezAún no hay calificaciones
- 2355 Díaz Nayeli Molina Monserrat Quintero María Saguilán José CristalizaciónDocumento33 páginas2355 Díaz Nayeli Molina Monserrat Quintero María Saguilán José CristalizaciónNayeli DíazAún no hay calificaciones
- Métodos Gravimétricos de AnálisisDocumento46 páginasMétodos Gravimétricos de AnálisisRonaldo Cañas BarreiroAún no hay calificaciones
- Practica 3 OrganicaDocumento9 páginasPractica 3 OrganicaeliiiacevedoAún no hay calificaciones
- Recristalizacion Purificacion PDFDocumento11 páginasRecristalizacion Purificacion PDFMarco Perez SanchezAún no hay calificaciones
- Recristalizacion (Purificacion)Documento11 páginasRecristalizacion (Purificacion)Zkar Carbajal33% (3)
- Lab 3 RecristalizaciónDocumento8 páginasLab 3 Recristalización976021350Aún no hay calificaciones
- Informe Cristalizacion 2021-2Documento10 páginasInforme Cristalizacion 2021-2Rommy Silvia Aragon YquiseAún no hay calificaciones
- Informe 2 Quimica Organica N2Documento9 páginasInforme 2 Quimica Organica N2Gonzalo RondanAún no hay calificaciones
- 1345FIN v3Documento76 páginas1345FIN v3Estefany Garcia LeonAún no hay calificaciones
- Copia de Re Cristalización de Benzoína Con EtanolDocumento6 páginasCopia de Re Cristalización de Benzoína Con Etanolpato.ingrid23Aún no hay calificaciones
- GravimetriaDocumento18 páginasGravimetriaGabriel Alejandro Ceron CortesAún no hay calificaciones
- Seminario RecristalizaciónDocumento43 páginasSeminario RecristalizaciónAndresDuranAún no hay calificaciones
- Informe CristalizacionDocumento5 páginasInforme CristalizacionYulieth RamírezAún no hay calificaciones
- Gravimetria AlumnosDocumento34 páginasGravimetria AlumnosRaul CabreraAún no hay calificaciones
- Cristalizacion Practica 1Documento9 páginasCristalizacion Practica 1Victoria PerezAún no hay calificaciones
- RecristalizacionDocumento7 páginasRecristalizacionMiguel TorresAún no hay calificaciones
- Quimica Organica Practica 2 Cristalizacion SimpleDocumento3 páginasQuimica Organica Practica 2 Cristalizacion Simplemikichiko2349Aún no hay calificaciones
- RecristalizacionDocumento19 páginasRecristalizacionmiguelAún no hay calificaciones
- Pract 2 Cristalización 2Documento4 páginasPract 2 Cristalización 2ArbildoAún no hay calificaciones
- Práctica 3 CristalizaciónDocumento10 páginasPráctica 3 CristalizaciónNancy Correa50% (2)
- Anica GonzalesDocumento7 páginasAnica GonzalesFabiana Gonzales JaureguiAún no hay calificaciones
- PREPARACIÓN DE LA MUESTRA PARA EL ANÁLISIS (Presentacion)Documento11 páginasPREPARACIÓN DE LA MUESTRA PARA EL ANÁLISIS (Presentacion)Noemí Peláez MarínAún no hay calificaciones
- Cristalizacion Del Sulfato de CobreDocumento3 páginasCristalizacion Del Sulfato de CobreLeidy LadinoAún no hay calificaciones
- CristalizacionDocumento10 páginasCristalizacionmgutierrezgonzalez86241Aún no hay calificaciones
- Informe 02Documento10 páginasInforme 02Jesus Manuel CruzAún no hay calificaciones
- Kimberly QuimicaDocumento16 páginasKimberly QuimicaAnonymous wcGt91CGAún no hay calificaciones
- Informe 03 - QuímicaDocumento10 páginasInforme 03 - QuímicaAny MonteroAún no hay calificaciones
- Antecedentes Practica 2 OrganicaDocumento5 páginasAntecedentes Practica 2 OrganicaCesar OrozcoAún no hay calificaciones
- CristalizacionDocumento9 páginasCristalizacionAgnes AlaertsAún no hay calificaciones
- E1.Cuestionario Cristalización SimpleDocumento2 páginasE1.Cuestionario Cristalización SimpleLizeth Sanchez TorresAún no hay calificaciones
- Practica 3 RecristalizacionDocumento14 páginasPractica 3 RecristalizacionKathia Yudith Requejo Peralta100% (1)
- Informe Recristalización Del Ácido BenzoicoDocumento3 páginasInforme Recristalización Del Ácido BenzoicoCamila TrianaAún no hay calificaciones
- Lab. Química - Informe 2Documento12 páginasLab. Química - Informe 2Yessi DcvAún no hay calificaciones
- Destrucción de Materia OrgánicaDocumento4 páginasDestrucción de Materia OrgánicacristianAún no hay calificaciones
- LABORATORIO 02 TIPOS DE SUSTANCIAS Y SEPARACION DE MEZCLAS-1-1jorgedanielDocumento14 páginasLABORATORIO 02 TIPOS DE SUSTANCIAS Y SEPARACION DE MEZCLAS-1-1jorgedanielJorge Daniel Mamani CanchaAún no hay calificaciones
- Clases 5Documento36 páginasClases 5NICOLAS ANDRES RUBILAR CASTILLOAún no hay calificaciones
- Reporte CristalizacionDocumento4 páginasReporte Cristalizaciondavid liraAún no hay calificaciones
- Informe 2Documento15 páginasInforme 2Miguel Pozo AllendeAún no hay calificaciones
- 3.-Disgregación, Destruccion M.ODocumento23 páginas3.-Disgregación, Destruccion M.ONathalie BonifazAún no hay calificaciones
- RESUMEN de RecristalizacionDocumento17 páginasRESUMEN de RecristalizacionMirtha Isabel Levano CarbajalAún no hay calificaciones
- Practica 2 Equipo 4 Flores Perez y Jimenez RodriguezDocumento4 páginasPractica 2 Equipo 4 Flores Perez y Jimenez RodriguezGarcia Ortiz Juan PabloAún no hay calificaciones
- Purificación de Compuestos Orgánicos Sólidos Por CristalizaciónDocumento3 páginasPurificación de Compuestos Orgánicos Sólidos Por CristalizaciónHector Jesus Roca LoaizaAún no hay calificaciones
- CRISTALIZACIONDocumento9 páginasCRISTALIZACIONYuvi Sánchez PacuriAún no hay calificaciones
- Informe 1 Quimica OrganicaDocumento12 páginasInforme 1 Quimica Organicaandré CrzAún no hay calificaciones
- Practica Nº3 - Sulfatos en SuelosDocumento5 páginasPractica Nº3 - Sulfatos en SuelosLuis Velasquez EbanAún no hay calificaciones
- Cristalización SimpleDocumento6 páginasCristalización SimplePedro SerranoAún no hay calificaciones
- CRISTALIZACIONDocumento10 páginasCRISTALIZACIONTatiana Rivera JaraAún no hay calificaciones
- RECRISTALIZACIÓN DE UNA SUSTANCIA ORGÁNICA EN MEDIO ACUOSO. N° 6. Corte 2,2Documento7 páginasRECRISTALIZACIÓN DE UNA SUSTANCIA ORGÁNICA EN MEDIO ACUOSO. N° 6. Corte 2,2Andres CaballeroAún no hay calificaciones
- Obtención y Cristalización de AcetanilidaDocumento5 páginasObtención y Cristalización de AcetanilidaESMERALDA PALACIO HERNANDEZAún no hay calificaciones
- Práctica 6.13 y 6.14 Equipo 7Documento11 páginasPráctica 6.13 y 6.14 Equipo 7Alexia Yazbetk Mejía CruzAún no hay calificaciones
- Problemas Propuestos para La Unidad de Complejometria y ArgentometríaDocumento12 páginasProblemas Propuestos para La Unidad de Complejometria y ArgentometríaAlexia Yazbetk Mejía CruzAún no hay calificaciones
- Práctica 1.3Documento14 páginasPráctica 1.3Alexia Yazbetk Mejía CruzAún no hay calificaciones
- Servicios Ambientales CD MaderoDocumento4 páginasServicios Ambientales CD MaderoAlexia Yazbetk Mejía CruzAún no hay calificaciones
- EXAMENDocumento2 páginasEXAMENAlexia Yazbetk Mejía CruzAún no hay calificaciones
- Nomenclatura R y SDocumento4 páginasNomenclatura R y SAlexia Yazbetk Mejía CruzAún no hay calificaciones
- Calidad Del Aire InteriorDocumento6 páginasCalidad Del Aire InteriorAlexia Yazbetk Mejía CruzAún no hay calificaciones
- Apuntes Unidad 1Documento34 páginasApuntes Unidad 1Alexia Yazbetk Mejía CruzAún no hay calificaciones
- Principios de CarnotDocumento13 páginasPrincipios de CarnotAlexia Yazbetk Mejía CruzAún no hay calificaciones
- Problemario de GravimetríaDocumento2 páginasProblemario de GravimetríaAlexia Yazbetk Mejía Cruz100% (2)
- CálculoDocumento4 páginasCálculoAlexia Yazbetk Mejía CruzAún no hay calificaciones
- DocumentoDocumento4 páginasDocumentoAlexia Yazbetk Mejía CruzAún no hay calificaciones
- Cálculo Integral: Investigacion Unidad 4Documento4 páginasCálculo Integral: Investigacion Unidad 4Alexia Yazbetk Mejía CruzAún no hay calificaciones
- EVALUACIÓN PRIMERA PARCIAL 2do BGU QUÍMICADocumento2 páginasEVALUACIÓN PRIMERA PARCIAL 2do BGU QUÍMICAJohys Arciniegas0% (1)
- Informe Reacciones de HdrocarburosDocumento13 páginasInforme Reacciones de HdrocarburosJorge Jesus Jeri JimenezAún no hay calificaciones
- 04 - Capitulo IV - Utensilios - 8 - 2021 PDFDocumento256 páginas04 - Capitulo IV - Utensilios - 8 - 2021 PDFro2608Aún no hay calificaciones
- Informe Practica 8Documento7 páginasInforme Practica 8Liseth YulianaAún no hay calificaciones
- Cuadro de Los 37 Principales Ensayos y Pruebas Aplicables A Empaques y Embalajes y A Sus Materias PrimasDocumento19 páginasCuadro de Los 37 Principales Ensayos y Pruebas Aplicables A Empaques y Embalajes y A Sus Materias PrimasJim BeltAún no hay calificaciones
- 5) Exámenes LaboratorioDocumento23 páginas5) Exámenes LaboratorioGERSON JAVIER SIS AGUILARAún no hay calificaciones
- U2 S2 FichadeTrabajo2 NomenclaturadeComp - InorgánicosDocumento2 páginasU2 S2 FichadeTrabajo2 NomenclaturadeComp - InorgánicoskikeAún no hay calificaciones
- Cinética Química Qumica 4Documento10 páginasCinética Química Qumica 4Janice VillatoroAún no hay calificaciones
- Accesorios Tub. Inoxidable SanitariaDocumento24 páginasAccesorios Tub. Inoxidable SanitariaDavid Alejandro DiazAún no hay calificaciones
- Gases IdealesDocumento13 páginasGases IdealeseliAún no hay calificaciones
- Técnicas de MicrobiologíaDocumento12 páginasTécnicas de MicrobiologíaDiversiones FiestaAún no hay calificaciones
- Actividades de Produccion para La Obtencion de Sulfato de CobreDocumento28 páginasActividades de Produccion para La Obtencion de Sulfato de CobreNICOLAS WLADIMIR CASTRO CALDERONAún no hay calificaciones
- Practica 3Documento6 páginasPractica 3Maria Fernanda Luna RojasAún no hay calificaciones
- 05 06 Actividad Enzimatica de La Catalasa y AmilasaDocumento19 páginas05 06 Actividad Enzimatica de La Catalasa y AmilasaJuliana PerezAún no hay calificaciones
- TD JorgeQuesadaSanchezDocumento278 páginasTD JorgeQuesadaSanchezCHIRE SARAYASI MANUELAún no hay calificaciones
- Unidad 3 Metabolismo Primario y SecundarioDocumento10 páginasUnidad 3 Metabolismo Primario y SecundarioFlorent TobarAún no hay calificaciones
- Resumen de Recomencaiones Chemlok - AMSTER - Sep 2023Documento30 páginasResumen de Recomencaiones Chemlok - AMSTER - Sep 2023Cristian loyolaAún no hay calificaciones
- Backer RodDocumento2 páginasBacker RodAnthony ChacaliazaAún no hay calificaciones
- Ciclo de CalvinDocumento4 páginasCiclo de CalvinDenisse MadridAún no hay calificaciones
- Anestésicos LocalesDocumento38 páginasAnestésicos LocalesXiomy Isa OrregoAún no hay calificaciones
- Datos de Data Bank YausDocumento3 páginasDatos de Data Bank YausJared PérezAún no hay calificaciones
- Informe Orgánica 2 Practica 2 - Preparacion de AlcoholesDocumento3 páginasInforme Orgánica 2 Practica 2 - Preparacion de AlcoholesJUAN CARLOS VILLOTA PINTOAún no hay calificaciones
- Cuadro Sinóptico Química Analítica #2Documento1 páginaCuadro Sinóptico Química Analítica #2M. DistorsiónAún no hay calificaciones
- Ficha Seguridad Esmalte Epoxico AluminioDocumento9 páginasFicha Seguridad Esmalte Epoxico Aluminiohse ipAún no hay calificaciones
- Practica LaboratorioDocumento10 páginasPractica LaboratorioLili BGAún no hay calificaciones
- Charla de Manejo de Productos QuimicosDocumento42 páginasCharla de Manejo de Productos QuimicosEdgar RamirezAún no hay calificaciones