Documentos de Académico
Documentos de Profesional
Documentos de Cultura
CUESTIONARIOS BIOQUIMICA (Refuerzo)
Cargado por
Leila Llanes0 calificaciones0% encontró este documento útil (0 votos)
8 vistas2 páginasEste documento resume las características principales de las enzimas. Explica que las enzimas son catalizadores biológicos que aceleran las reacciones químicas sin ser consumidas, y que su especificidad depende de las interacciones débiles entre el sustrato y el sitio activo de la enzima. También describe los diferentes tipos de enzimas según su mecanismo de acción y la nomenclatura sistemática utilizada para clasificarlas.
Descripción original:
Título original
CUESTIONARIOS BIOQUIMICA (refuerzo)
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEste documento resume las características principales de las enzimas. Explica que las enzimas son catalizadores biológicos que aceleran las reacciones químicas sin ser consumidas, y que su especificidad depende de las interacciones débiles entre el sustrato y el sitio activo de la enzima. También describe los diferentes tipos de enzimas según su mecanismo de acción y la nomenclatura sistemática utilizada para clasificarlas.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
8 vistas2 páginasCUESTIONARIOS BIOQUIMICA (Refuerzo)
Cargado por
Leila LlanesEste documento resume las características principales de las enzimas. Explica que las enzimas son catalizadores biológicos que aceleran las reacciones químicas sin ser consumidas, y que su especificidad depende de las interacciones débiles entre el sustrato y el sitio activo de la enzima. También describe los diferentes tipos de enzimas según su mecanismo de acción y la nomenclatura sistemática utilizada para clasificarlas.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
CUESTIONARIOS DE LAS CLASES TEORICAS ISOMERASAS: reordenamientos intramoleculares.
d- La especificidad de las enzimas depende de la cantidad de enlaces de tipo
ERA 1
debil que exista entre el sustrato con el sitio activo de la enzima, esto le
1) ENZIMAS
permitirá a la enzima discriminar entre sustratos con una estructura
a- Definición de CATALIZADOR: compuesto que con su sola presencia
molecular similar.
aumenta la velocidad de la reacción sin experimentar ninguna
Teniendo en cuenta la TEORIA DEL AJUSTE INDUCIDO, la
modificación.
especificdad se mide en el cambio conformacional de la enzima a
b- Características:
medida que entra en contacto con el sustrato, favoreciendo la
NO SE CONSUMEN EN LAS (R) QUE CATALIZAN
formaciond e interaccion de tipo: fuerzas de Van der Waals,
NO ALTERAN LA CONSTANTE DE EQUILIBRIO DE LA (R)
puente de hidrogeno, fuerzas hidroestaticas, ionicas, hodrofobas.
SE REQUIEREN EN CANTIDADES MINIMAS, son eficientes
Etc.
NO CREAN (R) NUEVAS, AUMENTAN LA VELOCIDAD DE LAS QUE
e- Investigar……………………….
SON POSIBLE.
f-
NO FORMAN PARTE DE LA REACCION QUE CATALIZAN
HOLOENZIMA: son enzimas conjugadas que están formadas por
NO ALTERAN EL EQUILIBRIO DE LA (R): Keq
una parte proteica (apoenzima) y un cofactor no proteicio
DISMINUYEN LA ENERGIA DE ACTIVACION, NO MODIFICAN EL ΔG.
APOENZIMA:
- Los catalizadores biológicos u organicos se distinguen de los inorgánicos
COFACTOR: se unen de manera transitoria y disociable a la
debido a que:
enzima o a un sustrato como ATP.
SON ESPECIFICOS: catalizan un solo tipo de reacción, y su grado
COENZIMA: sirven como transbordadores reciclables que
de especificidad por el sustrato es elevado.
transportan muchos sustratos desde un punto dentro de la cell
TERMOLABILES: pueden desnaturalizarse y perder su actividad
hacia otro. Ejemplos: FADH, NADH, acetato (coenzima A), grupos
biológica por acción de la temperatura.
metilos (folatos).
REGULABLES: tiene la capacidad de regular para tomar contacto
GRUPO PROSTETICO: incorporación estable hacia la estructura de
con otros procesos metabólicos, responder, crecer y
una proteica mediante fuerzas covalentes o no covalentes.
diferenciarse.
Ejemplos: Fosfato pifixodal, flavina adenina dinucletido (FAD)
c- Nomenclatura sistemática de las enzimas: 6 clases o familias
g- Mecanismo de acción: Dos tipos
OXIDORREDUCTASAS: catalizan reacciones redox
1) LLAVE-CERRADURA: el sustrato encaja en el centro activo de la
TRANSFERASAS: transfieren grupos funcionales dadores y
enzima de la misma manera que la llave en la cerradura. Esta
aceptores.
interacción es posible debido a la complementariedad del complejo.
LIGASAS: reacción de síntesis acopladas a sustancias de alto valor
2) ENCAJE INDUCIDO O DE GUANTE Y MANO: la enzima y el sustrato no
energético
son complementarios antes de que se produzca la interacción del
HIDROLASAS: hidrolisis; introducción de una molécula de agua
sustrato al centro activo sino una vez formado el complejo enzima-
para la ruptura.
sustrato.
LIASAS: formación o ruptura de enlaces covalentes sin ir
La función del sitio activo es facilitar la colisión y las condiciones
acoplados a sustancias de alto valor energético.
para que las posiciones de las moléculas sean las adecuadas.
[Dar lugar a la reacción química, es decir, el lugar donde se producen
las formaciones y roturas de ciertos enlaces para dar lugar al
producto.]
h-
También podría gustarte
- Programa para Fluidos CorporalesDocumento70 páginasPrograma para Fluidos CorporalesAnwarMedina100% (1)
- Presentación de Pancreatitis Aguda para EnfermeríaDocumento35 páginasPresentación de Pancreatitis Aguda para EnfermeríaHipolito Elias Ramirez MezaAún no hay calificaciones
- Conocemos y Cuidamos Nuestros SentidosDocumento12 páginasConocemos y Cuidamos Nuestros SentidosFelixAcfrAún no hay calificaciones
- Biocatalizadores y Referencias BibliograficasDocumento6 páginasBiocatalizadores y Referencias BibliograficasMaria Elizabeth M. Alberca0% (1)
- ENZIMASDocumento2 páginasENZIMASAngel Andres Ayquipa AlvitesAún no hay calificaciones
- BioquímicaDocumento26 páginasBioquímicaElbita RivasAún no hay calificaciones
- Enzimas y VitaminasDocumento6 páginasEnzimas y Vitaminascollantessantos.pieroAún no hay calificaciones
- Catalizadores BiológicosDocumento13 páginasCatalizadores BiológicosANDREA ISABEL ZAMORA HERNANDEZAún no hay calificaciones
- EnzimasDocumento24 páginasEnzimasClaudia InzunzaAún no hay calificaciones
- Enzimas Agro1 2023Documento52 páginasEnzimas Agro1 2023202208134Aún no hay calificaciones
- Metabolismo CelularDocumento9 páginasMetabolismo CelularamandaAún no hay calificaciones
- Mapa EnzimasDocumento1 páginaMapa Enzimasgabrielita030987Aún no hay calificaciones
- ENZIMASDocumento5 páginasENZIMASdaciairanAún no hay calificaciones
- Glosario de Bioquimica Cinetica EnzimaticaDocumento3 páginasGlosario de Bioquimica Cinetica EnzimaticasalvadorAún no hay calificaciones
- EnzimasDocumento36 páginasEnzimasbossmiguel667Aún no hay calificaciones
- Enzimas Bioquimica GralDocumento2 páginasEnzimas Bioquimica GralFernanda E OrtízAún no hay calificaciones
- Mecanismo de Acción de Las EnzimasDocumento29 páginasMecanismo de Acción de Las EnzimasDIEGO FABIAN DIAZ VERAAún no hay calificaciones
- Apuntes 1 Bioquímica 1º Cuatrimestre PDFDocumento91 páginasApuntes 1 Bioquímica 1º Cuatrimestre PDFAntonio Pérez CillerosAún no hay calificaciones
- Teoría 4 - Enzimas y Cinética EnzimáticaDocumento4 páginasTeoría 4 - Enzimas y Cinética Enzimática202220189Aún no hay calificaciones
- Presentación Beto Enzimas Final OkDocumento10 páginasPresentación Beto Enzimas Final OkRobin Buelvas HernandezAún no hay calificaciones
- BioQuimica Clase 1 CarboDocumento16 páginasBioQuimica Clase 1 CarboGuillermo YanacAún no hay calificaciones
- Mecanismo de Acción de Las EnzimasDocumento9 páginasMecanismo de Acción de Las EnzimasCarmelo RicardoAún no hay calificaciones
- Biocatalizadores y Membrana CelularDocumento16 páginasBiocatalizadores y Membrana CelularYorneilys NaranjoAún no hay calificaciones
- ENZIMASDocumento15 páginasENZIMASdgesgAún no hay calificaciones
- Biocatalisis Sesion 1.Documento16 páginasBiocatalisis Sesion 1.Jacqueline HernandezAún no hay calificaciones
- T.2 EnzimasDocumento20 páginasT.2 EnzimasLaura Prada SantanaAún no hay calificaciones
- Catalizadores EnzimáticosDocumento15 páginasCatalizadores EnzimáticosAlembert ZapataAún no hay calificaciones
- EnzimasDocumento11 páginasEnzimasMaria Victoria CaballeroAún no hay calificaciones
- Enzimas 10Documento15 páginasEnzimas 10Maria Victoria CaballeroAún no hay calificaciones
- EnzimasDocumento31 páginasEnzimasLuisa F PedrazaAún no hay calificaciones
- eZNIMAS CONTENIDODocumento3 páginaseZNIMAS CONTENIDOAbimael FloresAún no hay calificaciones
- Tipos de Reaccioneseq2Documento21 páginasTipos de Reaccioneseq2KASSANDRA PAMELA ORTEGA ALANISAún no hay calificaciones
- Bioquimica EnzimasDocumento46 páginasBioquimica EnzimasKrmen Naranjo MorilloAún no hay calificaciones
- Clasificacionynomenclaturaenzimas 130824094859 Phpapp01Documento26 páginasClasificacionynomenclaturaenzimas 130824094859 Phpapp01lissaird5Aún no hay calificaciones
- Taller de EnzimasDocumento6 páginasTaller de Enzimasalexander acosta solanoAún no hay calificaciones
- Enzimas 2Documento19 páginasEnzimas 2Eduardo FeriaAún no hay calificaciones
- 2 - EnzimasDocumento27 páginas2 - EnzimasLORENAAún no hay calificaciones
- MetabolismoDocumento16 páginasMetabolismoNatalia AssoAún no hay calificaciones
- EnzimasDocumento3 páginasEnzimasNatasha GabrielleAún no hay calificaciones
- Enzimas y VitaminasDocumento13 páginasEnzimas y VitaminaspapaquitoAún no hay calificaciones
- En ZimasDocumento53 páginasEn ZimasKathia Joselin Constantino MasAún no hay calificaciones
- BlancoDocumento36 páginasBlancoRoma GonzalezAún no hay calificaciones
- ProteínasDocumento8 páginasProteínasRomina VillafañeAún no hay calificaciones
- Tema 5 Enzimas5Documento97 páginasTema 5 Enzimas5CeliaAún no hay calificaciones
- ENZIMASDocumento21 páginasENZIMASjaelAún no hay calificaciones
- Tema 6. Enzimas.Documento12 páginasTema 6. Enzimas.DCPAún no hay calificaciones
- Accede A Apuntes, Guías, Libros y Más de Tu Carrera: Enzimas 8 PagDocumento9 páginasAccede A Apuntes, Guías, Libros y Más de Tu Carrera: Enzimas 8 PagVIOLETA ELIZABETH SANCHEZ CASTROAún no hay calificaciones
- Catalizadores y EnzimasDocumento24 páginasCatalizadores y EnzimasElias BoychukAún no hay calificaciones
- Enzimas PDFDocumento53 páginasEnzimas PDFNelson BeltranAún no hay calificaciones
- Actividad EnzimáticaDocumento1 páginaActividad EnzimáticaEsau YupanquiAún no hay calificaciones
- Bioquímica. Tema 6 EnzimasDocumento3 páginasBioquímica. Tema 6 EnzimasLucia GandarillasAún no hay calificaciones
- ENZIMASDocumento9 páginasENZIMASAruca DíazAún no hay calificaciones
- T.Metabolismo y EnzimasDocumento26 páginasT.Metabolismo y EnzimasGabriel Enrique Boadas MoreiraAún no hay calificaciones
- Clase 3 Morfologia 1Documento94 páginasClase 3 Morfologia 1Luisa SalazarAún no hay calificaciones
- Biologia Celular - Enzimas CelularesDocumento62 páginasBiologia Celular - Enzimas CelularesCesar Augusto Airampo MacedoAún no hay calificaciones
- Enzimas 2Documento22 páginasEnzimas 2Michelle QuinteroAún no hay calificaciones
- Tema 3 - EnzimasDocumento3 páginasTema 3 - EnzimasMari Carmen ReinéAún no hay calificaciones
- t2 EnzimasDocumento40 páginast2 Enzimashbetancor2005Aún no hay calificaciones
- 2 Enzimas ResumenDocumento3 páginas2 Enzimas ResumenEdith CastilloAún no hay calificaciones
- Sesià N 7 - UNIDAD III - Enzimas 2Documento80 páginasSesià N 7 - UNIDAD III - Enzimas 2Beatriz FerreiraAún no hay calificaciones
- Resumen Capitulo 7Documento2 páginasResumen Capitulo 7Albert GutiérrezAún no hay calificaciones
- Problemas Quimica GeneralDocumento75 páginasProblemas Quimica GeneralLeila LlanesAún no hay calificaciones
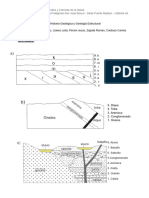
- Trabajo Practico GeologiaDocumento5 páginasTrabajo Practico GeologiaLeila LlanesAún no hay calificaciones
- TABLA CLASIFICATORIA DE MINERALES (Alumnos)Documento4 páginasTABLA CLASIFICATORIA DE MINERALES (Alumnos)Leila LlanesAún no hay calificaciones
- Planners Universitarios Ejemplificacion 22Documento68 páginasPlanners Universitarios Ejemplificacion 22Leila LlanesAún no hay calificaciones
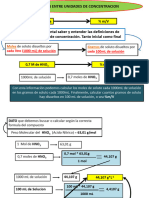
- Conversion Molaridad Porc - Masa - en - VolumenDocumento2 páginasConversion Molaridad Porc - Masa - en - VolumenLeila LlanesAún no hay calificaciones
- Informe de Experiencia de Laboratorio REDOXDocumento10 páginasInforme de Experiencia de Laboratorio REDOXLeila LlanesAún no hay calificaciones
- Seguridad en El Laboratorio 2020Documento12 páginasSeguridad en El Laboratorio 2020Leila LlanesAún no hay calificaciones
- Biologia General Resumen para EstudioDocumento7 páginasBiologia General Resumen para EstudioLeila LlanesAún no hay calificaciones
- Cemento DentalDocumento4 páginasCemento DentalSergio Alberto GarciaAún no hay calificaciones
- Cancer de EstomagoDocumento17 páginasCancer de EstomagonataliaglAún no hay calificaciones
- ¿La Dieta Baja en Grasas o Pritikin Dieta para Bajar de WeighthDocumento3 páginas¿La Dieta Baja en Grasas o Pritikin Dieta para Bajar de WeighthgoldenpwckooipjqAún no hay calificaciones
- Prueba de VigorDocumento22 páginasPrueba de VigorGissell Marisol Huamani Chavez100% (1)
- Question - 2021 - 06 - 29 - 15 - 00 - QZ - EXAMEN FINAL CELULADocumento18 páginasQuestion - 2021 - 06 - 29 - 15 - 00 - QZ - EXAMEN FINAL CELULAJose Ignacio Lopez GarciaAún no hay calificaciones
- Practica 7 Transmición SinápticaDocumento13 páginasPractica 7 Transmición SinápticaMiguel SaavedraAún no hay calificaciones
- Particular Fecha: 25 Ene 2024 Hora: 13:57:07 Sexo: Femenino Edad: 19 AñosDocumento6 páginasParticular Fecha: 25 Ene 2024 Hora: 13:57:07 Sexo: Femenino Edad: 19 Añosgmontanolopez7Aún no hay calificaciones
- Alteraciones Del Aparato Reproductor de La PerraDocumento13 páginasAlteraciones Del Aparato Reproductor de La Perrajob88264629100% (1)
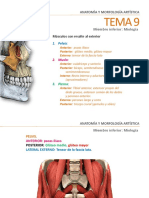
- Tema 9 Miembro Inferior. MiologíaDocumento37 páginasTema 9 Miembro Inferior. MiologíamakukikiAún no hay calificaciones
- 4 Modelo Control MotorDocumento11 páginas4 Modelo Control MotorAMPARO DE LOS ANGELES JARA MUÑOZAún no hay calificaciones
- Neoplasias Endocrina MultipleDocumento6 páginasNeoplasias Endocrina MultipleJorge Sanchez UlloaAún no hay calificaciones
- Tema 2Documento71 páginasTema 2Edgar SalazarAún no hay calificaciones
- 7 HemodinamiaDocumento23 páginas7 HemodinamiacesarAún no hay calificaciones
- Guia Sis Locomotor 1 AL 15Documento8 páginasGuia Sis Locomotor 1 AL 15Jairo GabinoAún no hay calificaciones
- Alimentación-Del-Petauro )Documento17 páginasAlimentación-Del-Petauro )Ery BlumAún no hay calificaciones
- c1 Examen DiagnosticoDocumento1 páginac1 Examen DiagnosticoOmar MartinezzAún no hay calificaciones
- Guía para El Desarrollo Del Componente Práctico - Unidad 1, 2 y 3 - Tarea 5 - Componente Práctico - Práctica de LaboratorioDocumento8 páginasGuía para El Desarrollo Del Componente Práctico - Unidad 1, 2 y 3 - Tarea 5 - Componente Práctico - Práctica de Laboratoriodairon benitezAún no hay calificaciones
- Simulacro 5BDocumento19 páginasSimulacro 5BbebecrAún no hay calificaciones
- Montserrat Alviani Tratamiento Psicologicos en El DolorDocumento10 páginasMontserrat Alviani Tratamiento Psicologicos en El DolorFrancisco Ignacio Muñoz MoragaAún no hay calificaciones
- La Base Cientifica de La ReflexologiaDocumento4 páginasLa Base Cientifica de La ReflexologiacharalinajeAún no hay calificaciones
- Enfermedades Ocupacionales (Mineras)Documento16 páginasEnfermedades Ocupacionales (Mineras)Jose Berrio100% (1)
- Hidro en Afecciones RespiratoriasDocumento16 páginasHidro en Afecciones RespiratoriasCesar karferAún no hay calificaciones
- Audesirk Capítulo 40Documento114 páginasAudesirk Capítulo 40Joël Molina ChiribogaAún no hay calificaciones
- ELONGACION EjerciciosDocumento7 páginasELONGACION EjerciciosMabel Espinoza RivaAún no hay calificaciones
- Estructura de CromosomasDocumento6 páginasEstructura de CromosomasAlita BearAún no hay calificaciones
- Aminoácidos y Enlace PeptídicoDocumento5 páginasAminoácidos y Enlace PeptídicocarlosAún no hay calificaciones
- SemiologiaDocumento67 páginasSemiologiaMiguel Sanabria Talavera0% (1)