Documentos de Académico
Documentos de Profesional
Documentos de Cultura
2023 06 25 Madrid Estabilización Problema3
Cargado por
Julio ZierrasDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
2023 06 25 Madrid Estabilización Problema3
Cargado por
Julio ZierrasCopyright:
Formatos disponibles
Procedimientos selectivos estabilización Madrid 2023, Física y Química 25 junio 2023
enrique@fiquipedia.es Revisado 6 julio 2023
Prueba B2 ejercicio práctico
Han de resolverse los SEIS PROBLEMAS, cada uno de los cuales se calificará de 0 a 10 puntos. En caso de tener
varios apartados, la calificación de cada uno de ellos será la que figure en el texto y de no figurar ninguna se entenderá
el mismo valor para todos. La calificación del ejercicio será la correspondiente a la media de las puntuaciones obtenidas
en cada uno de los problemas.
Se aplicarán los criterios de corrección generales y específicos de evaluación que ya han sido publicados.
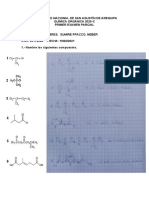
3. El benceno es un reactivo que se usa como producto de partida en la síntesis de
muchas sustancias químicas, entre ellas las espumas de poliuretano.
a. Escribe su fórmula semidesarrollada y justifica su aromaticidad, dibujando sus formas
resonantes. (1 punto)
b. Explica el tipo de hibridación de sus átomos de carbono, incluyendo un dibujo de todos
los orbitales en el anillo. (2 puntos)
c. Explica de forma gráfica (incluyendo el movimiento de los electrones) qué efecto
electrónico produce sobre el anillo aromático la sustitución de un hidrógeno del benceno
por un grupo –OH o bien por un grupo –NO2. (2 puntos)
d. Justifica brevemente, sin indicar el mecanismo, cuál será el producto/s de las siguientes
reacciones químicas, indicando el tipo de reacción que tiene lugar y nombrando y
formulando los compuestos químicos obtenidos. (3 puntos)
e. Otro compuesto orgánico muy importante es el ácido p-bencenodicarboxílico, capaz de
copolimerizar junto a otros compuestos químicos. Sabiendo que el PET
(polietilentereftalato) es un polímero muy usado en alimentación para envasar productos
fotosensibles como la leche y que puede representarse así:
Identifica el otro monómero de partida y nómbralo, justificando el tipo de polimerización
necesario para obtener PET. (2 puntos)
Referencias: se enlazan en cada figura. Ver además apuntes orgánica fiquipedia (efecto mesómero e inductivo)
Procedimientos selectivos estabilización Madrid 2023, Física y Química 25 junio 2023
enrique@fiquipedia.es Revisado 6 julio 2023
a) El nombre sistemático del benceno es
ciclohex-1,3,4-trieno. En notación esqueletal
tiene incluso un emoji ⌬ (carácter unicode
232C), y en fórmula semidesarrollada se
muestran explícitamente los carbonos con sus
enlaces pero no los enlaces carbono hidrógeno,
por lo que sería la fórmula planteada por Kekulé Kekulé 1872, Wikimedia, public domain
en 1872.
Su aromaticidad se justifica con la regla de Hückel, que indica que una molécula cíclica y plana es
aromática si tiene 4n+2 electrones en orbitales π. En el caso del benceno hay 6 electrones en
orbitales π, por lo que 4n+2=6 y se cumple la regla de Hückel n=1. La presencia de 6 electrones en
orbitales π se representa en un diagrama y se comenta de nuevo en el apartado b.
chem.libretexts.org cc-by-nc-sa chem.libretexts.org cc-by-nc-sa
Las formas resonantes del benceno son
fundamentalmente dos.
En forma esqueletal, representando el movimiento de electrones.
chem.libretexts.org cc-by-nc-sa
En forma desarrollada (representando explícitamente los enlaces carbono hidrógeno), se pueden ver
en la figura siguiente como “Kekulé structure”
Representaciones benceno, wikimedia Vladsinger cc-by-sa
b) Los átomos de carbono tienen hibridación sp2, con un orbital p no hibridado.
El carbono tiene configuración electrónica inicial 1s2 2s2 2px1 2py1 2px1, y un electrón del orbital 2s
Procedimientos selectivos estabilización Madrid 2023, Física y Química 25 junio 2023
enrique@fiquipedia.es Revisado 6 julio 2023
promociona a uno p, por lo que el carbono pasa un estado excitado con 1 electrón en cada orbital p.
Como cada carbono se une solo a tres átomos (dos carbonos y un hidrógeno), realiza una
hibridación sp2 en la que se combina el orbital s con dos orbitales p y se tienen 3 orbitales sp2.
https://www.chemguide.co.uk/basicorg/bonding/benzene2.html
Los 3 orbitales sp2 de cada carbono forman dos enlaces σ con dos carbonos, y un enlace σ con un
hidrógeno.
Cada orbital p no hibridado de cada carbono forma un enlace π con uno de los carbonos adyacentes,
por lo que hay en total 3 enlaces π (realmente un orbital molecular deslocalizado que se puede ver
como combinación de los 3 orbitales π y sus formas resonantes), en los que hay un total de 6
electrones (este número de electrones se ha comentado en apartado a asociado a aromaticidad)
Como dibujo de todos los orbitales en el anillo se puede ver la
figura del apartado anterior: en “Sigma bonds. Hybridized orbitals”
se ven los 6 orbitales sp2, y en “6 pz orbitals” los 6 no hibridados,
que forman 3 enlaces π (realmente un orbital molecular
deslocalizado que se puede ver como combinación de los 3
orbitales π y sus formas resonantes). También se incluye una
representación 3D de todos los orbitales simultaneamiente,
incluyendo los orbitales s del hidrógeno.
c) Existen dos fenómenos electrónicos asociados la presencia de
grupos funcionales que afectan a la reactividad: https://www.chemtube3d.com/orbitalsbenzene/
Efecto inductivo: Asociado a polarización de enlace entre elementos de diferente
electronegatividad.
• Efecto inductivo -I: elemento más electronegativo que C, atrae los electrones hacia él, y C
tiene carga +.
• Efecto inductivo +I: el elemento es menos electronegativo que el C.
Efecto mesómero (mesomerismo es sinónimo de resonancia)
Asociado a la capacidad de atraer o ceder electrones de ciertos grupos funcionales; supone
estructuras resonantes con distinta contribución a la estructura molecular global, con
desplazamiento de carga entre ellas. Supone una deslocalización de los electrones que estabiliza la
molécula con un término de energía de resonancia.
• Efecto -R ó -M: se da para grupos que en la resonancia atraen hacia ellos los electrones de
un enlace π de C, y se suele pasar en el C de enlace doble a simple, al tiempo que el grupo
pasa a estar unido con un enlace doble.
• Efecto +R ó +M: se da para grupos que en la resonancia ceden electrones al átomo de C, y
se suele pasar de enlace simple a doble. El primer átomo del grupo tiene pares de electrones
solitarios para donar.
El grupo alcohol (grupo –OH) tiene efecto -I poco importante y +R (el grupo alcohol puede ceder
electrones no compartidos y efecto de la resonancia dirige los electrones hacia el anillo). El efecto
+R hace que el grupo alcohol sea un grupo activante del anillo que dirige a orto y para
Procedimientos selectivos estabilización Madrid 2023, Física y Química 25 junio 2023
enrique@fiquipedia.es Revisado 6 julio 2023
chem.libretexts.org cc-by-nc-sa
www.researchgate.net
El grupo nitro (grupo –NO2) tiene efecto -I y -R (el grupo nitro puede aceptar electrones y efecto
de la resonancia dirige los electrones hacia fuera del anillo). El efecto -R hace que el grupo alcohol
sea un grupo activante del anillo que dirige a meta.
chem.libretexts.org cc-by-nc-sa
https://pubs.rsc.org/en/content/articlehtml/2016/cp/c5cp07483e
d) Los nombres de productos A y B serán o-bromofenol y p-bromofenol (se ha comentado en c
Procedimientos selectivos estabilización Madrid 2023, Física y Química 25 junio 2023
enrique@fiquipedia.es Revisado 6 julio 2023
que el grupo alcohol es un grupo activante en orto y para). Las fórmulas se incluyen en la siguiente
figura.
https://www.chegg.com/homework-help/give-structures-major-products-would-obtain-reaction-phenol-chapter-8-
problem-40ap-solution-9781439049716-exc
El tipo de reacción es una sustitución electrofílica aromática.
Los nombres de productos C y D serán anilina y ciclohexanamina. Las fórmulas se incluyen en la
siguiente figura.
https://www.researchgate.net/figure/Hydrogenation-of-nitrobenzene-via-aniline-to-cyclohexylamine-SEM-micrograph-of-
the_fig1_301350814
El tipo de reacción en ambos casos es una reducción. La segunda también se puede visualizar
como una adición de hidrógeno, una hidrogenación.
e) El otro monómero de partida es etan-1,2-diol de fórmula HO-CH2-CH2-OH
Es tipo de polimerización es polimerización por condensación entre el grupo ácido y el grupo
alcohol formándose un grupo éster y liberándose una molécula de agua.
https://www.freepng.es/png-a9semv/
También podría gustarte
- Practica 1 y 2 QuimicaDocumento19 páginasPractica 1 y 2 Quimicanatalia cordoba comba100% (3)
- Modulo ResueltoDocumento13 páginasModulo ResueltoErnestina TORRESAún no hay calificaciones
- EjerciciosDocumento12 páginasEjerciciosjose lico100% (1)
- Abad - Jesus - Unidad 1. Actividad 3. Problemas Energía PotencialDocumento2 páginasAbad - Jesus - Unidad 1. Actividad 3. Problemas Energía PotencialJesus Manuel Abad MuesesAún no hay calificaciones
- La Cara Oculta de Las Esferas - Luis Montejano PeimbertDocumento81 páginasLa Cara Oculta de Las Esferas - Luis Montejano PeimbertXavier Rivera100% (1)
- Razonamiento CuantitativoDocumento9 páginasRazonamiento CuantitativoYerly BaronAún no hay calificaciones
- Fresno Pntic Mec EsDocumento12 páginasFresno Pntic Mec EsCecilia Zen Caldas NefliteAún no hay calificaciones
- Química OrgánicaDocumento28 páginasQuímica OrgánicaHector TrianaAún no hay calificaciones
- Unidad 1Documento14 páginasUnidad 1kanekiAún no hay calificaciones
- Guía de Ejercicios y Problemas de La Clase 16. Versión 2.6Documento24 páginasGuía de Ejercicios y Problemas de La Clase 16. Versión 2.6Victoria Milagros BarciaAún no hay calificaciones
- Taller1 Estructuras y Formulas - QcaorgDocumento10 páginasTaller1 Estructuras y Formulas - QcaorgMayré Bermúdez Fuentes.Aún no hay calificaciones
- Guía de Ejercicios de Enlace QuímicoDocumento3 páginasGuía de Ejercicios de Enlace QuímicoNatalia Sandoval MAún no hay calificaciones
- Guia de Problemas 2021Documento27 páginasGuia de Problemas 2021Fran IgarzabalAún no hay calificaciones
- ISOMERÍA - BachilleratoDocumento8 páginasISOMERÍA - BachilleratoDabnysdAún no hay calificaciones
- Guía de Ejercicios y Problemas de La Clase 7 v.3.1Documento19 páginasGuía de Ejercicios y Problemas de La Clase 7 v.3.1katherinemicaela19Aún no hay calificaciones
- Primer ExamenDocumento4 páginasPrimer ExamenNeber Sumire PpaccoAún no hay calificaciones
- Taller Sem2-11Documento6 páginasTaller Sem2-11Nancy Becerra ErazoAún no hay calificaciones
- ISOMERÍADocumento7 páginasISOMERÍAAnneMoon55Aún no hay calificaciones
- Guía Orgánica 2º MedioDocumento5 páginasGuía Orgánica 2º MediobelenAún no hay calificaciones
- Modelos Del Primer Parcial de Química OrgánicaDocumento4 páginasModelos Del Primer Parcial de Química OrgánicaSaku-chancyn SalamoneAún no hay calificaciones
- Examen de Quimica 2 - PeriodoDocumento9 páginasExamen de Quimica 2 - PeriodoFernandaMartínezAún no hay calificaciones
- 61-Ejercicios de Enlace Quimico Con SolucionDocumento10 páginas61-Ejercicios de Enlace Quimico Con SolucionYanina Soledad PerezAún no hay calificaciones
- Taller Nomenclatura 2020Documento2 páginasTaller Nomenclatura 2020Neyibe Neried Gutierrez HerradaAún no hay calificaciones
- Quimica-Organica o Del CarbonoDocumento72 páginasQuimica-Organica o Del CarbonoSaida Fernandez50% (2)
- Quimica OrganicaDocumento25 páginasQuimica OrganicaAnghii Patricio100% (1)
- Prueba 2 Medio QuimicaDocumento4 páginasPrueba 2 Medio QuimicaFelipeIgnacioBustosAún no hay calificaciones
- Guía Química Orgánica Ing Ambiental I FaseDocumento23 páginasGuía Química Orgánica Ing Ambiental I FaseRuben Cacsire Ponce0% (1)
- Modulo Ees38 Iaq 5to 1raDocumento12 páginasModulo Ees38 Iaq 5to 1raErnestina TORRESAún no hay calificaciones
- Práctica No 1 Modelos MolecularesDocumento4 páginasPráctica No 1 Modelos MolecularesXIOMARA ANTONELLA CASTREJON RAMOSAún no hay calificaciones
- Tarea 2 - Geometría Molecular y Compuestos CoordinadosDocumento7 páginasTarea 2 - Geometría Molecular y Compuestos CoordinadosLUIS PEÑAAún no hay calificaciones
- Guia Hibridacion 11Documento20 páginasGuia Hibridacion 11Solomon GrundyAún no hay calificaciones
- Guía Química Orgánica USSDocumento106 páginasGuía Química Orgánica USSVale AguileraAún no hay calificaciones
- Ejercicios Quimica OrganicaDocumento10 páginasEjercicios Quimica OrganicaMónica CuevasAún no hay calificaciones
- Química OrgánicaDocumento17 páginasQuímica OrgánicaMaría Victoria Arques GalianaAún no hay calificaciones
- Química OrgánicaDocumento18 páginasQuímica OrgánicaAna Guerrero LecuonaAún no hay calificaciones
- Quimica Guia #3 Semana 3Documento5 páginasQuimica Guia #3 Semana 3Juan David GallegoAún no hay calificaciones
- Alcanos, Alquenos y AlquinosDocumento45 páginasAlcanos, Alquenos y AlquinosZul Guillen100% (2)
- Alquenos Locos QuimicaDocumento21 páginasAlquenos Locos QuimicaSan EdgardoAún no hay calificaciones
- 4 - Aspectos Generales de Los Compuestos Orgánica.Documento14 páginas4 - Aspectos Generales de Los Compuestos Orgánica.1971karlosAún no hay calificaciones
- Compuestos CordinadosDocumento17 páginasCompuestos CordinadosLisette Johana Silva ManosalvaAún no hay calificaciones
- Guía No. 10 Once Química 21Documento5 páginasGuía No. 10 Once Química 21patricia pizarro100% (1)
- Conceptos Basicos - 2013-1Documento28 páginasConceptos Basicos - 2013-1René AcostaAún no hay calificaciones
- Bateria 2 Quimica Sin RespuestaDocumento4 páginasBateria 2 Quimica Sin RespuestaJuan PerlazaAún no hay calificaciones
- Ej. Fisica y Quimica 4º de ESO BrunoDocumento48 páginasEj. Fisica y Quimica 4º de ESO Brunoceciliaromero1980Aún no hay calificaciones
- Química OrgánicaDocumento3 páginasQuímica OrgánicaCamelia CaicedoAún no hay calificaciones
- 2 Componentes Estructurales de Las Moléculas OrgánicasDocumento59 páginas2 Componentes Estructurales de Las Moléculas OrgánicasSebastián RodríguezAún no hay calificaciones
- Trabajo Artículo Celdas SolaresDocumento31 páginasTrabajo Artículo Celdas SolaresFRANCISCO QUESADA CALDERONAún no hay calificaciones
- Tema Quimica Organica 2Documento43 páginasTema Quimica Organica 2Francisco José Pardo JusticiaAún no hay calificaciones
- Problemas BruñoDocumento48 páginasProblemas BruñoNoelia García VallezAún no hay calificaciones
- Actividad (Compuestos Org.)Documento2 páginasActividad (Compuestos Org.)Yuber RomañaAún no hay calificaciones
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 5 de 5 estrellas5/5 (1)
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- Operaciones básicas del proceso, mezclas y disoluciones. QUIE0108: Operaciones básicas en planta químicaDe EverandOperaciones básicas del proceso, mezclas y disoluciones. QUIE0108: Operaciones básicas en planta químicaAún no hay calificaciones
- Acondicionado de materiales termoplásticos para su transformación. QUIT0209De EverandAcondicionado de materiales termoplásticos para su transformación. QUIT0209Aún no hay calificaciones
- Sistemas de Bose: Grandes desvíos y hamiltonianos aproximativosDe EverandSistemas de Bose: Grandes desvíos y hamiltonianos aproximativosCalificación: 2 de 5 estrellas2/5 (1)
- Carácterísticas Estáticas y DinámicasDocumento24 páginasCarácterísticas Estáticas y DinámicasALejandro PalaciosAún no hay calificaciones
- Tablas de ConversiónDocumento6 páginasTablas de ConversiónAndrexz Miguek Molina VAún no hay calificaciones
- Cuestionario FRG Ut4Documento4 páginasCuestionario FRG Ut4YurAún no hay calificaciones
- TEMA 5 Momento de InerciaDocumento48 páginasTEMA 5 Momento de InerciaCristianAún no hay calificaciones
- DobladoDocumento4 páginasDobladoxhunaAún no hay calificaciones
- Guía Matemáticas 2Documento7 páginasGuía Matemáticas 2Laura Valentina Lastra67% (3)
- PP A1 Uribe Ordaz.Documento5 páginasPP A1 Uribe Ordaz.Vann UriAún no hay calificaciones
- Semio CompletoDocumento209 páginasSemio Completosergio fernando reyes canastuj garcìaAún no hay calificaciones
- Mecanismos de RetroalimentaciónDocumento5 páginasMecanismos de RetroalimentaciónAngélica ValleAceAún no hay calificaciones
- Filtración. Practica 2Documento7 páginasFiltración. Practica 2Montserrat OsorioAún no hay calificaciones
- Manual Combate Contra IncendiosDocumento24 páginasManual Combate Contra IncendiosDiana Laura Bautista MontejoAún no hay calificaciones
- El Texto ArgumentativoDocumento10 páginasEl Texto Argumentativompetrini31Aún no hay calificaciones
- Geodesia FisicaDocumento4 páginasGeodesia FisicaMate BosaloAún no hay calificaciones
- Caja ExplosivaDocumento11 páginasCaja ExplosivaAngel TorresAún no hay calificaciones
- Pci ResistenciaDocumento3 páginasPci ResistenciaLuhanna BacaAún no hay calificaciones
- 11.4 Diseño Del Pavimento Zona1Documento21 páginas11.4 Diseño Del Pavimento Zona1Janett Roselyn Cerna GarciaAún no hay calificaciones
- VissimProtocol en Es PDFDocumento91 páginasVissimProtocol en Es PDFRenato ManzanoAún no hay calificaciones
- Teorías Sobre El Origen Del UniversoDocumento8 páginasTeorías Sobre El Origen Del UniversoJosué CornejoAún no hay calificaciones
- Unidad Didáctica 10 BMC - Cultivos CelularesDocumento27 páginasUnidad Didáctica 10 BMC - Cultivos CelularesMaryareAún no hay calificaciones
- Di Berardino, Maria Aurelia (2004) - La Concepcion Pragmatica de La Verdad. Dialogo Entre William James y Bertrand RussellDocumento9 páginasDi Berardino, Maria Aurelia (2004) - La Concepcion Pragmatica de La Verdad. Dialogo Entre William James y Bertrand RussellSandra EscuderoAún no hay calificaciones
- Turbinas FRANCIS ChuquimamaniDocumento39 páginasTurbinas FRANCIS ChuquimamanioliverAún no hay calificaciones
- Preenfriado y Conservación PrincipalesDocumento5 páginasPreenfriado y Conservación PrincipalesAlberto AdlfAún no hay calificaciones
- Modelado CajaChina 1054470Documento5 páginasModelado CajaChina 1054470Yusif Yaryura PaulinoAún no hay calificaciones
- Buses de CampoDocumento121 páginasBuses de CampoHector Huenulef Del RioAún no hay calificaciones
- Refill HP 802 CartridgeDocumento15 páginasRefill HP 802 CartridgeUmesh MaAún no hay calificaciones
- Práctica 3Documento2 páginasPráctica 3EdinAún no hay calificaciones
- Norma Co 10 7 602 Poblacion Mayor A 1000 HabitantesDocumento34 páginasNorma Co 10 7 602 Poblacion Mayor A 1000 HabitantesChristian Juanazo VillamarAún no hay calificaciones