Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Metodologia
Metodologia
Cargado por
Fabi Núñez0 calificaciones0% encontró este documento útil (0 votos)
5 vistas1 páginaTítulo original
metodologia
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
5 vistas1 páginaMetodologia
Metodologia
Cargado por
Fabi NúñezCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
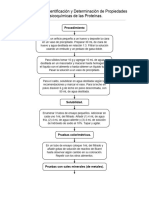
1.
Se colocaron 20ml de leche descremada de marca comercial en un vaso precipitado y se
procedió a calentar hasta una Tº de 40º c, llegado a ese punto de Temperatura, fueron
agregados 5gr de sulfato de amonio anhídrido vertiendo en pequeñas cantidades en un
periodo de tiempo de 10 a 12 min. manteniendo agitación constante a la solución.
se añadieron …. en un tubo de 1,5ml para luego centrifugar a velocidad máxima durante 1min.
Se recolecto el sobrenadante de este en otro tubo de….. y se ajustó el pH a 3 agregando……..
de Hcl concentrado.
Se centrifugo nuevamente la suspensión durante 15min. A 4500rpm. Se eliminó el
sobrenadante, para luego resuspender la proteína precipitada con 3ml de agua destilada
en…..y se volvió ajustar el pH a 9 con …… de NaoH 1N.se centrifugo por otros 10min. A
4500rpm. Se recuperó el sobrenadante. Al terminar se cuantifico la concentración de proteína
obtenida con el método de Bradford y se procedió a guardar la muestra a 4ºC.
2.
Se visualizó la proteína mediante la técnica de electroforesis en condiciones denaturantes,
para esto se preparó la muestra agregando 1ml de buffer de carga que contenia B-
mercaptoetanol (950ul de buffer de carga y 50ul de B- mercaptoetanol). Posteriormente en un
tubo eppendorf se calentó la muestra a baño maría a 95ºC por 10min. Se dejó a Tº ambiente,
para luego ser cargada a los pocillos del gel concentrador de nuestra electroforesis, se
cargaron …. De muestra y ……… de buffer de carga en los pocillos numero …….
Cerrado el sistema, se conectó la corriente aplicando un voltaje de 200volts constante durante
40min aprox. Terminando la migración se traspasó el gel a un recipiente con una solución de
tinción ….. dejándolo 30min a Tº ambiente en movimiento, para luego depositar el gel en una
solución de decoloración …… eliminando el exceso de tinción. Y para finalizar se visualizaron
los resultados en gel para el posterior análisis.
También podría gustarte
- Deliciosas recetas de comida cruda: Desde deliciosas ensaladas y sabrosos pasteles hasta batidos afrutadosDe EverandDeliciosas recetas de comida cruda: Desde deliciosas ensaladas y sabrosos pasteles hasta batidos afrutadosAún no hay calificaciones
- El Método Hanahan para La Preparación y Transformación Baterias EcoliDocumento4 páginasEl Método Hanahan para La Preparación y Transformación Baterias EcoliDavidAún no hay calificaciones
- Determinación de HumedadDocumento7 páginasDeterminación de HumedadJandy MalagónAún no hay calificaciones
- TrizolDocumento67 páginasTrizolISABELSSBAún no hay calificaciones
- Transformación de Escherichia Coli y Obtención de Adn Plasmídico (Método Convencional)Documento4 páginasTransformación de Escherichia Coli y Obtención de Adn Plasmídico (Método Convencional)Joao AlvaradoAún no hay calificaciones
- Protocolo 1 Obtencion de Adn de Bacterias Patogenas PDFDocumento6 páginasProtocolo 1 Obtencion de Adn de Bacterias Patogenas PDFGonzalo Bravo JimenezAún no hay calificaciones
- Materiales y Métodos TESISDocumento3 páginasMateriales y Métodos TESISWalter Alfredo Mora MurilloAún no hay calificaciones
- Análisis de Leche y Productos LácteosDocumento4 páginasAnálisis de Leche y Productos LácteosCfa SantiagoAún no hay calificaciones
- Correccion Trabajo Práctico - Controles de Calidad en La Leche Nadia Di ViscenzoDocumento9 páginasCorreccion Trabajo Práctico - Controles de Calidad en La Leche Nadia Di Viscenzodaniela cardozoAún no hay calificaciones
- Protocolo LaboratorioDocumento2 páginasProtocolo LaboratorioJuanBenalcazarAldazAún no hay calificaciones
- TP LecheDocumento4 páginasTP LecheNataliaSilvanaAún no hay calificaciones
- Informe N°4 de BioquímicaDocumento13 páginasInforme N°4 de Bioquímicaamanda grimaldoAún no hay calificaciones
- Tarea 3. Protocolo de Extracción de ADNDocumento7 páginasTarea 3. Protocolo de Extracción de ADNMarcos GarcíaAún no hay calificaciones
- MIDocumento4 páginasMICristinaMorenoPerezAún no hay calificaciones
- Analisis de Leche y Productos Lactos 19Documento38 páginasAnalisis de Leche y Productos Lactos 19Lucesita FAún no hay calificaciones
- InvertasaDocumento6 páginasInvertasaPedro Zúñiga100% (1)
- Extracción y Caracterización de PectinaDocumento2 páginasExtracción y Caracterización de PectinaKARYME GUTIERREZAún no hay calificaciones
- Determinacion de Vitamina B1Documento15 páginasDeterminacion de Vitamina B1DiazRuizJhonAún no hay calificaciones
- Procedimientos de BioquimicaDocumento2 páginasProcedimientos de BioquimicaCristhian ArocaAún no hay calificaciones
- Manual y Protocolos Del Area Biologia Molecualr HumanaDocumento43 páginasManual y Protocolos Del Area Biologia Molecualr HumanaAndreaAún no hay calificaciones
- Caolin PectinaDocumento2 páginasCaolin PectinaJavan Zaldivar100% (1)
- Parametros Fisicoquimicos de CarneDocumento5 páginasParametros Fisicoquimicos de CarneRuben RoseroAún no hay calificaciones
- Protocolo de Extracción de Adn de Plantas Basado en CtabDocumento4 páginasProtocolo de Extracción de Adn de Plantas Basado en CtabCesar Tolentino MasgoAún no hay calificaciones
- Laboratorio 3Documento3 páginasLaboratorio 3Cristian De la cruzAún no hay calificaciones
- 4 Bromatologia de La LecheDocumento42 páginas4 Bromatologia de La LecheAntu ATAún no hay calificaciones
- MetodologíaDocumento3 páginasMetodologíaDavid Ortiz GallegoAún no hay calificaciones
- Caracteristicas Organolepticas de La LecheDocumento4 páginasCaracteristicas Organolepticas de La LecheluisAún no hay calificaciones
- Primera Entrega - PropuestaDocumento3 páginasPrimera Entrega - PropuestaLuis Carlos benavidesAún no hay calificaciones
- Analisis de Leche Fresca de VacaDocumento7 páginasAnalisis de Leche Fresca de VacaMeinardo Bautista RuizAún no hay calificaciones
- ALMIDÓNDocumento13 páginasALMIDÓNOber Uquiche HuaracaAún no hay calificaciones
- Método Glories Con AnotacionesDocumento6 páginasMétodo Glories Con AnotacionesJosé Eduardo García SaucedoAún no hay calificaciones
- Práctica 1. Cuantificación Espectrofotométrica de FitoquímicosDocumento9 páginasPráctica 1. Cuantificación Espectrofotométrica de FitoquímicosDavid Vázquez HernándezAún no hay calificaciones
- Elaboracion de YogurtDocumento8 páginasElaboracion de YogurtSalinas Alexander ImodAún no hay calificaciones
- Métodos VitaminasDocumento10 páginasMétodos VitaminasJesxy PxrdoAún no hay calificaciones
- Procedimiento Extracción de Ácidos Nucleicos Por El Método de CTABDocumento8 páginasProcedimiento Extracción de Ácidos Nucleicos Por El Método de CTABCarlos FernandezAún no hay calificaciones
- Diagrama de Flujo Tirosinasa 1Documento3 páginasDiagrama de Flujo Tirosinasa 1Sebastián Rodríguez VelásquezAún no hay calificaciones
- Análisis Físico-Químico de HarinasDocumento13 páginasAnálisis Físico-Químico de HarinasMaria Teresa Barragan DominguezAún no hay calificaciones
- Analisis de Leche y Productos LactosDocumento28 páginasAnalisis de Leche y Productos LactosCarlos VelázquezAún no hay calificaciones
- Protocolos Laboratorio 1Documento23 páginasProtocolos Laboratorio 1ἄγγελος אבירAún no hay calificaciones
- NMX F 189 1970Documento3 páginasNMX F 189 1970Manuel JarabaAún no hay calificaciones
- Determinación de Cafeína en Bebidas EnergizantesDocumento4 páginasDeterminación de Cafeína en Bebidas EnergizantesCarlos Felipe Jaramillo LópezAún no hay calificaciones
- Ejercicios Espectroscopia VisibleDocumento3 páginasEjercicios Espectroscopia VisibleJAZ StylesAún no hay calificaciones
- PeroxidasaDocumento6 páginasPeroxidasadanko_3000Aún no hay calificaciones
- Practica 3.3Documento7 páginasPractica 3.3Elena Ayuso VergaraAún no hay calificaciones
- Determinación de Azucares Totales PDFDocumento6 páginasDeterminación de Azucares Totales PDFaguilaquecaeAún no hay calificaciones
- Instructivo de Los Metodos de Analisis de La Leche CrudaDocumento3 páginasInstructivo de Los Metodos de Analisis de La Leche CrudaYordan AlexisAún no hay calificaciones
- Determinación de PeroxidasasDocumento6 páginasDeterminación de PeroxidasasGabriela Vargas GonzálezAún no hay calificaciones
- Prueba Fosfatasa en La Leche Grupo 10Documento13 páginasPrueba Fosfatasa en La Leche Grupo 10ismael martinezAún no hay calificaciones
- Metodologías AdicionalesDocumento3 páginasMetodologías AdicionalesPaulina OrdoñezAún no hay calificaciones
- Analisis de LecheDocumento17 páginasAnalisis de LecheFATIMA DANIELA GUEVARA RUELASAún no hay calificaciones
- Análisis Cuantitativo Del Metabolito de Acetaminofen en OrinaDocumento2 páginasAnálisis Cuantitativo Del Metabolito de Acetaminofen en OrinaJohanna PegueroAún no hay calificaciones
- CIN2023 PracticaFinalDocumento23 páginasCIN2023 PracticaFinalDaniel CamachoAún no hay calificaciones
- Pract.3 IpnDocumento11 páginasPract.3 IpnSanchez Robles NaomiAún no hay calificaciones
- Trabajo LacteosDocumento4 páginasTrabajo LacteosAlondra Luciana Yarleque NavarroAún no hay calificaciones
- Higado de Rata Fosfatasa AlcalinaDocumento2 páginasHigado de Rata Fosfatasa AlcalinaNatali Zamora100% (1)
- Protocolo para Determinar La Calidad de La CarneDocumento3 páginasProtocolo para Determinar La Calidad de La CarneDoris Torres ParedesAún no hay calificaciones
- Pruebas de PlataformaDocumento5 páginasPruebas de PlataformaSarita AntolinezAún no hay calificaciones
- Informe de Laboratorio 1.2.3Documento41 páginasInforme de Laboratorio 1.2.3marcelaAún no hay calificaciones
- Determinacion de Arsenico en Papa Zanahoria y LecheDocumento5 páginasDeterminacion de Arsenico en Papa Zanahoria y LechePaola EstefaniAún no hay calificaciones
- Dieta Paleo: Recetas Fáciles De La Dieta Paleo Para Bajar De Peso, Cuerpo Sano Y Mente SanaDe EverandDieta Paleo: Recetas Fáciles De La Dieta Paleo Para Bajar De Peso, Cuerpo Sano Y Mente SanaAún no hay calificaciones