Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Retículo Endoplasmático Rugoso
Cargado por
Camila Peralta TamayoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Retículo Endoplasmático Rugoso
Cargado por
Camila Peralta TamayoCopyright:
Formatos disponibles
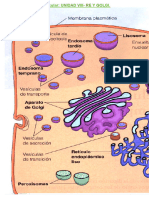
Los ribosomas son orgánulos no membranosos conocidos ampliamente por su
implicación en la síntesis de proteínas. Debido a su gran relevancia en el proceso de
síntesis de proteínas, en el presente video revisaremos como es la composición de los
ribosomas y de que manera y donde se sintetizan. Además hablaremos de cómo se
lleva a cabo el proceso de síntesis de proteínas a través de estos orgánulos.
¡Espero que lo disfrutes!
La síntesis de proteínas las pueden realizar libres en el citoplasma o unidos a un
orgánulo membranoso conocido como retículo endoplasmático rugoso, que además
de ser un almacenador de proteínas también ayuda a su plegamiento y promueve
modificaciones postraduccionales como la es incorporación de carbohidratos
(glicosilación). En el presente video hablaremos sobre la composición y función del
RER.
Capítulo 4: Síntesis y degradación de macromoléculas
Retículo endoplasmático rugoso
Estructura y composición
1952 —> Porter y Palade observan que los RER son uy abundantes en células
basófilas secretoras
Ejemplos de células basó filas secretoras:
- células plasmáticas
- células acinares del páncreas
- osteoblastos
Retículo endoplasmático configurado por:
Cisternas y no por túbulos
¿Por qué vemos como un tubo a los cortes de la microscopia electrónica
convencional?
Por la pérdida de una dimensión al observar sólo un plano y no una estructura
tridimensional, eso es lo que observamos al ver una microscoía electrónica
convencional.
Cuando se hacen cortes seriados se mantiene el aspecto tubular en una amplia
serie de cortes porque son cisternas.
Si fueran túbulos, no se verían así en los cortes, sino como ojales.
A: cisternas de RER dispuestas en espiral en una célula de Sertoli: x 12,000
B: células plasmáticas: con el citoplasma ocupado en casi su totalidad por
cisternas de retículo endoplasmático rugoso dispuestas ordenadamente (estrella),
excepto en la zona central donde hay un complejo de Golgi prominente (asterisco)
C: Fibroblasto de la cápsula glandular suprarrenal de perro
Tamaño de la luz del retículo endoplasmático rugoso: desde unos 20 a 40 nm hasta
casi un micrómetro cuando la cisterna está ensanchada por el contenido.
Aspecto del RER en microscopía electrónica convencional: NO se tiñe, por lo que su
aspecto es de sáculos o cisternas vacías aunque en algunas células tiene un aspecto
semidenso.
Excepciones: inclusiones cristalinas: cuerpos de Russell, aparecen dentro del RER: en
condiciones patológicas como mielomas.
RER: se aísla por: centrifugación diferencial
Claude (1945) describió al RER como: la fracción microcósmica. —> vesículas con
ribosomas adheridos (microsoma)
Se forman vesículas en vez de cisternas cuando: hay fragmentación y cierre sobre sí
mismas de las membranas del RER que se rompen en la centrifugación.
¿Cómo se separa al RER de los ribosomas?
1. Con el tratamiento con detergentes como desoxicolato
El desoxicolato…
* disuelve las membranas que quedan en el sobrenadante mientras los ribosomas se
precipitan
2. Con el tratamiento de la RNAasa, disuelve a los ribosomas y queda el retículo
endoplasmático.
Conformación de membranas del RER:
- 30% lípidos
- 70% proteínas
¿Qué tiene más contenido en proteínas, el RER o la membrana plasmática?
- El RER
La membrana del RER (7nm) es más delgada que la plasmática (10nm). Contiene más
de 140 proteínas diferentes, la mayoría específicas, implicada en:
* la fijación de los ribosomas por subunidad mayor.
* reconocimiento de péptico señal específico de las proteínas sintetizadas por esos
ribosomas
*translocación, glucolisación, y procesado de estas proteínas.
Ejemplo de proteínas:
* reductase de NADH
*nucleótido difosfatas
* citocromos b5 y P450
La bicapa lipídica del RER es más delgada también porque los grupos NO polares de
los lípidos miden 4nm de espesor en vez de 5nm porque sus cadenas son menos
largas y menos saturadas.
- carecen de: esfingomielina, glucolípidos y hay menos colesterol
- posee algo de ceramida : porque luego en el complejo de Golgi se va a formar la
esfingomielina en el complejo de Golgi (se le une fosfato y colina).
-posee algo de asimetría en la hemimembrana E del RE debido a que parte de la
fosfatidil serina se transforma en ceramida.
Enzima que distribuye los fosfolípidos de manera igual entre ambas
hemimembranas: escambralasa.
Se da la verdadera asimetría en la membrana plasmática porque sólo ahí
encontramos a la enzima: flipasa. Transloca fosfatidil etanolamina y fosfatidil serina
de la hemimembrana E a la P
Función RER:
-almacena proteínas sintetizadas por sus ribosomas para su glucolisación y
empaquetamiento
Las que no se quedan en el RER no se glucolisan, no se empaquetan y permanecen
en el hialoplasma: si se mueven es por membrana del organillo hacia donde van o por
sistema de bombeo.
Glucoproteínas en el hialoplasma o en el nucleoplasma (sint. Por ribososomas libres):
1. Heparin sulfato especiales localizados en en el nucleoplasma.
2. Proteoglucanos con residuos de manosa unidos a O, como en hialoplasma de
neuronas.
3.Residuos de manosa unidos a hidroxilos de tirosina durante la gluconeogénesis.
Glucolisación desfavorece: plegamiento de las proteínas y su unión de las chaperonas.
Porque se hacen más resistentes a degradación proteolítica y determina antígenos.
Almacenamiento de proteínas en el RER
-Se puede seguir y calcular el tiempo en el que pasan de un compartimento a otro. Si
se administra Leucina tiritada a células del páncreas, que se incorpora a la amilasa.
Luego se hace una centrifugación diferencial para obtener 3 componentes de la
fracción microsómica:
1. Membranas del RE
2. Ribosomas
3. Sobrenadante
Se mide la cantidad de leucina triturada: tomando muestras cada minuto tras la
administración del aminoácido marcado.
1. 3 primeros minutos: marcado radioactivo
2. 3 o 4 siguientes marcaje estable en ribosomas y comienzan a aparecer en el RER
3. A partir de los 7 minutos el marcaje alcanza nivel estable en el RER o ddisminuye
**** en el sobrenadante siempre aparece algo de leucina marcada que se atribuye a la
contaminación en la separación de fracciones.
Unión de ribosomas al RER y penetración de la proteína sintetizada comporta los
siguientes procesos:
1. Cadena polipeptídica que crece contiene: un péptico de señalización aminoterminal
que define el destino de ese polipéptido hacia el RER
2. Partícula de reconocimiento de del péptico señal formado por 6 proteínas sobre
armazón de un RNA 7s
- en bacterias: en hialoplasma unido por lugar A del Ribosomas, se desliza y queda en
en contacto con la SRP (unión que detiene temporalmente la síntesis protéica)
3. Ribosomas unido a la SRP se desplaza hasta RER, el extremo de la SRP no unido al
Ribosoma se une a una proteína integral de la membrana del RER llamada receptor de la
SRP. Cuando se ancla el Ribosomas al RER, la SRP se libera y vuelve al citosol. Esta
liberación requiere la hidrólisis del GTP Y SE RENAUDA LA SÍNTESIS PROTÉICA.
4. Actúa complejo translocador de la membrana del retículo endoplasmático rugoso:
complejo Sec61, que comprende 4 complejos proteicos: cada uno formado por 3
proteínas transmembrananosas ensambladas en anillo.
Sec61 actúa como poro acuoso y permite la entrada del polipéptido a la luz del RE
mientras se sintetiza.
Su extremo amino queda anclado en la membrana por la péptico señal y su transferencia
requiere ATP. Cuando el péptico señal se une a SEc61, la proteína translocadora se
activa y abre el poro.
5. El pe´ptido señal se queda anclado a la membrana hasta que finaliza la síntesis
protéica y ahí libera al péptico señal en la bicapa lipídica, donde se lisa y la proteína
queda libre en la luz del RER. No es común que las proteínas comiencen a transferirse si
no ha terminado su síntesis
glucolisación:
La mayoría de las proteínas contienen glúcidos
- cadena corta: oligoscáridos: glucoproteínas
Proteínas más resistentes a digestión por proteasas: enzimas digestivas, hormonas,
proteínas del plasma, anticuerpos y secreciones qu recubren células como el moco de
las células calciformes
proteínas con glúcidos: proteoglucanos: abundantes en matriz extracelular
Su proteína tiene un eje central del que cuelgan cadenas no ramificadas llamadas:
glucosaminoglucanos: cada uno formado por un disacárido repetido múltiples veces
hasta 80 residuos
Whur + Hersecovics: usaron manos tritiada y demostraron la incorporación de este azúcar
en el RER de células de glándula tiroidea: se han investigado los glúcidos que se unen a
las proteínas de este orgánulo
RER tipo de oligosacárido único ue se transfiere: 14 azúcares, dos moléculas de N-acetil-
glucosamina 9 de manosa y 3 de glucosa: unido a cadena lateral de residuos de -NH2
asparagina Asnal-X-Ser o Así-X-Thr y X es cualquier aminoácido unido a la propina:
oligosacáridos unidos a nitrógeno U oligosacáridos N
Los oligosacáridos N resultan de la modificación de esa única molécula precursora
y corre cuando pasa al complejo de Golgi, los oligosacáridos O son menos
frecuentes que los anteriores.
Las glucosil transferasas activan azúcares en el hialoplasmapor formación de productos
intermedios azúcar-nucleótido y así se llega al dolicol-fosfato que transfiere azúcares
desde el hialoplasma hasta la luz del RER DONDE SE UNEN A LA ASPARAGINA DEL
LADO LUMINAL de la membrana DEL RER:
- unión catalizada por la oligosacárido proteína transferasa 8centro activo en superficie
luminal)
-forma complejo con proteínas llamadas riboforinas
-los 3 residuos de la glucosa del oligosacárido y una manosa se eliminan rápidamente en
el propio RER
En la luz del RER algunas proteínas se unen a un oligosacárido que está unido a 2
moléculas de colina-fosfato y a su vez a un fosfatidil inositol de la hemimembrana E:
LUEGO CUANDO EMIGRA ESTA PROTEÍNA SE CONVIERTE EN GLUCOCÁLIX
También podría gustarte
- Páginas de Manual de Biología Celular-2Documento16 páginasPáginas de Manual de Biología Celular-2camila.sanchez20066Aún no hay calificaciones
- 20.retículo Endoplasmico RugosoDocumento22 páginas20.retículo Endoplasmico RugosoNadia SanchezAún no hay calificaciones
- Re, Golgi, Lisosoma, Peroxisoma, MitocondriaDocumento118 páginasRe, Golgi, Lisosoma, Peroxisoma, MitocondriaJosselin Saavedra LópezAún no hay calificaciones
- SEMDocumento11 páginasSEMjulissagonzalezzuritaAún no hay calificaciones
- Retículo RugosoDocumento6 páginasRetículo RugosoZuriel HernandezAún no hay calificaciones
- El Retículo EndoplasmáticoDocumento11 páginasEl Retículo EndoplasmáticoMartin CrisantoAún no hay calificaciones
- Citología Parcial 2Documento58 páginasCitología Parcial 2Aroa SilvaAún no hay calificaciones
- Trabajo de BiologiaDocumento11 páginasTrabajo de Biologialoaizaj12Aún no hay calificaciones
- Transporte de ProteinasDocumento9 páginasTransporte de ProteinasGise MathierAún no hay calificaciones
- Complejo RE y Aparato de GolgiDocumento38 páginasComplejo RE y Aparato de GolgileinyAún no hay calificaciones
- Sistema de Membranas Citoplasmaticas o Sistema de EndomembranasDocumento9 páginasSistema de Membranas Citoplasmaticas o Sistema de EndomembranasValentina CelaniAún no hay calificaciones
- Presentacion Retículo EndoplásmicoDocumento46 páginasPresentacion Retículo Endoplásmicobresojiar100% (2)
- Biologia SEMANA 9Documento4 páginasBiologia SEMANA 9john salchichon67% (9)
- Reticulo Endoplasmatico - Distribución y Transporte de ProteínasDocumento5 páginasReticulo Endoplasmatico - Distribución y Transporte de ProteínasSara NogueiraAún no hay calificaciones
- Proteinas Biologia LauDocumento14 páginasProteinas Biologia LauRita TolabaAún no hay calificaciones
- Distribución y Transporte de Proteínas PDFDocumento38 páginasDistribución y Transporte de Proteínas PDFtaurito26100% (1)
- CITOLOGIADocumento3 páginasCITOLOGIARo11Aún no hay calificaciones
- Cap.10 Orgánulos Que Participan en La Sintesis y DegradacionDocumento21 páginasCap.10 Orgánulos Que Participan en La Sintesis y DegradacionJuan Carlos Ledo GarciaAún no hay calificaciones
- Sistema de EndomembranasDocumento27 páginasSistema de EndomembranasSofía TorresAún no hay calificaciones
- MEMBRANA. ExposicionDocumento16 páginasMEMBRANA. ExposicionJuan PabloAún no hay calificaciones
- Sistema de EndomembranasDocumento35 páginasSistema de EndomembranasMaria Paula Quintero TamayoAún no hay calificaciones
- Taller EndomembranasDocumento9 páginasTaller EndomembranasPatty Lopez0% (1)
- Problema Integrador TP3Documento1 páginaProblema Integrador TP3Kevin Andres Z.Aún no hay calificaciones
- Reticulo Endoplasmatico RugosoDocumento9 páginasReticulo Endoplasmatico RugosoJt La Verdad Sin Verdad100% (1)
- Tema 9. Retículo Endoplásmico Liso y RugosoDocumento48 páginasTema 9. Retículo Endoplásmico Liso y RugosoCristina BlancoAún no hay calificaciones
- Retículo Endoplásmico y Secreción de ProteínasDocumento7 páginasRetículo Endoplásmico y Secreción de ProteínasKevin Andres Z.Aún no hay calificaciones
- Modulo 8-04Documento17 páginasModulo 8-04Gustavo RaeleAún no hay calificaciones
- Tema 5 Endomembranas Acortado 2018-2019Documento46 páginasTema 5 Endomembranas Acortado 2018-2019Daniel Fernandez-ValenciaAún no hay calificaciones
- Tema 5Documento9 páginasTema 5Irene Pulido SerranoAún no hay calificaciones
- E11 Retà - Culo EndoplasmáTicoDocumento28 páginasE11 Retà - Culo EndoplasmáTicoIago AraújoAún no hay calificaciones
- Distribución y Transporte de ProteínasDocumento41 páginasDistribución y Transporte de ProteínasJhonny Ponce Agui100% (2)
- Unidad 3 - Sistemas de EndomembranasDocumento17 páginasUnidad 3 - Sistemas de EndomembranasMelAún no hay calificaciones
- Sistema de EndomembranasDocumento50 páginasSistema de EndomembranasAngela AliagaAún no hay calificaciones
- Sistema de EndomenbranasDocumento25 páginasSistema de Endomenbranaselmedico2013Aún no hay calificaciones
- 10.1 - Sist Endome - Reticulo EndoplasmaticoDocumento32 páginas10.1 - Sist Endome - Reticulo Endoplasmaticojanire cabezasAún no hay calificaciones
- Retículo Endoplásmico Pi MZVDocumento29 páginasRetículo Endoplásmico Pi MZVCool BoyLVAún no hay calificaciones
- TEMA 10 Apuntes Bio-CelDocumento12 páginasTEMA 10 Apuntes Bio-CelBelén FernándezAún no hay calificaciones
- Biologia - Sistema de EndomembranasDocumento39 páginasBiologia - Sistema de EndomembranasDRAW KING ArtAún no hay calificaciones
- Unidad 5 BioDocumento7 páginasUnidad 5 Biomolina.ailen99Aún no hay calificaciones
- Taller OrgánulosDocumento23 páginasTaller OrgánulosJose TôrrësAún no hay calificaciones
- Tráfico VesicularDocumento55 páginasTráfico VesicularAficionadoAún no hay calificaciones
- Vesículas de Transporte o de TransiciónDocumento4 páginasVesículas de Transporte o de TransiciónÁlex Willan Acuña SilvaAún no hay calificaciones
- Retículo EndoplasmáticoDocumento20 páginasRetículo EndoplasmáticoAlba Macipe FeitoAún no hay calificaciones
- Tema 6 AcabadoDocumento13 páginasTema 6 AcabadoMagdalena Oñate SerranoAún no hay calificaciones
- Biología Re y GolgiDocumento6 páginasBiología Re y GolgiNabila InsfranAún no hay calificaciones
- Resolucion Guia 4 - Ayudantias DBIO1070Documento11 páginasResolucion Guia 4 - Ayudantias DBIO1070MarianaAún no hay calificaciones
- TEMA 5 - v1Documento19 páginasTEMA 5 - v1Bea LopezAún no hay calificaciones
- Reticulo EndoplasmaticoDocumento9 páginasReticulo EndoplasmaticoEnrique Ochoa0% (1)
- Reticulo Endoplasmatico Aparato de Golgi LisosomasDocumento28 páginasReticulo Endoplasmatico Aparato de Golgi LisosomasDiegoAún no hay calificaciones
- Retículo EndoplasmáticoDocumento8 páginasRetículo Endoplasmáticocongaconga123Aún no hay calificaciones
- Bloque Tematico 2 BiologiaDocumento39 páginasBloque Tematico 2 Biologiaangelica carrilloAún no hay calificaciones
- CLASE 3 Sistema de EndomembranasDocumento30 páginasCLASE 3 Sistema de EndomembranasKeren RuizAún no hay calificaciones
- Retículo Endoplásmico Rugoso.: Fisiología CelularDocumento23 páginasRetículo Endoplásmico Rugoso.: Fisiología CelularYane RosalesAún no hay calificaciones
- 13) Reticulo EndoplasmicoDocumento27 páginas13) Reticulo EndoplasmicoPerla Gutiérrez RogelAún no hay calificaciones
- Clase 11 - Sistema de EndomembranasDocumento29 páginasClase 11 - Sistema de EndomembranasBruno Emanuelli100% (1)
- Reticulo Endoplasmatico Aparato de Golgi Lisosomas-With-Cover-Page-V2 PDFDocumento29 páginasReticulo Endoplasmatico Aparato de Golgi Lisosomas-With-Cover-Page-V2 PDFScarlett OrtizAún no hay calificaciones
- Peroxisoma y REL1Documento7 páginasPeroxisoma y REL1Uther PendragonAún no hay calificaciones
- Sistemas de Endomembranas - Peroxisomas - Vacuola 2021-IIDocumento49 páginasSistemas de Endomembranas - Peroxisomas - Vacuola 2021-IIKaren FelixAún no hay calificaciones
- MITOCONDRIADocumento7 páginasMITOCONDRIAJorge Luis100% (1)
- Acceso a Universidad para Mayores de 25 años. Biología.: Solucionario Pruebas 2006-2012De EverandAcceso a Universidad para Mayores de 25 años. Biología.: Solucionario Pruebas 2006-2012Aún no hay calificaciones
- Celula Mitosis MeiosisDocumento11 páginasCelula Mitosis MeiosisMonikaDiosa04Aún no hay calificaciones
- ALFALFADocumento6 páginasALFALFACarmen IuzAún no hay calificaciones
- 4 M Todos Proteina Lic. Q. Marcela TorresDocumento32 páginas4 M Todos Proteina Lic. Q. Marcela TorresisabellaAún no hay calificaciones
- 08 PAU MetabolismoDocumento24 páginas08 PAU MetabolismoevaAún no hay calificaciones
- BMC8 9 12Documento10 páginasBMC8 9 12Juan Carlos LescanoAún no hay calificaciones
- Autoevaluaciones - 2 Bioquimica Metabolica Trabajo FinalDocumento15 páginasAutoevaluaciones - 2 Bioquimica Metabolica Trabajo FinalDyan Di TorreAún no hay calificaciones
- Fases de La FarmacocinéticaDocumento1 páginaFases de La FarmacocinéticaDiana JoselinAún no hay calificaciones
- Clase 01 Biologia Cpech - Organizacion Biologica v.2 (OliverClases)Documento39 páginasClase 01 Biologia Cpech - Organizacion Biologica v.2 (OliverClases)Oliver Henriquez Aracena100% (7)
- Hormonas VegetalesDocumento12 páginasHormonas VegetalesVALENTINA SANCHEZ GAVIRIAAún no hay calificaciones
- La Boca, La Faringe.Documento18 páginasLa Boca, La Faringe.Florinda RojasAún no hay calificaciones
- Ciclo Celular y Procesos de CrecimientoDocumento3 páginasCiclo Celular y Procesos de CrecimientoPacoLAún no hay calificaciones
- Tema IV Bacteriología MédicaDocumento37 páginasTema IV Bacteriología Médicavania anayaAún no hay calificaciones
- Tema 5. Digestión, Absorción y MetabolismoDocumento36 páginasTema 5. Digestión, Absorción y MetabolismoMarcos Belmar OrtizAún no hay calificaciones
- Movimiento Microbiano y Respuestas SensorialesDocumento12 páginasMovimiento Microbiano y Respuestas SensorialesIsabella MartinezAún no hay calificaciones
- Resistencia Bacteriana1Documento58 páginasResistencia Bacteriana1Elisa ArteagaAún no hay calificaciones
- Respuestas Guia de Biologia 2º Medio Manipulacion GeneticaDocumento3 páginasRespuestas Guia de Biologia 2º Medio Manipulacion GeneticaJaviera ValenzuelaAún no hay calificaciones
- Material GeneticoDocumento9 páginasMaterial GeneticoBrayan Gregori Uceda PaicoAún no hay calificaciones
- Reticulo Endoplasmatico Liso .....Documento7 páginasReticulo Endoplasmatico Liso .....DJ CRONOS100% (4)
- Hormonas (Mecanismo de Accion)Documento1 páginaHormonas (Mecanismo de Accion)Laisha Lynn Teran SantiagoAún no hay calificaciones
- MONOGASTRICOSDocumento21 páginasMONOGASTRICOSLupita SeFiAún no hay calificaciones
- Colegio Comunal Albert Einstein: "Educamos para Forjar Personas en Valores, Convivencia y Comportamiento Social"Documento2 páginasColegio Comunal Albert Einstein: "Educamos para Forjar Personas en Valores, Convivencia y Comportamiento Social"kiromy ytAún no hay calificaciones
- Cuestionario Principios Basicos de FarmacologiaDocumento4 páginasCuestionario Principios Basicos de FarmacologiaJüän Vërdthy FüëńtësAún no hay calificaciones
- Interacciones Farmacológicas de Los Anticuerpos MonoclonalesDocumento8 páginasInteracciones Farmacológicas de Los Anticuerpos MonoclonalesjosueAún no hay calificaciones
- Nuevo Documento de Microsoft WordDocumento3 páginasNuevo Documento de Microsoft WordLaura CalderonAún no hay calificaciones
- Bioquimica Carbohidratos y LipidosDocumento16 páginasBioquimica Carbohidratos y LipidosRodrigo Iriarte Gomez100% (1)
- 4enzimas Restriccion 1Documento44 páginas4enzimas Restriccion 1Ickroz ZuñigaAún no hay calificaciones
- El Nucléolo enDocumento29 páginasEl Nucléolo enFredy Alberto CabasAún no hay calificaciones
- Practica 7 Delgado y DiazDocumento10 páginasPractica 7 Delgado y DiazEdith Citlalli Diaz EstradaAún no hay calificaciones
- Modelos Preguntas Teoricas RespuestasDocumento29 páginasModelos Preguntas Teoricas RespuestasKatyalejandra Verjel NavaroAún no hay calificaciones
- Informe Biologia Acción de Una Enzima de Tejidos Vegetales y AnimalesDocumento12 páginasInforme Biologia Acción de Una Enzima de Tejidos Vegetales y AnimalesJuan Camilo Crespo Duque100% (1)