Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Fisiologia: Coagulación
Cargado por
Andrea Rojas Abad0 calificaciones0% encontró este documento útil (0 votos)
12 vistas38 páginasTítulo original
Untitled
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
12 vistas38 páginasFisiologia: Coagulación
Cargado por
Andrea Rojas AbadCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 38
FISIOLOGIA
COAGULACIÓN
VEREAU GUTIERREZ, MIGUEL ANGEL F.
AGENDA
1. Endotelio: Sustancias antitrombogénicas
2. Fases dela hemostasia y fibrinolisis
3. Coagulación: Vía clásica y nueva teoría
4. Control de la coagulación
5. Anticoagulantes: Heparinas, Warfarina, antiagregantes plaquetarios
(aspirina, clopidogrel)
6. Inhibidores de la fibrinolisis (ácidos aminocaproico y tranexámico)
7. Análisis de laboratorio que monitorean la coagulación
8. Trastornos de la coagulación ( Trastornos plaquetarios, de factores
de coagulación: hemofilias)
COAGULACIÓN
Hemostasia es el conjunto de mecanismos aptos para detener los procesos hemorrágicos.
En condiciones normales, los vasos sanos están recubiertos internamente por una capa de células
endoteliales, que forman el endotelio. Este tejido es antitrombogénico, es decir:
protege de la activación de las plaquetas, sintetizando prostaciclina (PGI2) y
monóxido de nitrógeno (NO). El endotelio también sintetiza proteoglucanos de
sulfato de heparán que aumentan la actividad de la antitrombina mil veces. La
antitrombina es una proteína plasmática, producida en el hígado, que inhibe las
enzimas de coagulación de las vías intrínseca, extrínseca y común.
Externamente al endotelio se encuentra el subendotelio, que es un tejido trombogénico: es
el lugar de adhesión de las plaquetas y de activación de la coagulación. Cuando se produce
daño tisular, los vasos se rompen y el subendotelio entra en contacto con la sangre: las
plaquetas entran en contacto con el colágeno de la matriz extracelular, lo que provoca su
activación y el inicio del proceso de hemostasia.
El actor principal de la hemostasia son las plaquetas. Presenta: gránulos α, que
contienen: factor 4 plaquetario, factor de von Willebrand, fibrinógeno,
fibronectina, factor V, factor VIII, PDGF y TGF-beta; gránulos densos o δ:
contienen calcio, ADP, ATP serotonina, histamina y adrenalina.
Fases de la hemostasia
Vasoconstricción refleja: Respuesta simpática inmediata al daño del vaso sanguíneo Favorece
la marginación de las células sanguíneas, acercándolas al sitio de la lesión.
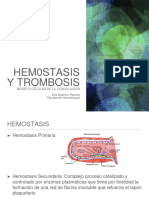
Hemostasia primaria (tapón hemostático primario) (tapón plaquetario)
Se forma un tapón o coágulo primario, soluble y reversible, porque los trombocitos se
adhieren fuertemente al colágeno libre del vaso sanguíneo dañado y se unen por una red de
fibrinógeno. Sus etapas son: Adhesión de las plaquetas (factor de von Willebrand), activación
y secreción de las plaquetas y agregación de las plaquetas.
Hemostasia secundaria (coagulación). Proceso enzimático, por el cual el fibrinógeno soluble
se convierte en fibrina insoluble, capaz de polimerizar y entrecruzarse, formando el coágulo
secundario, estable e insoluble.
Fibrinólisis: Después de que el coágulo se ha establecido, comienza la reparación de los
tejidos con el proceso de cicatrización. Para esto el coágulo es colonizado por células que
formarán nuevos tejidos y va siendo degradado. La degradación de la fibrina (fibrinólisis), es
catalizada por la plasmina. La plasmina se genera a partir del plasminógeno, un precursor
inactivo que se activa por el activador tisular del plasminógeno y el activador del
plasminógeno tipo urocinasa (uPA) que interviene en la fibrinolisis extravascular en respuesta
a estímulos inflamatorios. Estos activadores se producen en las células endoteliales.
El principal inhibidor de la fibrinolisis in vivo es el inhibidor del activador del plasminógeno
tipo 1 o PAI-1, que se sintetiza en el endotelio vascular y en el hígado. Otro mecanismo es la
vía del inhibidor de la fibrinolisis activable por trombina (TAFI).
INICIO DE LA COAGULACIÓN
Vía Extrínseca: El factor tisular (TF) se expresa en la superficie de las células
subendoteliales del musculo liso y los fibroblastos, que se exponen cuando la pared
del vaso está dañada. El TF une el factor VIIa y mejora su eficacia catalítica. El
complejo TF/factor VIIa inicia la coagulación activando los factores IX y X.
La vía intrínseca se inicia, in vitro, cuando el factor XII, precalicreína y cininógeno de alto peso molecular
interactúan con caolín, vidrio u otra superficie cargada, negativamente, para generar pequeñas cantidades de
factor XIIa. El factor XII puede activarse, in vivo, por contacto de la sangre con dispositivos médicos, como las
válvulas cardiacas mecánicas o círculos extracorpóreos; o por DNA libre de células trampas extracelulares de
neutrófilos, estructuras tipo red compuestas de DNA e histonas, extruidas a partir de neutrófilos activados, o
polifosfatos inorgánicos, liberados a partir de plaquetas activadas.
El factor XIIa activa el factor XI y el factor resultante XIa, luego activa el
factor IX. El factor IXa activa el factor X, en una reacción acelerada por el
factor VIIIa, fosfolípidos aniónicos y Ca2+. La generación optima de
trombina depende de la formación de este complejo de factor IXa porque
activa el factor X, de manera más eficiente que el complejo de factor
VIIa-TF. La deficiencia de factor XII o XI no da sangrado excesivo, sin
embargo la deficiencia de factor VIII o IX (hemofilia A y B,
Activación de protrombina
El factor VIII y el factor V son procofactores. Una vez activados, los
cofactores se unen a la superficie de las plaquetas activadas y sirven
como receptores, el factor VIIIa del factor IXa, mientras que el factor Va
del factor Xa. Los factores VIIIa y Va se unen también a sus sustratos,
los factores X y la protrombina (factor II), respectivamente.
En presencia del factor Va, una superficie fosfolípida cargada negativamente, y
Ca2+ (el llamado complejo de protrombinasa), el factor Xa activa la protrombina
en trombina con una eficacia 109 veces mayor. Esta tasa máxima de activación
solo ocurre cuando la protrombina y el factor Xa contienen residuos Gla en sus
terminales amino, lo que les otorga la capacidad de unirse al calcio e interactuar
con la superficie del fosfolípido aniónico.
Para prevenir la lisis prematura del coágulo, el factor XIIIa media la formación de enlaces
cruzados covalentes, de pequeñas cantidades de antiplasmina-α2, sobre la fibrina.
INICIACIÓN
El FT es el principal iniciador de la coagulación in vivo que actúa como
receptor para el factor VII. Cuando se produce una lesión (ruptura del enlace
peptídico ARG/ISO) en la pared vascular, las células subendoteliales que
contienen FT entran en contacto con el plasma y al unirse al factor VII crean el
complejo FT/ VIIa (primer complejo enzimático que inicia la cascada in vivo).
Éste complejo a su vez activa más VII, y también actúa sobre el factor IX y X. El
factor Xa se combina en la superficie celular (fibroblasto, célula endotelial, monocito) con el
Va para producir pequeñas cantidades de trombina, que activará a las plaquetas y al factor
VIII en la siguiente fase.
AMPLIFICACIÓN
En esta fase las plaquetas se activan al adherirse a la matriz subendotelial en
lugares donde se ha expuesto el FT. Las pequeñas cantidades de trombina generadas
en la fase anterior junto con el calcio sanguíneo y los fosfolípidos plaquetarios, amplifican la
señal procoagulante inicial activando a los factores V, VIII y XI que se ensamblan en
la superficie plaquetar formando dos complejos que iniciarán la fase siguiente.
PROPAGACIÓN
Los complejos iniciadores de la propagación son la tenasa (VIIIa/ IXa, Ca2+ y fosfolípidos) y el
complejo protrombinasa (Va/Xa, Ca2+ y fosfolípidos). El complejo tenasa cataliza la
conversión del factor Xa, mientras que el complejo protrombinasa cataliza, a nivel de la
superficie plaquetar, la conversión de protrombina en grandes
cantidades de trombina, lo que se conoce como “explosión de trombina” necesaria
para la formación de un coágulo estable de fibrina.
La trombina generada, activará al factor XIII o factor estabilizador de fibrina y a un inhibidor
fibrinolítico (TAFI) necesarios para la formación de un coágulo de fibrina resistente a la lisis.
La trombina es la enzima principal de la coagulación. Sus principales funciones son: Activación
de las plaquetas, del cofactor V y VIII, del factor XI y XIII, activación de la vía del inhibidor de la
fibrinolisis por trombina (TAFI), es la enzima responsable de la transformación del
fibrinógeno a fibrina, interviene en la unión al receptor PAR-4 en la superficie de las plaquetas
y participa en los procesos de inflamación y cicatrización de heridas.
En resumen, según el modelo celular de la hemostasia, la coagulación fisiológica depende del
contacto del FT subendotelial en el lugar de la lesión con el factor VIIa y del ensamblaje de las
reacciones de coagulación a nivel de superficie plaquetar, lo que favorece la formación de
trombina a nivel local y la generación de un coágulo estable de fibrina. Este modelo contempla
una vía única y la focalización del proceso en las superficies celulares.
CONTROL DE LA COAGULACIÓN
Existen varios mecanismos que regulan la coagulación para prevenir un exceso
de formación de trombina y la posible oclusión del flujo sanguíneo. Existe una
expresión de antitrombina III y del inhibidor de la vía del factor tisular (TFPI) que
inhiben al factor Xa que no está unido a las células que liberan TF o las plaquetas
activadas.
Por otra parte la trombina se autorregula al unirse a la trombomodulina y así
activar a la proteína C que va a impedir la generación de nuevas moléculas de
trombina al degradar irreversiblemente el factor Va y el VIIIa. Esta proteína
requiere de un cofactor la proteína S que va a actuar aumentando su afinidad
por la membrana celular unas 10 veces. La proteína C inhibirá al factor Va en un
endotelio no dañado, pero no lo bloqueará si se encuentra sobre una plaqueta
activada. El complejo proteína C-proteína S también inactiva a un importante
inhibidor de la fibrinolisis, el inhibidor del activador del plasminógeno. La
fibrinolisis es esencial para disolver el coágulo formado por los mecanismos
hemostáticos. La deficiencia de proteinas C o S se asocia con mayor riesgo e
trombosis venosa.
ANTICOAGULANTES
HEPARINA NO FRACCIONADA (HNF)
Se extrae habitualmente de la mucosa intestinal porcina, rica en mastocitos.
No tiene actividad anticoagulante intrínseca sino que se une a la
antitrombina III (ATIII), produciendo un cambio conformacional que aumenta
la capacidad inhibitoria de esta enzima sobre los factores de coagulación:
trombina (IIa), Xa y IXa. Neutraliza la trombina evitando la conversión del
fibrinógeno a fibrina. Previene la formación de un coágulo estable por
inhibición del factor estabilizador de la fibrina. Para que la inactivación de
trombina sea acelerada debe formarse un complejo terciario de ATIII +
heparina + trombina. Su efecto se mide con el TPT (21-35 segundos), que
evalúa la vía intrínseca (factores I, II, V, VIII, IX, X, XI y XII). El factor
plaquetario 4 limita la actividad de la heparina en la vecindad de los trombos
ricos en plaquetas. Dosis altas de heparina puede inhibir la agregación
plaquetaria y aumentar el tiempo de sangrado (0.5% de casos), pero la
enoxaparina tiene poco efecto sobre las plaquetas. La heparina también
ocasiona la liberación de una lipasa que degrada los triglicéridos y aumenta el
riesgo de osteoporosis; además puede inhibir la secreción aldosterona y
producir hiperkalemia.
HEPARINAS DE BAJO PESO MOLECULAR:
Resultan de la fragmentación de la heparina estándar. Tienen menor actividad
inhibitoria de la trombina o factor IIa pero mantienen igual potencia respecto al
factor Xa por lo que presentan menor riesgo de hemorragia pero igual actividad
antitrombótica. La vía subcutánea es la vía clásica de administración tanto de la
HNF como de las HBPM. La intravenosa se utiliza para la HNF en tratamientos de
urgencia.
En caso de hemorragia potencialmente mortal por heparina NF se usa
protamina EV que la revierte rápidamente uniéndose a la heparina y también
tiene efecto anticoagulante propio uniéndose a plaquetas y fibrinógeno.
Se recomiendan el uso de heparina en el tratamiento de
trombosis venosa profunda con o sin embolia pulmonar. Se
inicia con heparina y cuando se estabiliza el tiempo de protrombina al valor
deseado, se deja la heparina y se continua con los anticoagulantes orales.
En pacientes ambulatorios se prefiere la HBPM, asociada a dicumarínicos
desde el primer día.
HEPARINAS
En cuanto a profilaxis, en pacientes quirúrgicos, se recomienda la
administración de HNF o HBPM en pacientes de moderado a alto riesgo
(cirugía ortopédica mayor: prótesis de cadera o de rodilla, o fractura de
cadera; cirugía oncológica abdominal y pélvica. EPOC descompensado,
accidente vascular encefálico con paresia o parálisis, infarto agudo de
miocardio, insuficiencia cardíaca clase IV, estancia en unidades de cuidados
intensivos, obesidad mórbida, edad avanzada, neoplasias, inmovilización),
pero no en pacientes sometidos a cirugía menor, menores de 40 años y sin
otros factores de riesgo.
En los pacientes con síndrome coronario agudo inicial (angina inestable o
infarto agudo de miocardio) sin elevación del ST se recomienda la
administración de HBPM a dosis fijas junto con antiagregantes plaquetarios,
debido a la ventaja de la administración SC a dosis fijas.
HEPARINAS
También se usan en la angioplastia con balón coronario, con o sin colocación de
endoprótesis, para prevenir la trombosis; así como en las cirugías que requieren
bypass cardiopulmonar Aquí hay menos riesgo de trombo por el catéter y
circuito de bypass (activación factor XII) con las HNF.
Son de elección para anticoagulación en el embarazo ya que no cruzan la
barrera placentaria como los anticoagulantes orales, suspendiéndola 24 horas
antes del parto.
Las heparinas no se absorben vía GI. La HNF vía EV tiene efecto inmediato, de
acuerdo a la dosis, pero de corta duración (vida media de 1 a 5 horas,
eliminación por RES), por lo que es mejor en infusión. Vía SC actúa en 1 a 2
horas, mientras la de bajo peso molecular inicia más rápido y su absorción es
más uniforme (vida media 4-6 horas) pero están contraindicadas en
insuficiencia renal (eliminación renal) por riesgo de hemorragia.
WARFARINA
La vitamina K es una vitamina liposoluble y es el cofactor para la carboxilación
del carbono gamma de los residuos de ácido glutámico en los factores
dependientes de vitamina K. La vitamina K₁ (fitonadiona o filoquinona) se encuentra
en las plantas. Es la única vitamina K natural para uso terapéutico. La vitamina K₂ (
menadiona, menaquinona) es producida por la flora bacteriana del colon. La vitamina
K reducida es el cofactor esencial para la síntesis hepática de las denominadas
proteínas vitamina-K dependientes. Estas incluyen a factores de coagulación:
protrombina (II), VII, IX y X y también a proteínas anticoagulantes (proteína C,
proteína S y Z (ATIII o cofactor del inhibidor de Xa).
La Warfarina Inhibe el ciclo de interconversión de la vitamina K desde su forma
oxidada a la reducida (inhibe la enzima VKOR). Disminuye la cantidad funcional de
cada factor vitamina k dependiente en plasma en 30-70%, pero principalmente de
protrombina. Este efecto antitrombótico total se logra en 4-5 días, por lo que debe
agregarse heparina en pacientes con trombosis o alto riesgo, este tiempo.
Se evalúa con el TP (11-13 segundos), que evalúa II, VII y X. (vía
extrínseca). Mejor con el INR (TP corregido: 0,8-1,2).
INDICACIONES DE LA WARFARINA:
.
Se usan para prevenir la progresión o recurrencia de la trombosis venosa
profunda, aguda o embolia pulmonar, después de un curso inicial de heparina
NF o fraccionada, en pacientes con fibrilación auricular, válvulas cardiacas
mecánicas, cardiopatías congénitas, cardioversión de FA o flutter auricular,
miocardiopatía dilatada, cardiopatía isquémica: Angina inestable, Infarto
agudo de miocardio (IAM), eventos vasculares transitorios repetitivos,
secundarios a enfermedad cerebrovascular o trombosis arterial cerebral
progressiva, disección de pared de la carótida intracraneal, prevención de la
oclusión tras cirugía reconstructiva arterial periférica, prevención de alto riesgo
trombótico arterial: en caso de accidentes isquémicos transitorios de origen
carotídeo en pacientes portadores de “stent” intracoronario o en otras
localizaciones en injerto aortocoronario venoso u otros injertos arteriales. Para
la mayoría se mantiene un INR entre 2 y 3; 3.5 en caso de válvulas mecánicas
con fibrilación auricular o antecedente de accidente cerebro vascular.
Sustitución de los anticoagulantes orales
En pacientes a los que se va a aplicar procedimientos invasivos, quirúrgicos,
intolerancia oral, imposibilidad de realizar controles de INR, gestación, procesos
médicos intercurrentes en los que se encuentra contraindicado o profilaxis
secundaria de ETEV en los casos en que no se puedan administrar los ACO.
FÁRMACOS ANTIPLAQUETARIOS
1) ASPIRINA
Inhibe agregación plaquetaria al inhibir la formación de TxA₂ a partir de la COX-1
plaquetaria. El TXA₂ es un potente vasoconstrictor y débil inductor de la agregación
plaquetaria. Su efecto dura los 10 días del ciclo plaquetario, con 75 mg.
Se evalúa con Tiempo de sangría (2-5minutos) y Tiempo de coagulación (5-7 minutos)
En los pacientes con isquemia cerebral aguda y sin criterios para tratamiento
trombolítico no se aconseja el tratamiento con heparina, sino la administración de
antiagregantes plaquetarios.
2. Clopidogrel
Inhibe el receptor P2Y₁₂ plaquetario. Este receptor al ser activado por ADP
inhibe la adenilil ciclasa y el AMPc lo que disminuye la inhibición de la
activación plaquetaria dependiente de AMPc. Para una activación plaquetaria
máxima deben estimularse los receptores plaquetarios de ADP P2Y₁ y P2Y₁₂.
El clopidogrel es algo mejor que el acido acetilsalicílico para la prevención secundaria del
accidente cerebrovascular, y la combinación de clopidogrel mas acido acetilsalicílico es
superior al acido acetilsalicílico solo para la prevención de la isquemia recurrente, en pacientes
con angina inestable.
El clopidogrel, a menudo se usa en combinación con acido acetilsalicílico después de la
implantación de la endoprótesis coronaria.
INHIBIDORES DE LA FIBRINOLISIS
El ácido ε-aminocaproico y el ácido tranexámico son análogos de la lisina y compiten por los
sitios de unión a la lisina en el plasminógeno y la plasmina, bloqueando así su interacción con
la fibrina. Ambos se excretan vía renal. El principal problema con su uso es que los
trombos que se forman, durante el tratamiento, no se degradan. Por ejemplo, en
pacientes con hematuria, la obstrucción uretral por coágulos puede provocar
insuficiencia renal, después del tratamiento con estos inhibidores.
El acido ε-aminocaproico se ha usado por vía intravenosa para reducir el sangrado
después de la cirugía prostática y por vía oral, para reducir el sangrado después de
las extracciones dentales en hemofílicos.
El acido tranexámico se administra por vía intravenosa en la reanimación de traumatismos y en
pacientes con hemorragia masiva. También se usa para reducir el sangrado quirúrgico en
pacientes sometidos a artroplastia de cadera o rodilla o cirugía cardiaca. Parece haber poco o
ningún aumento del riesgo de trombosis. Vía oral se usa en tratamiento de la hemorragia
menstrual abundante.
TIEMPO PARCIAL DE TROMBOPLASTINA
El plasma citratado en presencia de tromboplastina parcial o cefalina y cloruro
cálcico se coagula a una velocidad dependiente de la concentración de todos los
factores (excepto VII y XIII). Se inicia la reacción añadiendo al plasma una
sustancia cargada negativamente (sílice, caolín o ácido elágico). Esta prueba
presenta un error sistemático cuando no se cumple la proporción 9:1 de sangre:
citrato y nos da un valor de TTPa alargado. La relación (TTPa / TTPa control) > 1,5
se correlaciona con déficit de factores y el riesgo de hemorragia. Evalúa la vía
intrínseca de la cascada de coagulación. Se usa para evaluar pacientes que
presentan sangrado inexplicable o que usan heparina. Mide el tiempo que tarda
la porción líquida de la sangre (plasma) en coagularse. La coagulación debe
ocurrir entre 21 a 35 segundos.
Si la persona está tomando anticoagulantes, la coagulación tarda hasta 2 ½
veces más tiempo. Un PTT alargado también puede ser debido a: Coagulación
intravascular diseminada (CID), deficiencia de factor XII, XI, hemofilia A,
hemofilia B, hipofibrinogenemia, enfermedad hepática, anticoagulantes
lúpicos, malabsorción, deficiencia de vitamina K o enfermedad de Von
Willebrand.
Tiempo de protrombina (TP)
El plasma citratado en presencia de tromboplastina y cloruro cálcico se coagula a una
velocidad dependiente de la actividad de protrombina, de los factores V, VII, X y el
fibrinógeno. Evalúa la vía extrínseca.
Se usa para evaluar pacientes que presentan sangrado inexplicable o para determinar el
grado de insuficiencia hepática, en la cirrosis hepática, deficiencia de
vitamina K o que usan warfarina (cumarínico). Mide el tiempo que tarda la porción
líquida de la sangre (plasma) en coagularse.
Los resultados se expresan en la unidad: índice normalizado internacional (INR) es la razón
del tiempo de coagulación del paciente respecto al control elevado a un valor
llamado ISI (índice de sensibilidad internacional) que es propio de cada tromboplastina. Si
uno toma warfarina para prevenir coágulos, debemos mantener el INR entre
2 y 3.
El rango normal del PT varía entre 11 y 13 segundos y el del INR
entre 0,8 y 1,2. Una elevación en esos valores puede deberse a una
deficiencia en los factores de coagulación II, V, VII, X o del fibrinógeno. Por lo
general el PT y el INR se evalúan en combinación con el Tiempo de Tromboplastina Parcial
Activada (aPTT).
TIEMPO DE SANGRÍA
El tiempo de sangría representa la duración entre la formación de
una herida y el cese de la hemorragia. Es una de las pruebas de
coagulación sanguínea donde se mide qué tan rápido se cierran los
vasos sanguíneos para detener el sangrado. Los valores normales son
de 1 a 3 minutos cuando la medición es realizada según la técnica de
Duke (incisión mínima sobre el lóbulo de la oreja), y de 3 a 5 minutos
cuando se utiliza la técnica de Ivy (incisión en el antebrazo después
de poner el brazo bajo presión por un tensiómetro).
El tiempo de sangría se extiende más tiempo en caso delas
alteraciones en la pared vascular, defectos en la agregación o
adhesión plaquetar, trombocitopenia (reducción del número de
plaquetas en la sangre), anemia, embarazo, enfermedad de
Willebrand. También puede resultar más largo en caso de tomar
aspirina, incluso en pequeñas dosis, en los 8 días precedentes a la
prueba.
TIEMPO DE COAGULACIÓN
Tiempo que tarda en coagular la sangre sin anticoagulantes a 37ºC en un tubo de cristal. V.N.
5-10 minutos. Valora la vía intrínseca.
Tiene poca reproducibilidad y es sensible solo a deficiencias graves de cualquier factor de la
coagulación, con excepción de una deficiencia pura de los factores VII y XIII; por lo tanto, su
uso en el laboratorio está limitado. Puede estar prolongado en las hemofilias graves, en la
afibrinogenemia y en estados fibrinolíticos severos.
Método de Lee-White: Partimos de dos tubos de cristal introducidos en un baño a 37ºC ·
Depositamos aproximadamente 1 ml de sangre sin anticoagulante en cada tubo y ponemos en
marcha el cronómetro · Uno de los tubos se saca del baño cada 30 segundos y se inclina para
ver si fluye la sangre · Cuando la sangre no fluya se saca el segundo tubo del baño cada 15
segundos, cuando la sangre no fluya se para el cronómetro y se anota el tiempo.
Utilidad clínica:
• Evaluación global del sistema de coagulación.
• Monitoreo de la terapia con heparina.
• Screening prequirúrgico.
SÍNDROMES HEMORRAGÍPAROS O PURPÚRICOS
ALTERACIONES ALTERACIONES DE ALTERACIONES DE LA
PLAQUETARIAS FACTORES DE PARED VASCULAR
LA COAGULACIÓN
1. Disminución en N° 1. Hemofilia A (factorVIII) y 1. Alteración
(trombocitopenias) B (factor IX). estructural de la
2. Alteración funcional 1. Insuficiencia hepática. pared vascular
(Deficiente aglutinación) 2. Deficiencia de vitamina K (telangiectasias,
Enfermedad de Von (nutricional, por escorbuto).
Willebrand antibióticos, o mala 2. Inflamación de la
Aspirina. absorción intestinal). pared vascular
3. Warfarina, heparina (infecciosa,
autoinmune).
TRASTORNOS DE LA HEMOSTASIA PRIMARIA
Trombocitopenia: Valores de plaquetas inferiores a 150000/µl. Por debajo de 50000/µl se
dan hemorragias espontáneas y por debajo de 10000/µl pueden resultar mortales. Puede deberse a:
disminución de la producción medular, secuestro en un bazo crecido, o mayor destrucción de las
plaquetas.
En primer lugar hay que descartar la posible presencia de una "Pseudotrombocitopenia", sobre todo
en pacientes sin una causa manifiesta de trombocitopenia. Es un error in vitro causado por la
aglutinación de las plaquetas mediada por los anticuerpos anti-EDTA. Se debe comprobar el resultado
y observar si se ha producido un coágulo en la muestra por incorrecta homogeneización del
anticoagulante con la sangre recién obtenida. Descartar la existencia de agregados plaquetarios con la
observación de un frotis de sangre periférica al microscopio óptico. Y por último diagnosticar la
psedotrombopenia con la realización del recuento plaquetario en sangre recogida en un tubo con
citrato de sodio.
Los síntomas de los pacientes con trombocitopenia son pequeños sangrados de vénulas pequeñas o
capilares en lugar de vasos grandes. La piel de estas personas muestra muchas manchas purpúreas
pequeñas, de las que deriva el nombre de púrpura trombocitopénica. La púrpura trombocitopénica es
un trastorno adquirido que desencadena la destrucción de plaquetas mediada por factores
inmunitarios y también se produce la inhibición de la liberación de plaquetas a partir del
megacariocito.
Trombocitopenia hereditaria , puede darse de forma aislada o como parte de otro síndrome. Es una
enfermedad hereditaria autosómica dominante, autosómica recesiva o ligada a X. Muchas formas de
trombocitopenia autosómica dominante están relacionadas con mutaciones en el gen de la cadena
pesada de miosina no muscular MYH9.
Trombocitosis:
Casi siempre se debe a una deficiencia de hierro, inflamación, cáncer o
infección (trombosis reactiva), o un proceso mieloproliferativo subyacente
(trombocitemia idiopática o policitemia verdadera).
Trombopatías:
A)Enfermedad de Von Willebrand: es el trastorno hemorrágico hereditario más frecuente. El factor
de von Willebrand desempeña dos funciones: como principal molécula de adhesión que fija la
plaqueta al subendotelio expuesto y como proteína fijadora para el factor VIII, lo cual trae consigo una
prolongación importante de la vida media del factor VIII en la circulación sanguínea. El tipo 1 es el más
frecuente. Los pacientes presentan, sobre todo, hemorragias en mucosas, equimosis excesiva y
epistaxis. A menudo, se manifiesta inicialmente durante las extracciones dentales o con la
amigdalectomía. Muchos factores influyen tanto en las concentraciones de FvW como en los síntomas
de hemorragia, se sabe que influyen el grupo sanguíneo del paciente, su estado hormonal tiroideo, la
raza, el estrés y el ejercicio.
La enfermedad de von Willebrand adquirida es un raro trastorno que se observa en pacientes con
gammapatías monoclonales, mieloma múltiple y macroglobulinemia de Waldenström. Se sospecha en
pacientes con síntomas recientes de hemorragia grave en mucosas, sobre todo en individuos de edad
avanzada.
Enfermedad de Bernard - Soulier: Autosómica recesiva que se manifiesta por hemorragias desde la
infancia. Existe un déficit del receptor plaquetario GpIb-IX-V.
Enfermedad de Glanzman: Autosómica recesiva, caracterizada por un déficit del receptor de plaquetas
GpIIb-IIIa.
TRASTORNOS DE LA COAGULACIÓN
Trombosis venosa: Principalmente en las venas profundas de la pierna, desde
donde a menudo embolizan hacia los pulmones. Los síntomas de trombosis
venosa no son específicos y requiere estudios por imágen. El tratamiento con
anticoagulantes debe ser rápido y adecuado. Los factores de riesgo están
relacionados con la inmovilización o con la hipercoagulabilidad.
Trombofilia hereditaria: Tendencia genéticamente determinada al
tromboembolismo venoso. El primer episodio de trombosis aparece alrededor
de los 25 años. No son recomendables los anticonceptivos orales que contienen
estrógenos y se considerará la profilaxis anticoagulante después del parto en
mujeres con trombofilia hereditaria.
Hemofilias:
La hemofilia es una enfermedad hemorrágica recesiva ligada a cromosoma
X producida por mutaciones en el gen F8 (hemofilia A o hemofilia
clásica -> déficit factor VIII) o el gen F9 (hemofilia B -> déficit factor IX).
Afecta a 1:10.000 varones, las mujeres son portadoras de la enfermedad.
Clínicamente la hemofilia A y la hemofilia B son indistinguibles. El fenotipo de la
enfermedad se correlaciona con la actividad residual del factor VIII o el IX y se clasifica
como grave (<1%), moderada (1 a 5%) o leve (6 a 30%). En las formas grave y
moderada, la enfermedad se caracteriza por episodios hemorrágicos en
articulaciones, partes blandas y músculos después de un traumatismo menor o
incluso en forma espontánea. Los pacientes con enfermedad leve experimentan
hemorragias poco frecuentes que por lo general son consecutivas a traumatismos.
Entre aquellos con actividad residual de factor VIII o IX de más de 25% del valor
normal, la enfermedad se descubre únicamente por la hemorragia que se presenta
posterior a un traumatismo importante o durante las pruebas de laboratorio que por
lo general se realizan antes de una intervención quirúrgica.
Prolongación de TTPa, tiempos de sangrado y recuentos plaquetarios
normales. El diagnóstico se establece después de la determinación específica de la
actividad coagulante de factor VIII o factor IX.
Coagulación intravascular diseminada (CID):
Síndrome caracterizado por la formación incontrolada de fibrina
intravascular en respuesta a la exposición de la sangre a
concentraciones patológicas de fosfolípidos de los tejidos que da lugar a
un consumo de factores de coagulación y plaquetas con una
hiperfibrinólisis secundaria.
Se produce un depósito de fibrina en zonas de microcirculación que
ocluyen los vasos en la microcirculación y puede derivar a un fallo
multiorgánico. Las causas más frecuentes son la sepsis bacteriana,
trastornos malignos como tumores sólidos, leucemia promielocítica
aguda y causas obstétricas. La púrpura fulminante es una forma grave de
coagulación intravascular diseminada debida a trombosis de zonas extensas de
la piel.
Los análisis de laboratorio deben incluir pruebas de coagulación (TTPa, TP y TT),
marcadores de productos de la degradación de la fibrina (dímero D), recuentos
plaquetarios y eritrocíticos y análisis del frotis sanguíneo al microscopio óptico,
con la observación de esquistocitos (fragmentos de eritrocitos).
También podría gustarte
- HEMOSTASIADocumento14 páginasHEMOSTASIAnaxin23Aún no hay calificaciones
- HEMOSTASIA PRIMARIA Secundaria, FibrinolisisDocumento3 páginasHEMOSTASIA PRIMARIA Secundaria, Fibrinolisisalexandra montalvo0% (1)
- T4 - Ciru - Hemostasia y Transfusion SanguineaDocumento14 páginasT4 - Ciru - Hemostasia y Transfusion SanguineaPablo Segales BautistaAún no hay calificaciones
- Hemostasia, Hemorragia Quirúrgica y TransfusiónDocumento12 páginasHemostasia, Hemorragia Quirúrgica y TransfusiónMario SalazarAún no hay calificaciones
- Resumen Del Capitulo de Hemostasia y Coagulacion de La Sangre de Fisiologia de GuytonDocumento5 páginasResumen Del Capitulo de Hemostasia y Coagulacion de La Sangre de Fisiologia de GuytonJOVI SANTOLALLA ALVARADOAún no hay calificaciones
- Desórdenes de La CoagulaciónDocumento56 páginasDesórdenes de La CoagulaciónJorge Adrián Laura BasurcoAún no hay calificaciones
- Hemostasia PDFDocumento11 páginasHemostasia PDFM Cristina Pg100% (1)
- Hemostasia clínica: fases, factores plasmáticos y coagulaciónDocumento8 páginasHemostasia clínica: fases, factores plasmáticos y coagulaciónlaura marina melero aanchezAún no hay calificaciones
- PLAQUETASDocumento13 páginasPLAQUETASMiriam Contreras BenitezAún no hay calificaciones
- Fisiologia de La Hemostasia y Coagulacion SanguineaDocumento6 páginasFisiologia de La Hemostasia y Coagulacion SanguineaYong MondragonAún no hay calificaciones
- 2 - HemostasiaDocumento31 páginas2 - Hemostasiacarelia2Aún no hay calificaciones
- Hemostasia y Transtornos HemorragicosDocumento28 páginasHemostasia y Transtornos HemorragicosGeraldine Bobadilla PastorAún no hay calificaciones
- Hemostasia Trombosis EmboliaDocumento13 páginasHemostasia Trombosis EmboliaELMER ELOY MAQUI SANTOAún no hay calificaciones
- Hemostasia, Coagulacion, Fibrinolisis y AnticougulantesDocumento15 páginasHemostasia, Coagulacion, Fibrinolisis y AnticougulantesEvelynn GarcíaAún no hay calificaciones
- Unidad 4. Trastornos Circulatorios-HemostasiaDocumento5 páginasUnidad 4. Trastornos Circulatorios-HemostasiaAnny RangelAún no hay calificaciones
- Fisiología coagulaciónDocumento3 páginasFisiología coagulaciónAna HernandezAún no hay calificaciones
- HEPARINADocumento21 páginasHEPARINACancino JavieraAún no hay calificaciones
- Mecanismos de La HemostasiaDocumento18 páginasMecanismos de La HemostasiaAndres PelayoAún no hay calificaciones
- Fármacos Anticoagulantes, Tombolíticos y AntiplaquetariosDocumento13 páginasFármacos Anticoagulantes, Tombolíticos y AntiplaquetariosJaidaly Andreina Avila MedinaAún no hay calificaciones
- Fisiología plaquetaria y factores de la coagulación sanguíneaDocumento3 páginasFisiología plaquetaria y factores de la coagulación sanguíneaManu BGAún no hay calificaciones
- Expo Farmacología TVPDocumento8 páginasExpo Farmacología TVPIsabella NegreteAún no hay calificaciones
- TrombofiliaDocumento13 páginasTrombofiliaAnny Diaz DussanAún no hay calificaciones
- Hemostasia y Trombosis AnatopatoDocumento10 páginasHemostasia y Trombosis Anatopatoss501100% (1)
- Fisiopatología de La HemostasiaDocumento3 páginasFisiopatología de La HemostasiaGianPier MonjeAún no hay calificaciones
- HemostasiaDocumento3 páginasHemostasiaAbileneAún no hay calificaciones
- HemostasiaDocumento6 páginasHemostasiaLetty LopezAún no hay calificaciones
- Factores coagulación sangreDocumento4 páginasFactores coagulación sangreCeleste VillatoroAún no hay calificaciones
- La Fisiología de La HemostasiaDocumento21 páginasLa Fisiología de La Hemostasiayuli andrea pinto pabaAún no hay calificaciones
- Hemostasia y trombosis (proteínas de la coagulación)Documento18 páginasHemostasia y trombosis (proteínas de la coagulación)lionmedstudyAún no hay calificaciones
- Seminario. HemostasiaDocumento10 páginasSeminario. Hemostasiaarios_409594100% (1)
- coagulacionDocumento7 páginascoagulacionLucia OblitasAún no hay calificaciones
- Fin 17Documento3 páginasFin 17Maria Virginia Sosa RodriguezAún no hay calificaciones
- Tema 2: Alteraciones de La Hemostasia: Diátesis Hemorrágica Y Diátesis TrombóticaDocumento11 páginasTema 2: Alteraciones de La Hemostasia: Diátesis Hemorrágica Y Diátesis TrombóticaMarina Navarro SavallAún no hay calificaciones
- Sistema de La PlasminaDocumento2 páginasSistema de La PlasminaAlejandro PvAún no hay calificaciones
- Trastornos de La HemostasiaDocumento12 páginasTrastornos de La Hemostasiaarios_409594Aún no hay calificaciones
- Fisiopatología de Los Trastornos de La Coagulación 2007Documento16 páginasFisiopatología de Los Trastornos de La Coagulación 2007api-3742102100% (5)
- Definición y mecanismos de la hemostasiaDocumento11 páginasDefinición y mecanismos de la hemostasiaBetsabe Corpa AlegriaAún no hay calificaciones
- Trabajo CoagulacionDocumento17 páginasTrabajo CoagulacionmariluAún no hay calificaciones
- Coagulacion 2009 Una Vision Moderna de La HemostasiaDocumento5 páginasCoagulacion 2009 Una Vision Moderna de La HemostasiaLucila MartinezAún no hay calificaciones
- Coagulacion 2009 Una Vision Moderna de La HemostasiaDocumento5 páginasCoagulacion 2009 Una Vision Moderna de La HemostasiaArturo Canseco LopezAún no hay calificaciones
- HematoDocumento5 páginasHematodavidAún no hay calificaciones
- T 29 Fisiopatología de La CoagulaciónDocumento8 páginasT 29 Fisiopatología de La Coagulaciónojoavizor82Aún no hay calificaciones
- He Most AsiaDocumento8 páginasHe Most Asiaanon-766477Aún no hay calificaciones
- Cascada de La CoagulaciónDocumento19 páginasCascada de La CoagulaciónSkarlett HenríquezAún no hay calificaciones
- Cascada de La CoagulaciónDocumento6 páginasCascada de La CoagulaciónMaribel RojasAún no hay calificaciones
- Coagulación sangre Mecanismo ENFERMERIADocumento8 páginasCoagulación sangre Mecanismo ENFERMERIAAmaya MirzaAún no hay calificaciones
- Hemostasia SecundariaDocumento7 páginasHemostasia Secundariala72559663Aún no hay calificaciones
- 4-Hemostasia Primara-Interacion Endotelio-PlaquetaDocumento20 páginas4-Hemostasia Primara-Interacion Endotelio-PlaquetaEsmeralda OHAún no hay calificaciones
- HyT Modelo CelularDocumento23 páginasHyT Modelo CelularevelinalejandralopezadameAún no hay calificaciones
- HemostasiaDocumento16 páginasHemostasiaEderth CorderoAún no hay calificaciones
- Hemostasia y TrombosisDocumento61 páginasHemostasia y TrombosisLorena ZepedaAún no hay calificaciones
- Monografia HemorragiaDocumento33 páginasMonografia HemorragiaRikardo C-b75% (4)
- Práctica 4 Pruebas de CoágulaciónDocumento11 páginasPráctica 4 Pruebas de CoágulaciónSandy MoralesAún no hay calificaciones
- Coagulación Para Todos: Medicina Para TodosDe EverandCoagulación Para Todos: Medicina Para TodosCalificación: 4.5 de 5 estrellas4.5/5 (3)
- Absorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleDe EverandAbsorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleAún no hay calificaciones
- Anemia Para Todos: Medicina Para TodosDe EverandAnemia Para Todos: Medicina Para TodosCalificación: 3 de 5 estrellas3/5 (1)
- Introducción Básica a la Microcirculación de la Sangre: La Siguiente Generación en Cuidados de la SaludDe EverandIntroducción Básica a la Microcirculación de la Sangre: La Siguiente Generación en Cuidados de la SaludAún no hay calificaciones
- Anemia perniciosaDocumento4 páginasAnemia perniciosaPaola OgandoAún no hay calificaciones
- Aorta Abdominal y Cava Inferior - EscalanteDocumento19 páginasAorta Abdominal y Cava Inferior - EscalanteNicki CondezaAún no hay calificaciones
- Sistema Reproductor Masculino FinalDocumento2 páginasSistema Reproductor Masculino FinalJhon Monzon100% (1)
- Anatomia Del CorazónDocumento5 páginasAnatomia Del CorazónAlvaro CastilloAún no hay calificaciones
- El PancreaDocumento2 páginasEl PancreaYadira Hernandez RamirezAún no hay calificaciones
- Anatomía del sistema óseo y sus componentesDocumento13 páginasAnatomía del sistema óseo y sus componentesItzel RodríguezAún no hay calificaciones
- Tecnicas de Anestesia en OdontologiaDocumento10 páginasTecnicas de Anestesia en Odontologianancy cruz martinez100% (1)
- Resumen Aporte 1Documento8 páginasResumen Aporte 1Genessis Julexy CevallosAún no hay calificaciones
- 7 Fagocitosis y PinocitosisDocumento13 páginas7 Fagocitosis y PinocitosisMigue MirandaAún no hay calificaciones
- Tarea 3Documento6 páginasTarea 3Daniel BonifacioAún no hay calificaciones
- Endomembranas y transporte intracelularDocumento14 páginasEndomembranas y transporte intracelularLucas RománAún no hay calificaciones
- El Cerebro y Su AnatomíaDocumento20 páginasEl Cerebro y Su Anatomíaimanolordiales50% (2)
- Nomenclatura Con SelloDocumento3 páginasNomenclatura Con SelloAgus LazarteAún no hay calificaciones
- Ecografia de Pancreas y BazoDocumento35 páginasEcografia de Pancreas y BazoClaudia Ramírez100% (1)
- Sistema MuscularDocumento54 páginasSistema MuscularMily PilyAún no hay calificaciones
- Actividada 04 Eda 5 CuartoDocumento6 páginasActividada 04 Eda 5 CuartoAna Maria Rojas AhumandaAún no hay calificaciones
- TEGUMENTOSDocumento19 páginasTEGUMENTOSWill Ore LauraAún no hay calificaciones
- Artritis ReumatoideDocumento23 páginasArtritis ReumatoideAnonymous Jqj8HPxh9HAún no hay calificaciones
- 2.5 Aplicación de Imanes en La Columna VertebralDocumento33 páginas2.5 Aplicación de Imanes en La Columna VertebralJesus Ovalle LievanosAún no hay calificaciones
- Aparato DigestivoDocumento10 páginasAparato DigestivoAdriana CastroAún no hay calificaciones
- Plan de Estudio MedicinaDocumento8 páginasPlan de Estudio MedicinaAdri_RondanAún no hay calificaciones
- Presentación CANALES Y COLATERALES 2021 (SEMINARIO FEBRERO) No. 1Documento9 páginasPresentación CANALES Y COLATERALES 2021 (SEMINARIO FEBRERO) No. 1Zayda Paredes100% (2)
- Teoría Del Mosaico FluidoDocumento3 páginasTeoría Del Mosaico FluidoCarolina PiñeroAún no hay calificaciones
- Gametogénesis: Espermatogénesis y sus 4 fasesDocumento5 páginasGametogénesis: Espermatogénesis y sus 4 fasesGarma Zegarra Julber RafaelAún no hay calificaciones
- Guía #9 Sistema CirculatorioDocumento4 páginasGuía #9 Sistema CirculatorioMonica Patricia Lopez RoaAún no hay calificaciones
- Cy LactanteDocumento52 páginasCy LactanteAlexander OrozcoAún no hay calificaciones
- Efectos de Los Toxicos en El Sistema CardiovascularDocumento13 páginasEfectos de Los Toxicos en El Sistema CardiovascularSaavedra Alberto LuisAún no hay calificaciones
- Ambiguedad de SexoDocumento29 páginasAmbiguedad de SexoIneska Bermudez seijasAún no hay calificaciones
- Conjuntiva 111001185739 Phpapp02Documento120 páginasConjuntiva 111001185739 Phpapp02LAURA CAMILA ARAGONES VARGASAún no hay calificaciones
- 1 Primera Clase de AnatomíaDocumento4 páginas1 Primera Clase de AnatomíadianaAún no hay calificaciones