Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Antígenos, Estructura y Función de Las Inmunoglobulinas, Receptores de Antígenos
Cargado por
CLAUDIA LORENA RAMIREZ FRANCOTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Antígenos, Estructura y Función de Las Inmunoglobulinas, Receptores de Antígenos
Cargado por
CLAUDIA LORENA RAMIREZ FRANCOCopyright:
Formatos disponibles
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS
INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS
jueves, 22 de abril de 2021 1:00
Profesor: Robinson Ramírez
HECHO POR: J-hope
Receptor para el Antígeno del Linfocito B → Inmunopíldoras 6.1, 6.2, 6.3, y 6.5
• A diferencia del linfocito T (LT), el linfocito B (LB) sí puede • Uno de los componentes de este receptor son las inmunoglobulinas (Ig), que
reconocer los antígenos en su presentación natural (nativa) según el ensamblaje del ARNm codificado por un mismo gen, se distinguen dos
a través de su receptor (BCR, B cell receptor) formas:
1. Forma transmembrana (mIg) → conservan dominios (exones)
BCR: receptor de células B transmembrana e intracelulares; siempre son monómeros y funcionan
como receptores.
2. Forma soluble (sIg) → expresan dominios (exones) para su
secreción; salen cuando el LB está activado (células plasmáticas) y
funcionan como efectores.
Fab
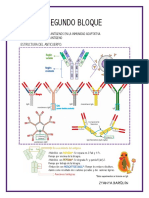
• La estructura básica de la Ig son 4 cadenas polipeptídicas,
idénticas 2 a 2:
○ 2 cadenas ligeras (light chain, LC) → con 2 dominios
tipo Ig cada una.
○ 2 cadenas pesadas (heavy chain, HC) → con 4 o 5
dominios tipo Ig cada una. Cadena ligera
• Puentes disulfuro (S-S), que unen cada LC con una HC. Puente
• Región bisagra: une las dos HC entre sí mediante S-S → le disulfuro
confiere flexibilidad a la molécula.
Cadena pesada
• La enzima papaína (usada en investigación) escinde la Ig en
dos fragmentos:
1. Fab (antigen-binding) → donde se une el antígeno
(Ag): le confiere la especificidad.
2. FC (fragmento conservado, cristalizable) → región
muy conservada: le confiere la funcionalidad. FC
• También se puede escindir la molécula con una pepsina, por
debajo de la región bisagra: se llamaría Fab2 en lugar de Fab.
• El dominio más externo de la Ig que entra en contacto con el Ag,
se denomina región variable (V), y con un subíndice se indica si
pertenece a la cadena ligera o pesada (V L y VH).
• Los demás dominios se denominan como región conservada (C) .
→ Si pertenece a la LC se denomina C1 → es su único dominio
conservado.
→ Si pertenece a la HC se denominan CH, y se adiciona un
subíndice numérico comenzando en 1 para el dominio
conservado más próximo al V H → por ejemplo: CH1, CH2, …,
CH4.
• Los dominios de Ig tienen una estructura terciaria muy
característica: el barril/tonel formado por 2 láminas beta anti-
paralelas unidas entre sí por enlaces S-S (que está en la
secuencia cada 100-110 aas).
• Las proteínas que tiene este plegamiento estructural, conforman
la superfamilia de las Igs → se cree que tiene una ventaja
evolutiva.
Modelo molecular y de láminas que presenta la estructura típica de una Ig con sus dominios estructurales y funcionales
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS página 1
Clases (isotipos) y Subclases (isotipos menores):
• Las LC tiene dos clases: κ y λ→ son equivalentes estructural y
funcionalmente.
• Las HC tiene cinco clases que le dan el nombre a la Ig:
→ A: tiene dos subclases → IgA1 e IgA2.
→ D → IgD.
→ E → IgE.
→ G: tiene cuatro subclases → IgG1, IgG2, IgG3, IgG4.
→ M → IgM.
• Las IgM e IgE tiene un quinto dominio en la HC → tienen reducida su
región bisagra.
• La glicosilación también es variable.
• La IgM se secreta en forma pentamérica, unido con cadena J (joining).
• La IgA se puede dimerizar después de secretarse.
IgM (5)
IgA (2)
Multímeros de inmunoglobulinas
Tejidos de Distribución y Función de las Igs:
Distribución tisular
Anticuerpo Subtipo Estructura Función principal
IgA IgA1 Monómero, Inmunidad de mucosas
IgA2 Dímero
IgD - Monómero Desconocida
IgE - Monómero Respuesta a parásitos
IgG IgG1 Monómero Respuesta secundaria a patógenos
IgG2 inmunidad a neonatal
IgG3
IgG4
IgM - Pentámero Respuesta primaria a patógenos
Variabilidad de la Inmunoglobulina:
• Puntos de contacto con Ag: parátopos (regiones
hipervariables) → se encuentran en los dominios
variables de ambas cadenas, y son los puntos calientes
(hot spots): se denominaron CDR (1, 2 y 3).
• Se une el Ag (el epítopo) como una llave a su cerradura
(el parátopo).
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS página 2
Parátopo
Hot spots
Enlaces Antígeno-Anticuerpo:
• La mínima porción capaz de disparar la respuesta inmune se le denomina
epítopo.
• Pueden ser:
→ Lineales: se encuentran consecutivamente en la secuencia de aas.
→ Conformacionales: conjunción espacial de la proteína → si se
desnaturaliza el Ag, se vuelve irreconocible para el parátopo.
• La unión epítopo-parátopo (Ag-Ac) se hace mediante enlaces no covalentes
(reversibles): ver tabla
→ Los enlaces hidrofóbicos son los más fuertes.
→ Son enlaces débiles, pero son tantos que generan uniones muy estables.
→ Es fácil desintegrar estos enlaces con: calor, pH, etc.
• Afinidad: fuerza de la unión Ag-Ac → determinada por el número total y tipo
de enlaces producidos.
• Avidez → determinada por el número de puntos de contacto (las Ig
multiméricas son más ávidas).
Tipos de enlace epítopo-parátopo
Esquema que diferencia valencia de avidez
Funciones Biológicas de las Igs:
• Mediadas por la porción constante → 9 genes que las codifican: uno por clase o subclase .
→ Genes: Cµ = IgM, Cα = IgA, Cδ = IgD, Cγ = IgG, Cε = IgE.
• Después de unirse los genes para los fragmentos V, D y J para formar la región variable, los genes que codifican las regiones constantes permanecen
separados por el ADN.
• Como la HC da la función a la Ig, las diferentes clases tendrán diferentes funciones.
• Las concentraciones relativas de las Ig es diferencial: IgG > IgA > IgM > IgD > IgE.
Estructura fina de un gen que codifica la cadena pesada (HC)
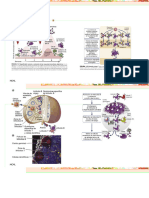
El Receptor del Linfocito B (BCR): El Complejo Correceptor:
• El BCR es una Ig de tipo mIg (forma de membrana). • Además tiene un correceptor, que son 3 proteínas NO asociadas:
• Tiene pocos aas intracelularmente → necesita 2 complejos CD21 + CD19 + CD81 → le dan la segunda señal de activación.
heterodiméricos con estructuras de tipo Ig unidas por S-S: los CD79 • Existen dos condiciones necesarias para desencadenar la cascada de
→ Cada heterodímero tiene una cadena α y otra β. señalización mediada por la activación de BCR, estas son dos señales:
1. Unión de BCR-ligando.
• Estos CD79 en sus secuencias citoplasmáticas tienen unas cajas 2. Unión correceptor-citoquinas (provenientes de LT), o correceptor-
denominadas ITAM (Immuno-Tyrosine Activation Motive), que tienen complemento.
secuencia consenso: V/LxYxxI = valina/isoleucina + aa + tirosina + aa +
aa + isoleucina. Estructura esquemática del BCR Estructura del Correceptor de BCR
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS página 3
Dominio ITAM
Activación de la Célula B:
• Un cambio conformacional en el receptor BCR induce la activación de las CD79 para desencadenar la señalización:
1. Entrecruzamiento de receptores → para la activación del LB, el Ag debe unirse simultáneamente a 2 BCR continuos.
2. La segunda señal es mediada por citoquinas (de LT), o por proteínas del complemento.
3. Inician proceso fosfo/defosfo: quitar y poner grupos fosfato a mensajeros químicos y enzimas → termina con activación de fosfolipasa
C: digiere fosfolípidos de membrana a DAG (Diacilglicerol) e IP3 (inositol-3-fosfato).
4. IP3 → ↑ Ca+2 citoplasmático → activa enzimas como la calcineurina.
5. DAG: activador de proteína-kinasa C (PKC).
6. Calcineurina y otras proteínas + PKC → inicia segunda ronda fosfo/defosfo → activación de factores nucleares de transcripción .
7. Producción masiva de Ig en su forma secretora (sIg).
• Si depende de participación de LT para activarse: Ag Timo-dependientes (TD); si el Ag tiene compuestos que activen la segunda señal
(como LPS o dextrano), no necesita un LT para activarse: Ag Timo-independientes (TI).
Clasificación de los BCR según señales de activación
Esquema de la señalización de activación de LB
Subpoblaciones Linfocitarias y el Receptor para el Antígeno del Linfocito T → Inmunopíldoras 7.5 y 7.6
Estructura del Receptor para Ag del LT:
• Es muy similar en estructura a la Ig digerida por papaína: como escindir la lg por
• Los LT no pueden reconocer los Ag en su presentación natural → necesita
la región bisagra, y luego cortar el S-S entre las dos cadenas HC y LH.
de una célula que se lo presente: la APC (antigen presenting cell);
• Tienen dos cadenas: α y β, unidas por S-S. Cada una tiene 2 dominios de la
mediante las moléculas HLA (human leukocyte antigen).
familia de las Ig (uno variable (V) y otro constante (C)).
Receptor de LT: LTR (TCR) → Alternativo a α y β, están las cadenas γ y δ (menos específicas).
Esquema del TCR Esquema del TCR
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS página 4
• Al igual que el BCR, este TCR tiene muy pocos aminoácidos (aa)
citoplasmáticamente, es por ello que su cascada de señalización está mediada
por otras proteínas asociadas: las CD3 (equivalente a CD79); que tiene dos
dominios tipo Ig:
→ ε-δ (cerca de la cadena α del TCR).
→ γ-ε (cerca de cadena β del TCR).
→ Entre ambos dominios no hay S-S.
• También se debe incorporar el homodímero Z: ζ-ζ→ en la región citoplasmática.
• El TCR reconoce el Ag, pero los dominios intracelulares de las CD3 y cadena Z,
tienen motivos de activación: ITAM → activación celular.
Activación del TCR mediado por APC
Estructura del TCR
Enfoque Clínico: déficit de CD3:
• Los genes que codifican el TCR se encuentran en el cromosoma 14 y 7.
• Los de CD3 están el cromosoma 11.
• Si las proteínas CD3 fallan: los TCR se vuelven disfuncionales → ↓LT activados:
inmunodeficiencia combinada severa → infecciones a repetición.
• El tratamiento, consiste en trasplante de médula ósea.
Correceptores de LCR:
• Para la activación de LT es necesaria la señalización de TCR, pero también la interacción de otras moléculas: los correceptor es. Estos son:
1. CD8: dos cadenas α y β (puede ser α-α) unidas por S-S.
→ Se une a proteína α3 de MHC (Major Histocompatibility Complex) clase I.
→ Interactúa con HLA clase I: todas las células nucleadas del organismo.
2. CD4: 4 dominios tipo Ig → proteína única y de membrana.
→ Se une a dominio β1 y β2 de MHC clase II.
→ Interactúa con APC profesionales: monocitos, CD y LB.
Los 2 correceptores del LT Unión correceptor-MHC
Otras moléculas que forman la sinapsis inmunológica LT-APCs:
• Muchas otras proteínas participan en la adhesión o activación → mediante síntesis de nuevas proteínas, inhibición de existentes o
sobreexpresión de éstas.
• Finalmente, entre LT y su APC existen múltiples interacciones de proteínas que contactan.
→ Ejemplo: CD28 media la señal coestimuladora , CD2 interviene en la activación, CD43 en la adhesión.
• Tantos puntos de unión, contacto y activación, le dan el nombre a este proceso de sinapsis inmunológica
Otras moléculas que intervienen en la sinapsis inmunológica
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS página 5
Mecanismos de Generación de la Diversidad del Linfocito T y B → Inmunopíldoras 8.1, 8.2, 8.3 y 8.9
Estructura de los Genes para las HC y LC de las Igs:
• Fragmentos de genes de Ig:
• El genoma humano tiene entre 22.000 - 30.000 genes, pero necesitamos
→ V: variable.
receptores para más de 10 11 Ag → ¿cómo se encaja?
→ D: diversidad → solo en HC.
→ Lo respondió Susumu Tonegawa → se ganó un Nobel de Medicina.
→ J: unión (joining).
• En lugar de tener un gen que codifica cada uno de esos receptores, el
→ C: constantes.
genoma fragmenta en trozos estos genes y los combina al azar en los genes
de HC y LC → dando así el número de receptores potenciales con altísima Número de fragmentos por gen
diversidad.
Cadenas V D J C Diversidad potencial
H 50 30 6 (9) 9.000
κ 40 0 5 1 200
λ 30 0 3 3 270
Entonces: 9.000 x 200 x 270 = 4,5 x 106
Estructura fina de los genes para las HC y LC
Diversidad Potencial: Recombinación Somática:
• Solo combinando al azar estos fragmentos se tiene una diversidad potencial de 4,5 x 10 6
→ Todavía insuficiente: se necesita un orden de 10 11
• Esta permutación se denomina recombinación somática:
→ En la LC se juntan una V con una J → que codifica dominio variable de la proteína.
→ En la HC se une D y J, luego se une uno V con uno DJ → codifica dominio variable de Ig (tanto de membrana como soluble) .
Permutación en la LC Permutación en la HC
Secuencias intrónicas
Secuencias Intrónicas implicadas en la Recombinación:
• La recombinación necesita de unas secuencias: las RSS (Recombination
Signaling Secuences), sus elementos son:
1. Heptámero: antes de V, después de J y a ambos lados de D.
2. Nonámero: antes de V, después de J y a ambos lados de D.
3. Espaciadores: distancia entre heptámeros y nonámeros: → más corto
RSS de D.
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS página 6
• Por tanto, un RSS = heptámero + espaciador + nonámero → ahí es donde se
unen las enzimas recombinasas Rag1 y Rag2, formando un heterodímero.
• Cada RSS forma un palíndromo con su sucedánea: entre V y J (en LH) o entre
V y D, así como D y J (en HC).
• Las cadenas C no participan en esta recombinación.
Palíndromo
Reordenamiento de los Genes de Ig: pesadas y ligeras, y enzimas
implicadas:
• La recombinación pueden ser válida: una proteína completa, productiva
1. La recombinasa (Rag1 + Rag2) se une de manera aleatoria de a dos y funcional → se sigue con transcripción.
fragmentos (V, D o J) y se une formando un bucle → de esto depende el • Si se da un reordenamiento NO productivo → se escinde este
sorteo que dará diversidad a los receptores. reordenamiento del ADN y se combinan otras secuencias (V, D o J).
2. Los segmentos consenso se separan del ADN, dejando la cadenas de los • Debe considerarse también que se tiene dos alelos para cada gen (uno
fragmentos expuestas: las horquillas. materno y otro paterno), lo que amplifica la recombinación de estos
3. Se pierden los consensos con enzimas como cinasas, artemisas, ku y fragmentos, y por ende su potencial de variabilidad.
ligasas → forman un círculo que se escinde del ADN original.
4. En la horquilla entran otras enzimas que introducen nucleótidos para
empatar las dos horquillas.
Paso 1: llegan las Rag Paso 2: Rag se unen al azar a RSS
Paso 3: se forma una horquilla
Paso 4: se separa el RSS Paso 5: llegan enzimas de escisión
Paso 6: las enzimas se conjugan en un multímero
Paso 8: llega la enzima TdT
Paso 7: se escinde la RSS como un fragmento circular
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS página 7
Paso 9: La TdT inserta nucleótidos en secuencias libres de la horquilla
Paso final: se empalman los dos fragmentos
Mecanismos de Amplificación de la Diversidad:
• Con la recombinación somática se alcanza una diversidad del orden de 10 6, pero tenemos que ser capaces de reconocer más de 10 11 Ags; para ello se
usan 2 mecanismos de amplificación de la diversidad:
1. Diversidad de Uniones:
a. Diversidad de unión en sí misma (flexibilidad de la unión): cuando se
hace el corte y empalme, se puede hacer en varios puntos, esto genera un
cambio en el marco de lectura o en el aminoácido codificado.
i. Se pueden llegar a formar codones de parada (como TAG), que
forman arreglos NO productivos → la proteína queda incompleta y
disfuncional: el linfocito morirá entonces por apoptosis.
b. Nucleótidos P: para el empalme de dos fragmentos, después de la
formación de la horquilla, quedan cadenas libres que mediante nucleótidos
complementarios se unen → formando un palíndromo: por ello se llaman
nucleótidos P.
c. Nucleótidos N: cuando se abre la horquilla y se añaden los nucleótidos del
palíndromo, una enzimas llamada TdT (terminal transferasa) añade nuevos
nucleótidos al azar entre ambas cadenas libres de la horquilla para unirlas.
Diversidad de unión en sí misma Codones de parada
2. Mutación Somática: maduración de la afinidad de los Ac.
• Sucede en respuestas secundarias o de memoria.
• Acumulación de mutaciones espontáneas o inducidas que el linfocito
permite que se den → no usa enzimas reparadoras del ADN.
• Puede suceder que se produzca un Ac incompleto o improductivo, pero
puede suceder que el nuevo Ac sea mucho más afín a su Ag, lo que le
confiere ventaja evolutiva.
Acumulación de mutaciones somáticas
Nucleótidos P
Nucleótidos N
En conclusión: recombinación somática + diversidad de uniones + mutación
somática = 1013 variables potenciales → lo que es suficiente para el
reconocimiento de Ag a los que nos vemos expuestos a lo largo de nuestras
vidas.
Variabilidad en el Repertorio de TCR en el LT:
Genes y Mecanismos de Reordenamiento: Comparación LB y LT: Comparación entre el potencial de variabilidad de TCR y BCR
• Los TCR solo tienen forma de membrana, no hacen splicing diferencial
del ARNm, ni acumulación de variantes por hipermutación somática.
• El gen de la cadena α o γ (pesada): segmentos V, J y C → similar a
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS página 8
Genes y Mecanismos de Reordenamiento: Comparación LB y LT: Comparación entre el potencial de variabilidad de TCR y BCR
• Los TCR solo tienen forma de membrana, no hacen splicing diferencial
del ARNm, ni acumulación de variantes por hipermutación somática.
• El gen de la cadena α o γ (pesada): segmentos V, J y C → similar a
arreglos de LC en Igs.
→ Están en el cromosoma 14 fragmentado: V (70-80), J (61) y C
(único).
• Para la cadena β o δ (ligera) es similar al de las HC de las Igs, en tanto
tiene segmentos V, D, J y C.
→ En el cromosoma 7 fragmentado: V (52), D (2), J (13), C (2).
• Los alternativos están en cromosoma 7 y son idénticos.
• Los de la cadena δ se incrustan entre los segmentos V y J (o D) de cada
cadena α o β.
Corte y empalme de los fragmentos de ambas cadenas del TCR Estructura fina de los genes de los TCR
Cuadro comparativo entre BCR y TCR
Grado Final de Diversidad:
• A diferencia del LB, en el LT las dos cadenas siempre
participan en la recombinación.
• Ello lleva a que los receptores TCR sean incluso más
diversos que los de BCR → del orden de 10 18.
Modelo Inmunológico de Inmunidad Adaptativa con SARS-CoV-2:
Para combatir un virus se utilizan las dos maquinarias de la inmunidad (innata y adaptativa).
• Puede suceder que una persona que ya ha sido infectada por SARS-CoV-2 no genere Ac, ya que su inmunidad innata erradicó por sí sola al patógeno.
• La mayoría de personas sí generan un respuesta adaptativa (con la que solo cuentan los animales vertebrados), la cual es alta mente específica y genera
memoria (logran vivir durante mucho tiempo).
→ Las de memoria adquieren un capacidad de activarse más fácil para combatir de manera más eficiente una posterior infección.
→ No le da "ventana amplia" al virus para replicarse.
→ Estas funciones están mediadas principalmente por los receptores de los linfocitos (BCR y TCR).
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS página 9
Esquema de la infección por SARS-CoV-2 Esquema del papel de la inmunidad adaptativa en la infección por SARS-CoV-2
• Todos nacemos con un repertorio de células B y T de unos 10 12 de cada uno. Individualmente cada una de estas células expresa unos receptores que se unen a Ag
específicos que nos podemos encontrar a los largo de nuestras vidas.
→ El repertorio tendrá un sub-repertorio que reconocen diferentes Ag del patógeno.
→ Una vacuna activará un sub-subrepertorio que reconoce el Ag que se aplica, dando células de memoria.
• Cuando el Ag se une a estos receptores, dejan de ser vírgenes → se da una expansión clonal de esa célula que mediará la respu esta inmune adaptativa.
→ Un pequeño grupo de células efectoras se convertirá en las células de memoria.
• Los linfocitos B se maduran en la médula ósea; en esta maduración se Repertorio es diferente a Memoria
tiene que ensamblar un BCR funcional.
• Los LT se diferencian en el timo.
Maduración de LB
• Los Ac tienen muchas funciones:
→ Neutralización.
→ Opsonización: los fagocitos tiene receptores para la porción
Fc de un Ac.
1. Degranulación celular.
2. Producción de moléculas pro-inflamatorias. Usos terapéuticos de los Ac monoclonales
• La producción constante de Ac se tiene muchos usos: terapéutico,
diagnóstico, pronóstico, etc.
Modelo de Ac monoclonales en modulación de la respuesta inmune
Electroforesis de proteínas séricas
• Todos los anticuerpos cuando se ponen a correr en
un campo electroforético, migran con un patrón
Acs denominado γ, es por ello que en sangre se les
conoce como γ-globulinas.
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS página 10
Electroforesis de proteínas séricas
• Todos los anticuerpos cuando se ponen a correr en
un campo electroforético, migran con un patrón
Acs denominado γ, es por ello que en sangre se les
conoce como γ-globulinas.
ANTÍGENOS, ESTRUCTURA Y FUNCIÓN DE LAS INMUNOGLOBULINAS, RECEPTORES DE ANTÍGENOS página 11
También podría gustarte
- Sueroterapia 1 PDFDocumento15 páginasSueroterapia 1 PDFJudasPriest100% (1)
- Guía Visual de Enfermedades Infecciosas PDFDocumento560 páginasGuía Visual de Enfermedades Infecciosas PDFJacinto Luque Aguilar100% (7)
- Interrelación Entre La NutriciónDocumento5 páginasInterrelación Entre La NutriciónGloria SalasAún no hay calificaciones
- Inmunoglobulinas 2010Documento36 páginasInmunoglobulinas 2010Esteban J Higuera-LizcanoAún no hay calificaciones
- Ensayo B02 4MDocumento31 páginasEnsayo B02 4MCony100% (1)
- Apuntes Del Tema de AnticuerposDocumento7 páginasApuntes Del Tema de AnticuerposPaola PintoAún no hay calificaciones
- Anual Decimo CCNN 2019-2020Documento12 páginasAnual Decimo CCNN 2019-2020damianAún no hay calificaciones
- Unidad 2 2022Documento112 páginasUnidad 2 2022alejandroescobar264Aún no hay calificaciones
- Estructura de Las Igs PDFDocumento14 páginasEstructura de Las Igs PDFEnny StrifeAún no hay calificaciones
- Clase - Articuerpos - 20206dDocumento130 páginasClase - Articuerpos - 20206dJA BrocaAún no hay calificaciones
- INMUNOGLOBULINASDocumento22 páginasINMUNOGLOBULINASMacky Alejandra Gómez MedranoAún no hay calificaciones
- InmulogíaDocumento19 páginasInmulogíaIgnacio RotellaAún no hay calificaciones
- Anticuerpos y Respuesta Humoral SecundariaDocumento20 páginasAnticuerpos y Respuesta Humoral SecundariaPabsAún no hay calificaciones
- Inmunoglobulinas y BCRDocumento14 páginasInmunoglobulinas y BCRLucas Francisco Vargas RodriguezAún no hay calificaciones
- InmunoglobulinasDocumento13 páginasInmunoglobulinasgiovanna ybarraAún no hay calificaciones
- Cadenas Pesadas y LigerasDocumento7 páginasCadenas Pesadas y LigerasGisbelly PayampsAún no hay calificaciones
- Anticuerpos InmunologíaDocumento3 páginasAnticuerpos InmunologíadieegoavromAún no hay calificaciones
- Wuolah Free Tema 3Documento14 páginasWuolah Free Tema 3JESUS LADRON DE GUEVARA MIRANDAAún no hay calificaciones
- Mapa Mental Anticuerpos.Documento6 páginasMapa Mental Anticuerpos.Brenda VergaraAún no hay calificaciones
- PowerPoint PresentationDocumento44 páginasPowerPoint PresentationHenry Ponce TamayAún no hay calificaciones
- REGUEIRO Capitulo 4Documento9 páginasREGUEIRO Capitulo 4MARIA CELESTEAún no hay calificaciones
- GM KM PresentaciónDocumento40 páginasGM KM PresentaciónJavierRodriguezAún no hay calificaciones
- 6 TCR BCR Igs y ToleranciaDocumento14 páginas6 TCR BCR Igs y ToleranciaGuille OliveraAún no hay calificaciones
- EstructuraDocumento8 páginasEstructuraZDKJFGHAún no hay calificaciones
- 05 - Receptores BCR y AnticuerposDocumento4 páginas05 - Receptores BCR y Anticuerpossanti2022Aún no hay calificaciones
- Anticuerpos y AntigenosDocumento10 páginasAnticuerpos y AntigenoskatherineAún no hay calificaciones
- Anticuerpos Monoclonales y Su Uso Como Tratamiento de Lupus Eritematoso SistémicoDocumento8 páginasAnticuerpos Monoclonales y Su Uso Como Tratamiento de Lupus Eritematoso SistémicoMargarita López AlvarezAún no hay calificaciones
- Recombinación Sitio Especifica y Recombinación SomáticaDocumento26 páginasRecombinación Sitio Especifica y Recombinación SomáticaEmerson Ynca PalominoAún no hay calificaciones
- Inmunoglobulina MDocumento7 páginasInmunoglobulina MElian HernándezAún no hay calificaciones
- Anticuerpos y Antigenos 1Documento3 páginasAnticuerpos y Antigenos 1mirope caceresAún no hay calificaciones
- RESUMEN de Inmunoglobulinas M FinalDocumento5 páginasRESUMEN de Inmunoglobulinas M FinalMaría IsabelAún no hay calificaciones
- ESTRUCTURA de Los ANTICUERPOSDocumento7 páginasESTRUCTURA de Los ANTICUERPOSJuan LozadaAún no hay calificaciones
- Repaso Capitulo 5-9Documento10 páginasRepaso Capitulo 5-9Araceli hernandez JaimeAún no hay calificaciones
- AnticuerposDocumento15 páginasAnticuerposfrediry david romero aularAún no hay calificaciones
- 4 MHC Y Present AgDocumento76 páginas4 MHC Y Present AgGeorge RojoAún no hay calificaciones
- 10 Inmunoglobulinas e Inmunidad HumoralDocumento27 páginas10 Inmunoglobulinas e Inmunidad HumoralJ. JoseAún no hay calificaciones
- IgbDocumento24 páginasIgbEsteban J Higuera-LizcanoAún no hay calificaciones
- AnticuerposDocumento30 páginasAnticuerposDavid ValdésAún no hay calificaciones
- DiversidadinmuneDocumento46 páginasDiversidadinmuneraphaelAún no hay calificaciones
- InmunlogiaDocumento3 páginasInmunlogiaLópez Venegas Jaziel PaulAún no hay calificaciones
- Antigenos y AnticuerposDocumento34 páginasAntigenos y AnticuerposmariaAún no hay calificaciones
- Linfocitos BDocumento38 páginasLinfocitos Blady laura restrepoAún no hay calificaciones
- Clase02 PDFDocumento11 páginasClase02 PDFNever MindAún no hay calificaciones
- Fundamentos en Inmunohematologà - ADocumento18 páginasFundamentos en Inmunohematologà - Ajuan pablo padgetAún no hay calificaciones
- Zyanopsis de Inmuno 2.0 - Segundo BloqueDocumento30 páginasZyanopsis de Inmuno 2.0 - Segundo BloqueSofía Vanessa Velázquez JuárezAún no hay calificaciones
- Capítulo 5 - TCR y BCR PDFDocumento7 páginasCapítulo 5 - TCR y BCR PDFJorgeAún no hay calificaciones
- 3.3. AnticuerposDocumento139 páginas3.3. AnticuerposGybran VargasAún no hay calificaciones
- Inmunoglobulina eDocumento26 páginasInmunoglobulina eLpMr Marco AntonioAún no hay calificaciones
- AnticuerposDocumento14 páginasAnticuerposMariano Félix DemasiAún no hay calificaciones
- Tema 3 AnticuerposDocumento6 páginasTema 3 AnticuerposJesus MoralesAún no hay calificaciones
- Organización y Expresión de Los Genes Receptores de LinfocitosDocumento32 páginasOrganización y Expresión de Los Genes Receptores de LinfocitosYareth FloresAún no hay calificaciones
- Resumen Del Prmer Parcial de InmunoDocumento19 páginasResumen Del Prmer Parcial de Inmunorocio bogadoAún no hay calificaciones
- AnticuerposDocumento21 páginasAnticuerposGomez UrsuAún no hay calificaciones
- AnticuerposDocumento58 páginasAnticuerposnomade.astralAún no hay calificaciones
- INMUNOGLOBULINASDocumento5 páginasINMUNOGLOBULINASLizbthAún no hay calificaciones
- Clases 9 y 10 - InmunologíaDocumento21 páginasClases 9 y 10 - Inmunologíafernanda.paredes.1Aún no hay calificaciones
- Antigenos (+clase 3)Documento32 páginasAntigenos (+clase 3)Sandra Gisel KunigkAún no hay calificaciones
- Estructura y Funcion Proteica II.Documento6 páginasEstructura y Funcion Proteica II.jesus sanchez coelhoAún no hay calificaciones
- AnticuerpoDocumento6 páginasAnticuerpocarolinaAún no hay calificaciones
- 3 Semana de InmunologiaDocumento53 páginas3 Semana de InmunologiaHector SalazarAún no hay calificaciones
- Linfocitos B e Inmunidad Humoral PDFDocumento7 páginasLinfocitos B e Inmunidad Humoral PDFJennyffer LopezAún no hay calificaciones
- Tema 9 AnticuerposDocumento40 páginasTema 9 AnticuerposDaniel OrtizAún no hay calificaciones
- Inmunidad HumoralultDocumento47 páginasInmunidad Humoralultbn.tarazona.ramirezAún no hay calificaciones
- Psicofármacos II - AnsiolíticosDocumento14 páginasPsicofármacos II - AnsiolíticosCLAUDIA LORENA RAMIREZ FRANCOAún no hay calificaciones
- Atención de Intoxicaciones en UrgenciasDocumento94 páginasAtención de Intoxicaciones en UrgenciasCLAUDIA LORENA RAMIREZ FRANCOAún no hay calificaciones
- Atención de Intoxicaciones en UrgenciasDocumento94 páginasAtención de Intoxicaciones en UrgenciasCLAUDIA LORENA RAMIREZ FRANCOAún no hay calificaciones
- Tiroideos y AntitiroideosDocumento40 páginasTiroideos y AntitiroideosCLAUDIA LORENA RAMIREZ FRANCOAún no hay calificaciones
- Auto InmunidadDocumento24 páginasAuto InmunidadCLAUDIA LORENA RAMIREZ FRANCOAún no hay calificaciones
- PR Hepáticas Anormales 2021.en - EsDocumento17 páginasPR Hepáticas Anormales 2021.en - EsCLAUDIA LORENA RAMIREZ FRANCOAún no hay calificaciones
- Discusion de RCVDocumento24 páginasDiscusion de RCVCLAUDIA LORENA RAMIREZ FRANCOAún no hay calificaciones
- Inmunorreacciones MixtasDocumento23 páginasInmunorreacciones MixtasArlen EscoberAún no hay calificaciones
- Exposición MicrobiologíaDocumento47 páginasExposición MicrobiologíaDIEGO STIVEN GARCIA ACEVEDOAún no hay calificaciones
- Curs Reumatologie PDFDocumento209 páginasCurs Reumatologie PDFanaflorinapadu6458Aún no hay calificaciones
- Complejo Mayor de Histocompatibilidad 2Documento58 páginasComplejo Mayor de Histocompatibilidad 2Raquel Tejada LantiguaAún no hay calificaciones
- Técnicas para El Estudio de Localización y Función de Proteínas y Ácidos NucleicosDocumento3 páginasTécnicas para El Estudio de Localización y Función de Proteínas y Ácidos Nucleicossofia perezAún no hay calificaciones
- Bruno Roxana Prueba PericialDocumento25 páginasBruno Roxana Prueba PericialRamon MartinezAún no hay calificaciones
- Caso Clinico Corregido 3 Nefrologia IiDocumento13 páginasCaso Clinico Corregido 3 Nefrologia IiYosting RojasAún no hay calificaciones
- Glosario Actividad 1 PDFDocumento6 páginasGlosario Actividad 1 PDFDayana VegaAún no hay calificaciones
- Formato Oficial para Iniciar Tramite de Visita A Internos en Los CeferesosDocumento6 páginasFormato Oficial para Iniciar Tramite de Visita A Internos en Los CeferesosAulcy GarciaAún no hay calificaciones
- Tesis VacunasDocumento47 páginasTesis VacunasBrunovvAún no hay calificaciones
- Clase 11 Citoquinas - SeroinmunologíaDocumento80 páginasClase 11 Citoquinas - SeroinmunologíaCésar Morante ChavarryAún no hay calificaciones
- Equipo 4 "Linfopoyesis" ENF02A 20-2Documento16 páginasEquipo 4 "Linfopoyesis" ENF02A 20-2Ruth Cobo RosalesAún no hay calificaciones
- F CV3 3B 1 - Silabo - Microbiologia - 2019 1Documento10 páginasF CV3 3B 1 - Silabo - Microbiologia - 2019 1Jose DanielAún no hay calificaciones
- Clase PPT Bacterias, Virus, InmunidadDocumento45 páginasClase PPT Bacterias, Virus, InmunidadPaulina GonzálezAún no hay calificaciones
- Hematopoyesis ExpoDocumento23 páginasHematopoyesis ExpoDavid PinedoAún no hay calificaciones
- AnafilaxiaDocumento3 páginasAnafilaxiaAmp CiclicoAún no hay calificaciones
- Tema InmunologiaDocumento9 páginasTema InmunologiaJUAN QUINTEROAún no hay calificaciones
- Tesis Pnie-Cancer 28Documento49 páginasTesis Pnie-Cancer 28Isela PérezAún no hay calificaciones
- Guías de Atención Lepra - Malaria - Dengue - Leishmaniasis - Fiebre Amarilla - Enfermedad de Chagas 2007Documento285 páginasGuías de Atención Lepra - Malaria - Dengue - Leishmaniasis - Fiebre Amarilla - Enfermedad de Chagas 2007obelixoAún no hay calificaciones
- Cuidados de Enfermería en Pacientes OncológicosDocumento4 páginasCuidados de Enfermería en Pacientes OncológicosLaTanaScalaAún no hay calificaciones
- Cronograma Biologia Histologia Embriologia GeneticaDocumento4 páginasCronograma Biologia Histologia Embriologia GeneticaestudianteubaAún no hay calificaciones
- COVID-19 FARMACOLOGÍA Seminario 3 OKDocumento51 páginasCOVID-19 FARMACOLOGÍA Seminario 3 OKEhtilMezaPastranaAún no hay calificaciones
- Bases Farmacológicas Del Tratamiento de La Mastitis BovinaDocumento14 páginasBases Farmacológicas Del Tratamiento de La Mastitis BovinaLuisa R. CalderónAún no hay calificaciones
- Vih Sida Harrison 149615 Downloadable 1669274Documento71 páginasVih Sida Harrison 149615 Downloadable 1669274OKELLY JASIEL GRANDA RIVERAAún no hay calificaciones
- 2021.12.03 - Killa, Canino, Perfil VSDocumento2 páginas2021.12.03 - Killa, Canino, Perfil VSLucero DávilaAún no hay calificaciones
- Roche A-Z (2007)Documento198 páginasRoche A-Z (2007)datitoxAún no hay calificaciones