Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Informe Orgánica Cinética Quimica
Cargado por
Emiliano LopezDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Informe Orgánica Cinética Quimica
Cargado por
Emiliano LopezCopyright:
Formatos disponibles
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
FACULTAD DE QUÍMICA
LABORATORIO QUIMICA ORGANICA 2
INFORME DE PRÁCTICA 2
CINÉTICA QUÍMICA
Por: Gonzalez Frias Julieta y López Barrera E. Emiliano
Docente: Mendoza Pérez Jacinto Eduardo
Grupo: 1
Fecha de realización: 05/03/23
Resumen
En una reacción de primer orden, la velocidad de esta, es directamente
proporcional a la concentración de una única especie A (como en el caso de las
reacciones de sustitución nucleofílica unimolecular y eliminación unimolecular)
donde k es el coeficiente de velocidad específica. Para la determinación de esta se
traza una recta a la que se le aplica el método de mínimos cuadrados que se ajusta
a los valores experimentales, obteniendo así, una recta con pendiente negativa.
El mecanismo de hidrólisis de cloruro de terbutilo consiste en una sustitución
nucleofílica unimolecular, cuya velocidad de reacción depende sólo de la
concentración del substrato. Esta tuvo lugar desde el momento en que añadimos la
mezcla de etanol y agua, por lo que procedimos a titular para obtener nuestros
valores correspondientes de concentración y posteriormente cinéticos.
En nuestro caso, pudimos obtener una gráfica que concuerda con lo buscado
en una reacción de orden 1, solo que no contamos con la pendiente negativa
reportada en la teoría. El resultado obtenido de la cinética de orden 1 que pudimos
observar, justifica efectivamente la presencia del mecanismo SN1 en el experimento
de esta práctica, contemplando que este proceso sólo depende de la concentración
del substrato.
Antecedentes
La cinética química es el campo de la química que se ocupa de la rapidez o
velocidad con la que ocurren las reacciones químicas, dicho con otras palabras, es
la desaparición de reactivos para convertirse en productos. Introduce la variable
tiempo en el estudio de las reacciones y estudia el camino que siguen los reactivos
para convertirse en productos.
La velocidad de una reacción está definida como la cantidad formada en una
reacción química o transformada por una unidad de tiempo, la cual no es constante.
Se necesita medir la cantidad de reactivo que desaparece por unidad de tiempo, la
velocidad de reacción se mide en unidades de concentración sobre tiempo (mol/
L.s).
La velocidad de aparición del producto es igual a la velocidad de desaparición del
reactivo:
𝑎𝐴 + 𝑏𝐵 → 𝑔𝐺 + ℎ𝐻
Su velocidad de reacción se define como:
𝑎 𝑏
𝑟 = 𝐾[𝐴] [𝐵 ]
r= denota la velocidad de reacción
K= es la constante de velocidad
La ecuación de la velocidad para reacciones de primer orden será:
𝑑[𝐴]
− 𝑑𝑡
= 𝐾[𝐴]
[𝐴]
𝐼𝑛 [𝐴] =− 𝐾𝑡
0
[A]= concentración en el instante t cualquiera
[A]0= concentración cuando t=0
Cuando no se conoce el valor de la constante de velocidad específica, se puede
[𝐴]
operar de forma gráfica representando [𝐴] en función del tiempo, como la gráfica
0
siguiente:
Resultados y observaciones
Pruebas de identificación:
En la primera prueba se formó un precipitado blanco, el cual nos indica la
presencia del halógeno. En la segunda prueba, al principio de esta se puede notar
un color amarillento-naranja que con el paso del tiempo va desapareciendo el color
para quedar totalmente transparente. En la tercera y última prueba se mantuvo en
un color entre amarillento y naranja.
Tiempo Vol. de X=conce (a-x) 𝑎
𝑙𝑜𝑔
𝑎 k
(𝑎−𝑥) (𝑎−𝑥)
NaOH ntración (mol/L)
(mL) mol/L de
NaOH
10 1.7 7.99x10^-3 0.08401 1.095107 0.039456 3.582x10^-
4
20 0.8 3.76x10 ^-3 0.08824 1.042611 0.018122 6.946x10^-
4
30 1.5 7.05x10^-3 0.08495 1.082989 0.034624 1.327x10^-
4
40 2 9.4x10^-3 0.0826 1.113801 0.046807 1.794x10^-
4
50 2.3 0.01081 0.08119 1.133144 0.054285 2.080x10^-
4
60 2.5 0.01175 0.08025 1.146417 0.059342 2.274x10^-
4
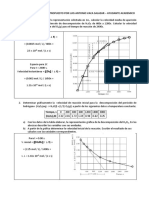
Gráfica 1.
k=0.00138 s^-1
Discusión
En la búsqueda de la obtención del cloruro de ter-butilo, se utilizó ácido
clorhídrico que es un disolvente polar prótico, favoreciendo el mecanismo SN1, en el
cual está involucrado un carbocatión terciario (muy estable) que será atacado por el
cloruro, dando lugar al producto deseado. Después, del producto se tomó un ml y se
aforó a 100 ml con una solución de etanol y agua, su concentración fue determinada
utilizando la densidad, el volumen de la alícuota y el peso molecular, obteniendo
0.092mol/L.
En la tabla encontramos varias columnas que nos ayudarán para la
determinación de la constante de velocidad de la hidrólisis del cloruro de terbutilo,
en la cuarta columna se observa (a-x), donde a corresponde a la concentración
inicial del cloruro de ter-butilo, y x corresponde a la concentración que se fue
obteniendo del mismo, lo cual realmente muestra lo que no reaccionó a diferentes
tiempos, y se puede observar que va disminuyendo. En el caso de la quinta y sexta
columna en la tabla, también es posible observar cálculos útiles para poder después
obtener la constante de velocidad (k), utilizando la fórmula planteada en la práctica.
En el momento en que la mezcla de etanol y agua es añadida, comienza la
hidrólisis, por lo que ahora se tiene el tiempo medido para empezar a recolectar los
datos en titulación para obtener las concentraciones en función del tiempo que
posteriormente transformaremos en datos cinéticos de la reacción, el primer dato
debió ser a los 2 minutos, pero fuimos un poco lentos en el proceso general de
terminado de montado y titulación, por lo que comenzamos con nuestro primer dato
a los 10 minutos y continuamos así, por los siguientes 60 minutos. Ahora tendremos
en cuenta que debemos tener todo preparado con anticipación para la próxima vez.
Graficando los valores, se obtuvo una figura similar a una línea recta
exceptuando algún valor, sobre esta se plantea regresión lineal, comprobando hasta
cierto punto, la veracidad de que efectivamente se trata de una ecuación de primer
orden, a pesar de que supuestamente debimos haber obtenido una recta de
pendiente negativa.
La interpretación de que se trate de una ecuación de primer orden, nos dice
que solo existe una dependencia en la rapidez de esta reacción, premisa que
coincide con la teoría de los mecanismos SN1 y E1, procesos en los cuales la
rapidez de reacción sólo depende del substrato (única dependencia) por lo que la
cinética tratada en esta práctica, puede ser una forma de probar que este es el
mecanismo presente en el trabajo experimental.
Por lo que al determinar que el orden de reacción presente es 1, podemos
afirmar que en esta práctica existe el mecanismo SN1
Conclusión
Fue posible determinar experimentalmente el mecanismo de sustitución
nucleofílica unimolecular, a partir de obtener la constante de la velocidad de
reacción a partir de las concentraciones que se obtuvieron. Para consecuentemente
hidrolizar y determinar la constante de velocidad de reacción, a través del método
gráfico para comprobar el orden presente de la ecuación, y justificar la existencia del
mecanismo existente en una reacción.
Cálculos
Para el cálculo de a, que es la concentración inicial del cloruro de terbutilo:
a= 1mL (0.85)(10/92) = 0.092 mol/L
Para calcular x en el tiempo t:
x=Vol. NaOH x Normalidad/10 = mol/L
0.047 𝑒𝑞/𝐿 −3
𝑋 = (1. 7 𝑚𝐿 )( 10 𝑚𝐿
) = 7. 99𝑥 10 𝑒𝑞/𝐿 = 𝑚𝑜𝑙/𝐿
Para el cálculo de a-x:
−3
𝑎 − 𝑥 = 0. 092 𝑚𝑜𝑙/𝐿 − 7. 99𝑥 10 𝑚𝑜𝑙/𝐿 = 0. 08401 𝑚𝑜𝑙/𝐿
Para el cálculo de a/(a-x) :
𝑎 0.092 𝑚𝑜𝑙/𝐿
(𝑎−𝑥)
= 0.08401 𝑚𝑜𝑙/𝐿
= 1. 095107
Para el cálculo de log(a/a-x):
𝑎
𝑙𝑜𝑔 𝑎−𝑥
= 𝑙𝑜𝑔1. 095107 = 0. 039456
Para el cálculo de “k” en los distintos tiempos, se utilizó la siguiente fórmula:
𝑎 1 1 −4 −1
𝑘 = 2. 3 𝑙𝑜𝑔 (𝑎−𝑥)
( 𝑇 ) = 2. 3(0. 093456)( 600 ) = 3. 582𝑥 10 𝑠
Para encontrar “k” por el método gráfico, se construye una gráfica, cuya pendiente
es igual a m=Y2-Y1/X2-X1 y nos da el valor de k=2.3m
La pendiente de la gráfica es igual a m=0.0006
−1
𝑘 = 2. 3(𝑚) = 2. 3(0. 0006) = 0. 00138 𝑠
Referencia bibliográficas
▷El Método de mínimos cuadrados: definición y ejemplos☑. (2016, abril 12). Mi
Profe. https://miprofe.com/minimos-cuadrados/
Cinética_química. (s/f). Quimica.es. Recuperado el 5 de marzo de 2023, de
https://www.quimica.es/enciclopedia/Cin%C3%A9tica_qu%C3%ADmica.html
de Las Reacciones Químicas, T. 6. C. (s/f). Cinética de las Reacciones Químicas.
Upo.es. Recuperado el 5 de marzo de 2023, de
https://www.upo.es/depa/webdex/quimfis/quimbiotec_termo_files/Temas%20y%2
0programa%20de%20Termo/Tema%206_2.pdf
Reacciones de Primer Orden. (s/f). Quimicafisica.com. Recuperado el 5 de marzo de
2023, de
https://www.quimicafisica.com/cinetica-quimica-reacciones-de-primer-orden.html
P. W. Atkins, “Fisicoquímica”, 3ª edición, 1991, editorial Addison-Wesley
Iberoamericana.
Levine, Ira N., “Fisicoquímica”, 3ª edición, editorial Mc Graw-Hill.
También podría gustarte
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Práctica 4 CinéticaDocumento7 páginasPráctica 4 CinéticaPérez Carrasco Paulina GabrielaAún no hay calificaciones
- Práctica 2 CinéticaDocumento12 páginasPráctica 2 CinéticaXanath PotAún no hay calificaciones
- Practica 4 CinéticaDocumento17 páginasPractica 4 CinéticaJuan Daniel Silvas CondeAún no hay calificaciones
- Saponificacion de Acetato de EtiloDocumento21 páginasSaponificacion de Acetato de EtiloJean LkAún no hay calificaciones
- ViscosimetriaDocumento9 páginasViscosimetriaPabloAún no hay calificaciones
- Velocidad de ReaccionDocumento7 páginasVelocidad de ReacciongenesisAún no hay calificaciones
- Transferencia de Masa y Cinética CombinadaDocumento9 páginasTransferencia de Masa y Cinética Combinadaestefa0116Aún no hay calificaciones
- T1.DiagnósticoQC ArantxaYaniraRuizPadillaDocumento16 páginasT1.DiagnósticoQC ArantxaYaniraRuizPadillaJose Jair Bonilla Cuevas100% (1)
- Pre InformeDocumento11 páginasPre InformeMC RapthorAún no hay calificaciones
- Practica 10 Cinetica de La Reduccion Del Ion MnO4Documento11 páginasPractica 10 Cinetica de La Reduccion Del Ion MnO4sofi DiazAún no hay calificaciones
- Escenario 1Documento10 páginasEscenario 1Jessica Guadalupe BermudezAún no hay calificaciones
- Constante EquilibrioDocumento6 páginasConstante EquilibrioJhon Andres Diaz PerezAún no hay calificaciones
- Metodo de VelocidadesDocumento20 páginasMetodo de VelocidadesFrancisco LaraAún no hay calificaciones
- Taller Cinetica de Las Reacciones Homogeneas 2Documento18 páginasTaller Cinetica de Las Reacciones Homogeneas 2Melanie Verbel EscobarAún no hay calificaciones
- Trabajo Práctico #9 Cinética QuímicaDocumento11 páginasTrabajo Práctico #9 Cinética QuímicaPau ZalazarAún no hay calificaciones
- Saponifinación Acetato de EtiloDocumento5 páginasSaponifinación Acetato de Etilolavaro15Aún no hay calificaciones
- Practica No. 1Documento16 páginasPractica No. 1UlisesAún no hay calificaciones
- Fase-2 FisicoquimicaDocumento8 páginasFase-2 FisicoquimicaPiolín CarameloAún no hay calificaciones
- Cinetica Química de Segundo Orden CinéticoDocumento7 páginasCinetica Química de Segundo Orden CinéticoFernando GabrielAún no hay calificaciones
- Determinación de La Ley Experimental de RapidezDocumento10 páginasDeterminación de La Ley Experimental de RapidezPauzh PérezAún no hay calificaciones
- Informe 2. Cinetica 2 OrdenDocumento7 páginasInforme 2. Cinetica 2 OrdenDayan Ocampo PatiñoAún no hay calificaciones
- Asignacion #3 Reactores IsotermicosDocumento18 páginasAsignacion #3 Reactores IsotermicosLeidy EstradaAún no hay calificaciones
- Cinetica ResueltosDocumento15 páginasCinetica ResueltosIgnacio Aragones NovellaAún no hay calificaciones
- Práctica 1 RedoxDocumento6 páginasPráctica 1 RedoxaNa BaRaKaLdOAún no hay calificaciones
- Reporte de Práctica Saponificación A y BDocumento11 páginasReporte de Práctica Saponificación A y BKike SalasAún no hay calificaciones
- CINETICA QUIMICA 2apDocumento46 páginasCINETICA QUIMICA 2apAGUSTIN GONZALEZ SANTAMARIAAún no hay calificaciones
- Tarea No. 1 - Diagnostico - Ingenieria de ReactoresDocumento26 páginasTarea No. 1 - Diagnostico - Ingenieria de ReactoresJúpiter100% (1)
- DDDDDocumento7 páginasDDDDRoberto Andres Estupiñan CuadradoAún no hay calificaciones
- Práctica BDocumento6 páginasPráctica Bjuan de dios macia lopezAún no hay calificaciones
- Manual Practicas - CinéticaDocumento24 páginasManual Practicas - CinéticaFernando GonzalezAún no hay calificaciones
- Practica 2-Quimica AcuaticaDocumento6 páginasPractica 2-Quimica AcuaticaHenry JuarezAún no hay calificaciones
- Exp. 03 - PÉNDULO SIMPLEDocumento11 páginasExp. 03 - PÉNDULO SIMPLENare24Aún no hay calificaciones
- Práctica 10 Cinética Reacciones ReversiblesDocumento6 páginasPráctica 10 Cinética Reacciones ReversiblesstephanieAún no hay calificaciones
- Serie2009 L10 PDFDocumento4 páginasSerie2009 L10 PDFAnna Maria VeraAún no hay calificaciones
- Practica 6 Termo 4 TeoriaDocumento14 páginasPractica 6 Termo 4 TeoriaChristian Aquino100% (1)
- Cinetica Quimica Resueltos PDFDocumento4 páginasCinetica Quimica Resueltos PDFJorge Pibaque100% (1)
- Tratamiento de DatosDocumento10 páginasTratamiento de DatosNick Renzo Barzola YauceAún no hay calificaciones
- Informe 4Documento16 páginasInforme 4Sandra Maldonado PerezAún no hay calificaciones
- EQUIPO2 R1 2-FlattenedDocumento10 páginasEQUIPO2 R1 2-FlattenedSalvador Zúñiga IbarraAún no hay calificaciones
- Flujo Viscoso PDFDocumento7 páginasFlujo Viscoso PDFRuth De la CruzAún no hay calificaciones
- Segundo Parcial de Fisicoquimic1 ModeloDocumento2 páginasSegundo Parcial de Fisicoquimic1 ModeloWendy Guaman MendozaAún no hay calificaciones
- Practica 1Documento10 páginasPractica 1Iezuz HerreraAún no hay calificaciones
- Tarea 4.1Documento7 páginasTarea 4.1Luis alejandro Perez mercadoAún no hay calificaciones
- Informe 2 CineticaDocumento7 páginasInforme 2 CineticaFernando GabrielAún no hay calificaciones
- Actividad 03 - Viscodidad y Ejercicios Grupo 12Documento8 páginasActividad 03 - Viscodidad y Ejercicios Grupo 12Drue Daniel Tuesta GarcíaAún no hay calificaciones
- Difusión MolecularDocumento11 páginasDifusión MolecularTania HoneyAún no hay calificaciones
- Laboratorio Integral 2. - Práctica 12. - Determinación de La Energía de Activación.Documento8 páginasLaboratorio Integral 2. - Práctica 12. - Determinación de La Energía de Activación.DavidHerreraAún no hay calificaciones
- Informe de Quimica Laboratorio 6Documento8 páginasInforme de Quimica Laboratorio 6Alexander MejíaAún no hay calificaciones
- Reporte de Práctica Lab 1Documento10 páginasReporte de Práctica Lab 1Montse CapuchinoAún no hay calificaciones
- P2R - Trejo Ortiz Jose AntonioDocumento9 páginasP2R - Trejo Ortiz Jose AntonioAlan ZamudioAún no hay calificaciones
- PIA LAB REACTORES CasiDocumento7 páginasPIA LAB REACTORES CasiGrecia Alejandra Ramirez RicoAún no hay calificaciones
- Ley de NernstDocumento11 páginasLey de NernstAna HerreroAún no hay calificaciones
- PRÁCTICA 4 Cinética QuímicaDocumento15 páginasPRÁCTICA 4 Cinética Químicafelipecaycedo50% (2)
- P#8 - Determinación de La Ley Experimental de Rapidez. Yodación de La Acetona.Documento6 páginasP#8 - Determinación de La Ley Experimental de Rapidez. Yodación de La Acetona.Ana Karen GuillermoAún no hay calificaciones
- Reporte Propiedades ColigativasDocumento3 páginasReporte Propiedades ColigativasCésar DavidAún no hay calificaciones
- Problemas de Fisicoquimica (Cinetica Microbiana)Documento11 páginasProblemas de Fisicoquimica (Cinetica Microbiana)Charly DickensAún no hay calificaciones
- Proyecto Final HidráulicaDocumento18 páginasProyecto Final HidráulicaDiego ArmandoAún no hay calificaciones
- Practica 6 Lab 2Documento32 páginasPractica 6 Lab 2Saul LunaAún no hay calificaciones
- Previo CiclofosfacenosDocumento17 páginasPrevio CiclofosfacenosEmiliano LopezAún no hay calificaciones
- Previo Estabilidad de Plomo y Estaño 4Documento12 páginasPrevio Estabilidad de Plomo y Estaño 4Emiliano LopezAún no hay calificaciones
- Previo Sal de FremyDocumento8 páginasPrevio Sal de FremyEmiliano LopezAún no hay calificaciones
- Previo Ditiocarbamatos de PostasioDocumento9 páginasPrevio Ditiocarbamatos de PostasioEmiliano LopezAún no hay calificaciones
- Previo Explosivos y Reacciones ViolentasDocumento6 páginasPrevio Explosivos y Reacciones ViolentasEmiliano LopezAún no hay calificaciones
- Informe Reducción Del Grupo Carbonilo Con NaBH4Documento6 páginasInforme Reducción Del Grupo Carbonilo Con NaBH4Emiliano LopezAún no hay calificaciones
- Informe Obtencion de Bromuro de N-ButiloDocumento6 páginasInforme Obtencion de Bromuro de N-ButiloEmiliano LopezAún no hay calificaciones
- Informe Eliminación OrgánicaDocumento6 páginasInforme Eliminación OrgánicaEmiliano LopezAún no hay calificaciones
- Informe P5Documento7 páginasInforme P5Emiliano LopezAún no hay calificaciones
- Diccionario Judeo EspañolDocumento76 páginasDiccionario Judeo EspañolEmir AsadAún no hay calificaciones
- Cereales Gluten Seco y HumedoDocumento20 páginasCereales Gluten Seco y HumedoGreka Romero MorilloAún no hay calificaciones
- Concreto en Climas Calidos y Climas FriosDocumento28 páginasConcreto en Climas Calidos y Climas FriosLizbe Peña MoranAún no hay calificaciones
- Acta de Entrega Del SG-SSTDocumento7 páginasActa de Entrega Del SG-SSTJuanPabloVargas67% (3)
- Manual Medicina TradicionalDocumento7 páginasManual Medicina TradicionalCitlali GonzálezAún no hay calificaciones
- Recepción Del LenguajeDocumento5 páginasRecepción Del LenguajeDulce MariaAún no hay calificaciones
- Definamos Acciones para El Mejoramiento Continuo de La CalidadDocumento6 páginasDefinamos Acciones para El Mejoramiento Continuo de La CalidadLisbeth LópezAún no hay calificaciones
- Informe Europeo Sobre Los Progresos en Lalucha Contra La Trata 2022Documento21 páginasInforme Europeo Sobre Los Progresos en Lalucha Contra La Trata 2022lolaps18037095Aún no hay calificaciones
- Ecologia de PoblacionesDocumento28 páginasEcologia de PoblacionesCamilo :DAún no hay calificaciones
- BarfDocumento34 páginasBarfmiguel33% (3)
- Guía Viernes de La PrevenciónDocumento164 páginasGuía Viernes de La PrevenciónMarvin BatresAún no hay calificaciones
- Proceso Actual Practicas ViDocumento26 páginasProceso Actual Practicas ViBri Bea VargasAún no hay calificaciones
- 01 Informe Topografía PTPASDocumento11 páginas01 Informe Topografía PTPASEnoc FrancisAún no hay calificaciones
- Educacion SocioemocionalDocumento50 páginasEducacion SocioemocionalAra Zunún50% (2)
- AP E O: Anticoncepción Post Evento ObstetricoDocumento23 páginasAP E O: Anticoncepción Post Evento ObstetricoLizbeth GarciaAún no hay calificaciones
- Asignatura Calidad en La Gestión Del CuidadoDocumento20 páginasAsignatura Calidad en La Gestión Del CuidadoMobiliario InfantilAún no hay calificaciones
- Catéteres para ACTPDocumento75 páginasCatéteres para ACTPmariae2Aún no hay calificaciones
- Evolucion Enfermeria Materno InfantilDocumento10 páginasEvolucion Enfermeria Materno InfantilCRISTOBAL URIZAR CRUZAún no hay calificaciones
- PodoconiosisDocumento4 páginasPodoconiosisJavier Duran AlmonteAún no hay calificaciones
- Origen de La Estrella Michellin y Su SignificadoDocumento11 páginasOrigen de La Estrella Michellin y Su SignificadoRandyCairoAún no hay calificaciones
- ReSimple - Gransic Ley REPDocumento26 páginasReSimple - Gransic Ley REPJose Garrido ChacanaAún no hay calificaciones
- Blusa y Sus ModificacionesDocumento36 páginasBlusa y Sus ModificacionesIntershenyAún no hay calificaciones
- Informe JoaDocumento11 páginasInforme Joabryan reyespiAún no hay calificaciones
- El AbortoDocumento3 páginasEl AbortoAlanna Carrillo justinianoAún no hay calificaciones
- Tarea 2 AnatomiaDocumento12 páginasTarea 2 AnatomiaGarmo EIRLAún no hay calificaciones
- ModelosDocumento4 páginasModelosDubraka NavarrAún no hay calificaciones
- Dermatitis SeborreicaDocumento24 páginasDermatitis SeborreicaRafael Cruz MAún no hay calificaciones
- Laboratorio 2 SonometríaDocumento11 páginasLaboratorio 2 SonometríafranzAún no hay calificaciones
- Ácido Úrico LiquiformDocumento4 páginasÁcido Úrico Liquiformalexa1715Aún no hay calificaciones
- 2011 SEMA-3.XI MartinezDocumento38 páginas2011 SEMA-3.XI Martinezzosimopanopolitano100% (1)