Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Receptores Del Tipo RIG
Cargado por
Reyner CovarrubiasTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Receptores Del Tipo RIG
Cargado por
Reyner CovarrubiasCopyright:
Formatos disponibles
Receptores del tipo RIG
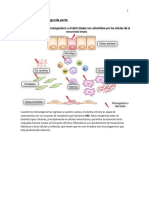
Los receptores del tipo RIG (RLR) son detectores citosólicos del ARN vírico
que responden a ácidos nucleicos víricos, induciendo la producción de
interferones antivíricos del tipo I. Los RLR pueden reconocer ARN bicatenario y
heterodúplex de ARN-ADN, lo que incluye los genomas de virus ARN y
transcriptos de virus ARN y ADN. Los dos RLR mejor caracterizados son RIG-I
(gen inducible por ácido retinoico I) y MDA5 (gen asociado a la diferenciación
del melanoma 5). Ambas proteínas contienen dos dominios de reclutamiento de
caspasas N terminales que interaccionan con otras proteínas transmisoras de
señales, un dominio ARN-helicasa y un dominio C terminal; los dos últimos
participan en el reconocimiento del ARN. RIG-I y MDA5 reconocen diferentes
grupos de ARN víricos que son característicos de diferentes virus, en parte en
función de la longitud de los ARN. Los RLR también pueden discriminar el ARN
unicatenario vírico de los transcriptos de ARN unicatenarios celulares
normales. Por ejemplo, RIG-I solo reconocerá ARN con una estructura 5'
trifosfato, que no está presente en el ARN citosólico de la célula anfitriona del
mamífero por la adición de un capuchón de 7-metilguanosina o la eliminación
del 5' trifosfato. Los RLR se expresan en una amplia variedad de tipos
celulares, incluidos los leucocitos derivados de la médula ósea y varias células
tisulares. Por tanto, estos receptores capacitan a muchos tipos celulares
proclives a la infección por virus ARN a participar en las respuestas
inmunitarias innatas frente a estos virus.
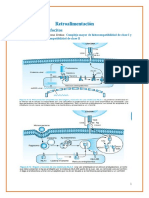
Al unirse al ARN, el RLR inicia las señales que conducen a la fosforilación y
activación de IRF3 e IRF7, así como la de NF-kB, y estos factores de
transcripción inducen la producción de interferones del tipo I. Esta interacción
(al unirse al ARN) causa dimerización de las helicasas tipo RIG y el inicio de
una vía de señalización que conduce a la fosforilación del factor de
transcripción, factor 3 de respuesta a interferón (IRF3) en el citoplasma. IRF3
se dimeriza a continuación y entra al núcleo para ayudar a iniciar la
transcripción de los genes IFN-β, que también requieren de los factores de
transcripción NFκB y AP-1. Una familia de genes en el cromosoma 9 codifica
los interferones tipo I, que comprenden IFN-β, múltiples formas de IFN-α y
varios tipos adicionales: IFN-δ, IFN-κ, IFN-λ, IFN-θ e IFN-ω. Una vez que se
secreta IFN-β, actúa tanto de forma autocrina, al unirse a los receptores en la
célula que lo elaboró, y paracrina, al unirse a los receptores en las células no
infectadas cercanas.
Detectores citosólicos de ADN y vía STING
Los detectores citosólicos del ADN (CDS, del inglés citosolic DNA sensors) son
moléculas que detectan el ADN citosólico y activan vías transmisoras de
señales que inician respuestas antimicrobianas, como la producción de
interferón del tipo I y la autofagia. El ADN procedente de varios microbios intra-
celulares puede liberarse en el citosol por diferentes mecanismos. Se han
caracterizado bien varias moléculas citosólicas detectaras del ADN y sus vías,
incluidas las siguientes:
• La vía STING (estimulador de genes de IFN, del inglés stimulator of IFN
genes) es un mecanismo importante de activación de las respuestas del
interferón del tipo I inducidas por el ADN. STING es una proteína
transmembranaria localizada en el retículo endoplásmico que activa de forma
indirecta el ADN microbiano en el citosol. El ADN citosólico se une a la enzima
sintasa del GMP-AMP cíclico (GASc) que sintetiza un dinucleótido cíclico
llamado GMP-AMP cíclico (GAMPc) después de encontrarse con el ADN. La
GAMPc interactúa entonces con STING y estimula su translocación a
membranas derivadas del Golgi, donde sirve de molécula de apoyo que
promueve la fosforilación de IRF3. El IRF3 fosforilado pasa al núcleo e induce
la expresión del gen del interferón del tipo I. STING también estimula la
autofagia, un mecanismo por el cual las células degradan sus propios
orgánulos, como las mitocondrias, secuestrándolas dentro de vesículas
rodeadas de membrana y fusionando las vesículas con los lisosomas. En la
inmunidad innata, la autofagia es un mecanismo para llevar microbios
citosólicos al lisosoma, donde las enzimas proteolíticas los matan.
El activador dependiente del ADN de los factores reguladores del IFN
(DAI, del inglés IFN-regulatory factors) se une al ADN de varias fuentes
microbianas y activa al IRF3, lo que conduce a una respuesta del IFN
del tipo I. El DAI también activa la vía NF-kB.
La ARN-polimerasa 3 se une al ADN microbiano, lo transcribe en ARN y
este activa la vía de RIG que conduce a la expresión del interferón del
tipo I, como se describió antes.
AIM2 (ausente en el melanoma 2) es otro CDS que reconoce ADNbc
citosólico. Forma un inflamasoma que contiene la caspasa 1 y que
procesa la pro-IL-lp y la pro-IL-18.
Otros receptores celulares para el reconocimiento del patrón
Varios tipos de receptores de membrana plasmática y citoplásmicos transmiten
señales activadoras, como el TLR, que promueven respuestas inflamatorias y
potencian la muerte de los microbios o participan, sobre todo, en la captación
de microbios por los fagocitos.
Receptores para glúcidos
Los receptores que reconocen glúcidos en la superficie de los microbios
facilitan la fagocitosis de los microbios y la secreción de citocinas que estimulan
las respuestas inmunitarias adaptativas consiguientes. Estos receptores
pertenecen a la familia de la lectina del tipo C, denominada así porque se une a
glúcidos (de ahí, lectinas) de una forma que depende del Ca++ (de ahí, tipo C)
y han sido llamados receptores lectina del tipo C (CLR, del inglés C-type lectin
receptors). Algunas lectinas son proteínas solubles que se encuentran en la
sangre y los líquidos extracelulares, otros son proteínas de membrana
integrales que se encuentran en las superficies de los macrófagos, las células
dendríticas y algunas células tisulares. q Hay varios tipos de lectinas del tipo C
de membrana plasmática con especificidades hacia diferentes glúcidos, como
la manosa, la glucosa, la N-acetilglucosamina y los B-glucanos. En general,
estas lectinas de la superficie celular reconocen estructuras glucídicas que se
encuentran en las paredes celulares de los microorganismos, pero no en las
células de los mamíferos. Algunos de estos receptores de lectina del tipo C
intervienen en la fagocitosis de microbios, y otros tienen funciones transmisoras
de señales que inducen respuestas protectoras de las células del anfitrión
frente a los microbios.
Receptores de manosa. Una de las lectinas del tipo C de membrana
más estudiadas es el receptor de manosa (CD206), que participa en la
fagocitosis de los microbios. Es una lectina tipo C que se une a
carbohidratos que contienen manosa de bacterias, hongos, protozoarios
y virus. La estructura de la MBL asemeja un ramo de flores,donde cada
tallo es una triple hélice formada por tres polipéptidos idénticos. Estas
hélices son exactamente como las que se encuentran en las moléculas y
fibras de colágeno. Cada polipéptido aporta un dominio de
reconocimiento de carbohidrato, y los tres juntos forman una “flor”. Este
receptor reconoce ciertos azúcares terminales en los glúcidos de la
superficie del microbio, como la D-manosa, la L-fucosa y la N-acetil-D-
glucosamina. Estos azúcares terminales están presentes a menudo en
la superficie de los microorganismos, mientras que los glúcidos de las
células eucariotas suelen terminar con galactosa y ácido siálico, de
modo que no se enlazan con la lectina de unión a manosa porque su
configuración geométrica no permite la unión en múltiples puntos. De
este modo, los azúcares terminales situados en los microbios pueden
considerarse PAMP. Los receptores para la manosa no tienen ninguna
función intrínseca de transmisión de señales, y se cree que se unen a
los microbios como un primer paso para su posterior ingestión por los
macrófagos y las células dendríticas. Sin embargo, se desconoce la
importancia global de la eliminación fagocítica de microbios mediada por
el receptor para la manosa.
Dectinas. La dectina 1 (lectina del tipo C asociada a la célula dendrítica
1) y la dectina 2 son receptores de la célula dendrítica que sirven de
receptores para el reconocimiento del patrón durante dos ciclos vitales
de los organismos micó- ticos. La dectina 1 se une al p-glucano, que es
el principal componente de la pared celular de la forma de levadura de
Candida albicans, un hongo ubicuo, pero potencialmente patógeno. La
dectina 2 reconoce oligosacáridos ricos en manosa en la forma de hifa
de Candida. Los ligandos glucídicos de las dectinas también se
expresan en algunas bacterias y otros microbios. En respuesta a la
unión de sus Iigandos, ambas dectinas inducen señales en las células
dendríticas que estimulan la producción de citocinas y otras proteínas
que promueven la inflamación y potencian las respuestas inmunitarias
adaptativas. La estimulación de la dectina en las células dendríticas
induce la producción de algunas citocinas que promueven la
diferenciación de los linfocitos T vírgenes CD4+ en un tipo de linfocito T
efector llamado TH17, que es particularmente eficaz en la defensa
contra las infecciones micóticas y algunas infecciones bacterianas.
Otros receptores para glúcidos de la célula dendrítica son la langerina
(CD207), que expresan sobre todo las células de Langerhans
epidérmicas, y DC-SIGN (CD209), que expresan la mayoría de las
células dendríticas. DC-SIGN podría tener un papel patogénico, al
facilitar la infección de los linfocitos T por el VIH-1. La glucoproteína de
la cubierta gpl20 del VIH-1 se une a DC-SIGN en las células dendríticas
de los tejidos mucosos, las células dendríticas llevan el virus a través de
los linfáticos hasta los ganglios linfáticos de drenaje y el virus se
transfiere entonces a los linfocitos T CD4+ y los infecta.
Receptores basurero
Los receptores basurero forman un grupo diverso estructural y funcional de
proteínas de superficie celular que se agruparon originalmente en función de la
característica común de mediar la captación de lipoproteínas oxidadas por las
células. Algunos de estos receptores basurero, como SR-A y CD36, se
expresan en los macrófagos y median la fagocitosis de los microorganismos.
Además, CD36 funciona como un correceptor en el reconocimiento de TLR2/6
y en la respuesta al ácido lipoteicoico y los lipopéptidos diacilados de origen
bacteriano. Hay una amplia variedad de estructuras moleculares que se unen a
cada receptor basurero, como el LPS, el ácido lipoteicoico, los ácidos
nucleicos, el p-glucano y proteínas. La relevancia de los receptores basurero
en la inmunidad innata la subrayan la mayor propensión a la infección de los
ratones con genes inactivados que carecen de estos receptores y las
observaciones de que varios microorganismos patógenos expresan factores de
virulencia que bloquean el reconocimiento y la fagocitosis mediados por el
receptor basurero.
Receptores para péptido formilado
El receptor para péptido formilado 1 (FPR1), expresado en los leucocitos,
reconoce péptidos bacterianos que contienen aminoácidos N-formilmetionina y
estimula el movimiento dirigido de las células. Debido a que todas las proteínas
bacterianas y pocas proteínas de mamíferos (solo aquellas sintetizadas dentro
de la mitocondria) comienzan con N-formilmetionina, FPR1 permite a los
fagocitos detectar y responder preferentemente a las proteínas bacterianas.
Los ligandos de péptidos bacterianos que se unen a este receptor son algunas
de las más potentes sustancias quimiotácticas para los leucocitos. Entre las
sustancias quimiotácticas están varios tipos de moléculas difusibles,
producidas a menudo en lugares de infección, que se unen a receptores
específicos situados en las células y dirigen su movimiento hacia la fuente de la
sustancia quimiotáctica. Otras sustancias quimiotácticas, como las quimiocinas
expuestas en el capítulo 3, las producen las células del anfitrión. FPR1 y todos
los receptores de sustancias quimiotácticas, pertenecen a la superfamilia de
receptores acoplados a la proteína (G) Iigadora de trifosfato de guanosina
(GTP) de siete dominios transmembranarios (GPCR). Estos receptores inician
las respuestas intracelulares a través de proteínas G triméricas asociadas. Las
proteínas G estimulan muchos tipos de respuestas celulares, incluidos cambios
citoesqueléticos, lo que aumenta la motilidad celular.
También podría gustarte
- Guía Segundo Parcial InmunologíaDocumento7 páginasGuía Segundo Parcial Inmunologíaanaca59505Aún no hay calificaciones
- Investigaciones InmunologiaDocumento15 páginasInvestigaciones InmunologiaErick Salazar ManzanoAún no hay calificaciones
- Seminario 2. Inmunidad Innata. Parte 2.Documento29 páginasSeminario 2. Inmunidad Innata. Parte 2.lilianabarbagallo.estilistaAún no hay calificaciones
- Inmuno 2Documento36 páginasInmuno 2Al CaralzAún no hay calificaciones
- TEMA 3. La Respuesta Inmune InnataDocumento14 páginasTEMA 3. La Respuesta Inmune InnataNina Souto BlancoAún no hay calificaciones
- Receptores Citosólicos para Pamp y DampDocumento4 páginasReceptores Citosólicos para Pamp y DampPame FloresAún no hay calificaciones
- 3 - PAMPs y RRPDocumento3 páginas3 - PAMPs y RRPGino MartinezAún no hay calificaciones
- La Enfermedad Del Sueño Tiene Sus Orígenes en La Región Afrotropical Del ContinenteDocumento4 páginasLa Enfermedad Del Sueño Tiene Sus Orígenes en La Región Afrotropical Del ContinentejordanAún no hay calificaciones
- Inmunidad InnataDocumento22 páginasInmunidad InnataIsabellaAún no hay calificaciones
- Inmunidad de MucosasDocumento13 páginasInmunidad de MucosasIGNACIO SALVADOR FERNANDEZ GIRONAún no hay calificaciones
- Resumen Respuesta InmunitariaDocumento9 páginasResumen Respuesta InmunitariaMishVencesAún no hay calificaciones
- Sesion 2Documento109 páginasSesion 2Diego LópezAún no hay calificaciones
- Fichas 7Documento7 páginasFichas 7Noelita RiveraAún no hay calificaciones
- Sistema Fagocitico MononuclearDocumento66 páginasSistema Fagocitico MononuclearJose Luis Calle Quispe80% (5)
- T4 InmunoDocumento21 páginasT4 InmunoCris SánchezAún no hay calificaciones
- Actividad Receptores de PRRDocumento11 páginasActividad Receptores de PRRAndres PelayoAún no hay calificaciones
- Chopita - Inmunidad InnataDocumento9 páginasChopita - Inmunidad InnataMartita JuárezAún no hay calificaciones
- Resumen - Generalidades Del Reconocimiento Por La Inmunidad InnataDocumento7 páginasResumen - Generalidades Del Reconocimiento Por La Inmunidad InnataRanciovichAún no hay calificaciones
- Resumen Inmunidad Secretora GRUPO 3Documento10 páginasResumen Inmunidad Secretora GRUPO 3De La Cruz JordanAún no hay calificaciones
- RESPUESTA INNATADocumento4 páginasRESPUESTA INNATAAndrea Mariel PeñaAún no hay calificaciones
- Resumen Capitulo 4 Inmunología Basica AbbasDocumento8 páginasResumen Capitulo 4 Inmunología Basica Abbaswig in a boxAún no hay calificaciones
- Resumen Inmunologia AcoDocumento135 páginasResumen Inmunologia AcoManuel González AlayesAún no hay calificaciones
- El Papel de Los Receptores de Reconocimiento de Patrones en La Inmunidad InnataDocumento46 páginasEl Papel de Los Receptores de Reconocimiento de Patrones en La Inmunidad InnataKArdo23Aún no hay calificaciones
- CITOTOXICIDAD NK Y CTLDocumento2 páginasCITOTOXICIDAD NK Y CTLOctavio ZmAún no hay calificaciones
- Innata 2Documento46 páginasInnata 2henriquecastelanAún no hay calificaciones
- URP Seminario 03 Receptores SolublesDocumento13 páginasURP Seminario 03 Receptores SolublesYébeny Tufino AlvaradoAún no hay calificaciones
- Células, Tejidos y Órganos Del Sistema InmuneDocumento12 páginasCélulas, Tejidos y Órganos Del Sistema InmuneRocío StürtzAún no hay calificaciones
- Respuesta Inmune Innata - 1ra ParteDocumento18 páginasRespuesta Inmune Innata - 1ra Parteirving hilarioAún no hay calificaciones
- Citotoxicidad Mediada Por CélulasDocumento6 páginasCitotoxicidad Mediada Por CélulasSuanny ConsuegraAún no hay calificaciones
- BARRERAS EPITELIALES Y FAGOCITOSIS: DEFENSAS DE LA INMUNIDAD INNATADocumento12 páginasBARRERAS EPITELIALES Y FAGOCITOSIS: DEFENSAS DE LA INMUNIDAD INNATAMariana CaraveoAún no hay calificaciones
- Clase 26 - 8. Inmunidad Innata IDocumento4 páginasClase 26 - 8. Inmunidad Innata IElías Damián Martínez TerénAún no hay calificaciones
- Ensayo 2 InmunologiaDocumento8 páginasEnsayo 2 InmunologiaGaddiel ibarraAún no hay calificaciones
- Desórdenes en Receptores CelularesDocumento40 páginasDesórdenes en Receptores CelularesMarco MadridAún no hay calificaciones
- Receptores Citosólicos para PAMPY DAMP 1Documento11 páginasReceptores Citosólicos para PAMPY DAMP 1BiiancaRodriguezAún no hay calificaciones
- INMUNIDADDocumento9 páginasINMUNIDADLizenia BTAún no hay calificaciones
- FagocitosisDocumento32 páginasFagocitosisMagui DanyAún no hay calificaciones
- Cuestionario Rii EgsDocumento6 páginasCuestionario Rii EgsStephanie RoblesAún no hay calificaciones
- Inmunidad InnataDocumento17 páginasInmunidad InnataWraysthell CordovaAún no hay calificaciones
- Fagocitosis, proceso de ingestión de patógenosDocumento10 páginasFagocitosis, proceso de ingestión de patógenosJuliana AmayaAún no hay calificaciones
- Receptores de La Inmunidad Innata, Otros Receptores para El Reconocimiento de Patrón y Receptores de La Inmunidad AdaptativaDocumento8 páginasReceptores de La Inmunidad Innata, Otros Receptores para El Reconocimiento de Patrón y Receptores de La Inmunidad AdaptativaDonia Abou ArabAún no hay calificaciones
- Tema 3 Antígenos, Receptores y Barreras Del SIDocumento38 páginasTema 3 Antígenos, Receptores y Barreras Del SIFernando Gual BarrosoAún no hay calificaciones
- inmuno borradorDocumento8 páginasinmuno borradorjuan guamanAún no hay calificaciones
- Mhs Tramo Dos SisamDocumento73 páginasMhs Tramo Dos SisamZiaraAún no hay calificaciones
- Receptores de los linfocitos B y TDocumento11 páginasReceptores de los linfocitos B y TPaola PintoAún no hay calificaciones
- Inmunidad InnataDocumento14 páginasInmunidad InnataMelissa RodriguezAún no hay calificaciones
- 5.clase 7 - 9 Inmunidad Innata IIIDocumento10 páginas5.clase 7 - 9 Inmunidad Innata IIIElías Damián Martínez TerénAún no hay calificaciones
- Receptores CitosolicosDocumento33 páginasReceptores CitosolicosVanessa YapoAún no hay calificaciones
- Inmunidad InnataDocumento38 páginasInmunidad InnataAnyello BuitragoAún no hay calificaciones
- Mecanismos Generales de Comunicación CelularDocumento4 páginasMecanismos Generales de Comunicación CelularPatricia SolanoAún no hay calificaciones
- Enfermedades InmunesDocumento25 páginasEnfermedades InmunesIsabella TabaresAún no hay calificaciones
- Presentacion Receptores Citosolicos y de MembranaDocumento41 páginasPresentacion Receptores Citosolicos y de Membranaisabella vAún no hay calificaciones
- inmunologia de lepraDocumento8 páginasinmunologia de lepraEfrain Teran CarbonoAún no hay calificaciones
- 169 Sistema Inmunitario Cutáneo PDFDocumento63 páginas169 Sistema Inmunitario Cutáneo PDFJ C Torres Formalab100% (1)
- Presentacion de AntigenosDocumento4 páginasPresentacion de Antigenoscami_0724Aún no hay calificaciones
- Capítulo 8Documento7 páginasCapítulo 8Mayeli UrrutiaAún no hay calificaciones
- Activación de Linfocitos T y B: Reconocimiento Antigénico y SeñalizaciónDocumento22 páginasActivación de Linfocitos T y B: Reconocimiento Antigénico y SeñalizaciónDove CameronAún no hay calificaciones
- Acceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017De EverandAcceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017Aún no hay calificaciones
- Parque AviacionDocumento17 páginasParque AviacionReyner CovarrubiasAún no hay calificaciones
- Con Solid A Do Partida Me Tra DoDocumento6 páginasCon Solid A Do Partida Me Tra DoRobbyn QSAún no hay calificaciones
- Pre Supuesto Client eDocumento1 páginaPre Supuesto Client evictorAún no hay calificaciones
- Pre Supuesto Client eDocumento1 páginaPre Supuesto Client evictorAún no hay calificaciones
- Pre Supuesto Client eDocumento1 páginaPre Supuesto Client evictorAún no hay calificaciones
- Vitaminas PresentacionDocumento13 páginasVitaminas PresentaciondeibyAún no hay calificaciones
- Semana 9. Metabolismo de Los Ácidos Grasos, Biosíntesis de Fosfolípidos, Glicólipidos, Colesterol.Documento69 páginasSemana 9. Metabolismo de Los Ácidos Grasos, Biosíntesis de Fosfolípidos, Glicólipidos, Colesterol.Carmen Villegas GermànAún no hay calificaciones
- Proteasas digestivas: Enzimas proteolíticas para digerir proteínasDocumento4 páginasProteasas digestivas: Enzimas proteolíticas para digerir proteínasJonathanAún no hay calificaciones
- MACRONUTRIENTESDocumento5 páginasMACRONUTRIENTESMagaly Perez PerezAún no hay calificaciones
- Caso Clinico N°11Documento20 páginasCaso Clinico N°11LYNDA FERNANDA RODRIGUEZ MEDINAAún no hay calificaciones
- Examen BiotecnologiaDocumento4 páginasExamen BiotecnologiaJuan FigueroaAún no hay calificaciones
- Gluconeogénesis y Metabolismo Del GlucógenoDocumento35 páginasGluconeogénesis y Metabolismo Del GlucógenoLucia Estrada ZuñigaAún no hay calificaciones
- Menú Área Suero Ensayos (Web)Documento4 páginasMenú Área Suero Ensayos (Web)Daniela ReyesAún no hay calificaciones
- Mulgatol JuniorDocumento4 páginasMulgatol JuniorMiriam Vargas DehneAún no hay calificaciones
- Bases Cientificas en El Consumo de Complementos y Suplementos Alimenticios-Magdalena NievesDocumento22 páginasBases Cientificas en El Consumo de Complementos y Suplementos Alimenticios-Magdalena NievesShaneDanielChanEsparzaAún no hay calificaciones
- Practica 1. Reaccion de Aminoacidos y ProteinasDocumento2 páginasPractica 1. Reaccion de Aminoacidos y ProteinasPierdant O-oAún no hay calificaciones
- Carbohidratos, lípidos, vitaminas y metabolismo mineralDocumento10 páginasCarbohidratos, lípidos, vitaminas y metabolismo mineralGreciaAún no hay calificaciones
- La Chia Salvia Hispanica L Desarrollo Alimentos SaludablesDocumento43 páginasLa Chia Salvia Hispanica L Desarrollo Alimentos SaludablesPablo Fernando Abarca PereiraAún no hay calificaciones
- Laboratorio 4Documento7 páginasLaboratorio 4Jahiro Rivas FloresAún no hay calificaciones
- Introducción Extracción Del ADNDocumento2 páginasIntroducción Extracción Del ADNAlejandra TKTAún no hay calificaciones
- Reacciones Enzimáticas de Oxido ReducciónDocumento5 páginasReacciones Enzimáticas de Oxido ReducciónDynarko RuizAún no hay calificaciones
- Simulador Glucólisis y Ciclo de Krebs Bioquímica Parcial 2Documento9 páginasSimulador Glucólisis y Ciclo de Krebs Bioquímica Parcial 2Isaac GómezAún no hay calificaciones
- Historia Del AdnDocumento1 páginaHistoria Del Adnmarco jeffreyAún no hay calificaciones
- PROSTAGLANDINASDocumento33 páginasPROSTAGLANDINASjunieth sequeiraAún no hay calificaciones
- GLUCÓLISISDocumento6 páginasGLUCÓLISISCamila ContrerasAún no hay calificaciones
- Fermentacion HeterolacticaDocumento2 páginasFermentacion HeterolacticaRomina Arévalo0% (1)
- Serie Didáctica Qca de La VidaDocumento104 páginasSerie Didáctica Qca de La VidaCarlos Alfredo LópezAún no hay calificaciones
- Biotina y MarcadoresDocumento8 páginasBiotina y MarcadoresNaty Liz Cantuña100% (1)
- Carbohidratos Glúcidos: Marta Gutiérrez Del CampoDocumento26 páginasCarbohidratos Glúcidos: Marta Gutiérrez Del CampoHéctor MejiasAún no hay calificaciones
- Modulo Ciencias Naturales Ciclo V Grado DecimoDocumento99 páginasModulo Ciencias Naturales Ciclo V Grado DecimoJuan CarlosAún no hay calificaciones
- VitaminasDocumento25 páginasVitaminasAde RendónAún no hay calificaciones
- Bioquimica EjerciciosDocumento2 páginasBioquimica EjerciciosSteven Cristofer Lopez Carbajal100% (6)
- 2do PARCIAL DE BIOQUIMICA 2020 OooooDocumento19 páginas2do PARCIAL DE BIOQUIMICA 2020 OooooIdyel T. Cris100% (1)
- Tema 26 - Hemostasia y CoagulaciónDocumento27 páginasTema 26 - Hemostasia y Coagulaciónangye daniela contreras contrerasAún no hay calificaciones
- Los Lípidos para Cuarto de SecundariaDocumento8 páginasLos Lípidos para Cuarto de SecundariaElden CulquicondorAún no hay calificaciones