Documentos de Académico
Documentos de Profesional
Documentos de Cultura
El Papel de Los Receptores de Reconocimiento de Patrones en La Inmunidad Innata
Cargado por
KArdo23Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
El Papel de Los Receptores de Reconocimiento de Patrones en La Inmunidad Innata
Cargado por
KArdo23Copyright:
Formatos disponibles
El papel de los receptores de reconocimiento de patrones en la inmunidad innata: actualizacin de receptores Toll-like
Durante la ltima dcada, ha habido un rpido progreso en la comprensin de reconocimiento inmune innato de los componentes microbianos y su papel fundamental en la defensa del husped contra la infeccin. El concepto inicial de la inmunidad innata es que los microbios no especficamente reconocido, sin embargo, el descubrimiento de los receptores tipo Toll (TLR) en la dcada de 1990 demostraron que el reconocimiento de patgenos por el sistema inmune innato es en realidad en lugar especficos, apoyndose en la lnea germinal codificados patrn de reconocimiento de receptores (RRP) que se han desarrollado para detectar los componentes de patgenos extraos conoce como patgenos patrones moleculares asociados (PAMP). TLRs son protenas transmembrana de tipo I con ectodomains contiene ricos en leucina repite que median en el reconocimiento de PAMP, dominios transmembrana e intracelular Lnea interleucina 1 (IL-1) receptor (TIR) dominios necesarios para la transduccin de seal aguas abajo. Hasta ahora, 10 y 12 TLR funcionales han sido identificados en humanos y ratones, respectivamente, con TLR1-TLR9 se conserva en las dos especies. TLR10 ratn no es funcional debido a una insercin de retrovirus y TLR11, TLR12 y TLR13 se han perdido en el genoma
humano. Los estudios de los ratones deficientes en cada TLR han demostrado que cada TLR tiene una funcin distinta en trminos de reconocimiento de PAMP y la respuesta inmune. La elucidacin de la estructura cristalina de ectodomains varios TLR ha proporcionado informacin estructural que sugiere que varias PAMPs actuar como "ligandos" para los TLR. PAMP reconocidos por TLR incluyen lpidos, lipoprotenas, protenas y cidos nucleicos derivados de una amplia gama de microbios, como bacterias, virus, parsitos y hongos. El reconocimiento de los PAMP por TLRs se produce en distintos compartimentos celulares, incluyendo la membrana plasmtica, endosomas, lisosomas y endolysosomes. La correcta localizacin celular de los TLR se cree que es importante para la accesibilidad ligando, el mantenimiento de la tolerancia a las molculas del mismo, tales como los cidos nucleicos y la transduccin de seales TLR vas de sealizacin se estudiaron intensamente abajo. despus del
descubrimiento de la molcula que contiene el dominio TIR adaptador MyD88. La posterior determinacin de otros TIR que contiene el dominio adaptadores ha demostrado que los TLR individuales selectivamente reclutar distintas molculas adaptador,
dar
respuestas
concretas
inmunolgicas
adaptadas
las
infectar
los microbios. Los estudios han indicado que hay tipo de clulas especficas de sealizacin las vas que definen sus propiedades inmunolgicas. Por ejemplo,
las clulas dendrticas plasmacitoides (PDC) y los monocitos inflamatorios nicas vas de sealizacin que regulan las respuestas antivirales que son probablementeausente en otros tipos celulares. Recientemente, la atencin tanto en el campo de la
La sealizacin de TLR ha centrado en la post-transcripcional modificaciones, el regulacin espacial de las molculas de sealizacin y la caracterizacin de los TLR
los genes diana. Tras el descubrimiento de TLRs, varias clases de derechos y responsabilidades parentales citoslica, incluidos RIG-I-like receptors (RLRs) y como Nod-receptores (NLRs), fueron identificados. La familia RLR se compone de tres miembros, que RIG, Mda5 y LGP2,
que detectan los virus ARN. La familia de NLR est compuesto por ms de 20 miembros, y varios responder a las diversas PAMP, las partculas no PAMP y estreses celulares para activar respuestas pro-inflamatorias, incluyendo la secrecin de
IL-1 . Adems, las clulas expresan derechos y responsabilidades parentales, que an no identificados que reconocen la doble cadena (dsDNA) e inducir la produccin de interfern de tipo I. Estos derechos y responsabilidades parentales son expresados por muchos tipos celulares, incluyendo clulas inmunes, y en algunos casos reconocen PAMPs compartida con los TLR. Estos derechos y responsabilidades parentales, de acuerdo con TLR, tienen un papel fundamental en la respuesta inmune innata y adaptativa.
Aunque los TLR son esenciales para la inmunidad protectora contra la infeccin, respuestas inapropiadas TLR contribuyen a la inflamacin aguda y crnica, as como a las enfermedades autoinmunes sistmicas. De hecho, los ratones con defectos en la regulacin negativa de las respuestas mediadas por TLR desarrollar estas enfermedades. Ms importante an, hay una creciente evidencia que indica que las molculas endgenas producidas por las clulas que mueren, o en ciertas condiciones patolgicas, estimular los TLR, que resulta en el desarrollo o la aceleracin de las enfermedades inflamatorias y autoinmunes. En esta revisin, estudio de los conocimientos actuales de la biologa estructural, biologa celular y la sealizacin de TLR. A continuacin describimos las contribuciones de los TLR y los derechos y responsabilidades
parentales citoslica de la respuesta inmune adaptativa y, por ltimo, discutir los ltimos avances en TLR mediada por el reconocimiento de molculas endgenas y su papel en las enfermedades autoinmunes.
Estructura y ligandos de TLR superficie de la clula
Los TLR son en gran parte dividido en dos subgrupos en funcin de su localizacin celular y ligandos respectivos PAMP. Un grupo se compone de TLR1, TLR2, TLR4, TLR5, TLR6 y TLR11, que se expresan en la superficie celular y reconocer componentes de la membrana microbiana, principalmente, como los lpidos, lipoprotenas y las protenas y el otro grupo se compone de TLR3, TLR7, TLR8 y TLR9 , que se expresan exclusivamente en las vesculas intracelulares como el retculo endoplasmtico (ER), endosomas, lisosomas y endolysosomes, donde se reconocen los cidos nucleicos microbianos. TLR4, miembro fundador de la familia de TLR, fue identificado como el receptor de tan buscada de que responde a lipopolisacrido bacteriano (LPS), un componente de la membrana externa de bacterias Gram-negativas que pueden causar un shock sptico. TLR4 forma un complejo con MD2 en la superficie celular, y juntos sirven como el principal componente de unin al LPS. Un estudio estructural de TLR4-MD2 en el complejo con LPS se ha demostrado que cinco
de las seis cadenas de lpidos de LPS se unen el bolsillo hidrofbico de MD2, y la cadena de lpidos restantes que se expone a la superficie de los asociados MD2 con TLR4 (referencias 13, 14;. Fig. 1). Los grupos fosfato tambin interactuar con los residuos de carga positiva de TLR4. La formacin resultante de un multmero receptor formado por dos ejemplares del complejo TLR4-MD2LPS inicia la transduccin de seales mediante la contratacin de molculas intracelulares adaptador. Protenas adicionales, tales como protena de unin LPS (LBP) y CD14 tambin estn involucrados en la unin de LPS. LBP es una protena plasmtica soluble que se une a LPS, y CD14 es un
glicosilfosfatidilinositol vinculados, ricos en leucina repetir que contienen protena que se une el dolor lumbar y ofrece LPSLBP al complejo TLR4-MD2. Adems de LPS vinculante, TLR4 est involucrado en el reconocimiento de las vas respiratorias protenas de fusin virus sincitial, el ratn de tumor mamario de protenas de la envoltura del virus, Streptococcus pneumoniae
neumolisina y la planta de derivados de paclitaxel, un medicamento citosttico, a pesar de puntos de vista estructural en la interaccin entre ligandos TLR4 y estos an no han sido siempre. TLR2 est implicado en el reconocimiento de una amplia gama de PAMP derivados de bacterias, hongos, parsitos y virus. Estos incluyen lipopptidos de las bacterias, el cido peptidoglicano y
lipoteicoico de bacterias Gram-positivas, lipoarabinomannan de micobacterias, zymosan de hongos,
tGPI-mucina de Trypanosoma cruzi y la protena hemaglutinina del virus del sarampin. TLR2 en general, forma heterodmeros con TLR1 o TLR6. En concreto, el heterodmero TLR2 reconoce TLR1 lipopptidos triacylated de bacterias Gram-negativas y micoplasma, mientras que el heterodmero TLR2 reconoce TLR6 lipopptidos diacilado de bacterias grampositivas y
micoplasmas. Los estudios han proporcionado informacin estructural de los mecanismos por los cuales estos heterodmeros discriminar las estructuras de las lipoprotenas. Heterodmeros TLR2 TLR1 y TLR2 TLR6-comparten una estructura en forma de M (Fig. 1). En el complejo TLR2 TLR1-ligando, dos de las tres cadenas de lpidos de Pam3CSK4 (un lipopptido triacylated) interactan con TLR2, mientras que la tercera cadena se une el canal hidrofbico de TLR1. Por lo tanto, el reconocimiento de la lipopptido triacylated se facilita. Sin embargo, el canal hidrofbico est ausente de TLR6, por lo que el heterodmero TLR2 TLR6 no reconoce lipopptidos riacylated. En conjunto, los diferentes lpidos de unin a los bolsillos de TLR1 TLR6 y son responsables de la discriminacin entre las lipoprotenas. Por otra parte, TLR2 tiene la capacidad de actuar conjuntamente con otros correceptores en la superficie
celular que ayudan a reconocer PAMP. Estos incluyen CD36, que acta junto con el heterodmero TLR2 TLR6 para mediar en la deteccin de algunos, pero No todos los agonistas de TLR2 y Dectin-1, una lectina tipo C que une a los hongos -glucano TLR2 e induce su internalization18. principalmente la Aunque produccin se de crea que
agonistas
inducen
citoquinas
inflamatorias y no interfern de tipo I por los macrfagos y clulas dendrticas (DC), se puede desencadenar la produccin de interfern de tipo I por los monocitos inflamatorios en respuesta a la infeccin con el virus vaccinia, lo que sugiere un tipo de clula papel especfico de TLR2 en la respuesta antiviral. Parece que los cidos nucleicos, que suelen ser el desencadenante de la produccin de interfern de tipo I, se no participan en la activacin de TLR2. TLR5 reconoce el componente de protena flagelina de los flagelos bacterianos (Fig. 1). CD11c + CD11b + lmina propia pases en desarrollo en el intestino delgado tienen un alto TLR5 expresin. Los pases en desarrollo la lmina propia son nicos en la promocin de la diferenciacin de la IL-17 que producen las clulas T (clulas
TH17) y tipo T helper 1 (TH1) las clulas, as como la diferenciacin de los ingenuosLas clulas B en la inmunoglobulina A-clulas productoras de plasma en respuesta a
flagelina. Adems, la lmina propia DC son capaces de producir retinoico cidos, lo que facilita estas respuestas inmunes humoral y celular. La rin y la vejiga tienen una alta expresin de ratn TLR11, que es un relativa de TLR5. TLR11 se cree reconocer uropatgena bacteriana componentes, como TLR11 ratones deficientes son susceptibles a la infeccin estas bacterias. TLR11 tambin reconoce la molcula profilina-como derivados de Toxoplasma gondii.
Estructura y ligandos para la deteccin de cidos nucleicos-TLR
TLR3 fue originalmente identificado como el reconocimiento de un anlogo sinttico de la doble
ARN de cadena (dsRNA), poliinosnico-policitidlico cido (poli (I: C)), que imita la infeccin viral e induce la respuesta inmune antiviral mediante la promocin de la produccin tanto de interfern de tipo I y las citocinas inflamatorias. El mecanismo de reconocimiento fue aclarada por structuralanalysis del ser humano TLR3 ectodominio obligado a dsRNA (Fig. 2). El ectodominio TLR3
tiene una gran herradura que forma funciona probablemente para aumentar su superficie y facilitar el reconocimiento dsRNA. El dsRNA se une a dos sitios diferentes en el N y C terminales en la parte lateral de la superficie convexa de la ectodominio TLR3, que proporciona una estabilidad suficiente para permitir que TLR3 para formar un homodmero a travs de la regin C-terminal. Adems de reconocer poli (I: C), TLR3 reconoce el ARN genmico de los reovirus, dsRNA producidos durante la replicacin del ARN de cadena simple (ssRNA), los virus, incluyendo el virus respiratorio sincitial, virus de la encefalomiocarditis y el virus del Nilo Occidental, y algunos pequeos interferencia ARN. TLR3 desencadena la respuesta inmune antiviral mediante la produccin de interfern de tipo I y las citocinas inflamatorias, lo que sugiere que TLR3 tiene un papel esencial en la prevencin de infeccin por el virus. En consonancia con ello, TLR3 ratones deficientes son susceptibles a la infeccin letal por citomegalovirus murino, y la deficiencia de TLR3 en humanos est asociada con la susceptibilidad al virus de tipo herpessimplex 1 (HSV-1). TLR7, originalmente identificado como el reconocimiento de imidazoquinoline derivados como el imiquimod y resiquimod (R-848) y los anlogos de la guanina, como loxoribine (que tienen propiedades antivirales y antitumorales), reconoce ssRNA derivados de los virus de ARN, tales como virus de la
estomatitis vesicular, virus de la influenza y los derechos humanos virus de la inmunodeficiencia (Fig. 2). TLR7 tambin reconoce sinttico poli (U) del ARN y algunos pequeos RNAs de interferencia. Hay una alta expresin de TLR7 en PDC que son capaces de producir grandes cantidades de interfern de tipo I despus de la infeccin del virus, y la induccin de citoquinas por PDC en respuesta a los virus de ARN es totalmente dependiente de TLR7 (referencias 3,5), lo que sugiere que TLR7 sirve como el sensor de la infeccin con el virus ssRNA. Por otra parte, TLR7 expresado en pases en desarrollo convencional (CDC) detecta el ARN especies de bacterias como Streptococcus del grupo B e induce interfern de tipo I. TLR7 mediada por el reconocimiento de los virus de ARN de PDC se produce de forma independiente de la replicacin. Los virus son internalizados y reclut a los endolysosomes, donde se activan TLR7 mediada por el reconocimiento de ssRNA y la iniciacin de la respuesta antiviral. Por otra parte, tambin TLR7 sentidos replicar el virus de la estomatitis vesicular que entra en el citoplasma a travs de la autofagia, un proceso de degradacin lisosomal de protenas celulares que implica la formacin de vesculas de doble membrana llamada autofagosomas (Fig. 2). El PDC que carecen de la protena relacionada con la autofagia Atg5, que se abstengan de inducir la formacin de los autofagosomas, muestran defectos en la produccin
de interfern- despus de la infeccin con el virus de la estomatitis vesicular. Por otra parte, PDC muestran la formacin de los autofagosomas constitutiva. Estos hallazgos sugieren que pDC autofagia es importante para la entrega de citoslica viral
intermediarios de replicacin de los lisosomas, donde TLR7 participa en su el reconocimiento y el posterior inicio de las respuestas antivirales. TLR8 es filogenticamente ms similar a TLR7. Humanos TLR8 media el reconocimiento de ssRNA R-848 y virales. En contraste con los ratones que carecen de
TLR7, los ratones que carecen de TLR8 responden normalmente a estos agonistas. TLR8
se expresa en diversos tejidos, con su mxima expresin en los monocitos, y est regulado al alza despus de la infeccin bacteriana. TLR9 reconoce unmethylated 2'-desoxirribonucleico (citidina-phosphateguanosine) (CpG) los motivos de ADN que se presentan con frecuencia en las bacterias y los virus, pero son poco frecuentes en clulas de mamferos (Fig. 2). Sintticos oligodesoxinucletidos CpG funcionar como TLR9 ligandos y activan
directamente los pases en desarrollo, los macrfagos y las clulas B, y un fuerte impulso las respuestas Th1. La columna de azcar de ADN, 2'-
desoxirribosa,
es
importante
para
TLR9
reconocimiento
cuando
el
oligonucletido de ADN tiene una columna vertebral fosfodister. Por el contrario, el motivo CpG es indispensable en el caso de la columna vertebral hosphorothionate natural. Hay una alta expresin de TLR9 por PDC, y sirve como un sensor de la infeccin por el virus de ADN (por ejemplo, murino citomegalovirus, el VHS-1 y HSV-2). Adems de reconocer el ADN, TLR9 reconoce directamente la hemozona cristalina insoluble, que se genera como un subproducto del proceso de desintoxicacin despus de la digestin de la hemoglobina de acogida por Plasmodium falciparum.
Localizacin celular de los cidos nucleicos de deteccin de cido TLRs
Como se mencion anteriormente, el cido nucleico de deteccin de TLR localizar a varios compartimentos intracelulares. El hallazgo de que el bloqueo de la acidificacin endolysosome impide TLR7 y respuestas TLR9 inducida sugiere que la
entrega de los cidos nucleicos interiorizado a la endolysosomes es fundamental para
interaccin con los TLR. TLR9 y TLR7 exclusivamente secuestrado en la sala de emergencias en las clulas estimuladas y rpidamente el trfico
de endolysosomes despus de la estimulacin ligando (Fig. 2). Este desplazamiento est regulado por la UNC93B1 protena ER-localizacin, a 12 que atraviesa la membrana de protenas (Fig. 2). Triple D (3d) los ratones con una mutacin sin sentido nico en el gen que codifica UNC93B1 tienen defectos en la produccin de citoquinas y la regulacin positiva de molculas co-estimuladoras en respuesta a TLR7 y TLR9 ligandos, as como ligandos TLR3, y son altamente susceptibles a la infeccin viral y bacteriana. Se ha informado que UNC93B1 deficiencia es responsable de la encefalitis por HSV-1 en pacientes humanos. Las clulas derivadas de estos pacientes son hiporrespuesta a los agonistas de TLR3, TLR7 y TLR9, pero tienen intactas las respuestas a los agonistas de otros TLRs extracelular. UNC93B1 se une especficamente a las regiones transmembrana de TLR3, TLR7 y TLR9 en la sala de emergencias, y TLR7 y TLR9 no salga de la sala de emergencias en pases en desarrollo con la mutacin en 3D. En conjunto, estos resultados sugieren que UNC93B1 ayuda en la entrega de los TLR7 y TLR9 de la sala de emergencias a la endolysosome, que es un requisito previo para la induccin de respuestas inmunes por estos TLRs. El trfico de los TLR tambin est regulada por otras dos protenas que residen en la sala de emergencias: PRAT4A y gp96. PRAT4A asociados con TLR4 y
TLR9 y es necesario para el trfico de TLR4 y TLR9 al plasma membrana y endolysosme, respectivamente. Las respuestas a los agonistas de TLR2, TLR4 y TLR9 se derog en PRAT4A dficit de las clulas, mientras que las respuestas mediadas por TLR3 estn intactas en estos cells37, lo que indica que
el trfico de TLR3 y TLR9 se regula de manera diferente. Macrfagos deficiencia de gp96, un miembro de la ER-residente protena de choque trmico 90 familia, tienen defectos en la induccin de citoquinas en respuesta a los agonistas de
TLR1, TLR2, TLR4, TLR5, TLR7 y TLR9. Adems, la gp96, se ha demostrado que se unen TLR9. Estos hallazgos sugieren que la gp96, funciona como un
acompaante en general para la mayora de los TLR, a diferencia de PRAT4, que regula el trfico
slo en algunos de los TLR. TLR9 se sabe que es proteolticamente escindida por proteasas intracelulares en endolysosomes, lo que genera un receptor funcional que el reconocimiento ligando media e inicia la transduccin de seales (Fig. 2). Las proteasas que potencialmente mediar TLR9 divisin
incluyen catepsinas, tales como la catepsina B, S catepsina, la catepsina L, H catepsina K y la catepsina, y endopeptidasa asparaginil. Sin embargo, an existe controversia en cuanto a la divisin funcional de TLR9. La supresin de determinados ricos en leucina repite en la regin N-terminal hace TLR9 que no responde a su ligando, y la carga positiva N-terminal de la regin de TLR9 se propone para mediar
unin al ADN CpG, lo que sugiere la importancia de la estructura de larga duracin en TLR9 activacin.
TIR de dominio que contienen los adaptadores en la sealizacin de TLR
TLRs individuales desencadenar respuestas biolgicas especficas. Por ejemplo, TLR3 y TLR4 generar tanto interfern de tipo I y las respuestas de citoquinas inflamatorias, mientras que la superficie de la clula TLR1-TLR2, TLR2 TLR6 y TLR5 induce principalmente citoquinas inflamatorias (Figuras 1 y 2). Estas diferencias se explican por el descubrimiento de la TIR de dominio que contienen molculas adaptadoras, incluyendo MyD88, TIRAP (Mal), TRIF y tranva, que son reclutados por distintos TLRs y activar distintas vas de sealizacin (Figuras 1 y 2). MyD88, el primer miembro identificado de esta
familia TIR, es universalmente utilizado por todos los TLR, excepto TLR3, y activa el factor de transcripcin NF-kB y activada por mitgenos protenas quinasas (MAPKs) para inducir citoquinas inflamatorias. Por el contrario, TRIF es utilizada por TLR3 y TLR4 e induce a caminos alternativos que conducen a la activacin de los factores de transcripcin NF y IRF3 kB y la consecuente induccin de la
interfern de tipo I y las citocinas inflamatorias. TRAM y la funcin TIRAP como adaptadores de clasificacin que reclutan TRIF a TLR4 y MyD88 de TLR2 y TLR4, respectivamente. Por lo tanto, las vas de sealizacin TLR puede ser en gran medida clasifican como MyD88 dependen de las vas, lo que lleva la induccin de citoquinas inflamatorias, o las vas de TRIF-dependientes, que son responsables de la induccin de interfern de tipo I, as como las citoquinas inflamatorias. TLR4 es el nico que utiliza TLR los cuatro adaptadores y activa tanto la MyD88 y TRIF dependen de las vas (Fig. 1). TLR4 inicialmente reclutas TIRAP en la membrana plasmtica y, posteriormente, facilita la contratacin de MyD88 para desencadenar la activacin inicial del NF-kB y MAPK. TLR4 posteriormente se somete a dynamin dependientes de endocitosis y se trafica con el endosoma, donde forma un complejo de sealizacin con el tranva y TRIF, en lugar de TIRAP y MyD88, para iniciar el camino que conduce
a TRIFdependent IRF3 activacin, as como la activacin de la fase tarda de NF-kB y MAPK46 48. As, TLR4 activa la va MyD88 dependientes antes de la va TRIF-dependiente. En particular, la activacin tanto de la MyD88 y TRIF dependen de las vas es necesario para la induccin de citoquinas inflamatorias a travs de TLR4 de sealizacin, que est en contraste con otros TLR, por lo que la activacin de cualquiera de los
MyD88 o la va TRIF-dependiente es suficiente para la induccin de citoquinas inflamatorias. Sigue siendo un misterio por qu la activacin de cualquiera de las vas no es suficiente para la induccin de citoquinas inflamatorias a travs de TLR4 sealizacin.
la
va
MyD88
dependientes
Despus de la participacin de los TLR por sus PAMPs afines, MyD88 recluta el receptor de IL-1 asociados quinasas IRAK4, IRAK1, y IRAK2 IRAK-M (Fig. 3). IRAK4 se activa inicialmente, y tiene un papel esencial en la activacin de NF-kB y MAPK aguas abajo de MyD88 (ref. 3). IRAK1 y se activan de forma secuencial IRAK2, y la activacin de ambas quinasas es necesaria para la activacin robusta de NF-kB y MAPK. IRAK activacin resulta en una interaccin con TRAF6, una ligasa E3 que cataliza la sntesis de polyubiquitin
vinculados a Lys63 (K63) en las protenas diana, incluyendo TRAF6 s mismo y IRAK1, junto con el E2 dimrica ubiquitinconjugating enzimas Ubc13 y Uev1A. Las cadenas polyubiquitin K63-vinculada a continuacin, enlazar a la novela dedo de zinc de tipo ubiquitina dominio de unin de TAB2 y tab3, los componentes de regulacin de la quinasa TAK1 complejo, para activar TAK1. Las cadenas polyubiquitin K63-vinculada tambin se unen al dominio de la ubiquitina-unin de NEMO, un componente esencial de regulacin del complejo IKK necesarios para la activacin de NF-kB. As, el K63
cadenas polyubiquitin podra ser responsable de la contratacin TAK1 para formar un complejo con IKK, lo que permite TAK1 para fosforilar IKK a travs de su proximidad al complejo IKK, que conduce a la activacin de NF-kB a travs de la fosforilacin y posterior degradacin de las protenas IkB. Sin embargo, Ubc13 clulas deficientes muestran intacta la activacin de NF-kB en respuesta a los agonistas de TLR, a pesar de los defectos K63-vinculada polyubiquitination de NEMO, lo que sugiere que un K63-vinculada
ubiquitinacin independiente del mecanismo existe en NEMO mediada por la activacin de NF-kB. De cabeza a la cola polyubiquitination lineal de NEMO por el complejo montaje lineal de la cadena de ubiquitina (que consiste en Hoil-1L y HOIP) ha demostrado ser un proceso importante para la activacin de IKK.
TAK1 al mismo tiempo activa la MAPKs Erk1, Erk2, p38 y JNK mediante la induccin de la fosforilacin (en lugar de ubiquitinacin) de las quinasas MAPK, que a su vez activan la transcripcin de varios factores, incluida la AP-1, adems de influir en la traduccin. A pesar de tener normales la activacin de NF-kB, Ubc13 clulas deficientes muestran deterioro de MAPK activation51. Sin embargo, el objetivo directo de Ubc13 que es responsable de la activacin de MAPK permanece sin identificar. La activacin de la va da MyD88 que dependen de la induccin de muchos genes, y algunos de ellos tienen un papel fundamental en la modulacin de NF-kB dependiente de la transcripcin (Fig. 3). Estos incluyen el I B protena IkB, que funciona como un coactivador inducible de la NF-kB subunidad p50 para facilitar la IL-6 y la induccin de IL12p40;C / EBP , que acta junto con el NF-kB para maximizar la produccin de IL-6; IkB-NS, que suprime la induccin de IL-6 y factor de necrosis tumoral (TNF), modulando la actividad de unin al ADN de la NF-kB subunidad p65, y ATF3, que restringe la actividad de NF-kB mediante la contratacin de la histona.
La
va
TRIF-dependiente
La va TRIF dependiente culmina en la activacin de ambos IRF3 y NF- B24 (Fig. 3). TRIF reclutas TRAF6 y activa TAK1 para la activacin de NF-kB, probablemente a travs de ubiquitinacin dependiente de mecanismos similares a los de la va dependiente de MyD88. TRIF tambin recluta a los RIP1 adaptador a travs de los distintos motivos RIP interaccin homotpicos. RIP1 sufre K63-vinculada polyubiquitination despus de la estimulacin por agonistas de TLR3, y esta modificacin es necesaria para la activacin de NFkB. El adaptador se une TRADD RIP1, y TRADD clulas deficientes muestran deterioro RIP1 ubiquitinacin con la consiguiente prdida de NF-kB
activation59, de 60 aos, lo que sugiere la participacin de TRADD en RIP1 posterior activacin de TLR3. Pellino-1 es un miembro de la familia Pellino de forma de anillo que contiene el dominio E3 ubiquitina ligasas, y Pellino-1 deficiencia causa prdida de RIP1 ubiquitinacin y la activacin de NF-kB en respuesta a los agonistas de TLR3, a pesar de lo normal MyD88 dependientes de NF-kB activation61. En conjunto, TRIF forma un complejo multiproteico de sealizacin, junto con TRAF6, TRADD, Pellino-1 y RIP1 para la activacin de TAK1, que a su vez activa la NF-kB y las vas de MAPK. Adems de conducir a la activacin de NF-kB, la va dependiente de TRIF conduce a la activacin de la transcripcin IRF3 y el interfern -(Fig. 3). TRIF recluta a un complejo de
sealizacin que involucra la no cannicos TBK1 IKKS e Ikki (IKK ), que catalizan la fosforilacin de IRF3 e inducen su translocacin nuclear. La activacin de TBK1-Ikki por TRIF requiere TRAF3. TRAF3 deficiencia afecta el interferninduccin de TLR3, as como por TLR7, TLR9 y RLRs, lo que induccin por el cido
indica una funcin general de TRAF3 de interfern-
nucleico de deteccin de diversos derechos y responsabilidades parentales. TRAF3 tambin se incorpora en el complejo durante MyD88 TLR4 sealizacin. Sin embargo, esto expone a TRAF3 K48-vinculada ubiquitinacin
y la degradacin a travs de cIAP1 y cIAP2, que son los dos componentes del complejo de sealizacin MyD88, pero no complejo TRIF sealizacin. TRAF3 resultados de degradacin en la translocacin de la sealizacin de la membrana proximal compleja en el citoplasma, lo que conduce a la activacin TAK1. Estos hallazgos sugieren que promueve TRAF3 IRF3 activacin, as como la inhibicin de la va dependiente de MyD88. Las diferencias en la regulacin de la MyD88 y TRIF dependen de las vas por una sola molcula se ha observado tambin en estudios de NRDP1, un anillo que contiene ligasa E3 que interacta con y potencia TBK1 activacin a travs de ubiquitinacin K63vinculada, por lo que es Ubc13 required66 . Al mismo tiempo, inhibe la activacin de la va MyD88 dependientes a travs de su interaccin con y la
degradacin de MyD88. Produccin equilibrada de citoquinas inflamatorias y interfern de tipo I por estas molculas podran tener un papel clave en el control del crecimiento de clulas tumorales y enfermedades autoinmunes.
TLR7
TLR9
sealizacin
en
PDC
El TLR7 y TLR9 vas de sealizacin en PDC ha sido ampliamente investigado para aclarar su potencial para inducir la produccin de interfern de tipo I despus de la infeccin viral. El TLR7 y TLR9 vas de sealizacin en el PDC son los nicos que ambos requieren MyD88 para la induccin de interfern de tipo I (Fig. 3). En este contexto, IRF7, que es constitutivamente expresadas por PDC, se une MyD88 y forma un complejo multiproteico de sealizacin con IRAK4, TRAF6, TRAF3, IRAK1 y IKK 24 (Fig. 3). En este complejo, se convierte en IRF7 fosforilados por IRAK1 y / o IKK , se disocia del complejo y se transloca hacia el ncleo. Adems de la fosforilacin requiere, IRF7 activacin probablemente requiere TRAF6 y ubiquitinacin Ubc13dependiente. Mientras que IRAK1, IKK y TRAF3 estn especficamente
involucradas en la activacin de IRF7, MyD88, IRAK4 y TRAF6 son fundamentales para la activacin de ambos IRF7 y NF-kB. Los componentes
adicionales que controlan la produccin de interfern de tipo I por PDC tambin han sido identificados (Fig. 3). Un precursor de la osteopontina, una protena que es OPNi TLR9-inducible que est retenido en el citoplasma y funciona como un componente del complejo de MyD88 IRF7 en PDC. La inhibicin farmacolgica de fosfoinositol 3-OH-quinasa (PI (3)
K) abroga la translocacin nuclear de IRF7. Por otra parte, la inhibicin de mTOR y p70S6K, los cuales son los objetivos intermedios de la PI (3) K, interrumpe la interaccin entre el TLR9 y MyD88, que se traduce en deterioro de la translocacin nuclear del IRF7 y la induccin de tipo I interferon68. Estos hallazgos sugieren que la PI (3) K-mTOR va acelera la produccin de interfern de tipo I por PDC durante la infeccin viral. IRF5 se incorpora en el complejo MyD88 y los controles de la induccin de IL-6 e IL-12p40 (ref. 69). La va MyD88 IRF5 tambin es utilizado por los TLR en muchos otros tipos de clulas, como los macrfagos y los CDC. IRF8 nulo PDC muestran la prdida de TLR9 mediada por la induccin de ambos tipo I interfern y citoquinas inflamatorias, con menos de activacin de NF-kB, lo que sugiere la posibilidad de que IRF8, en cooperacin con la NF-kB, los controles de la induccin de citoquinas. La retencin de la sealizacin en CpG TLR9 complejo en el
endosoma es tambin un importante mecanismo utilizado por los PDC para controlar la respuesta inmune innata antiviral. El A (D)-tipo oligodeoxynucleotide CpG, que contiene un solo motivo CpG y una cola poli (G) en un esqueleto phosphorothioatephosphodiester, es capaz de inducir la secrecin de interfern de tipo I por PDC. Es estable mantenido a principios de los endosomas en PDC junto con TLR9, MyD88 y IRF7 (ref. 71). En contraste, el B (K)-tipo oligodeoxynucleotide CpG, que contiene mltiples motivos CpG en un esqueleto fosfotioato y puede inducir la IL-12 por los CDC y la activacin de clulas B, es rpidamente trasladado a finales de ysosomes endosomas o, lo que se traduce en menos la activacin de IRF7.
Reguladores
negativos
de
la
sealizacin
TLR
La regulacin negativa de TLR inducida por las respuestas es importante para la supresin de
inflamacin y respuesta inmune perjudicial. Hasta ahora, muchos reguladores negativos que inhiben las vas de sealizacin TLR a varios niveles han sido identificados. Estos incluyen las variantes de empalme de los adaptadores o sus protenas relacionadas, ligasas de ubiquitina, deubiquitinases, reguladores de la transcripcin y microRNAs. Aqu nos centramos en los reguladores
negativos de TLR-mediada por la respuesta inmune, cuya alteracin o mutacin resulta en la inflamacin persistente en vivo. TANQUE une TBK1 e Ikki y se ha relacionado con la activacin de NF-kB tanto y IRF3. Deficiente CISTERNA ratones desarrollan espontneamente nefritis glomerular autoinmune, lo que es suprimida por el tratamiento con antibiticos o deficiencia de MyD88 o IL-6 (ref. 79). A pesar de tener intacta la induccin de interfern de tipo I, los macrfagos deficientes TANK-y las clulas B muestran ms activacin de NF-kB y de IL-6 en respuesta a ligandos TLR. Deficiente CISTERNA clulas tambin muestran una mayor TRAF6 ubiquitinacin. Por lo tanto, tanque acta como un regulador negativo de TRAF6 ubiquitinacin, tanto en los macrfagos y las clulas B (Fig. 3). Las mutaciones en el gen que codifica la molcula de la autofagia ATG16L1 relacionadas se han relacionado con disease80 de Crohn. ATG16L1 ratones deficientes son muy susceptibles al sulfato de dextrano de sodio inducida por colitis aguda, que es bloqueada por el tratamiento con anticuerpos contra la IL1 e IL-18 (ref. 81). Adems, los macrfagos derivados de estos ratones
mostraron una mayor activacin de la caspasa-1 y la produccin de IL-1 e IL18 en respuesta a LPS. Sobreactivacin de la caspasa-1 por LPS en ausencia de ATG16L1 requiere TRIF, lo que sugiere que ATG16L1 regula negativamente las vas que conducen a TRIFdependent caspasa-1 de activacin (Fig. 3). Por
otra parte, las clulas intestinales Paneth derivados de ATG16L1 ratones deficientes muestran una mayor expresin de genes implicados en la respuesta a una lesin intestinal. ATG16L1 tanto, es esencial para la supresin de la inflamacin intestinal. Estimulacin TLR induce rpidamente la Zc3h12a protena reguladora,
que contiene una CCCH de tipo zinc-finger de dominio y un dominio RNasa. Zc3h12a objetivos de las regiones 3 'no traducida del ARNm de IL-6 e IL12p40ARNm de la degradacin a travs de su actividad RNasa. Zc3h12a deficiencia de los macrfagos
producen siempre muy grandes cantidades de IL-6 e IL-12p40 cantidades normales, pero de TNF en respuesta a los agonistas de TLR, y los ratones deficientes en Zc3h112a tienen niveles de inmunoglobulina srica y la produccin de autoanticuerpos. En conjunto, estos resultados sugieren que Zc3h12a regula negativamente TLR-nduced respuestas inflamatorias que afectan a la estabilidad del mRNA y evita que la autoinmunidad (Fig. 3). Otra protena de dedos de zinc, tristeraprolin (Xfp36), impide el desarrollo de la artritis autoinmune. Tristeraprolin une AU-ricos elementos en la regin 3 'no traducida del ARNm de TNF y elimina la poli (A) de cola deadenylation, lo que
conduce a la degradacin (Fig. 3). Por lo tanto, estas protenas zincfinger control de la estabilidad del mRNA a travs de diferentes mecanismos. A20 es una protena en la estimulacin de TLR que tiene dos enzimtica actividades, que acta como una ligasa E3 ubiquitina y deubiquitinase una. En los anlisis in vitro han demostrado que A20 restringe la activacin de NF-kB por la modulacin
RIP1 y TRAF6 (Fig. 3). A20-ratones deficientes mueren prematuramente debido al desarrollo espontneo de la inflamacin multiorgnico y caquexia severa, lo que indica que A20 tiene propiedades anti-inflamatorias in vivo. Deficiencia en los A20 y MyD88 rescata a los ratones de la muerte prematura y disminuye la inflamacin en estos ratones. Adems, la administracin de antibiticos impide caquexia. Por lo tanto, A20 podra inhibir la sealizacin de TLR inducida por bacterias comensales. Los ratones con mutaciones en el gen que codifica la tirosina fosfatasa SHP-1 desarrollan lesiones inflamatorias asociadas con la activacin de los macrfagos en respuesta a las aberrantes TLR stimulation86. MyD88 deficiencia
suprime la inflamacin, lo que sugiere que la SHP-1 regula negativamente la va MyD88 dependientes. Tambin se ha informado de que SHP-1 suprime la funcin de ambos IRAK1 y IRAK2 (ref. 87;. Fig. 3).
No
TLR
PRR
citoslico
en
PAMP
reconocimiento
El sistema inmune innato reconoce PAMPs citoplasma a travs de RLRs, NLRs y un sensor de ADN de doble cadena no identificados. RLRs (RIG-I, Mda5 y LGP2) son ARN helicasas que detectan virus especies de ARN y la seal a travs de la molcula adaptadora IPS-1, lo que induce una respuesta antiviral. NLRs representan una gran familia de los derechos y responsabilidades parentales que responden a varios estmulos, incluyendo PAMP, las partculas no PAMP y estreses celulares. Entre los NLRs, NOD1 y NOD2 reconocen los productos de degradacin de la pared celular bacteriana componentes, y NLRP3 (NALP3) responde o estmulos diversos para formar el complejo inflamasoma, que promueve la liberacin de IL-1 e IL-18 a travs de la
caspasa-1. Adems, las clulas responden a derivados de patgenos dsDNA y no digeridos dsDNA auto mediante la activacin de la induccin de interfern de tipo I a travs de vas no identificados, a pesar de Sting y TBK1 son componentes esenciales en el ADN de doble cadena que activa la sealizacin. DAI (ZBP1-DLM1) ha sido identificado como un sensor de supuestos citoslica de ADN de doble cadena que aumenta la produccin de interfern tipo I en respuesta a
ADN de doble cadena. Sin embargo, la induccin de interfern de tipo I por la estimulacin con ADN de doble cadena est intacto en el DAI-ratones deficientes, lo que sugiere la redundancia. AIM2, que contiene una pirina y HIN200 dominio de unin al ADN, se une a ADN de doble cadena, y que forma inflamasoma con ASC para activar la IL-1 de produccin. AIM2 se requiere
para la produccin de la caspasa-1-dependiente de IL-1 , pero es prescindible para la induccin de interfern de tipo I en respuesta a la estimulacin de ADN de doble cadena, la infeccin con el virus vaccinia (un virus ADN de doble cadena) y el intracelular facultativo Gram-negativas bacteria Francisella tularensis que ofrece ADN en el citoplasma de acogida. Por otra parte, AIM2 ratones deficientes son ms susceptibles a la infeccin letal con F. tularensis que son los ratones de control, probablemente debido a los defectos de la IL-1 de produccin. Por lo tanto, AIM2 es un componente crucial que participa en el ADN de doble cadena inducida por la produccin de IL-1 en lugar de interfern de tipo I. La fosfatasa Eya fue identificado como una molcula que interacta con Sting y IPS-1 y aumenta el promotor del gen que codifica para el interfern en ADN de doble cadena y la sealizacin de RLR, aunque la funcin fisiolgica de la protena permanece Eya unclear94. Estas clases de derechos y responsabilidades parentales citoslica se expresan por muchas clulas,
incluyendo clulas inmunes y no inmunes, como los fibroblastos y las clulas de los epitelios, y reconocer PAMP compartida con los TLR. Tanto el especfico y superposicin de funciones de estos derechos y responsabilidades parentales se han estudiado en el contexto de la respuesta inmune adaptativa durante la infeccin. Entre los derechos y responsabilidades parentales, los TLR se expresan principalmente en clulas presentadoras de antgeno, como pases en desarrollo y los macrfagos, as como en las clulas B, y los agonistas de muchos TLR activar tanto la respuesta de anticuerpos y linfocitos TH1 y TH17 respuestas. Varias lneas de evidencia indican el papel fundamental de los TLR en la conformacin de la inmunidad adaptativa. Un modelo in vivo de la infeccin por virus de influenza A, que es detectado por TLR7 en PDC y de RIG-I en las clulas de otros, demuestra que TLR7, en lugar de RIG-I, es necesario para el montaje de las clulas B y clulas CD4 + en las respuestas de clulas T. TLR7 ha demostrado ser fundamental para la inmunidad protectora en un modelo de vacuna. Por otra parte, TLR7, en lugar de RIG-I, es necesaria para la diferenciacin de las clulas T CD8 + despus de la infeccin con la coriomeningitis linfoctica virus96. Estos datos en conjunto sugieren que TLR7 contribuye a la induccin de respuestas inmunes antivirales eficaces de
adaptacin. Sin embargo, los TLR son insuficientes para la induccin de inmunidad robusta infiltraadaptive, porque las respuestas CD8 + de clulas T de virus de influenza A no requieren TLR7 o RLRs. Virus de la gripe son capaces de activar el inflamosoma NLRP3 para activar la IL-1 de produccin, y es esta va
necesarios para la conformacin de la inmunidad adaptativa. Aunque varios mecanismos han sido propuestos para desencadenar la activacin de la inflamasoma NLRP3, se ha demostrado que el virus de influenza A-inducida por la activacin de la inflamasoma NLRP3 es nico en el que el canal codificada por el virus de iones M2 es responsable de desencadenar la activacin. A pesar de las contribuciones relativas de los derechos y responsabilidades parentales citoslica a la formacin de la inmunidad adaptativa siguen siendo poco claras, se ha sugerido que la sealizacin citoslicas de derechos y responsabilidades parentales en los no-clulas presentadoras de antgeno (APC no) est involucrado en la facilitacin de DC-mediada por la respuesta inmune adaptativa. Poli (I: C) se utiliza como adyuvante de la vacuna y es reconocido por TLR3 y Mda5. Hay una alta expresin de TLR3 por CD8 + pases en
desarrollo, que tienen actividad fagoctica de alto para que las clulas infectadas por el virus de apoptosis. TLR3 deficiencia de los pases en
desarrollo no pueden montarse CD8 + en las respuestas de clulas T cuando envolver bien las clulas dsRNA-cargado o
clulas infectadas por virus. Por lo tanto, el reconocimiento de TLR3 dsRNA entrega de las clulas infectadas por el virus en los pases en desarrollo provoca la maduracin de DC y la presentacin del antgeno viral en el complejo mayor de histocompatibilidad de clase I molculas, lo que estimula respuestas CD8 + de clulas T (Fig. 2). Este proceso, conocido como 'crosspriming ", puede ser facilitado por interfern de tipo I y otras citocinas liberadas por las clulas infectadas inicialmente en el que Mda5 est involucrado en el reconocimiento de virus y la produccin de citoquinas. De hecho, un estudio que evala los efectos adyuvante de poli (I: C) en los ratones deficientes en TLR3 y / o Mda5 componentes de sealizacin ha demostrado
que el antgeno especfico de la produccin de anticuerpos y la diferenciacin de CD4 + y CD8 + T se regula a travs tanto TLR3 y Mda5 mediada vas. Por otra parte, un estudio ha demostrado que el reconocimiento de poli (I: C) por Mda5 en pases en desarrollo, los monocitos y las clulas del estroma, con consecuente induccin de interfern de tipo I, es necesaria para las respuestas Th1 en un modelo de ratn de una vacuna humana protena Gag
del virus de inmunodeficiencia . Esto sugiere que la sealizacin PRR, tanto en vehculos blindados y vehculos blindados no, y la interaccin entre ellos, son suficientes para el montaje de una robusta respuesta inmune adaptativa. El papel fundamental de la no-APC en el establecimiento de la inmunidad adaptativa Tambin se ha demostrado por el estudio de las vacunas de ADN que incorporan los plsmidos con las secuencias antignicas y otros elementos que potencian la respuesta inmune innata. La induccin ptima de las respuestas de clulas B y clulas T se
no requiere de TLR9, RLR o DAI, pero requiere TBK1 y Sting. En particular, la transferencia de clulas de experimentos han demostrado que las respuestas al ADN de doble cadena en las clulas hematopoyticas y no hematopoyticas tanto se requieren para el adyuvante de vacunas de ADN in vivo.
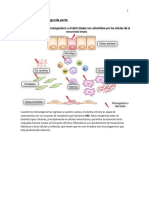
Ligandos endgenos para los TLR superficie de la clula
Cada vez es ms evidente que, adems de responder a PAMP, TLR responden a las molculas endgenas de acogida y desencadenar respuestas inflamatorias. La mayora de estos se producen como consecuencia de la muerte celular y lesiones o por las clulas tumorales, y que incluyen los productos de degradacin de la matriz extracelular (MEC), protenas de choque trmico y de alta movilidad de grupo 1 (HMGB1) las protenas, que actan como estimuladores de TLR de la superficie celular (Fig. 4). Por otra parte, la cromatina del ADN y los complejos de ribonucleoprotena liberada por las clulas mueren y complejos inmunes que contienen antgenos propios, todos los cuales contienen nucletidos s, puede estimular intracelular TLR7 y TLR9 y conducir al desarrollo de enfermedad autoinmune sistmica (Fig. 4). Como resultado de lesin o inflamacin, los componentes de ECM son escindidos por proteasas celulares y se liberan las clulas exteriores. Algunos de los componentes puestos en libertad activar TLR2 o TLR4 o ambos (Fig. 4). Estos incluyen biglycan, cido hialurnico, versicano, extradomain A de la fibronectina y la protena surfactante A. biglicano se sabe que inducen la produccin de citocinas inflamatorias y quimiocinas, y esta induccin es totalmente abolida por la deficiencia en ambos TLR2 y TLR4. Biglicano ratones deficientes son muy resistentes a zymosan y LPS inducido por los golpes y estn asociados con
menores
concentraciones
de
TNF
la
infiltracin
cin
de
clulas
mononucleares en los pulmones, lo que sugiere un papel para las vas biglicano-TLR2-TLR4 en la mejora de la bacteriainduced la lesin pulmonar. Fragmentos de cido hialurnico, que se acumulan y son liberados despus de una lesin pulmonar, puede estimular los macrfagos para producir quimiocinas a travs de TLR2 y TLR4. En un modelo de ratn de la lesin pulmonar no infecciosa en la que participa el cido hialurnico, los ratones doblemente deficientes en TLR2 y TLR4 muestran una menor supervivencia asociada con menos reclutamiento de clulas inflamatorias, la apoptosis de las clulas epiteliales mayor
y ms dao tisular, lo que sugiere que TLR2-TLR4 mediada por el reconocimiento de cido hialurnico favorece la inflamacin y las respuestas de reparacin. Extradomain protena A y un agente tensioactivo tambin pueden ser reconocidos por TLR4 (Ref. 107108).
Adems de los componentes de ECM, otros componentes celulares como HMGB1 y protenas de choque trmico-sirven como ligandos de TLR (Fig. 4). HMGB1, una central nuclear no histona protena que es liberada por las clulas necrticas o durante la inflamacin, es un mediador proinflamatorio en el shock sptico y modelos de isquemia reperfusin y es reconocido por TLR2, TLR4 y /
o TLR9 (ref. 109). Los anticuerpos neutralizantes para inhibir el dao HMGB1 en un modelo de isquemia reperfusin heptica y TLR4-ratones deficientes muestran un menor dao en este modelo. Este descubrimiento sugiere que TLR4 responde a las molculas endgenas y media en las respuestas inflamatorias en una situacin no infecciosas. El papel de las protenas citoplasmticas HMGB HMGB1, HMGB2 y HMGB3 como universal
centinelas de los cidos nucleicos que se activan los TLR, RLRs y sensores de ADN ha sido demonstrated111. Protenas de choque trmico, incluyendo Hsp60, Hsp70, Hsp22 y gp96, tambin han sido vinculados a la activacin de los macrfagos y DC para inducir mediadores proinflamatorios a travs de TLR2, TLR4 y TLR2-TLR4, aunque todava no est claro si este efecto se debe a la contaminacin de estos preparados de protenas recombinantes de productos de Escherichia coli.
TLR tambin participan en las respuestas inflamatorias en ciertas condiciones patolgicas. En las enfermedades inflamatorias no infecciosas, tales como la aterosclerosis y la enfermedad de Alzheimer, oxidados lipoprotenas de baja densidad y el amiloide , respectivamente, desencadenar la inflamacin estril y se reconocen en una forma dependiente de TLR4 y TLR6 (ref. 113;. Fig. 4).
Este reconocimiento es, probablemente, logra a travs de un heterodmero TLR4-TLR6 en cooperacin con el receptor scavenger CD36. Versicano, un proteoglicano ECM que se acumula en las clulas tumorales, estimula tumorinfiltrating clulas mieloides (a travs de TLR2, TLR6 y CD14) para producir TNF, lo que acelera la metstasis de clulas tumorales. Hay una interaccin directa entre TLR2 y versican. Por lo tanto, el reconocimiento de versican por TLR2
y el medio ambiente inflamatorio consiguiente puede apoyar tumorcell supervivencia. La infeccin tambin es un disparador para la liberacin de molculas endgenas -
que son reconocidos por los TLR (Fig. 4). Los pptidos antimicrobianos
defensinas 2, que directamente neutraliza los microbios invasores y se produce en respuesta a la infeccin en el tejido de la mucosa y la piel, se activa a travs de pases en desarrollo inmaduro TLR4 para inducir a la regulacin positiva de molculas estimuladoras, que conduce a la induccin de la efectiva respuesta inmune adaptativa. TLR4-TRIF y ratones deficientes estn protegidos de la lesin pulmonar aguda causada por la administracin de virus inactivado de la gripe aviar H5N1. Este virus desencadena la produccin de los fosfolpidos oxidados que son responsables de la lesin pulmonar aguda a travs de la
TLR4-TRIF eje. Por lo tanto, la respuesta al estrs oxidativo a travs del TLR4 va es la clave para controlar la lesin pulmonar aguda.
Inadecuado TLR mediada por el reconocimiento de uno mismo los cidos nucleicos
Auto-derivados cidos nucleicos no activan la respuesta inmune innata en condiciones normales. S los cidos nucleicos son adecuadamente degradado por nucleasas suero antes de ser reconocidos por los TLR en la endolysosomes. La localizacin intracelular de TLR7 y TLR9 es importante para evitar el contacto con extracelular cidos nucleicos auto. Adems,
maduracin proteoltica de TLR9 (y posiblemente TLR7) es importante para prevenir el reconocimiento inadecuado de ADN por s TLR9 fugas a la superficie celular. Es posible que estas medidas de seguridad son destruidos en
enfermedades inflamatorias y autoinmunes. Por ejemplo, cuando selfderived los cidos nucleicos forman complejos con las protenas endgenas, podra llegar a ser resistentes a las nucleasas y tener acceso a la endosomal TLR, que a su vez, promover y mantener los procesos autoinmunes. Adems, el hallazgo de que el trfico de TLR7 y TLR9 de la
ER endolysosomes es inducida por LPS, adems de sus ligandos sugiere la posibilidad de que la inflamacin podra en realidad aumentar la accesibilidad de los cidos nucleicos a TLR7 y TLR9 (ref. 32). En el lupus eritematoso sistmico, hay una mayor concentracin de anticuerpos para uno mismo o los cidos nucleicos nucleoprotenas. De suero de pacientes con lupus eritematoso sistmico promueve PDC para producir interfern de tipo I, y la concentracin de interfern de tipo I se correlaciona con la severidad de la enfermedad. Auto cidos nucleicos o nucleoprotenas obligado a
autoanticuerpos son internalizados a travs de receptores Fc RIIa en pases en desarrollo y se entregan a TLR7 y TLR9 vesculas que contienen, lo que conduce a la produccin de interfern de tipo I (Fig. 4). Adems, estos complejos inmunes se unen a los receptores de antgenos de clulas B y son internalizados para la activacin de estos TLR, que contribuye a la activacin de las clulas B autorreactivas. La activacin de las clulas cooperativa pases en desarrollo y B es, por tanto, importante para la progresin y perpetuacin de las enfermedades autoinmunes.
HMGB1 se puede unir a los dos ADN del patgeno y de s mismo. EstosHMGB1
Complejos de ADN se unen a los receptores RAGE y se entregan en endosomas tempranos de TLR9 reconocimiento, que se traduce en la activacin del PDC y las clulas B (Fig. 4). LL37 (catelicidina) es un antimicrobiano pptidos producidos por los neutrfilos y los queratinocitos, y lesiones de la piel de psoriasis tienen un alto LL37 expresin. LL37 forma agregados con ADN y ARN auto liberado por las clulas necrticas, y agrega estos se endocitosis y mantuvo a principios de los endosomas de PDC, donde TLR9 se activan y TLR7, respectivamente. La duplicacin de TLR7 se encontraron en ratones que son hiper-reactivo a TLR7 ligandos. Estos ratones desarrollan nefritis, junto con la produccin de anticuerpos que contienen ARN autoantgenos. Tetrametilpentadecano (pristane) es un alcano isoprenoides se encuentran en las plantas que produce una enfermedad similar al lupus en ratones cuando se inyecta en la cavidad peritoneal. La produccin de autoanticuerpos que sigui requiere interfern sealizacin. La fuente de la produccin de interfern tipo I en este caso es monocitos inmaduros en lugar de PDC y TLR7, pero no RLRs, es indispensable para esto. El U1 ribonucleoprotena nuclear pequea sirve para activar TLR7 en este modelo, a
pesar de los receptores Fc son indispensables para la produccin de interfern de tipo I.
Aunque TLR7 y TLR9 son similares en trminos de expresin, la localizacin, las vas de sealizacin y la expresin del gen objetivo, su papel en la patognesis de la enfermedad autoinmune en ratones son distintos. TLR7 deficiencia resulta en una menor cantidad de anticuerpos contra los antgenos asociados a ARN en MRL lpr / lpr ratones que desarrollan las enfermedades autoinmunes sistmicas como lupus eritematoso sistmico. Sin embargo, la deficiencia de TLR9 tiene el efecto contrario. Esto sugiere que la va TLR9 mediada lmites TLR7 respuestas. Parece que las enfermedades autoinmunes tambin son causados por el aclaramiento inadecuado de auto cidos nucleicos. Las mutaciones en el gen que codifica DNasa I en suero se asocian a un sndrome similar al lupus en ratones y seres humanos. Los ratones deficientes en lisosomales II DNasa ADN no digeridos se acumulan en los macrfagos, tienen concentraciones ms altas de interfern de tipo I y TNF y presenta sntomas autoinmunes, como la poliartritis crnica. En particular, el aumento de interfern de tipo I puede ocurrir en ausencia de DNasa II y con independencia de los TLR. Las mutaciones en el gen que codifica la TREX1 exonucleasa de reparacin se encuentran en el sndrome de Aicardi-Goutieres,
que se caracteriza por una encefalopata fatal asociada con una mayor produccin de interfern de tipo I. La prdida de TREX1 en los resultados de las clulas de la acumulacin de ADN derivadas de elementos retro, que son responsables de la induccin de respuestas interfern. Los ratones con mutaciones en el gen que codifica la FEN1 endonucleasa tambin tienen ms ADN sin digerir en las clulas apoptticas y estn predispuestos a la autoinmunidad, la inflamacin crnica y el cncer. Por otra parte, las mutaciones en el gen que codifica SAMHD1, un componente de RNasa H2, tambin estn asociados con el sndrome de Aicardi-Goutieres y se han relacionado con la regulacin negativa de la respuesta inmune innata antiviral. Aunque se sabe mucho menos acerca de los mecanismos por los cuales estos cidos nucleicos inadecuado causa autoinmunidad, derechos y
responsabilidades parentales citoslica de los cidos nucleicos estn probablemente involucradas (Fig. 4).
Las
perspectivas
de
futuro
Durante la ltima dcada, ha habido enormes progresos en la comprensin de las funciones de los TLR en el reconocimiento de patgenos y de defensa
del husped. Anlisis estructural de los TLR varios han dilucidado los mecanismos de reconocimiento de PAMP por homo o heterodmeros TLR, y muchas de las molculas de sealizacin implicadas en la activacin de NF-kB, AP-1 y protenas IRF se han identificado y caracterizado en detalle. El enfoque actual de muchas investigaciones es entender la compleja regulacin de la sealizacin de TLR, incluyendo regulacin post-transcripcional como
ubiquitinacin, la fosforilacin y la estabilidad del ARNm, y la regulacin espacial y temporal de los TLRs y sus complejos de sealizacin. Por otra parte, la constatacin de que la prdida de la regulacin negativa est directamente relacionado con las enfermedades inflamatorias sugiere que la supresin farmacolgica de las respuestas de TLR sera una herramienta til para el tratamiento de estas enfermedades.
El hallazgo de que hay una activacin de la sealizacin de TLR en el dao tisular en situaciones de enfermedades varias, en ausencia de infeccin sugiere que las molculas endgenas servir como agonistas de TLR, aunque es sin Lear si esta respuesta es de importancia biolgica para el mantenimiento de la homeostasis, como la reparacin de los tejidos, o si este reconocimiento no es
ms
que
accidental. Es de destacar que la infeccin microbiana activa la produccin de modificar las molculas endgenas (como HMGB1, fosfolpidos oxidados, -defensinas 2 y cidos nucleicos) que son reconocidos por los TLR u otros derechos y responsabilidades parentales citoslica. Esto puede sugerir que estas molculas endgenas, junto con el PAMP, actuar como adyuvantes para activar programas innata inmune a travs de los TLR y / o derechos y responsabilidades parentales, y tienen un papel clave en la facilitacin de la inmunidad adaptativa contra los microbios infectantes. Por otra parte, se ha hecho evidente que la PRR citoslica de sealizacin en las clulas inmunes tienen un papel en la promocin o impulsar la maduracin de DC y la posterior activacin de antgenos especficos de clulas T. or lo tanto, el uso de PAMP y / o agonistas endgenos que estimulan tanto a las clulas inmunes y no inmunes ser una herramienta til en el diseo de adyuvantes de vacunas eficaces. Comprensin de la complejidad de las redes de transcripcin que
operar durante la activacin de TLR y definir la respuesta inmune posterior es un foco importante de la investigacin actual. Las herramientas de la biologa de sistemas son tiles aqu, ya que este enfoque ha predicho con xito que varios factores de transcripcin, como ATF3 y C / EBP , son reguladores de la
transcripcin de IL-6, y esto ha sido comprobado en clulas knock-out. Adems, los anlisis globales encaminadas a lograr la comprensin de las redes TLR complejo transcripcional utilizando pequeos ARN de interferencia han hecho ms que empezar. Teniendo en cuenta que la sealizacin de TLR es distinto para los TLR individual, as como para diferentes tipos de clulas, y que los patgenos microbianos
contienen PAMPs mltiple, la acumulacin de conocimiento respecto a la perfiles de expresin gentica de muchos tipos de clulas despus de la estimulacin con cada
Agonista TLR o patgeno se requerir. Para una mejor comprensin de la funciones de cooperacin de la PRR diferentes en las defensas contra la infeccin,una combinacin de in vitro, in vivo e in silico enfoques que se necesita.
También podría gustarte
- Respuesta Inmune Innata - 1ra ParteDocumento18 páginasRespuesta Inmune Innata - 1ra Parteirving hilarioAún no hay calificaciones
- Seminario 2. Inmunidad Innata. Parte 2.Documento29 páginasSeminario 2. Inmunidad Innata. Parte 2.lilianabarbagallo.estilistaAún no hay calificaciones
- Papel de Los Receptores Tipo Toll en La Inmunidad InnataDocumento6 páginasPapel de Los Receptores Tipo Toll en La Inmunidad InnataG-orgina Coello0% (1)
- 01 Toll-Like Receptors - Roles in Disease and Therapy - UpToDate PDFDocumento23 páginas01 Toll-Like Receptors - Roles in Disease and Therapy - UpToDate PDFMarceloAún no hay calificaciones
- Actividad Receptores de PRRDocumento11 páginasActividad Receptores de PRRAndres PelayoAún no hay calificaciones
- El Papel de Los TLR en La Activación de NeutrófilosDocumento6 páginasEl Papel de Los TLR en La Activación de NeutrófilosVic VargasAún no hay calificaciones
- Patrones Moleculares Asociados A PatogenosDocumento6 páginasPatrones Moleculares Asociados A PatogenosLUCERO MILITZA SANCHEZ AVILESAún no hay calificaciones
- Receptores Citosólicos para Pamp y DampDocumento4 páginasReceptores Citosólicos para Pamp y DampPame FloresAún no hay calificaciones
- RESPUESTA INNATADocumento4 páginasRESPUESTA INNATAAndrea Mariel PeñaAún no hay calificaciones
- PRRsDocumento3 páginasPRRsOmar Adrian Hernandez JimenezAún no hay calificaciones
- Receptores Tipo Toll (TLR)Documento36 páginasReceptores Tipo Toll (TLR)Brenda Collantes VidalAún no hay calificaciones
- LPS y Receptores Toll (MAOG)Documento13 páginasLPS y Receptores Toll (MAOG)miguel angel100% (3)
- Inmunidad InnataDocumento22 páginasInmunidad InnataIsabellaAún no hay calificaciones
- Receptores de MEmbranaDocumento8 páginasReceptores de MEmbranak-coglyAún no hay calificaciones
- Inmunidad de MucosasDocumento13 páginasInmunidad de MucosasIGNACIO SALVADOR FERNANDEZ GIRONAún no hay calificaciones
- Inmunidad InnataDocumento17 páginasInmunidad InnataWraysthell CordovaAún no hay calificaciones
- Presentacion Receptores Citosolicos y de MembranaDocumento41 páginasPresentacion Receptores Citosolicos y de Membranaisabella vAún no hay calificaciones
- Ensayo 2 InmunologiaDocumento8 páginasEnsayo 2 InmunologiaGaddiel ibarraAún no hay calificaciones
- Receptores Del Tipo RIGDocumento7 páginasReceptores Del Tipo RIGReyner CovarrubiasAún no hay calificaciones
- Pattern Recognition Receptors (Receptores Que Reconocen Patrones (PRRS) )Documento4 páginasPattern Recognition Receptors (Receptores Que Reconocen Patrones (PRRS) )Paul Suarez MaldonadoAún no hay calificaciones
- Patrones Moleculares Asociados A PatógenosDocumento2 páginasPatrones Moleculares Asociados A PatógenosJ.h PlazaAún no hay calificaciones
- Resumen Inmunidad Secretora GRUPO 3Documento10 páginasResumen Inmunidad Secretora GRUPO 3De La Cruz JordanAún no hay calificaciones
- Resumen - Generalidades Del Reconocimiento Por La Inmunidad InnataDocumento7 páginasResumen - Generalidades Del Reconocimiento Por La Inmunidad InnataRanciovichAún no hay calificaciones
- 3 - PAMPs y RRPDocumento3 páginas3 - PAMPs y RRPGino MartinezAún no hay calificaciones
- Receptores Tipo Toll (TLR) Estructura, Clasificación y Sus LigandosDocumento8 páginasReceptores Tipo Toll (TLR) Estructura, Clasificación y Sus LigandosGuisely Sempertegui BenavidezAún no hay calificaciones
- inmuno borradorDocumento8 páginasinmuno borradorjuan guamanAún no hay calificaciones
- Receptores Tipo TollDocumento5 páginasReceptores Tipo TollMayra Nedelka VegaAún no hay calificaciones
- Resumen Inmunologia IDocumento194 páginasResumen Inmunologia IFernando FloresAún no hay calificaciones
- Resumen Capitulo 1 Inmunologia Fundamentos Roitt t 502946 Downloable 860800Documento9 páginasResumen Capitulo 1 Inmunologia Fundamentos Roitt t 502946 Downloable 860800Michelle AmayaAún no hay calificaciones
- La Enfermedad Del Sueño Tiene Sus Orígenes en La Región Afrotropical Del ContinenteDocumento4 páginasLa Enfermedad Del Sueño Tiene Sus Orígenes en La Región Afrotropical Del ContinentejordanAún no hay calificaciones
- Resumen Respuesta InmunitariaDocumento9 páginasResumen Respuesta InmunitariaMishVencesAún no hay calificaciones
- Fichas 7Documento7 páginasFichas 7Noelita RiveraAún no hay calificaciones
- Sem1 InmunoDocumento79 páginasSem1 InmunoRicardo DanielAún no hay calificaciones
- Odontoblasto 2Documento12 páginasOdontoblasto 2MISHELL ESTEFANIA GUAMAN LAVERDEAún no hay calificaciones
- Inflamasomas: sensores clave de la respuesta inmune innataDocumento5 páginasInflamasomas: sensores clave de la respuesta inmune innataMarijose Salas VargasAún no hay calificaciones
- Capítulo I - Respuesta Inmune. de La Fisiología A La MedicinaDocumento26 páginasCapítulo I - Respuesta Inmune. de La Fisiología A La Medicinaicaro chaineAún no hay calificaciones
- Receptores Tipo Toll - TareasDocumento12 páginasReceptores Tipo Toll - TareasDayana Torrico VAún no hay calificaciones
- Fagocitosis y PRRDocumento4 páginasFagocitosis y PRRisrael tulcanazaAún no hay calificaciones
- Receptores Tipo Toll - TareasDocumento12 páginasReceptores Tipo Toll - TareasDayana Torrico VAún no hay calificaciones
- 169 Sistema Inmunitario Cutáneo PDFDocumento63 páginas169 Sistema Inmunitario Cutáneo PDFJ C Torres Formalab100% (1)
- Inmuno 2Documento36 páginasInmuno 2Al CaralzAún no hay calificaciones
- Receptores de La Inmunidad Innata, Otros Receptores para El Reconocimiento de Patrón y Receptores de La Inmunidad AdaptativaDocumento8 páginasReceptores de La Inmunidad Innata, Otros Receptores para El Reconocimiento de Patrón y Receptores de La Inmunidad AdaptativaDonia Abou ArabAún no hay calificaciones
- 03 Que Son Los InflamasomasDocumento8 páginas03 Que Son Los InflamasomasLeon-lv Londoño100% (1)
- Genes Contra VirusDocumento21 páginasGenes Contra ViruslorenadelherAún no hay calificaciones
- 3 Innate ImmunityDocumento57 páginas3 Innate ImmunityJuan MoranAún no hay calificaciones
- Inmunidad InnataDocumento14 páginasInmunidad InnataMelissa RodriguezAún no hay calificaciones
- Investigaciones InmunologiaDocumento15 páginasInvestigaciones InmunologiaErick Salazar ManzanoAún no hay calificaciones
- Receptores de La Inmunidad Innata y AdaptativaDocumento6 páginasReceptores de La Inmunidad Innata y AdaptativaMaria Jose Intriago CedeñoAún no hay calificaciones
- 572-Texto Del Artículo-1074-1-10-20190702 PDFDocumento10 páginas572-Texto Del Artículo-1074-1-10-20190702 PDFFernanda AltamiranoAún no hay calificaciones
- Receptores Tipo Toll PDFDocumento7 páginasReceptores Tipo Toll PDFNiria GamboaAún no hay calificaciones
- Receptores CitosolicosDocumento33 páginasReceptores CitosolicosVanessa YapoAún no hay calificaciones
- INMUNIDADDocumento9 páginasINMUNIDADLizenia BTAún no hay calificaciones
- Cuadro Comparativo - E1Documento12 páginasCuadro Comparativo - E1Oscar Jesus Aguilar VenturaAún no hay calificaciones
- PAMPs, DAMPs, TLRs, NOD y receptores de glúcidosDocumento2 páginasPAMPs, DAMPs, TLRs, NOD y receptores de glúcidosIvan Pacheco71% (7)
- Receptores y Marcadores LinfocitariosDocumento16 páginasReceptores y Marcadores LinfocitariosSilvana JsbAún no hay calificaciones
- InmunologiaDocumento58 páginasInmunologiaSantiago PerezAún no hay calificaciones
- Conservación de MedicinaDocumento11 páginasConservación de MedicinaKArdo23Aún no hay calificaciones
- Auditoria Revision SGSSTDocumento34 páginasAuditoria Revision SGSSTPatoNaranjo100% (1)
- Guia PDFDocumento10 páginasGuia PDFDionel PorrasAún no hay calificaciones
- Estrategia Didáctica para Promover El Estudio de Los ServiciosDocumento90 páginasEstrategia Didáctica para Promover El Estudio de Los ServiciosKArdo23Aún no hay calificaciones
- Articulo Diversidad Genetica MalariaeDocumento4 páginasArticulo Diversidad Genetica MalariaeKArdo23Aún no hay calificaciones
- Modelo ViscoelasticoDocumento5 páginasModelo Viscoelasticosolita__Aún no hay calificaciones
- Identificacion de La Mutacion f1076l en El Gen MDR 1 Aislado de Muestras de Plasmodium Vivax Obtenidas Del Sur de BolivaDocumento5 páginasIdentificacion de La Mutacion f1076l en El Gen MDR 1 Aislado de Muestras de Plasmodium Vivax Obtenidas Del Sur de BolivaKArdo23Aún no hay calificaciones
- Caso Practico ZikaDocumento3 páginasCaso Practico ZikaKArdo23Aún no hay calificaciones
- 497Documento4 páginas497KArdo23Aún no hay calificaciones
- La Importancia de La Evolución de Las EspeciesDocumento2 páginasLa Importancia de La Evolución de Las EspeciesKArdo23Aún no hay calificaciones
- Mecanismos de Participación AmbientalDocumento3 páginasMecanismos de Participación AmbientalKArdo23Aún no hay calificaciones
- Enfermedad Diverticular y Cáncer de Colon - Artículos - IntraMedDocumento8 páginasEnfermedad Diverticular y Cáncer de Colon - Artículos - IntraMedAnnie OllarvesAún no hay calificaciones
- RankDocumento14 páginasRankmaria camila hoyosAún no hay calificaciones
- Histologia OsteoporosisDocumento14 páginasHistologia OsteoporosisCamila DolorierAún no hay calificaciones
- Alimentaria - Lácteos, Pro, Pre y Diabetes - 8ppDocumento8 páginasAlimentaria - Lácteos, Pro, Pre y Diabetes - 8ppPdfzAún no hay calificaciones
- Encefalitis CaninaDocumento6 páginasEncefalitis CaninaAlejandro AlcantaraAún no hay calificaciones
- Neuroinflammatory Process Involved in Different Preclinical Models of ChemotherapyDocumento15 páginasNeuroinflammatory Process Involved in Different Preclinical Models of ChemotherapyManuel Omar Libreros CoyAún no hay calificaciones
- 2-Resumen AzufreDocumento10 páginas2-Resumen AzufreMaritza ZatarainAún no hay calificaciones
- Silimarina y Como Ayuda A Disminuir El Hígado GrasoDocumento4 páginasSilimarina y Como Ayuda A Disminuir El Hígado GrasoCristobal Andres Fernandez CoentraoAún no hay calificaciones
- Sirtulinas y Factores de TranscripcionDocumento14 páginasSirtulinas y Factores de TranscripcionAna GómezAún no hay calificaciones
- Progesterona y Embarazo PDFDocumento7 páginasProgesterona y Embarazo PDFstivenAún no hay calificaciones
- Factor Nuclear KappaDocumento12 páginasFactor Nuclear KappaAnthony Aguilar PizánAún no hay calificaciones
- Curcumina en Hidrogel para Reabsorción ÓseaDocumento4 páginasCurcumina en Hidrogel para Reabsorción ÓseaDiana MAún no hay calificaciones
- Biología Molecular y GenéticaDocumento5 páginasBiología Molecular y GenéticaKitKitAún no hay calificaciones
- Celulas PlasmaticasDocumento62 páginasCelulas PlasmaticasGALILEA FIERROAún no hay calificaciones
- Osteoclastos PDFDocumento13 páginasOsteoclastos PDFMannie O. Carhuaricra FloresAún no hay calificaciones
- HAEMATOComunicaciones 10 PDFDocumento227 páginasHAEMATOComunicaciones 10 PDFYulizaFTAún no hay calificaciones
- Mecanismos de La Evasión Inmune Innata Humana Por Toxoplasma GondiiDocumento7 páginasMecanismos de La Evasión Inmune Innata Humana Por Toxoplasma GondiiPedroCordovageAún no hay calificaciones
- Comunicación CelularDocumento3 páginasComunicación CelularMARIA FERNANDA BARROS DOMINGUEZAún no hay calificaciones
- Reviasta de Bioquimica PDFDocumento41 páginasReviasta de Bioquimica PDFCharito HCAún no hay calificaciones
- Curcuma Como AnalgesicoDocumento6 páginasCurcuma Como AnalgesicoSamuel Vazquez CabreraAún no hay calificaciones
- BIO4.2-A Tecnologias para Plantas Medicinales-Manuel SandovalDocumento55 páginasBIO4.2-A Tecnologias para Plantas Medicinales-Manuel SandovalGrupoComunidadesAún no hay calificaciones
- Efectos Saludables de La Cúrcuma y de Los CurcuminoidesDocumento13 páginasEfectos Saludables de La Cúrcuma y de Los CurcuminoidesAmparo SGAún no hay calificaciones
- Blastocystis SP PDFDocumento17 páginasBlastocystis SP PDFDiego CacayAún no hay calificaciones
- Envejecimiento y Función Renal - Mecanismos de Predicción y ProgresiónDocumento12 páginasEnvejecimiento y Función Renal - Mecanismos de Predicción y ProgresiónnathaliepichardoAún no hay calificaciones
- Curcuma PDFDocumento10 páginasCurcuma PDFDaniel Alonso Luna MermaAún no hay calificaciones
- Importancia del CD30 en el diagnóstico y tratamiento de neoplasiasDocumento28 páginasImportancia del CD30 en el diagnóstico y tratamiento de neoplasiasRoxxana ChávezAún no hay calificaciones
- Bone Cells - En.esDocumento19 páginasBone Cells - En.esGabriela VillagomezAún no hay calificaciones
- Linfoma de HodgkinDocumento5 páginasLinfoma de HodgkinJohan Taborda SierraAún no hay calificaciones
- Reconocimiento de La Respuesta Inmune InnataDocumento5 páginasReconocimiento de La Respuesta Inmune InnataJose FranciscoAún no hay calificaciones
- Tesis BCadiz 2020 v4 PDFDocumento78 páginasTesis BCadiz 2020 v4 PDFDaniel GonzálezAún no hay calificaciones