Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Paca, Paspuel, Portero, Poveda 9852 Laboratorio Protozoarios y Platelmintos
Cargado por
Estefany VallejosDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Paca, Paspuel, Portero, Poveda 9852 Laboratorio Protozoarios y Platelmintos
Cargado por
Estefany VallejosCopyright:
Formatos disponibles
DEPARTAMENTO DE CIENCIAS
GUÍA PARA LAS PRÁCTICAS DE LABORATORIO, TALLER O CAMPO
DE LA VIDA
CÓDIGO: DCVI-GS-v3-2018-001
DEPARTAMENTO DE
CIENCIAS DE LA INGENIERIA EN
DEPARTAMENTO: CARRERA:
VIDA Y LA BIOTECNOLOGÍA
AGRICULTURA
Período Mayo-Septie
ASIGNATURA: Biología Animal NIVEL: 2
Lectivo: mbre 2021
DOCENTE: Sarah Martin Solano NRC: 5225-5221 PRÁCTICA N°: 3
LABORATORIO DONDE SE
Online
DESARROLLARÁ LA PRÁCTICA
TEMA DE LA Protozoarios y Platelmintos
PRÁCTICA:
INTRODUCCIÓN:
Los protozoos son organismos unicelulares con características en común con el reino protista y
presentan varias cualidades, Álvarez A, (2017) define las siguientes: son considerados heterótrofos ya que
realizan procesos como la fagocitosis y pinocitosis, poseen núcleo propio con formas diversas, se encuentran
individualmente o formando colonias, utilizan estructuras diferenciadas como cilios, flagelos, seudópodos
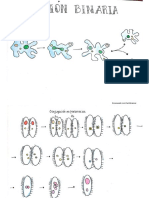
para su movilización, mientras que su reproducción puede ser asexual por medio de la fisión binaria, como
también sexual por medio de la formación de gametos, tienen la capacidad de formar quistes para lograr
sobrevivir en diversos medios y pueden parasitar a animales y seres humanos.
Los platelmintos son organismos aplanados, simétricos e invertebrados; pueden ser componentes
libres y encontrarse en su mayoría en medios acuáticos, al igual que en medios terrestres y cálidos; en cuanto
su estructura poseen sistemas como el digestivo con ausencia de ano y el nervioso altamente desarrollado ya
que trabaja en presencia de órganos y estímulos sensoriales, mientras que carecen de sistema circulatorio y
exoesqueleto o coraza, recubiertos únicamente de una capa simple (epitelio y músculos) usualmente con
cilios permitiéndoles adquirir distintas formas y moverse a través del sustrato, su reproducción se da a través
de la fertilización cruzada que consiste en la formación de espermas que luego se intercambian entre estos
CÓDIGO DE DOCUMENTO: DCVI-v3-2018-001 REV. UPDI: F.MORENO
CODIGO: FRM.7.3.001 FECHA: 21-12-2018
DEPARTAMENTO DE CIENCIAS
GUÍA PARA LAS PRÁCTICAS DE LABORATORIO, TALLER O CAMPO
DE LA VIDA
CÓDIGO: DCVI-GS-v3-2018-001
gusanos; pueden ser parasitarios (Neodermata) que con ayuda de su tegumento tienen la capacidad de robar
nutrientes de varios hospederos considerándose un éxito parasítico. (Collins, 2017).
Los parásitos son microorganismos que se encuentran en constante unión y dependes de varios
hospederos (intermediarios, definitivos) para su supervivencia, constituye la mayor causa de enfermedades
infecciosas y duraderas en los seres humanos, algunos ejemplos recalcables son: Leishmania, provoca
infección cutánea y visceral; Plasmodium, causante de fiebre, malestar, dificultad para respirar; Giardia
duodenalis, produce alergías, diarrea, fatiga, entre otros; se han desarrollado varios mecanismos como
barreras físicas e inmunológicas para evitar dicho contagio (Theel & Pritt, 2016).
OBJETIVOS:
Adquirir conocimiento básico de las formas de vida de los protozoarios y helmintos.
MATERIALES:
REACTIVOS:
Solución salina fisiológica/agua destilada INSUMOS:
Formaldehído 40% / formalina al 10% Internet
Éter/ diethyl ether
EQUIPOS:
Computadora
MUESTRA:
Heces fecales
INSTRUCCIONES:
Analizar bien los protocolos y los videos a disposición
ACTIVIDADES POR DESARROLLAR:
1) Lea el siguiente protocolo a detalle:
Protocolo de extracción de protozoarios y platelmintos
CÓDIGO DE DOCUMENTO: DCVI-v3-2018-001 REV. UPDI: F.MORENO
CODIGO: FRM.7.3.001 FECHA: 21-12-2018
DEPARTAMENTO DE CIENCIAS
GUÍA PARA LAS PRÁCTICAS DE LABORATORIO, TALLER O CAMPO
DE LA VIDA
CÓDIGO: DCVI-GS-v3-2018-001
Método de Ritchie modificado
Instituto de Salud Pública y Zoonosis - Proyecto Primates Ecuador
a) 1g de materia es diluido en 10ml de agua destilada y filtrada para remover los desechos
b) Agregar agua destilada al tubo de ensayo si hace falta para centrifugar.
c) La solución es centrifugada por 1 minuto a 2000 rpm.
d) Se descarta el sobre nadante
e) Agregar 5 ml de formalina al 10% y mezclar, esperar 10 minutos
f) Agregar 1.5 ml de diethyl ether y se agita por 1 minuto
g) Luego la suspensión se centrifuga por 2 minutos a 1500 rpm
h) Se remueve la grasa con un hisopo y el sobre nadante se quita
El sedimento que queda se mezcla con una pipeta Pasteur y se toma una muestra de una gota para
observar bajo el microscopio como se observa en la siguiente imagen.
CÓDIGO DE DOCUMENTO: DCVI-v3-2018-001 REV. UPDI: F.MORENO
CODIGO: FRM.7.3.001 FECHA: 21-12-2018
DEPARTAMENTO DE CIENCIAS
GUÍA PARA LAS PRÁCTICAS DE LABORATORIO, TALLER O CAMPO
DE LA VIDA
CÓDIGO: DCVI-GS-v3-2018-001
2) Vea el siguiente video:
https://www.youtube.com/watch?v=qBk3LtJf3vg
3) Responda a las siguientes preguntas:
a) ¿En que afecta a la técnica de Ritchie, el uso del formol al 10% (guía) y al 40% (video)?
b) ¿Cuál será la función de la solución salina fisiológica (video) en vez de agua destilada (guía),
influye su uso a que la técnica tenga mejores resultados?
c) ¿Qué ventajas y desventajas nos proporcionara el centrifugar a mayor tiempo y a mayor rpm
según el video en comparación a la técnica de la guía?
d) ¿Cuál es la función del Ether en la técnica de Ritchie?
e) ¿Que otras técnica coproparasitarias se pueden utilizar para identificar parásitos en heces?
f) ¿Qué tipos de protozoarios y helmintos ocurren en áreas con poca higiene y por qué?
g) ¿Por qué los niños son más propensos a tener infecciones con oxiuros?
h) ¿Por qué los Áscaris no son digeridos en el tracto digestivo de los hospedadores?
RESULTADOS OBTENIDOS:
a) ¿En que afecta a la técnica de Ritchie, el uso del formol al 10% (guía) y al 40% (video)?
El método de Ritchie fue fundamental para el diagnóstico de enfermedades parasitarias, con una sensibilidad
y especificidad del 100%, por lo que se debe complementar con el método convencional de coproparasitario
directo para tener un resultado más veraz y confiable. El uso de formol como desinfectante de nacedoras
tiene un efecto positivo para disminuir la carga microbiológica del ambiente, el método más efectivo en la
desinfección es la aplicación de Formol al 40% durante 10 minutos, en donde el porcentaje de
contaminación solo alcanzo el 23,33%; sin embargo, no se evidencio regeneración alguna de los
explantes.así también al realizarse la técnica de concentración de Ritchie, va a permitir utilizar una buena
cantidad de muestras, donde se busca eliminar las grasas de las heces para dejar visible a los parásitos y
poder ser identificados en el microscopio. (Villareal, 2020)
CÓDIGO DE DOCUMENTO: DCVI-v3-2018-001 REV. UPDI: F.MORENO
CODIGO: FRM.7.3.001 FECHA: 21-12-2018
DEPARTAMENTO DE CIENCIAS
GUÍA PARA LAS PRÁCTICAS DE LABORATORIO, TALLER O CAMPO
DE LA VIDA
CÓDIGO: DCVI-GS-v3-2018-001
b) ¿Cuál será la función de la solución salina fisiológica (video) en vez de agua destilada (guía),
influye su uso a que la técnica tenga mejores resultados?
El Cloruro de Sodio al 0,9% nos da mejores resultados ya que es el cristaloide no balanceado de amplio uso
en nuestro país. Es isotónica pero su composición dista mucho de ser fisiológico para el organismo humano.
El ion cloruro es el electrolito más abundante después del sodio con un rol clave en la regulación de los
fluidos corporales, balance electrolítico, la preservación de electro neutralidad, del estado ácido básico y es
un componente esencial de muchas condiciones patológicas. (Rojas, 2019)
c) ¿Qué ventajas y desventajas nos proporcionara el centrifugar a mayor tiempo y a mayor rpm
según el video en comparación a la técnica de la guía?
Las técnicas de sedimentación de Ritchie utilizan solución formolada al 10%, las técnicas de sedimentación,
se utilizan para la observación de quistes de protozoos, huevos y larvas de helmintos, pero la desventaja de
estas técnicas consiste en que los preparados contienen más residuos que los procesados por flotación. En
este caso, el acetato de etilo se usa para extraer los residuos y las grasas de las heces y llevar los parásitos al
fondo de la suspensión. Estas técnicas entonces son recomendadas por ser fáciles de realizar, tener baja
probabilidad de errores técnicos y recuperar un amplio rango de organismos.
Ellos consideraron que probablemente este parásito se deforme por la centrifugación y quede en el anillo de
residuos que resulta de la aplicación de esta técnica de sedimentación. Sin embargo, la frecuencia de
diagnóstico de B. hominis observada en el presente trabajo fue mayor utilizando esta técnica que los restantes
métodos de concentración. (Rojas, 2019)
d) ¿Cuál es la función del Ether en la técnica de Ritchie?
Siendo que la técnica de Ritchie permite diagnosticar parásitos intestinales, el éter participa en la misma
como un agente liberador de los parásitos de la grasa. En ese momento, las formas parásitas se disuelven por
acción del formol. Una vez hecha la centrifugación, se encuentra en la muestra quistes por sedimentación
que ya pueden ser analizados. Por este método, las formas parasitarias se conservan lo suficientemente
sólidas, mostrando 4 capas diferenciadas, de arriba hacia abajo: éter superficial, restos fecales, formaldehído
y elementos parasitarios asentados en el fondo (Garcés, 2020).
e) ¿Qué otras técnicas coproparasitarias se pueden utilizar para identificar parásitos en heces?
CÓDIGO DE DOCUMENTO: DCVI-v3-2018-001 REV. UPDI: F.MORENO
CODIGO: FRM.7.3.001 FECHA: 21-12-2018
DEPARTAMENTO DE CIENCIAS
GUÍA PARA LAS PRÁCTICAS DE LABORATORIO, TALLER O CAMPO
DE LA VIDA
CÓDIGO: DCVI-GS-v3-2018-001
Otra técnica que se puede usar para identificar parásitos en heces es la de Kato-Katz-Saf. Este método,
avalado por la OMS, permite analizar geohelmintiasis. Una de sus desventajas más significativas es que el
análisis del mismo solo puede ser hecho hasta 2 días después de que se tomó la muestra, por la degradación
de los huevos. Esta técnica usa el fijador SAF, compuesto por acetato de sodio, ácido acético y formaldehído.
Para realizar este procedimiento, se sumerge la muestra en SAF, para luego tomar 2 gramos de materia fecal.
Posteriormente, se coloca una malla de 200 micro poro encima de la muestra fecal, presionando con una
espátula hasta que filtre. Una vez que esta materia fecal haya filtrado, se coloca en una placa Kit-OMS, la
cual se instala en un portaobjetos y se cubre con papel celofán hidrofílico, el cual fue sumergido previamente
en glicerina verde por un día completo. Si la muestra está estirada totalmente en el portaobjetos, se debe
esperar 3 cuartos de hora para que se aclare la muestra. Finalmente, se puede observar la cantidad de huevos,
la cual representa 1/24 de la cantidad de huevos en gramo de heces. (Forero y Carreño, 2017).
f) ¿Qué tipos de protozoarios y helmintos ocurren en áreas con poca higiene y por qué?
Los protozoarios y helmintos ocasionan muchas infecciones intestinales, siendo que estos principalmente se
transmiten por el agua. Protozarios como los Cryptosporidium spp, Giardia spp, Entoamoeba spp o
Balantidium spp. se encuentran en varias fuentes de agua contaminada, pues son altamente resistentes.
(Castillo y Rovira, 2020). En el caso de los helmintos, causan enfermedades por el ingreso de sus larvas en el
suelo, a través de las heces contaminadas. Esto se da en zonas donde la higiene es deficiente. Los helmintos
más comunes de encontrar en estos casos son Ascaris lumbricoides (ascáride), Trichura trichura (tricocéfalo)
o Necator americanus (anquilostoma). Las condiciones de los ambientes no higiénicos permiten mayor
proliferación de estos parásitos. (Silva de la Cruz, 2021).
Esto se da porque la mayoría de parásitos intestinales, como los protozoarios y helmintos, se proliferan
mayoritariamente en zonas de bajo saneamiento; usando a fuentes de agua o alimento como vector. Por
ejemplo, lugares donde aún se practica la defecación en el ambiente, tiene mayor probabilidad de
transmitirlos. Mientras exista poca higiene, los protozoarios y helmintos tendrán mecanismos de
supervivencia. (Nichols, 2016).
g) ¿Por qué los niños son más propensos a tener infecciones con oxiuros?
Los niños son más propensos a desarrollar estas infecciones ya que estos paracitos se encuentran de manera
muy sencilla ya sea un agua no potable, en poblaciones de escasa pobreza y principalmente en el suelo, es
CÓDIGO DE DOCUMENTO: DCVI-v3-2018-001 REV. UPDI: F.MORENO
CODIGO: FRM.7.3.001 FECHA: 21-12-2018
DEPARTAMENTO DE CIENCIAS
GUÍA PARA LAS PRÁCTICAS DE LABORATORIO, TALLER O CAMPO
DE LA VIDA
CÓDIGO: DCVI-GS-v3-2018-001
por eso que los niños son más vulnerables ya que ellos se llevan la mano a la boca después de gatear o tocar
algo sucio y no existe un previo lavado de manos, así mismo los niños pasan alrededor de más niños ya sean
en parques, jardines, escuelas y también tienen la costumbre de compartir comida, así mismo los juegos y
hasta los baños y son exactamente lugares que se encuentran las larvas o huevos de estos parásitos llamados
oxiuros. Estos parásitos afectan a su digestión principalmente sufren de gran pérdida de hierro y no pueden
absorber todos los nutrientes necesarios para su buena alimentación. (Pérez, 2017).
h) ¿Por qué los Áscaris no son digeridos en el tracto digestivo de los hospedadores?
No son digeridos ya que ingresan las larvas o pequeños huevos los cuales luego se logran trasladar al
corazón o a los pulmones mediante el torrente sanguíneo o el sistema linfático después de unos 15 días
aproximadamente acabo su etapa de madurez por consiguiente pueden salir del cuerpo por medio de un
estornudo o al toser y hay otras que vuelven a ingresar aquellas se van al intestino a convertirse en gusanos.
(Wang y Davis, 2020).
CONCLUSIONES:
● Podemos concluir que aprendimos la manera en la cual los protozoarios y platelmintos se
desarrollan durante toda su vida. Mediante el método de sedimentación de Ritchie se logra ver
a estos protozoarios y platelmintos en las heces, o mejor dicho si el organismo está infectado
por esos parásitos. Con este método dice que al visualizar no es visible a simple vista, también
logramos aprender que estos parásitos son muy fáciles de adquirirlos ya que si no se
encuentran en condiciones favorables o que no exista una higiene correcta somos propensos a
adquirir estos parásitos.
● El nivel de sanidad es un factor muy importante para evitar la transmisión de formas parásitas,
tales como los helmintos y protozoarios. Estas formas parásitas pueden causar varias
afecciones a la salud, por lo que se debe procurar condiciones adecuadas de higiene.
Afortunadamente, técnicas coproparasitarias como la de Ritchie o Kato-Katz-Saf permiten
identificar a las formas parásitas, para ofrecer un oportuno tratamiento. Igualmente, la
visualización de las formas parásitas compactadas, en el método de Ritchie, permitió mayor
comprensión del nivel de quistes existente en las heces fecales, de acuerdo a la parasitosis.
● Adquirimos conocimientos básicos de los protozoarios, platelmintos y parásitos,
profundizamos previamente en cuanto sus características principales de cada uno como
taxonomía, ciclo de vida, hábitat, reproducción, especies relevantes, entre otras; para así
lograr su extracción e identificación gracias al método de Ritchie.
● Observamos que el método de Ritchie se puede realizar de varias maneras cambiando algunos
componentes o concentraciones de cada compuesto variando su porcentaje y así al momento
CÓDIGO DE DOCUMENTO: DCVI-v3-2018-001 REV. UPDI: F.MORENO
CODIGO: FRM.7.3.001 FECHA: 21-12-2018
DEPARTAMENTO DE CIENCIAS
GUÍA PARA LAS PRÁCTICAS DE LABORATORIO, TALLER O CAMPO
DE LA VIDA
CÓDIGO: DCVI-GS-v3-2018-001
de realizar la sedimentación, observarlo de mejor manera en el microscopio consiguiendo
mejores resultados al momento de observar los parásitos existentes en nuestro organismo.
RECOMENDACIONES:
Consultar el material disponible para la práctica antes de realizar el laboratorio.
FIRMAS
F: F: F:
………………………… ………………………… ……………………………
…………………. ……………………. ………………………
Nombre: Sarah Martin Nombre: Jakeline Torres Nombre: Patricia Jiménez
Solano COORDINADOR DE ÁREA JEFE DE LABORATORIOS
DOCENTE DE CONOCIMIENTO MULTIDISCIPLINARIOS
BIBLIOGRAFÍA
Alvarez, A. R. (2017). Los protozoos: características generales y su rol como agentes patógenos. Ciencia
Veterinaria, 8(1), 62-71.
Collins J. J., 3rd (2017). Platyhelminthes. Current biology : CB, 27(7).
https://doi.org/10.1016/j.cub.2017.02.016
Castillo, A., & Rovira, D. (2020). El agua como factor de riesgo para la transmisión de protozoarios y
helmintos. Revista Plus Economía, 8(1), 47-67.
Forero, J. C. G., & Carreño, A. M. G. (2017). Comparación de sensibilidad y especificidad de dos técnicas
de diagnóstico directo: Kato–Katz-Saf y Ritchie–Frick (formol-gasolina) en examen
coproparasitológico para la identificación de estadios infectivos de geohelmintos en población
infantil en edad preescolar y escolar. Revista Med de la Facultad de Medicina, 25(2), 22-41.
Garcés Clavijo, X. (2020). Comparación entre el método directo de heces frente al método de Ritchie para el
diagnóstico de parásitos intestinales en los niños de la Casa Hogar Campesino de
Esmeraldas (Doctoral dissertation, Ecuador-PUCESE-Escuela de Laboratorio Clínico).
CÓDIGO DE DOCUMENTO: DCVI-v3-2018-001 REV. UPDI: F.MORENO
CODIGO: FRM.7.3.001 FECHA: 21-12-2018
DEPARTAMENTO DE CIENCIAS
GUÍA PARA LAS PRÁCTICAS DE LABORATORIO, TALLER O CAMPO
DE LA VIDA
CÓDIGO: DCVI-GS-v3-2018-001
Navone, G. T., Gamboa, M. I., Kozubsky, L. E., Costas, M. E., Cardozo, M. S., Sisliauskas, M. N., &
González, M. (2005). Estudio comparativo de recuperación de formas parasitarias por tres diferentes
métodos de enriquecimiento coproparasitológico. Parasitología latinoamericana, 60(3-4), 178-181
Nicholls, S. (2016). Parasitismo intestinal y su relación con el saneamiento ambiental y las condiciones
sociales en Latinoamérica y el Caribe. Biomédica, 36(4), 496-497.
Rojas, C. A. (2019). La solución salina fisiológica y su alta concentración de cloruro. Ciencia e
Investigación, 22(1), 27-30.
Romero Perez, Y. P. (2017). HÁBITOS DE CONSUMO-ALMACENAMIENTO DEL AGUA Y SU
RELACIÓN CON LA PARASITOSIS INTESTINAL EN NIÑOS MENORES DE 5 AÑOS DEL
AA. HH. SAN ANTONIO DEL DISTRITO DE CHOSICA.
Silva de la Cruz, P. (2021). Frecuencia de Protozoarios y Helmintos Intestinales en niños de 01 a 10 años
atendidos en el centro de salud San Martín de Porres 2020.
Theel, S & Pritt, B. (2016) Parasites. Microbiol Spectr, 4(4). doi: 10.1128/microbiolspec.DMIH2-0013-2015.
PMID: 27726821.
Villca, E. R. L., Rodriguez, R. S., & Ruíz, J. D. L. (2020). ESTABLECIMIENTO IN VITRO DEL
LAPACHO BLANCO (Tabebuia rosealba) UTILIZANDO TRES CONCENTRACIONES DE
BENCILAMINOPURINA (BAP) Y DOS MÉTODOS DE DESINFECCIÓN. Ventana Cientifica
Estudiantil, 1(2), 43-45.
Villarreal Bonifaz, E. A. (2020). Efecto de diferentes niveles de formaldehido en nacedoras sobre el status
sanitario y desempeño productivo de pollos broilers.
Wang, J. y Davis, RE (2020). Ascaris. Biología actual , 30 (10), R423-R425.
CÓDIGO DE DOCUMENTO: DCVI-v3-2018-001 REV. UPDI: F.MORENO
CODIGO: FRM.7.3.001 FECHA: 21-12-2018
También podría gustarte
- Guía Prácticas Laboratorio, Taller o Campo 2 - Biologia NRC 9453 - AlumnoDocumento4 páginasGuía Prácticas Laboratorio, Taller o Campo 2 - Biologia NRC 9453 - AlumnoCamilo VinuezaAún no hay calificaciones
- Práctica 1 Uso y Manejo Del Microscopio ÓpticoDocumento2 páginasPráctica 1 Uso y Manejo Del Microscopio ÓpticoJHOAN ALFREDO PLUA MONTIELAún no hay calificaciones
- Guía FagocitosisDocumento2 páginasGuía FagocitosisSilvana RomoAún no hay calificaciones
- 17 - Guia Medio Ambiente Signed SignedDocumento4 páginas17 - Guia Medio Ambiente Signed SignedEVELIN DAMARIS QUIROZ TAPIAAún no hay calificaciones
- 5 Guía Laboratorio Botánica FLORDocumento3 páginas5 Guía Laboratorio Botánica FLORStefania GarofaloAún no hay calificaciones
- GUIA LAB 5-SignedDocumento3 páginasGUIA LAB 5-SignedJenny S-boomAún no hay calificaciones
- Práctica Biotecnología No 4Documento2 páginasPráctica Biotecnología No 4fran asanzaAún no hay calificaciones
- Guia Lab Sist Biolog Protozoos 201811Documento3 páginasGuia Lab Sist Biolog Protozoos 201811Marilyn RuizAún no hay calificaciones
- Akmanual en Formato Marzo - Julio 2019.Documento33 páginasAkmanual en Formato Marzo - Julio 2019.Dayu PiñarcajaAún no hay calificaciones
- Práctica Biotecnología No3Documento2 páginasPráctica Biotecnología No3fran asanzaAún no hay calificaciones
- LAB 2 v1Documento3 páginasLAB 2 v1Marcelo David GHAún no hay calificaciones
- GUIA LAB 6-SignedDocumento2 páginasGUIA LAB 6-SignedJenny S-boomAún no hay calificaciones
- Proyecto y Lab FinalDocumento7 páginasProyecto y Lab FinalAndres AmaguaAún no hay calificaciones
- Guía de Prácticas de Laboratorio Biología Vegetal - Grace Páez - 201820Documento46 páginasGuía de Prácticas de Laboratorio Biología Vegetal - Grace Páez - 201820Fernando EstradaAún no hay calificaciones
- Guia 1.1 Nuevas Tendencias GAma IIDocumento8 páginasGuia 1.1 Nuevas Tendencias GAma IIEvelin QuirozAún no hay calificaciones
- 2.-Formato Informe Prácticas 2017-2018Documento4 páginas2.-Formato Informe Prácticas 2017-2018AntoneyAguilarAún no hay calificaciones
- Guia Bioquimica Labotatorio 7 - 2021Documento8 páginasGuia Bioquimica Labotatorio 7 - 2021Pepita PerezzAún no hay calificaciones
- Modelo de InformeDocumento10 páginasModelo de InformeDanyelQuispeAún no hay calificaciones
- SISTEMA DE GESTIÓN DE CALIDAD HoteleriaDocumento8 páginasSISTEMA DE GESTIÓN DE CALIDAD HoteleriaandysebasAún no hay calificaciones
- Informe Identificación de Proteínas (Biuret)Documento4 páginasInforme Identificación de Proteínas (Biuret)Kelly Belen Campoverde BuestanAún no hay calificaciones
- GUIA DE LABORATORIO ZOOLOGIA No 1Documento3 páginasGUIA DE LABORATORIO ZOOLOGIA No 1maria martinez100% (1)
- 11 Guia para Practicas de Laboratorio DCVA ACTUALDocumento3 páginas11 Guia para Practicas de Laboratorio DCVA ACTUALEsteban GarcesAún no hay calificaciones
- 4 TALLO Guía de Práctica Laboratorio Biología Vegetal I 201820Documento3 páginas4 TALLO Guía de Práctica Laboratorio Biología Vegetal I 201820Joami WayAún no hay calificaciones
- Ruiz.M 3726 Informe de Sistemática Vegetal.Documento8 páginasRuiz.M 3726 Informe de Sistemática Vegetal.Marilyn RuizAún no hay calificaciones
- MANUAL LAB BIOTEC AMB 2023 IBQ Def PDFDocumento36 páginasMANUAL LAB BIOTEC AMB 2023 IBQ Def PDFElizabeth SandovalAún no hay calificaciones
- Guía Lab 1Documento3 páginasGuía Lab 1Hyllary BorjaAún no hay calificaciones
- Guía de Laboratorio - Tallo - 202251Documento3 páginasGuía de Laboratorio - Tallo - 202251Kevin Jefferson BalladaresAún no hay calificaciones
- Docsity Practica de Osmosis Dialisis y DifusionDocumento12 páginasDocsity Practica de Osmosis Dialisis y DifusionIngrid AucancelaAún no hay calificaciones
- Silabo-1704253-Reproduccion y Genetica Acuicola (2023-B)Documento6 páginasSilabo-1704253-Reproduccion y Genetica Acuicola (2023-B)Diego Vargas NoaAún no hay calificaciones
- GUÍA 02 Fisiología VegetalDocumento4 páginasGUÍA 02 Fisiología VegetalSandra Burbano DelgadoAún no hay calificaciones
- ENTOMOLOGIADocumento13 páginasENTOMOLOGIAJUAN CARLOS FUENTES MARTÍNEZAún no hay calificaciones
- Silabo-Cultivos Especiales (2021-A)Documento5 páginasSilabo-Cultivos Especiales (2021-A)joseAún no hay calificaciones
- Villamar Samanta 9791 Laboratorio 1Documento2 páginasVillamar Samanta 9791 Laboratorio 1jngavilanesAún no hay calificaciones
- Guía de Laboratorio - Semilla - 202251Documento3 páginasGuía de Laboratorio - Semilla - 202251Kevin Jefferson BalladaresAún no hay calificaciones
- 1 Glicerinizacin Perfeccionada s3Documento9 páginas1 Glicerinizacin Perfeccionada s3Cristopher Pinedo CarranzaAún no hay calificaciones
- Manual de Prácticas - IBIMDocumento21 páginasManual de Prácticas - IBIMRomi RamónAún no hay calificaciones
- 01 GuíaDocumento4 páginas01 GuíaSilvana RomoAún no hay calificaciones
- REC C. Nat OnceDocumento6 páginasREC C. Nat OnceGeraldin RodriguezAún no hay calificaciones
- ProyectoDocumento16 páginasProyectoGustavo Cesar VazquezAún no hay calificaciones
- Ficha para Desarrollar Actividad-Convención Utm-2023Documento16 páginasFicha para Desarrollar Actividad-Convención Utm-2023jclavijo6311Aún no hay calificaciones
- Guia Biotecnologia - 2019 - IIDocumento39 páginasGuia Biotecnologia - 2019 - IIYenny Suxe SánchezAún no hay calificaciones
- Hito 2 - Planificacion Monitoreo Biologico e HidrobiologicoDocumento17 páginasHito 2 - Planificacion Monitoreo Biologico e HidrobiologicoEddy Lomax CastilloAún no hay calificaciones
- Problemática AmbientalDocumento8 páginasProblemática AmbientalJuly L.Aún no hay calificaciones
- Guias III Lab Segundo Periodo 2017Documento41 páginasGuias III Lab Segundo Periodo 2017angie MeraAún no hay calificaciones
- Informe #1Documento3 páginasInforme #1AMY DAYANNA GONZÁLEZ CHELEAún no hay calificaciones
- Guía 01. Bioseguridad - Biologia 212-11-13Documento4 páginasGuía 01. Bioseguridad - Biologia 212-11-13Felipe AmadoAún no hay calificaciones
- Microcurriculo Patología Medica II - 2022 - 2Documento8 páginasMicrocurriculo Patología Medica II - 2022 - 2Javier HernandezAún no hay calificaciones
- AAAr051 - V10 - CITOLOGÍA GENERALDocumento5 páginasAAAr051 - V10 - CITOLOGÍA GENERALdavid Sierra gaonaAún no hay calificaciones
- Guia Del Laboratorio La FlorDocumento3 páginasGuia Del Laboratorio La FlorGeovanny VelascoAún no hay calificaciones
- Microbiologia InformeDocumento5 páginasMicrobiologia InformeERIKA PAMELA ALVAREZ MALDONADOAún no hay calificaciones
- Practica 4 CaviaculturaDocumento2 páginasPractica 4 CaviaculturaMiguetoAún no hay calificaciones
- ANX-PR/CL/001-01 Guía de Aprendizaje: 20504322 - Procesos Y Productos BiotecnológicosDocumento19 páginasANX-PR/CL/001-01 Guía de Aprendizaje: 20504322 - Procesos Y Productos BiotecnológicosCarlos Rodríguez MartínAún no hay calificaciones
- Sílabo de Zoocría 2021-IDocumento12 páginasSílabo de Zoocría 2021-Icarlos chuAún no hay calificaciones
- Practica 1 CaviaculturaDocumento2 páginasPractica 1 CaviaculturaDAVID ANDRES TOALONGO CUSCOAún no hay calificaciones
- Sandoval - Mishell - 5104 - Laboratorio 3Documento3 páginasSandoval - Mishell - 5104 - Laboratorio 3Mishell SandovalAún no hay calificaciones
- Ith-Ac-po-004-07 Programa de Practicas Yaneth 2023Documento5 páginasIth-Ac-po-004-07 Programa de Practicas Yaneth 2023Yaneth HernándezAún no hay calificaciones
- Manual Lab Biotec Amb 2021 - PDocumento38 páginasManual Lab Biotec Amb 2021 - PKarla HermosilloAún no hay calificaciones
- Folleto Plan Recuperación Microbiologia GeneralDocumento23 páginasFolleto Plan Recuperación Microbiologia GeneralAnita OrtegaAún no hay calificaciones
- Pract N°2 Lab Operaciones Uni. AmbientalesDocumento7 páginasPract N°2 Lab Operaciones Uni. AmbientalesQu Alva FatimaAún no hay calificaciones
- Guías de laboratorio de bioquímica para la carrera de químicaDe EverandGuías de laboratorio de bioquímica para la carrera de químicaCalificación: 5 de 5 estrellas5/5 (1)
- Paspuel Vallejos 9852 Tarea#1Documento2 páginasPaspuel Vallejos 9852 Tarea#1Estefany VallejosAún no hay calificaciones
- Paca, Paspuel, Portero, Poveda 9852 Laboratorio Teorico PlatelmintosDocumento5 páginasPaca, Paspuel, Portero, Poveda 9852 Laboratorio Teorico PlatelmintosEstefany VallejosAún no hay calificaciones
- Paspuel Shirley 9852 Tarea#3Documento3 páginasPaspuel Shirley 9852 Tarea#3Estefany VallejosAún no hay calificaciones
- Biodiversidad - 202151Documento51 páginasBiodiversidad - 202151Estefany VallejosAún no hay calificaciones
- 14.1 Clase Ecologia - Factores Abióticos 202151Documento26 páginas14.1 Clase Ecologia - Factores Abióticos 202151Estefany VallejosAún no hay calificaciones
- Sistematica Vegetal - 202151Documento28 páginasSistematica Vegetal - 202151Estefany VallejosAún no hay calificaciones
- 240422-Tema-A-SimulacroNacional - Estudios M y C - UnlockedDocumento23 páginas240422-Tema-A-SimulacroNacional - Estudios M y C - UnlockedZonia Reyes QuispeAún no hay calificaciones
- Examen Segundo Parcial 2022 - Revisión Del IntentoDocumento11 páginasExamen Segundo Parcial 2022 - Revisión Del IntentoAlberto SaenzAún no hay calificaciones
- Estilos D Evida Saludable PositivaDocumento36 páginasEstilos D Evida Saludable PositivaDiana Carolina ContrerasAún no hay calificaciones
- Qué Es El SedentarismoDocumento2 páginasQué Es El SedentarismoCARPIO GELDRES Leandro EliasAún no hay calificaciones
- Salud Fisica Del ParvuloDocumento107 páginasSalud Fisica Del ParvuloNachooPerezAún no hay calificaciones
- Caso Clinico 2020 Escoliosis PediatriaDocumento6 páginasCaso Clinico 2020 Escoliosis PediatriaLuisArroboAún no hay calificaciones
- Traumatismos Oculares en La Infancia: Ventana A Otras EspecialidadesDocumento4 páginasTraumatismos Oculares en La Infancia: Ventana A Otras EspecialidadesgabrielaAún no hay calificaciones
- Resumen NeumoníaDocumento12 páginasResumen NeumoníaAngello PereiraAún no hay calificaciones
- Manejo de Aves de EngordaDocumento22 páginasManejo de Aves de EngordaGilson Yhovany Sanchez MontenegroAún no hay calificaciones
- Un Milagro para LorenzoDocumento5 páginasUn Milagro para LorenzoDiego Vasquez Pando67% (3)
- Semiología Del Aparato Digestivo - Anamnesis - Examen FísicoDocumento34 páginasSemiología Del Aparato Digestivo - Anamnesis - Examen FísicoLA ESQUINA IMPRESIONESAún no hay calificaciones
- DEMANDA DE INTERDICCION - OdtDocumento5 páginasDEMANDA DE INTERDICCION - OdtAlexandra Valverde JuarezAún no hay calificaciones
- Atencion Integral A Los Menores de 5 AñosDocumento8 páginasAtencion Integral A Los Menores de 5 AñoscarolinaAún no hay calificaciones
- Sindrome Nefritico Emilio GarciaDocumento8 páginasSindrome Nefritico Emilio GarciaEmilio GarciaAún no hay calificaciones
- Sistema CirculatorioDocumento7 páginasSistema CirculatorioValeriaAún no hay calificaciones
- Actividad 3 Signos VitalesDocumento9 páginasActividad 3 Signos Vitalesyoharlys garavitoAún no hay calificaciones
- Cuello UterinoDocumento91 páginasCuello UterinoAnaí SiqueiraAún no hay calificaciones
- PTS Prueba HidrostaticaDocumento41 páginasPTS Prueba HidrostaticaAnonymous qnv7vD0enGAún no hay calificaciones
- Presentation Oxitocina y TLPDocumento39 páginasPresentation Oxitocina y TLPClaudia AranedaAún no hay calificaciones
- Anemia AplásicaDocumento10 páginasAnemia AplásicaGIULIANA KARINA ARANA HUAMANAún no hay calificaciones
- Cancer de PulmónDocumento17 páginasCancer de PulmónPatricia Morales SepúlvedaAún no hay calificaciones
- Comunicado Sobre Medidas de Prevención Contra El Contagio Por Covid19-1Documento10 páginasComunicado Sobre Medidas de Prevención Contra El Contagio Por Covid19-1Leila YgbAún no hay calificaciones
- Bimestral BiologiaDocumento2 páginasBimestral Biologiajamh8625Aún no hay calificaciones
- Informe Sistema OsteomuscularDocumento21 páginasInforme Sistema OsteomuscularFelipe Humberto Reyes Olguin100% (1)
- MAT - U4 - 1er Grado - Sesion 12Documento3 páginasMAT - U4 - 1er Grado - Sesion 12NOEMI MARLENE BERROCAL PÉREZAún no hay calificaciones
- Guia 12-2000 de ASHRAE Minimizando El Riesgo de Legionelosis Asociado A Las Instalaciones de Agua Del Edificio PDFDocumento19 páginasGuia 12-2000 de ASHRAE Minimizando El Riesgo de Legionelosis Asociado A Las Instalaciones de Agua Del Edificio PDFJair Cuesta GomezAún no hay calificaciones
- Grandes Vasos RetroPeritoneoDocumento33 páginasGrandes Vasos RetroPeritoneoDavidSumerenteTorresAún no hay calificaciones
- Dengue 2024-2Documento15 páginasDengue 2024-2Florencia CuellarAún no hay calificaciones
- Protocolo de Medios de Contraste para TAC Ambulatorio HRRDocumento14 páginasProtocolo de Medios de Contraste para TAC Ambulatorio HRRJose GuamanAún no hay calificaciones
- Trabajo Práctico, Manipulacion de Alimentos. Juan XXIIIDocumento5 páginasTrabajo Práctico, Manipulacion de Alimentos. Juan XXIIIAlejandra Bertola100% (1)