Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practica 3
Cargado por
Mauricio SaMoDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Practica 3
Cargado por
Mauricio SaMoCopyright:
Formatos disponibles
Universidad autónoma de Nuevo León
Facultad de Ingeniería Mecánica y
Eléctrica
Laboratorio Termodinámica de Gases y Vapores
Practica 3:
Cambio de entropía en un líquido.
M.C. Diana Cobos
Mauricio Sánchez Morales
1889258
Carrera: IMA
Día: Jueves
Hora: M5
Salón: 8300
Ponderación Obtenido
Revisión bibliográfica 20%
Desarrollo de la práctica (observaciones, 30%
cálculos, graficas
Conclusiones 30%
Bibliografía. 10%
Limpieza y claridad en la presentación. 10%
Total 100%
Saturday, 22 de October de 2022
Enunciar los dos postulados de la segunda ley de la termodinámica.
Enunciado de Kelvin-Planck, es imposible que un sistema realice un proceso
cíclico cuyos únicos efectos sean el flujo de calor desde una fuente de calor al
sistema y la realización, por parte del sistema, de una cantidad equivalente de
trabajo.
La segunda ley impide la existencia de una máquina capaz de convertir todo el
calor que absorbe en trabajo durante un proceso cíclico.
Se entiende por fuente de calor (o foco de calor) un cuerpo suficientemente
grande para que el flujo de calor entre él y el sistema no provoque cambio de
temperatura en el foco (el océano, es un buen foco de calor).
Enunciado de Clausius, es imposible que un sistema realice un proceso cíclico
cuyos únicos efectos sean el flujo de calor hacia el sistema desde una fuente
fría y el flujo de una cantidad igual de calor desde el sistema hacia la fuente
caliente
El sistema de Clausius es una máquina frigorífica y para funcionar necesita que
se realice trabajo sobre el sistema.
Definir entropía.
Segunda ley de la termodinámica: en cualquier proceso cíclico, la entropía
aumentará, o permanecerá igual.
Puesto que la entropía da información sobre la evolución en el tiempo de un
sistema aislado, se dice que nos da la dirección de la "flecha del tiempo". Si las
instantáneas de un sistema en dos momentos diferentes, muestran uno que
está más desordenado, entonces se puede deducir que este estado se produjo
más tarde en el tiempo que el otro. En un sistema aislado, el curso natural de
los acontecimientos, lleva al sistema a un mayor desorden (entropía más alta)
de su estado.
Describa el principio de incremento de entropía.
La entropía de un sistema aislado durante un proceso o, en el caso de
procesos reversibles permanece constante.
El cambio de entropía durante un proceso aislado es igual a la suma de
cambios de entropía del sistema y su entorno, lo cual recibe el nombre de
entropía total o generación de entropía Sgen.
El principio del aumento de entropía puede definirse como.
Definir que es un vapor.
El vapor es el estado en el que se encuentra un gas cuando se halla a un nivel
inferior al de su punto crítico; éste hace referencia a aquellas condiciones de
presión y temperatura por encima de las cuales es imposible obtener un líquido
por compresión. Si un gas se encuentra por debajo de ese punto, esto significa
que es susceptible de condensación a través de una reducción de su
temperatura (manteniendo la presión constante) o por vía de la presurización
(con temperatura constante).
Desarrollo de la práctica.
La práctica se realizara en el Software ciclepad para obtener una mejor
resolución de los datos y poder interpretar mucho mejor la tabla
Se usaran los siguientes comandos para la simulación
o Sourse
o Heater
o Sink
Se usaran datos recabados por la maestra en Tiempo y Temperatura en un
proceso Isobárico para obtener los resultados y llenar la tabla.
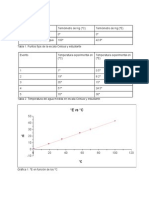
Cálculos y gráfica.
Tiempo Temperatura Presión Fase X Δs
°C °K kPa kJ/Kg K
0 25 298 200 Liquido Sat 0 0.3669
5 50 323 200 Liquido Sat 0 0.7037
10 70 343 200 Liquido Sat 0 0.9548
15 80 353 200 Liquido Sat 0 1.08
20 90 363 200 Liquido Sat 0 1.19
25 99 372 200 Liquido Sat 0 1.26
30 99 372 200 Mezcla 1 1.26
32 99 372 200 Mezcla 5 1.26
34 99 372 200 Mezcla 15 1.26
36 99 372 200 Mezcla 30 1.26
Diagrama T vs. S dibuje el proceso que siguió el agua hasta evaporarse.
T-s
400
350
300
250
200
T °K
150
100
50
0
0.2 0.4 0.6 0.8 1 1.2 1.4
S
Conclusiones.
La práctica fue un poco confusa por la falta de entendimiento de la misma y al
no ver que datos se iban a utilizar realmente ocurrió una confusión al momento
de poder interpretarla. El procedimiento era sencillo sin embargo si la falta de
atención y de comunicación entre maestro y alumnos podría ocasionar errores
durante la práctica.
Bibliografía.
Termodinámica
Yunus Cengel · Mcgraw-Hill
También podría gustarte
- Practica 3 Laboratorio de Termodinamica de Gases y Vapores PDFDocumento7 páginasPractica 3 Laboratorio de Termodinamica de Gases y Vapores PDFMario UrquizoAún no hay calificaciones
- Eficiencia energética en las instalaciones de calefacción y acs en los edificios. ENAC0108De EverandEficiencia energética en las instalaciones de calefacción y acs en los edificios. ENAC0108Aún no hay calificaciones
- Reporte No. 3 Cambio de Entropia en Un LiquidoDocumento7 páginasReporte No. 3 Cambio de Entropia en Un LiquidoChristian CabreraAún no hay calificaciones
- Practica 3 Laboratorio de Termodinamica de Gases y VaporesDocumento7 páginasPractica 3 Laboratorio de Termodinamica de Gases y VaporesDaniel LoeraAún no hay calificaciones
- Componente Practico (Reparado)Documento24 páginasComponente Practico (Reparado)johan sebastian vega cardenasAún no hay calificaciones
- PRACTICA 3 TERMODINAMICA GyVDocumento8 páginasPRACTICA 3 TERMODINAMICA GyVLuz CasillasAún no hay calificaciones
- Laboratorio Virtual #05Documento57 páginasLaboratorio Virtual #05briggit lucero calderon ramosAún no hay calificaciones
- Sexta Práctica Equilibrio y Cinética Propiedades Coligativs ElectrolitosDocumento23 páginasSexta Práctica Equilibrio y Cinética Propiedades Coligativs ElectrolitosSerCL1Aún no hay calificaciones
- Practica Lab 3Documento5 páginasPractica Lab 3Adrián RodríguezAún no hay calificaciones
- Practica 3 TGV PDFDocumento5 páginasPractica 3 TGV PDFdiegoAún no hay calificaciones
- Informe 4 Final FisicoQuimicaDocumento10 páginasInforme 4 Final FisicoQuimicaSebastián GuerreroAún no hay calificaciones
- Practica 1 - Equilibrio de Fases para Sustancias PurasDocumento16 páginasPractica 1 - Equilibrio de Fases para Sustancias PurasGibran RomeroAún no hay calificaciones
- Practica 7 Laboratorio de Termodinamica Calor TrabajoDocumento11 páginasPractica 7 Laboratorio de Termodinamica Calor TrabajoMARÍA PAULA TELLEZ MORENOAún no hay calificaciones
- Newton Ley EnfriamientoDocumento7 páginasNewton Ley EnfriamientoDanielSilvaAún no hay calificaciones
- Determinación de La Constante de Enfriamiento de Un LíquidoDocumento10 páginasDeterminación de La Constante de Enfriamiento de Un LíquidoMario HalleyAún no hay calificaciones
- Laboratorio n07Documento12 páginasLaboratorio n07Adair Weill RuizAún no hay calificaciones
- Prac 13 BRDocumento8 páginasPrac 13 BRBRISA ESTEFANIA HERNANDEZ CARRILLOAún no hay calificaciones
- PRACTICA °2-Primera Ley de La TermodinamicaDocumento10 páginasPRACTICA °2-Primera Ley de La TermodinamicaLOS SAITAMAS 2.0Aún no hay calificaciones
- Informe TermodinámicaDocumento5 páginasInforme TermodinámicaKendall HidalgoAún no hay calificaciones
- Practica 1: Determinación Experimental de La Presión de Vapor de Un Líquido PuroDocumento10 páginasPractica 1: Determinación Experimental de La Presión de Vapor de Un Líquido PuroEloisa InfiniteAún no hay calificaciones
- Calor Absorbido, Dispado y ConveccionDocumento14 páginasCalor Absorbido, Dispado y ConveccionROMER RAFAEL SURCO QUISPEAún no hay calificaciones
- Laboratorio N°7Documento11 páginasLaboratorio N°7Omar ObregónAún no hay calificaciones
- 3er Informe Presión de Vapor de Un Líquido PuroDocumento5 páginas3er Informe Presión de Vapor de Un Líquido PuroAlejandro González33% (3)
- Practica 2 MAQTDocumento7 páginasPractica 2 MAQTOscar HerreraAún no hay calificaciones
- Informe 6 Final FisicoQuimicaDocumento12 páginasInforme 6 Final FisicoQuimicaSebastián GuerreroAún no hay calificaciones
- Ley de EnfriamientoDocumento15 páginasLey de EnfriamientoEfrain Iturri GonzalesAún no hay calificaciones
- Informe N 3 Fisicoquimica TerminadoDocumento20 páginasInforme N 3 Fisicoquimica TerminadoKarnol Ruiz BarbozaAún no hay calificaciones
- Taller 2 TM David ParedesDocumento13 páginasTaller 2 TM David ParedesJhon Luis Muncha100% (1)
- P6 Termodinámica - Equilibrio Mecánico y Balance de EneregíaDocumento10 páginasP6 Termodinámica - Equilibrio Mecánico y Balance de EneregíaDaniela GutiérrezAún no hay calificaciones
- Informe de Tension Superficial FluidosDocumento7 páginasInforme de Tension Superficial FluidosJuan David AcevedoAún no hay calificaciones
- Practica 8Documento7 páginasPractica 8javierAún no hay calificaciones
- R2 FqiiiDocumento21 páginasR2 FqiiiValeria ZarzaAún no hay calificaciones
- Practica 1 Fisica LaboratorioDocumento17 páginasPractica 1 Fisica LaboratorioDIANA LOAYZA PAREDESAún no hay calificaciones
- 1 p1 Control FinalDocumento8 páginas1 p1 Control FinalWILIAN RENE CHURQUI CONDORIAún no hay calificaciones
- Termodinamica InformeDocumento10 páginasTermodinamica InformejomestoyAún no hay calificaciones
- Tp3-Equilibrio Quimico MPJMCDocumento4 páginasTp3-Equilibrio Quimico MPJMCMaría Paula Monsalves CartesAún no hay calificaciones
- REPORTE16 - Equilibrio Liquido-Vapor Del AguaDocumento13 páginasREPORTE16 - Equilibrio Liquido-Vapor Del AguaIreneAún no hay calificaciones
- Post1 Termo2Documento9 páginasPost1 Termo2Valeria AlpucheAún no hay calificaciones
- Informe 2 Sistema CerradoDocumento9 páginasInforme 2 Sistema Cerradofernando4talaveraAún no hay calificaciones
- Universidad Nacional Mayor de San Marcos: Asignatura Laboratorio de FísicaDocumento10 páginasUniversidad Nacional Mayor de San Marcos: Asignatura Laboratorio de FísicaGIANELLA CAROLYN ROMERO RAYMUNDOAún no hay calificaciones
- Termodinámica - Practica 3 - Capacidad CaloríficaDocumento8 páginasTermodinámica - Practica 3 - Capacidad CaloríficaNohelyBadilloAún no hay calificaciones
- Fisica 6Documento19 páginasFisica 6jordiAún no hay calificaciones
- Fisica 2 Informe 8 Calor AbsorbidoDocumento16 páginasFisica 2 Informe 8 Calor AbsorbidoAnyela Eliezer0% (1)
- Practica 3 LTGVDocumento6 páginasPractica 3 LTGVJesus MontantesAún no hay calificaciones
- Practica 7 FisicoquimicaDocumento8 páginasPractica 7 FisicoquimicaDINOAún no hay calificaciones
- 1212 Práctica 7 CASI SUBIRDocumento9 páginas1212 Práctica 7 CASI SUBIRAXEL URIEL VILLEDA CORONAAún no hay calificaciones
- Practica TemperaturaDocumento4 páginasPractica TemperaturaIgnacio GarciaAún no hay calificaciones
- Efecto de La Temperatura en La Estimación de La Difusividad Másica Mediante La Ley de FickDocumento9 páginasEfecto de La Temperatura en La Estimación de La Difusividad Másica Mediante La Ley de Fickadrian3baqueAún no hay calificaciones
- Inf 12 Cinetica de RX de 2do OrdenDocumento7 páginasInf 12 Cinetica de RX de 2do OrdenEvelyn LoretoAún no hay calificaciones
- Practica 7 Equivalencia Calor TrabajoDocumento9 páginasPractica 7 Equivalencia Calor TrabajoJomara GonzálezAún no hay calificaciones
- Practica 3Documento10 páginasPractica 3LOS SAITAMAS 2.0Aún no hay calificaciones
- p10. Coeficiente de Calor en Tubo CircularDocumento8 páginasp10. Coeficiente de Calor en Tubo CircularLuisAntonioDavilaZuñigaAún no hay calificaciones
- Lab 5 Ley de Enfriamiento de NewtonDocumento7 páginasLab 5 Ley de Enfriamiento de NewtonLizeth HigueraAún no hay calificaciones
- Fenomenos 1y2 1Documento20 páginasFenomenos 1y2 1Iván RamosAún no hay calificaciones
- Calor Latente Fusion de AguaDocumento8 páginasCalor Latente Fusion de AguaSaray CubasAún no hay calificaciones
- INFORME FISICA6 Grupo DELTA PDFDocumento13 páginasINFORME FISICA6 Grupo DELTA PDFPaola De la torre orralaAún no hay calificaciones
- Calor Latente Fusion de AguaDocumento9 páginasCalor Latente Fusion de AguaAldair TrejoAún no hay calificaciones
- Reporte Practica 3# CalorimetriaDocumento18 páginasReporte Practica 3# CalorimetriaOmar Hernandez GarciaAún no hay calificaciones
- P2. Efecto de La Temperatura Sobre La Tensión SuperficialDocumento9 páginasP2. Efecto de La Temperatura Sobre La Tensión SuperficialSalma BrambilaAún no hay calificaciones
- Analisis FodaDocumento2 páginasAnalisis FodaMauricio SaMoAún no hay calificaciones
- Practica 2Documento5 páginasPractica 2Mauricio SaMoAún no hay calificaciones
- Estudió de Métodos y MovimientosDocumento3 páginasEstudió de Métodos y MovimientosMauricio SaMoAún no hay calificaciones
- Practica 4Documento5 páginasPractica 4Mauricio SaMoAún no hay calificaciones
- Practica 1Documento4 páginasPractica 1Mauricio SaMoAún no hay calificaciones
- 27INTERCAMBIADORES1FDocumento10 páginas27INTERCAMBIADORES1FSpanishRacingAún no hay calificaciones
- Clase 1 - Educación - Tecnológica 3º Año - Profesor Pablo F. MezaDocumento9 páginasClase 1 - Educación - Tecnológica 3º Año - Profesor Pablo F. MezaPamela DoelloAún no hay calificaciones
- Sílabo de Simulación de SistemasDocumento5 páginasSílabo de Simulación de SistemasPedroInfante123Aún no hay calificaciones
- 1.7 Procesos y CiclosDocumento14 páginas1.7 Procesos y CiclosluiscorpionsAún no hay calificaciones
- La Teoría de Sistema Como Marco de Referencia para El Estudio de La Familia Steven Preister PDFDocumento18 páginasLa Teoría de Sistema Como Marco de Referencia para El Estudio de La Familia Steven Preister PDFPaulina Cotroneo100% (1)
- Tema 70 PDFDocumento15 páginasTema 70 PDFAvelino SantiagoAún no hay calificaciones
- Índice Adiabático de GasesDocumento11 páginasÍndice Adiabático de GasesAngie Aliaga LeroAún no hay calificaciones
- Presentacion ConfiabilidadDocumento14 páginasPresentacion ConfiabilidadRony OmarAún no hay calificaciones
- Guia de Evolución y Clásicos de La AdministraciónDocumento24 páginasGuia de Evolución y Clásicos de La AdministracióninesAún no hay calificaciones
- Apuntes Sobre Sistemas ComplejosDocumento4 páginasApuntes Sobre Sistemas ComplejosCarlos GonzálezAún no hay calificaciones
- Rosin Rammler LabDocumento5 páginasRosin Rammler LabGianela Madyori Zegarra YaringañoAún no hay calificaciones
- Proyecto IntegradorDocumento3 páginasProyecto IntegradorchessedbAún no hay calificaciones
- Sistemas de Control de Modelos AutomotricesDocumento13 páginasSistemas de Control de Modelos Automotricesalex9pAún no hay calificaciones
- Planificación-Enfoque Estructurado Vs Periodización TácticaDocumento11 páginasPlanificación-Enfoque Estructurado Vs Periodización TácticajuankuevaAún no hay calificaciones
- Mapa Conceptual para Identificación y Caracterización de Los Componentes Del Ciclo de Vida Del SoftwareDocumento5 páginasMapa Conceptual para Identificación y Caracterización de Los Componentes Del Ciclo de Vida Del SoftwarehaiverdiaztoroAún no hay calificaciones
- Prueba-Resuelta - SEGUNDA LEYDocumento3 páginasPrueba-Resuelta - SEGUNDA LEYMishell Heredia BenalcázarAún no hay calificaciones
- 2007 TESIS UPC - SISTEMA GESTION DE CALIDAD EN TRANSPORTE LOGISTICO (Alejandro Indacochea)Documento120 páginas2007 TESIS UPC - SISTEMA GESTION DE CALIDAD EN TRANSPORTE LOGISTICO (Alejandro Indacochea)Fredy River Ponce RamirezAún no hay calificaciones
- PTO PGCO COLOMBIANO - El Concepto de Sistema en EducaciónDocumento6 páginasPTO PGCO COLOMBIANO - El Concepto de Sistema en EducaciónJULIO CESAR MURCIA PADILLAAún no hay calificaciones
- Evaluacion 1 TermodinamicaDocumento8 páginasEvaluacion 1 Termodinamicawillinton238967% (3)
- Libro. SOBRE SISTEMAS COMPLEJOS PDFDocumento186 páginasLibro. SOBRE SISTEMAS COMPLEJOS PDFCesar Augusto Cardona Orjuela0% (1)
- TP1 I3 Aire AcondicionadoDocumento87 páginasTP1 I3 Aire AcondicionadoPaola Loayza Alarcón100% (2)
- Práctica de Laboratorio n5Documento7 páginasPráctica de Laboratorio n5Jhoan Aguilar CrisolesAún no hay calificaciones
- CARATULADocumento11 páginasCARATULABrayan Roldan RevueltaAún no hay calificaciones
- Ley de MayerDocumento3 páginasLey de MayerSandra Flores VargasAún no hay calificaciones
- La Piramide de AutomatizacionDocumento6 páginasLa Piramide de AutomatizacionJordano Vivar RomeroAún no hay calificaciones
- Enfoque Sistemico en Las OrganizacionesDocumento4 páginasEnfoque Sistemico en Las OrganizacionesromuloisaiasAún no hay calificaciones
- Evaluacion Sumativa #2Documento14 páginasEvaluacion Sumativa #2Alex Godoy LippiAún no hay calificaciones
- Guia 1-2 Estudio Conceptos Basicos Tqca TERCERO MEDIODocumento4 páginasGuia 1-2 Estudio Conceptos Basicos Tqca TERCERO MEDIOVictor Peña AranedaAún no hay calificaciones
- Taller 3Documento2 páginasTaller 3Nicolás Andrés Vargas CáceresAún no hay calificaciones
- Informe 6 - Sistemas de ControlDocumento6 páginasInforme 6 - Sistemas de ControlRonal HbAún no hay calificaciones
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (203)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Inteligencia artificial: Lo que usted necesita saber sobre el aprendizaje automático, robótica, aprendizaje profundo, Internet de las cosas, redes neuronales, y nuestro futuroDe EverandInteligencia artificial: Lo que usted necesita saber sobre el aprendizaje automático, robótica, aprendizaje profundo, Internet de las cosas, redes neuronales, y nuestro futuroCalificación: 4 de 5 estrellas4/5 (1)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- El concepto Mulligan de terapia manual (Color)De EverandEl concepto Mulligan de terapia manual (Color)Calificación: 5 de 5 estrellas5/5 (3)
- Ondas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasDe EverandOndas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasCalificación: 5 de 5 estrellas5/5 (3)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- UF0054: APROVISIONAMIENTO DE MATERIAS PRIMAS EN COCINA (HOTR0108)De EverandUF0054: APROVISIONAMIENTO DE MATERIAS PRIMAS EN COCINA (HOTR0108)Aún no hay calificaciones
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Anatomía del caballo: Guía práctica ilustradaDe EverandAnatomía del caballo: Guía práctica ilustradaCalificación: 4 de 5 estrellas4/5 (9)
- La medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónDe EverandLa medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónCalificación: 3.5 de 5 estrellas3.5/5 (2)
- Sesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesDe EverandSesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesCalificación: 4.5 de 5 estrellas4.5/5 (13)
- Neurociencia para vencer la depresión: La esprial ascendenteDe EverandNeurociencia para vencer la depresión: La esprial ascendenteCalificación: 4.5 de 5 estrellas4.5/5 (10)
- Toma de decisiones en las empresas: Entre el arte y la técnica: Metodologías, modelos y herramientasDe EverandToma de decisiones en las empresas: Entre el arte y la técnica: Metodologías, modelos y herramientasAún no hay calificaciones
- El psoas: Músculo vital (Color)De EverandEl psoas: Músculo vital (Color)Calificación: 3.5 de 5 estrellas3.5/5 (9)
- Cuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresDe EverandCuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresCalificación: 5 de 5 estrellas5/5 (2)
- Las Enfermedades comienzan y terminan en tu mente: Una guía para la autosanaciónDe EverandLas Enfermedades comienzan y terminan en tu mente: Una guía para la autosanaciónCalificación: 4 de 5 estrellas4/5 (4)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Probabilidad y estadística: un enfoque teórico-prácticoDe EverandProbabilidad y estadística: un enfoque teórico-prácticoCalificación: 4 de 5 estrellas4/5 (40)