Documentos de Académico
Documentos de Profesional
Documentos de Cultura
FQ II Clase 13,2 Enzimatica
Cargado por
ANGYE ISABEL MONGE AVILESDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
FQ II Clase 13,2 Enzimatica
Cargado por
ANGYE ISABEL MONGE AVILESCopyright:
Formatos disponibles
Semana 13,2
CATÁLISIS ENZIMÁTICA
Las enzimas son moléculas de proteínas, que catalizan a la mayoría de las reacciones
químicas que ocurren en los seres vivos. La característica más importante de la catálisis
enzimática es la especificidad de la enzima con respecto a una reacción particular. Por
ejemplo, la ureasa cataliza la hidrólisis de la urea y de ninguna otra reacción.
(NH2)2 CO + H2O CO2 + 2NH3
Ureasa
Por otro lado, la concentración de la enzima en el sistema reactante es muy baja (10-9 moles)
y la velocidad de la reacción se incrementa de 106 a 1018 veces. Una enzima posee uno o más
centros activos, donde se realiza las reacciones con los sustratos. Un centro activo puede
abarcar sólo unos pocos residuos de aminoácido, mientras que el resto de la proteína sirve
para mantener la estructura tridimensional de la red. Muchas enzimas tienen especificidad
estereoquímica, ya que catalizan las reacciones de una configuración, pero no de otra. Por
ejemplo, las enzimas proteolíticas catalizan sólo la hidrólisis de los péptidos formados por
L-aminoácidos. Las enzimas son moléculas muy sensibles a las variaciones del pH de la
solución, en función del pH pueden presentar las siguientes estructuras:
a) Estructura desenrollada, en este caso no presentan propiedades catalíticas porque los
centros activos están muy separados
b) Estructura enrollada. Cuando la molécula esta enrollada, los centros catalíticos están
juntos, la enzima presenta propiedades catalíticas.
De acuerdo a la Unión Bioquímica Internacional las enzimas se clasifican de acuerdo al tipo
de reacción que catalizan.
- Óxido reductasas. Enzimas que catalizan las reacciones de óxido – reducción, o sea,
transferencia de electrones o de átomos de hidrógeno de un sustrato a otro. Por ejemplo
la enzima deshidrogenasa.
- Transferasas. Catalizan la transferencia de un grupo químico específico diferente del
hidrógeno, de un sustrato a otro.
- Liasas. Catalizan las reacciones en las que grupos se unen a los enlaces doble, o también
desprendimiento de grupos que dan origen al enlace doble.
- Hidrolasas. Catalizan las reacciones de hidrólisis.
- Isomerasas. Hacen variar la estructura geométrica de una molécula.
- Ligasas. Catalizan la unión de sustratos mediante la hidrólisis simultánea de nucleótidos
de trifosfatos análogos, tales como el ATP (adenosina trifosfato) o el GTP (guanosin
trifosfato)
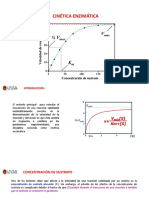
Velocidad inicial con respecto al tiempo
En la cinética enzimática se acostumbra medir la velocidad inicial W0 de una reacción
para minimizar las reacciones reversibles y la inhibición de las enzimas por los
productos. Además, la velocidad inicial corresponde a una concentración fija y conocida del
sustrato. Al avanzar el tiempo, la concentración del sustrato siempre disminuye. La gráfica
de la velocidad inicial W0 en función de la concentración inicial del sustrato S 0 se muestra
en la figura adjunta.
W0
Saturación centros activos ocupados
Wlim.
Wlim./ 2
Km S0
Figura 1. Velocidad inicial W0 versus concentración inicial [S]0
Deducción de la Ecuación de Michaelis-Menten
Para explicar la dependencia entre la velocidad inicial y la concentración inicial del sustrato,
el bioquímico alemán Leonor Michaelis y el bioquímico canadiense Maud Leonora Menten,
en 1913, propusieron el siguiente mecanismo
K1
E+S ES (rápido)
K2
K3
ES E+P (lenta)
Donde ES representa el complejo enzima-sustrato, E es la enzima y S es el sustrato. De
acuerdo al mecanismo propuesto la velocidad de la reacción se define por la etapa lenta, o
sea la descomposición del complejo enzima substrato [ES]
d ES
W= = K3 ES (13,1)
dt
Utilizando el método de las concentraciones estacionarias de Bodenstein para el compuesto
intermedio enzima-sustrato, se tiene
d ES
= K1 S E - K2 ES - K3 ES = 0 (13,2)
dt
La concentración inicial de la enzima será igual a la concentración E en el tiempo t de la
reacción más la concentración ES, es decir
E0 = E + ES (13,3)
De esta ecuación para la concentración de la enzima E en el tiempo t de la reacción se tiene
E = E0 - ES (13,4)
Sustituyendo esta expresión en (13,2), se obtiene:
K1 S (E0 - ES) – K2 ES - K3 ES = 0
K1 S E0 – K1 S ES - K2 ES - K3 ES = 0 (13,5)
Despejando de esta ecuación la concentración del complejo enzima-sustrato ES, se obtiene:
K 1 S E 0
ES = (13,6)
K 2 K 3 K 1 S
Sustituyendo esta ecuación en (13,1), para la velocidad de la reacción, se obtiene:
K1 K 3 E 0 S
W (13,7)
K 2 K 3 K1 S
Esta es la ecuación de Michaelis. Si se divide el numerador y el denominador de esta ecuación
por la constante de velocidad K1, se obtiene:
K 3 E 0 S
W (13,8)
K2 K3
S
K1
Introduciendo la constante K m ( K 2 K 3 ) K1 en la ecuación (13,8) se obtiene
K 3 E 0 S
W= (13,9)
K m S
Donde Km es la constante de Michaelis. Del análisis de esta ecuación se puede deducir los
siguientes casos particulares.
a) Si la concentración del sustrato es menor que la constante de Michaelis, S < Km, se
obtiene:
W
K3
E 0 S (13,10)
Km
De esta ecuación se deduce que velocidad del proceso catalítico depende linealmente de la
concentración del sustrato. La reacción es de primer orden con respecto a la concentración
del substrato y a la concentración del catalizador.
b) Si la concentración del sustrato es mayor que la concentración del catalizador, S >> Km,
se obtiene:
Wlim K 3 E 0 (13,11)
Entonces la velocidad de la reacción es de orden cero con respecto al substrato y de
primer orden con respecto al catalizador.
La velocidad de las diferentes reacciones enzimáticas se pueden comparar cuando se alcanza
una concentración saturada del sustrato, es decir, cuando la velocidad de la reacción deja de
ser función de la concentración, o sea cuando S >> Km. Despejando K3 de la ecuación
(13,11) se tiene
Wlim
K3 (13,12)
E 0
La constante K3 recibe la denominación de “número de retorno” o “número de
vueltas”. Esta constante determina el número de moléculas del substrato transformadas en
un centro activo del catalizador.
Ecuación de Michaelis para la velocidad inicial W0
Si consideramos que la concentración del sustrato en la ecuación (13,9) es igual a la
concentración inicial, S = S0, se tiene:
K 3 E 0 S 0
W0
K m S 0
Dividiendo el numerador y denominador de esta igualdad por S 0 , se obtiene:
K 3 E 0
W0 (13,13)
Km
1
S 0
Introduciendo la velocidad límite en el numerador Wlim K 3 E 0 , se tiene:
Wlim
W0 (13,14)
Km
1
S 0
En esta ecuación, cuando S0 = Km se obtiene el siguiente caso particular
K 3 E 0 W
W0 = lim (13,15)
2 2
De esta ecuación se deduce que cuando la constante de Michaelis, Km, es igual a la
concentración inicial del sustrato, la velocidad inicial es igual a la mitad de la velocidad
límite, lo cual concuerda con los datos experimentales (ver la gráfica de W0 versus [S]0).
Forma lineal de la ecuación de michaelis
Para obtener la forma lineal de la ecuación (13,14) es necesario invertir la ecuación, es decir.
1 K S 0 1 1 1 K 1
m m . (13,16)
W0 Wlim W0 Wlim Wlim S 0
Esta es la ecuación de Linewer-Bark, la gráfica de esta se muestra en la figura adjunta.
1/W0
tg =
Wlim
-1/Km
1/S0
Figura 2. Gráfica de la ecuación lineal de Michaelis - Menten
Del intercepto con el eje de la abscisa 1/W0 = 0, se tiene:
1 1 K 1 1 1
0 m (13,17)
W0 Wlim Wlim S 0 K m S 0
Ejemplo 1. La hidratación de CO2 catalizada por la enzima carbónico-anhidrasa ocurre de acuerdo
a la reacción:
CO2 + H2O HCO 3 + H+
El bicarbonato es transportado por el flujo sanguíneo y se vuelve a convertir en CO2 en los pulmones,
catalizada por la misma enzima. Para la concentración inicial de la enzima [E]0=2,3x10-9 M a la
temperatura de 0,5 0C se han obtenido los siguientes datos experimentales:
W0 x10 5 (mol / s) 2.78 5.00 8.33 16.7
CO2 0 x103 mM 1.25 2.5 5.0 20.0
Utilizando la ecuación de Lineweaver- Burk, calcular Wlim y Km.
1 1 K 1
Solución: m y a bx
W0 Wlim Wlim S 0
1
800 400 200 50
S 0
1
35871,22 20000 12004.8 5988.02
W0
a 4027.07 b 39.83 r 0.999
1
4027.07 Wlim 2.48 x10 4 mol / s
Wlim
Km
Wlim
39.83 K m 39.83 2.48 x10 4 98.79 x10 4 s 1
También podría gustarte
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaDe EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaAún no hay calificaciones
- Ecuacion Michaelis y MentenDocumento7 páginasEcuacion Michaelis y MentenClase MicroAún no hay calificaciones
- Reacciones Redox 2da ParteDocumento35 páginasReacciones Redox 2da ParteANA LAURA0% (1)
- Sistema de Conversión de Energía Integrado VENTUSDocumento8 páginasSistema de Conversión de Energía Integrado VENTUSAlvaro Car MarAún no hay calificaciones
- Ejercicios de Integrales y Ecuaciones Integrales-DiferencialesDe EverandEjercicios de Integrales y Ecuaciones Integrales-DiferencialesAún no hay calificaciones
- Ecuación de Michaelis MentenDocumento3 páginasEcuación de Michaelis MentenLourdes Sánchez100% (1)
- HhhuhuDocumento33 páginasHhhuhudaby78Aún no hay calificaciones
- p11 Respuesta Natural RCDocumento29 páginasp11 Respuesta Natural RCmoises crisostomoAún no hay calificaciones
- Ecuación de NernstDocumento17 páginasEcuación de NernstPedro AlvarezAún no hay calificaciones
- Cinética EnzimáticaDocumento11 páginasCinética EnzimáticaVirginia Elena Jimenez JimenezAún no hay calificaciones
- BiofísicaDocumento33 páginasBiofísicaKlaus KöhlerAún no hay calificaciones
- Cinetica EnzimatticaalfinDocumento12 páginasCinetica EnzimatticaalfinIker MendezAún no hay calificaciones
- Presentación 18V4Documento36 páginasPresentación 18V4Juliana Guevara100% (2)
- Pila DaniellDocumento5 páginasPila DaniellmarzinusAún no hay calificaciones
- Modelo Cinético de MichaelisDocumento7 páginasModelo Cinético de MichaelisEdward Jorge Matias AtenciaAún no hay calificaciones
- Electrolitos Debiles12Documento4 páginasElectrolitos Debiles12miguelAún no hay calificaciones
- CinéticaDocumento9 páginasCinéticaFabiola Pacheco CamargoAún no hay calificaciones
- Informe FielDocumento3 páginasInforme Fielcarolina3gutierrez3bAún no hay calificaciones
- Cinética de Michalis-Menten y de Briggs-Haldane para La Glucosa IsomerasaDocumento4 páginasCinética de Michalis-Menten y de Briggs-Haldane para La Glucosa IsomerasaMokr Guerrero EsperanzaAún no hay calificaciones
- Volumetría Redox IDocumento29 páginasVolumetría Redox ISol PolitanoAún no hay calificaciones
- ElectroquimicaDocumento12 páginasElectroquimicaMario FlorencioAún no hay calificaciones
- Cin Mol05Documento42 páginasCin Mol05ちゅちゃAún no hay calificaciones
- Cinetica de Las ReaccionesDocumento11 páginasCinetica de Las ReaccionesSharon FonsecaAún no hay calificaciones
- Fem y ElectrolisisDocumento8 páginasFem y ElectrolisisMailyn CentonAún no hay calificaciones
- Taller Propiedades de Mezcla de GasesDocumento2 páginasTaller Propiedades de Mezcla de GasesSebastian CastroAún no hay calificaciones
- Conceptos Básicos de Cinética QuímicaDocumento8 páginasConceptos Básicos de Cinética QuímicaNicole Del Solar LagosAún no hay calificaciones
- Practica L9 - Determinación de Coeficientes de Distribución.Documento22 páginasPractica L9 - Determinación de Coeficientes de Distribución.Diego_Segoviano19Aún no hay calificaciones
- Presentacion 6 Cinetica EnzimaticaDocumento46 páginasPresentacion 6 Cinetica EnzimaticaE Clinton LMAún no hay calificaciones
- Serie 3 Cinetica Quimica2021-2Documento6 páginasSerie 3 Cinetica Quimica2021-2Josue Hernandez MrkzAún no hay calificaciones
- Lab 08Documento7 páginasLab 08ttavvoAún no hay calificaciones
- LCAE2PG19T15Documento16 páginasLCAE2PG19T15Ronal ChAún no hay calificaciones
- Ecuacion de Born-Lande 19748Documento6 páginasEcuacion de Born-Lande 19748Gustavo PorrasAún no hay calificaciones
- KPS AgClDocumento6 páginasKPS AgClmarzinusAún no hay calificaciones
- POTENCIOMETRIADocumento8 páginasPOTENCIOMETRIAKevinAltamirano100% (1)
- Cinética de Reacciones Enzimáticas HeterogéneasDocumento12 páginasCinética de Reacciones Enzimáticas HeterogéneasSebastian Alexy Navarro JuarezAún no hay calificaciones
- Celdas Galvanicas PDFDocumento9 páginasCeldas Galvanicas PDFBaci CarezzeAún no hay calificaciones
- Cinetica QuimicaDocumento16 páginasCinetica QuimicaISRAEL M CONDORIAún no hay calificaciones
- Unidad 2: Aplicaciones de Los Potenciales Estandar de ElectrodoDocumento92 páginasUnidad 2: Aplicaciones de Los Potenciales Estandar de ElectrodoSanchez LeilaAún no hay calificaciones
- Ecuación de NernstDocumento4 páginasEcuación de NernstAnonymous 1OpwaoCv6NAún no hay calificaciones
- Cinetica de La Inversion de La SacarosaDocumento2 páginasCinetica de La Inversion de La Sacarosa.:("*"BLacK BuLLeT"*"):.50% (4)
- Electroquímica. Cap 16Documento17 páginasElectroquímica. Cap 16Rebeca CorderoAún no hay calificaciones
- Modelo de Van Der WaalsDocumento7 páginasModelo de Van Der WaalsDavid Franklin Mamani RamosAún no hay calificaciones
- Celdas Galvanicas y ElectroliticasDocumento6 páginasCeldas Galvanicas y ElectroliticasFely M LiendoAún no hay calificaciones
- MECÁNICA ESTADÍSTICA 2020 Clase 6Documento19 páginasMECÁNICA ESTADÍSTICA 2020 Clase 6Gonzalo de SouzaAún no hay calificaciones
- Unidad 3 Circuito RL, RC y RLCDocumento27 páginasUnidad 3 Circuito RL, RC y RLCciber023Aún no hay calificaciones
- Ecuaciones Diferenciales Aplicados A La CarreraDocumento22 páginasEcuaciones Diferenciales Aplicados A La Carrerayamely portaAún no hay calificaciones
- Guia 7Documento9 páginasGuia 7Paula Andrea Martínez ZamoraAún no hay calificaciones
- Marco TeoricoDocumento12 páginasMarco TeoricoDIEGO ALEJANDRO FIGUEROA VILLALOBOSAún no hay calificaciones
- Cuestionario Métodos CuantitativosDocumento12 páginasCuestionario Métodos CuantitativoskarlaAún no hay calificaciones
- Parcial InvestigaciónDocumento8 páginasParcial InvestigaciónLina MonteroAún no hay calificaciones
- La Teroria de Las Velocidades AbsolutasDocumento7 páginasLa Teroria de Las Velocidades AbsolutasIsai Keoma Chirinos DiazAún no hay calificaciones
- Laboratorio 6.fisicoquímica...Documento7 páginasLaboratorio 6.fisicoquímica...Emma Espejo SantosAún no hay calificaciones
- Valor Inicial y FinalDocumento9 páginasValor Inicial y FinalJessy BelénAún no hay calificaciones
- Determinación de La Constante de Equilibrio Del Ácido Acético Mediante Medidas de ConductividadDocumento6 páginasDeterminación de La Constante de Equilibrio Del Ácido Acético Mediante Medidas de ConductividadGerardo León CastilloAún no hay calificaciones
- Columnas ExcéntricasDocumento23 páginasColumnas ExcéntricasCarlos Enrique Cruzado VasquezAún no hay calificaciones
- Ecuación de NernstDocumento6 páginasEcuación de NernstMelanie Elena RodasAún no hay calificaciones
- Apuntesparte5 10178Documento38 páginasApuntesparte5 10178Josimar Pasquel100% (1)
- FQ II Clase 15,2 SMDocumento16 páginasFQ II Clase 15,2 SMANGYE ISABEL MONGE AVILESAún no hay calificaciones
- FQ II Clase 15,1 QCDocumento11 páginasFQ II Clase 15,1 QCANGYE ISABEL MONGE AVILESAún no hay calificaciones
- FQ II Clase 14,2 B QC 22Documento13 páginasFQ II Clase 14,2 B QC 22ANGYE ISABEL MONGE AVILESAún no hay calificaciones
- Espectro G4Documento13 páginasEspectro G4ANGYE ISABEL MONGE AVILESAún no hay calificaciones
- FQ-II-Clase 14,1QCDocumento19 páginasFQ-II-Clase 14,1QCANGYE ISABEL MONGE AVILES100% (1)
- Lab 5 - Práctica 5 Separación e Identificación de BiomoleculasDocumento8 páginasLab 5 - Práctica 5 Separación e Identificación de BiomoleculasANGYE ISABEL MONGE AVILESAún no hay calificaciones
- Proteinas G4Documento8 páginasProteinas G4ANGYE ISABEL MONGE AVILESAún no hay calificaciones
- Clase 8Documento51 páginasClase 8ANGYE ISABEL MONGE AVILESAún no hay calificaciones
- Informe 4 - Precipitación de Proteínas 2021Documento11 páginasInforme 4 - Precipitación de Proteínas 2021ANGYE ISABEL MONGE AVILESAún no hay calificaciones
- Electroforesis de ProteínasDocumento8 páginasElectroforesis de ProteínasANGYE ISABEL MONGE AVILESAún no hay calificaciones
- Clase 12 FQ CinéticaDocumento18 páginasClase 12 FQ CinéticaANGYE ISABEL MONGE AVILESAún no hay calificaciones
- Tema 11 - Interración Magnética 2Documento20 páginasTema 11 - Interración Magnética 2ANGYE ISABEL MONGE AVILESAún no hay calificaciones
- Triptico Clase3 Ismael MadrilDocumento2 páginasTriptico Clase3 Ismael Madrilismael madridAún no hay calificaciones
- No. 8 MicroDocumento8 páginasNo. 8 MicroMerryAún no hay calificaciones
- Manual Usuario Milwaukee PH55-56 Phmetro de BolsilloDocumento2 páginasManual Usuario Milwaukee PH55-56 Phmetro de Bolsillocarlos pablo pableteAún no hay calificaciones
- Predicción de La DifusividadDocumento4 páginasPredicción de La DifusividadRocio Riquelme RosasAún no hay calificaciones
- 253 IQS Spinetoram DOWDocumento2 páginas253 IQS Spinetoram DOWRicardo Manuel Ventura Tito AstoAún no hay calificaciones
- Papel de Los Fluidos en La Formación de Yacimientos MineralesDocumento4 páginasPapel de Los Fluidos en La Formación de Yacimientos Mineralescaleb guevaraAún no hay calificaciones
- Ensayo DefinitivoDocumento4 páginasEnsayo DefinitivoAnnel PerezAún no hay calificaciones
- Eett Alcantarillado Sanitario 1438270809566Documento59 páginasEett Alcantarillado Sanitario 1438270809566Roowsber Pompa CalderonAún no hay calificaciones
- Adhesivos en EsDocumento17 páginasAdhesivos en EsMauro ZabaletaAún no hay calificaciones
- Deterioro Del HormigónDocumento5 páginasDeterioro Del HormigónErick Aguilar MedinaAún no hay calificaciones
- Análisis FlamometriaDocumento2 páginasAnálisis Flamometriasaul saavedraAún no hay calificaciones
- MasterbachtsDocumento8 páginasMasterbachtsELIANA GABRIELA ALVAREZ ZUÑIGAAún no hay calificaciones
- Documento InformeDocumento21 páginasDocumento InformeDaniel CarlosAún no hay calificaciones
- Análisis de Textura de Suelos Ubicados en Tres Zonas Diferentes de La Universidad de PamplonaDocumento9 páginasAnálisis de Textura de Suelos Ubicados en Tres Zonas Diferentes de La Universidad de Pamplonaerika_torres089336Aún no hay calificaciones
- Manual de Mantenimiento Business Class M2Documento152 páginasManual de Mantenimiento Business Class M2edgardo100% (2)
- Ensayo Motor 2 TiemposDocumento4 páginasEnsayo Motor 2 TiemposCarlos BuenAún no hay calificaciones
- Pavimentos de Alto ModuloDocumento27 páginasPavimentos de Alto ModuloNohemi Santacruz TzantecomaniAún no hay calificaciones
- AluminosisDocumento17 páginasAluminosisJan Douglas García Contreras100% (1)
- Guía de Laboratorio Química GeneralDocumento58 páginasGuía de Laboratorio Química GeneralDavid Alejandro Garcia MingaAún no hay calificaciones
- Manual de Biol MX 2016Documento16 páginasManual de Biol MX 2016Mtro. Darki Nube GarciaAún no hay calificaciones
- Matesexto PDFDocumento4 páginasMatesexto PDFGraciela Ortiz GonzalezAún no hay calificaciones
- Cable 3.31Documento1 páginaCable 3.31Omar FonsecaAún no hay calificaciones
- Hivmedicine2003 Spanish2b PDFDocumento255 páginasHivmedicine2003 Spanish2b PDFRonald MirallesAún no hay calificaciones
- Practica CalcinacionDocumento11 páginasPractica CalcinacionAlex Paul MuñozAún no hay calificaciones
- Linx 4900 Impresora PDFDocumento16 páginasLinx 4900 Impresora PDFElputo Facebuc De Oscar100% (1)
- Métodos Básicos para El Estudio de La Sensibilidad A Los AntimicrobianosDocumento58 páginasMétodos Básicos para El Estudio de La Sensibilidad A Los AntimicrobianosDaniel Pacheco RojasAún no hay calificaciones
- Detracciones ParancelariaDocumento63 páginasDetracciones ParancelariacaizquierdoAún no hay calificaciones
- Aafh Manual de Farmacovigilancia Hospitalaria Version FinalDocumento307 páginasAafh Manual de Farmacovigilancia Hospitalaria Version FinalEtchegoyenAún no hay calificaciones
- EdafologíaDocumento35 páginasEdafologíaapi-3702178100% (9)
- Mantenimiento de Sistemas HidraulicosDocumento13 páginasMantenimiento de Sistemas HidraulicosVictor Gaytan RuizAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (203)
- Liberación del trauma: Perdón y temblor es el caminoDe EverandLiberación del trauma: Perdón y temblor es el caminoCalificación: 4 de 5 estrellas4/5 (4)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Ondas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasDe EverandOndas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasCalificación: 5 de 5 estrellas5/5 (3)
- Había una vez el átomo: O cómo los científicos imaginan lo invisibleDe EverandHabía una vez el átomo: O cómo los científicos imaginan lo invisibleCalificación: 5 de 5 estrellas5/5 (3)
- Cerebro y silencio: Las claves de la creatividad y la serenidadDe EverandCerebro y silencio: Las claves de la creatividad y la serenidadCalificación: 5 de 5 estrellas5/5 (2)
- Guía práctica para la refracción ocularDe EverandGuía práctica para la refracción ocularCalificación: 5 de 5 estrellas5/5 (2)
- El psoas: Músculo vital (Color)De EverandEl psoas: Músculo vital (Color)Calificación: 3.5 de 5 estrellas3.5/5 (9)
- Cerebros rotos: Pacientes asombrosos que me enseñaron a vivirDe EverandCerebros rotos: Pacientes asombrosos que me enseñaron a vivirCalificación: 5 de 5 estrellas5/5 (3)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Guía para la aplicación de ISO 9001 2015De EverandGuía para la aplicación de ISO 9001 2015Calificación: 4 de 5 estrellas4/5 (1)
- CLEAN 7 \ El Método Clean 7 (Spanish edition): Detoxifica y rejuvenece tu cuerpo en tan sólo siete díasDe EverandCLEAN 7 \ El Método Clean 7 (Spanish edition): Detoxifica y rejuvenece tu cuerpo en tan sólo siete díasCalificación: 5 de 5 estrellas5/5 (1)
- Sesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesDe EverandSesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesCalificación: 4.5 de 5 estrellas4.5/5 (13)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- SNC - Soporte neurocrítico: De la urgencia a la terapia intensivaDe EverandSNC - Soporte neurocrítico: De la urgencia a la terapia intensivaAún no hay calificaciones
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- Historia del cuerpo humano: Evolución, salud y enfermedadDe EverandHistoria del cuerpo humano: Evolución, salud y enfermedadAún no hay calificaciones