Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Quimica Ipn
Cargado por
Los IncomprendidosDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Quimica Ipn
Cargado por
Los IncomprendidosCopyright:
Formatos disponibles
Quimica
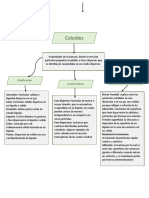
Cantidad de masa que tiene algún Son las que podemos apreciar mediante alguno
cuerpo de los 5 sentidos, son la textura, la dureza, combinación de 2 o más sustancias,
color, aroma, etc. estás no poseen una estructura
química definida y al no estar unidas
químicamente es posible separarla
Espacio que ocupa un cuerpo por métodos físicos.
Son las que dependen de la cantidad de
materia: Masa y volumen.
Porción de materia que tiene un
determinado volumen. Estas no dependen de la cantidad de materia: Su composición es uniforme y no se
Densidad, temperatura de fusión y ebullición, ve con claridad sus componentes.
viscosidad, etc.
Forma de materia que tiene
composición definida constante y Combinación de 2 elementos, estos tienen una
cuenta con propiedades distintivas. composición química que permiten reconocerla.
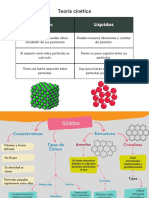
Destilación: se usa en mezclas
líquido-líquido (evaporación), ejemplo:
Sustancia pura que no puede descomponerse agua y alcohol
Masa que posee un cuerpo junto con en otra más simple (los de la tabla periódica)
un volumen. Decantación: para mezclas líquido-
líquido (con diferentes densidades) y
Unidad mínima de una sustancia, formada por solido-líquido (el sólido es insoluble).
atamos iguales o diferentes, ejemplo la
Cantidad de materia que hay dentro molécula de agua: Cristalización: mezclas sólido-líquido,
de un volumen. H2O donde el sólido debe ser soluble y el
líquido cristalizable.
Son las que permiten reconocer y diferenciar a Tamizado: sólido-sólido, con
la sustancia de otras. diferentes tamaños, es como si
Es la resistencia que tiene un líquido pusiéramos un colador.
a fluir.
Aquellas que identifican a la sustancia sin
alterar su composición.
Cuando un sólido pasa a líquido.
Ductilidad
Maleabilidad
Cuando el líquido pasa a estado Color
gaseoso. Viscosidad
Son las que se manifiestan al alterar su
Solubilidad
estructura interna o molecular cuando
Índice de refracción
interactúan con otras sustancias o elementos.
Capacidad de una sustancia para
disolverse en otra
Cantidad de soluto en una disolución.
Entre metales M: metal
No alteran su composición interna. nM: no metal
Estado de agregación H: hidrógeno
Dilatación: aumento de O: Oxígeno
tamaño Entre elementos no metálicos
Fragmentación: romperse
Rotación o movimiento
M+Nm
Los electrones se comparten de
forma no equitativa entre átomos.
Estos alteran su composición
interna. M1+M2+nM+O
Combustión
Oxidación: perdida de Se forman entre 2 átomos del
electrones mismo elemento.
Corrosión deterioro del M+(OH)+nM
metal M+(OH)+nM+O
Crean polos, son dipolo-dipolo, es
Cuando se forman o rompes decir un polo negativo y uno
nuevos enlaces entre átomo. positivo. M+H+nM
M+H+Nm+O
Reacción química que se produce Dipolo inducido-dipolo
por absorción de calor. instantáneo, son apolares, es
M+nM+O
decir no crean polos negativos ni
Reacción exotérmica positivos.
Reacción química que libera calor.
M+H
Fuerza entre moléculas.
Elemento que participa en la
reacción química
Fuerza dentro de las moléculas. M+H+O
nM+H+O
Reacción que se produce al unir Oxidación: perdida de electrones y
los reactivos. su número de oxidación aumenta. H+nM
Reducción: ganancia de
electrones y disminuye su número
Es el que mantiene unida a las de oxidación.
moléculas y crean conexiones Nm+H+O
Agente reductor: el elemento que
pierde electrones, es decir el que
se oxida.
Formado por iones con cargas Agente oxidante: gana electrones
negativas, catión-ion positivo, y su número de oxidación
anión-ion negativo. disminuye
Met:1
Et:2
Función+Prefijo del elemento+terminación
Prop:3
Ejemplo: óxido férrico, acido hipocloroso, etc.
But:4
Pent:5
Función+prefijo de cantidad+elemento Para las ramificaciones o radicales
Ejemplo: Monoxido de dihierro, heptaoxocromato
Funcion+elemento+ número de oxidación
Ejemplo: óxido de hierro (II)
Mono:1
Di:2
Tri:3
Tetra:4
Penta:5
Hexa:6
Hepta:7
Octa:8
Nona:9
Deca:10
También podría gustarte
- II-Unidad-Interrelación de La Materia y EnergíaDocumento34 páginasII-Unidad-Interrelación de La Materia y EnergíaNayeli Abigail PerdomoAún no hay calificaciones
- II-Unidad-Interrelación de La Materia y EnergíaDocumento27 páginasII-Unidad-Interrelación de La Materia y EnergíaLiliana ParsonAún no hay calificaciones
- Guìa de Trabajo Química Grado Decimo y OnceDocumento5 páginasGuìa de Trabajo Química Grado Decimo y Oncecamila rodriguez100% (1)
- Unidad I - Quimica GeneralDocumento9 páginasUnidad I - Quimica GeneralMilagros LeonAún no hay calificaciones
- Presentación Clase de Ciencias Naturales y Química de Primaria Educativo Violeta y NaranjaDocumento31 páginasPresentación Clase de Ciencias Naturales y Química de Primaria Educativo Violeta y NaranjaJosee MaayaAún no hay calificaciones
- Química1 EMIM2021Documento24 páginasQuímica1 EMIM2021Ian PerezAún no hay calificaciones
- Cuaderno de Trabajo de Química-Preparación IDocumento29 páginasCuaderno de Trabajo de Química-Preparación Ijhoselyn zuñigaAún no hay calificaciones
- Quimica Cantidades QuimicasDocumento4 páginasQuimica Cantidades QuimicasBelen MonicoAún no hay calificaciones
- El Estudio Del Cambio.Documento18 páginasEl Estudio Del Cambio.Caleb HernándezAún no hay calificaciones
- Cap. 2 - Propiedades MateriaDocumento10 páginasCap. 2 - Propiedades MateriaNELLY NICOLE PELAEZ RODRIGUEZAún no hay calificaciones
- Propiedades de La Materia - Mapa ConceptualDocumento1 páginaPropiedades de La Materia - Mapa ConceptualMeneses Andres73% (11)
- Tarea 3Documento3 páginasTarea 3Memin PinguinAún no hay calificaciones
- Tecnologico Nacional de México Instituto Tecnologico de TlalnepantlaDocumento25 páginasTecnologico Nacional de México Instituto Tecnologico de TlalnepantlaDaniel LazcanoAún no hay calificaciones
- Materiayme 1676143351Documento3 páginasMateriayme 1676143351scarAún no hay calificaciones
- Guia Propiedades de La Materia Grado Septimo Iete 2016Documento2 páginasGuia Propiedades de La Materia Grado Septimo Iete 2016Diana Carolina Burbano Ruano100% (1)
- Propiedades de La MateriaDocumento4 páginasPropiedades de La MateriaMARCO ELOHIM RODRIGUEZ CONTLAAún no hay calificaciones
- Actividad 2 de QuímicaDocumento2 páginasActividad 2 de QuímicaPao Morales MartínezAún no hay calificaciones
- Guia de Aprendizale Ciclo 5. QuimicaDocumento6 páginasGuia de Aprendizale Ciclo 5. Quimicayirly peñalozaAún no hay calificaciones
- Tipos de Soluciones 1Documento6 páginasTipos de Soluciones 1luisAún no hay calificaciones
- Esquema Tema 3 F y QDocumento4 páginasEsquema Tema 3 F y QCristinaAún no hay calificaciones
- Qui MicaDocumento20 páginasQui MicaRangel Aldape Daniel GiovanniAún no hay calificaciones
- Luis Eduardo Lozano Garcia A1P1Documento4 páginasLuis Eduardo Lozano Garcia A1P1Yael NoeggerathAún no hay calificaciones
- Sesion 1 - Materia y EnergíaDocumento23 páginasSesion 1 - Materia y EnergíaIgnacio MejiaAún no hay calificaciones
- T3. Propiedades de La MateriaDocumento6 páginasT3. Propiedades de La MateriaMiguel ValdovinosAún no hay calificaciones
- Fisica AplicadaDocumento27 páginasFisica AplicadaHxxlr CaalAún no hay calificaciones
- Resumen Quimica-2Documento6 páginasResumen Quimica-2Nicole RomeroAún no hay calificaciones
- QUIMICA2 TeoriaDocumento134 páginasQUIMICA2 Teoriapepe suarez100% (1)
- Tema 3Documento74 páginasTema 3Paula ArcoAún no hay calificaciones
- Mapa Conceptual de QuimicaDocumento1 páginaMapa Conceptual de QuimicaJAQUELINE ALEJANDRA GALVAN CASTA�ON0% (1)
- SolucionesDocumento6 páginasSolucionesPatricio CarreraAún no hay calificaciones
- Mapa Conceptual de Las Propiedades de La MateriaDocumento1 páginaMapa Conceptual de Las Propiedades de La MateriaNIL EDWIN ALDAHIR MARURI HUILLCAAún no hay calificaciones
- Trabajos de RecuperaciónDocumento8 páginasTrabajos de RecuperaciónmonseeAún no hay calificaciones
- Cap 2. Propiedades MateriaDocumento14 páginasCap 2. Propiedades MateriaRoger Coronel QuintanaAún no hay calificaciones
- Constitucion de La MateriaDocumento4 páginasConstitucion de La MateriafertarifacastroAún no hay calificaciones
- MateriaDocumento5 páginasMateriamomamanihuAún no hay calificaciones
- La MateriaDocumento14 páginasLa MateriaAlvaro QCAún no hay calificaciones
- ColoidesDocumento1 páginaColoidesQuetzalli NetzahualcoyotlAún no hay calificaciones
- La Materia y Sus PropiedadesDocumento29 páginasLa Materia y Sus PropiedadesKatika Valderrama TorregrozaAún no hay calificaciones
- Teoria Cinetica en Liquidos y SolidosDocumento5 páginasTeoria Cinetica en Liquidos y SolidosLm SunAún no hay calificaciones
- QUÍMICADocumento20 páginasQUÍMICALatex666Aún no hay calificaciones
- Guía #4 de QuímicaDocumento12 páginasGuía #4 de QuímicaAna GantesAún no hay calificaciones
- Clasificacion de La Materia 7moDocumento44 páginasClasificacion de La Materia 7moJENNIFER CORTESAún no hay calificaciones
- TEMA 1.3: Propiedades de La MateriaDocumento9 páginasTEMA 1.3: Propiedades de La MateriaXimena Garcia RamirezAún no hay calificaciones
- Quimica Colegio Peña 2° AñoDocumento13 páginasQuimica Colegio Peña 2° AñoSofia LandoniAún no hay calificaciones
- Cta Mapa ConceptualDocumento7 páginasCta Mapa Conceptualfabian rondoyAún no hay calificaciones
- Glosario Sobre La MateriaDocumento4 páginasGlosario Sobre La MateriaLuz Marly Tumay100% (1)
- Lectura Interactiva 1 Química Propiedades y TranformacionesDocumento10 páginasLectura Interactiva 1 Química Propiedades y TranformacionesSofia MaguirreAún no hay calificaciones
- Metarial II Sedena Física - 024428Documento2 páginasMetarial II Sedena Física - 024428charli049837Aún no hay calificaciones
- 1.cuestionario - Materia y EnergiaDocumento4 páginas1.cuestionario - Materia y EnergiaJOSE ESPINOAún no hay calificaciones
- 1 - Modulo 1, Propiedades de La MateriaDocumento50 páginas1 - Modulo 1, Propiedades de La Materiamenesesgaviria2008Aún no hay calificaciones
- Apunte 7º - MezclasDocumento60 páginasApunte 7º - Mezclassans927Aún no hay calificaciones
- Resumen de Quínica RjalDocumento28 páginasResumen de Quínica RjalDani.El.CorderoAún no hay calificaciones
- Materia PosterDocumento1 páginaMateria Posternora valverdeAún no hay calificaciones
- Mapa Mental Propiedades de La MateriaDocumento1 páginaMapa Mental Propiedades de La MateriaMaría Paula Palomino BayonaAún no hay calificaciones
- MATERIADocumento75 páginasMATERIAMontse DíazAún no hay calificaciones
- Clasificación y Propiedades de La MateriaDocumento10 páginasClasificación y Propiedades de La MateriaDemetrio SanchezAún no hay calificaciones
- Propiedades y Cambios de La MateriaDocumento18 páginasPropiedades y Cambios de La MateriaKemelli MarquezAún no hay calificaciones
- Aylin Villalobos 1709200001200Documento15 páginasAylin Villalobos 1709200001200Aylin MejiaAún no hay calificaciones
- 1 Materia Medicion Atomos Moleculas IonesDocumento35 páginas1 Materia Medicion Atomos Moleculas IonesAntonioSilloAún no hay calificaciones
- Infografía de Línea de Tiempo CASTRO GONZALEZ ARI RICARDODocumento1 páginaInfografía de Línea de Tiempo CASTRO GONZALEZ ARI RICARDOLos IncomprendidosAún no hay calificaciones
- Boton NanceDocumento4 páginasBoton NanceLos IncomprendidosAún no hay calificaciones
- Barra Traspalatina Practica ATP 2Documento5 páginasBarra Traspalatina Practica ATP 2Los IncomprendidosAún no hay calificaciones
- Banda Ansa PracticaDocumento5 páginasBanda Ansa PracticaLos Incomprendidos100% (1)
- Arco LingualDocumento6 páginasArco LingualLos IncomprendidosAún no hay calificaciones
- Actividad de Aprendizaje 1.3Documento3 páginasActividad de Aprendizaje 1.3Los IncomprendidosAún no hay calificaciones
- Botón Nance Vidal AlanDocumento5 páginasBotón Nance Vidal AlanLos IncomprendidosAún no hay calificaciones
- Arco Lingual Vidal AlanDocumento6 páginasArco Lingual Vidal AlanLos IncomprendidosAún no hay calificaciones
- Banda Ansa Vidal AlanDocumento5 páginasBanda Ansa Vidal AlanLos IncomprendidosAún no hay calificaciones
- Taller 5. El Oxigeno en La Tierra - 2021Documento2 páginasTaller 5. El Oxigeno en La Tierra - 2021gladysgbAún no hay calificaciones
- Practica de Tecnologia EducativaDocumento5 páginasPractica de Tecnologia EducativaElaineAún no hay calificaciones
- Listado de Examenes Segun CargoDocumento3 páginasListado de Examenes Segun CargoEdinson Gonzalez100% (1)
- Presentacion Telegram para DocentesDocumento54 páginasPresentacion Telegram para DocentesCarlos Luis Mendoza VelázquezAún no hay calificaciones
- Investigación Aplicada - 2020 - IDocumento16 páginasInvestigación Aplicada - 2020 - ILenin Barrantes LlanosAún no hay calificaciones
- Taller No. 2. Funciones y Sus GráficasDocumento4 páginasTaller No. 2. Funciones y Sus GráficasAlexander RodríguezAún no hay calificaciones
- Tarea 2 Etiqueta y ProtocoloDocumento14 páginasTarea 2 Etiqueta y ProtocoloYasli AriasAún no hay calificaciones
- Analisis de Impacto Ambiental Con e TerrenoDocumento9 páginasAnalisis de Impacto Ambiental Con e TerrenoYoselyn LiñanAún no hay calificaciones
- 7 Plan HipocaloricoDocumento5 páginas7 Plan HipocaloricoErick Raphael Vizcarra InfantesAún no hay calificaciones
- Maestría en Formación Integral Humana y ReligiosaDocumento15 páginasMaestría en Formación Integral Humana y ReligiosaDiana Carolina GarciaAún no hay calificaciones
- 7 - Rogers y SpinosaDocumento7 páginas7 - Rogers y SpinosaCecilia Comesana DuranAún no hay calificaciones
- Taller #7 Comprensión LectoraDocumento6 páginasTaller #7 Comprensión LectoraYurey Peral67% (6)
- Resolución 462 2017Documento10 páginasResolución 462 2017JaimColVAún no hay calificaciones
- Tríptico - Tema 7Documento2 páginasTríptico - Tema 7Kim ZoldyckAún no hay calificaciones
- Aplicaciones en La SaludDocumento3 páginasAplicaciones en La SaludJhosue MundacaAún no hay calificaciones
- Musculo CardiacoDocumento2 páginasMusculo CardiacoFrancesca PupoAún no hay calificaciones
- INSPECCION Escalera - RODILLO - EMPACDocumento1 páginaINSPECCION Escalera - RODILLO - EMPACPerla Lezama SSOMAAún no hay calificaciones
- Presentación PMRT 2022Documento17 páginasPresentación PMRT 2022Jean CorimayaAún no hay calificaciones
- Planificación de Clases y Materiales de ManicuraDocumento6 páginasPlanificación de Clases y Materiales de ManicuraAna Paula PerronAún no hay calificaciones
- CAST (2011) - Universal Design For Learning Guidelines Version 2.0. Wakefield, MA: Author. Traducción Al Español Version 2.0. (2013)Documento22 páginasCAST (2011) - Universal Design For Learning Guidelines Version 2.0. Wakefield, MA: Author. Traducción Al Español Version 2.0. (2013)Pauli DuránAún no hay calificaciones
- Aclaración, Rectificación O EnmiendaDocumento3 páginasAclaración, Rectificación O EnmiendaFernando Faret Saalfeld0% (1)
- 1.preguntas TeodiceaDocumento3 páginas1.preguntas TeodiceaDavid Galarza FernándezAún no hay calificaciones
- Prueba de Independencia y HomogeneidadDocumento10 páginasPrueba de Independencia y HomogeneidadLotty MazaneAún no hay calificaciones
- Proyecto Inversión Rodriguez Marquez Gomez WilliamsDocumento39 páginasProyecto Inversión Rodriguez Marquez Gomez WilliamsGeorgina GomezAún no hay calificaciones
- Powerflex RV KDocumento1 páginaPowerflex RV KPablo Hidalgo ValenzuelaAún no hay calificaciones
- CDU Abreviada 2016 PDFDocumento966 páginasCDU Abreviada 2016 PDFGabriela Salinas100% (1)
- Plan Preventivo y Correctivo Restaurante y Bodega Ut Gobernacion Huila 2018Documento50 páginasPlan Preventivo y Correctivo Restaurante y Bodega Ut Gobernacion Huila 2018Jorge Rivera M100% (1)
- La Integración Del Plogging A Través Del Aprendizaje Servicio en Educación Física. Una Intervención Educativa ...Documento23 páginasLa Integración Del Plogging A Través Del Aprendizaje Servicio en Educación Física. Una Intervención Educativa ...luiscarlosguerrero1983Aún no hay calificaciones
- Universidad Nacional Autónoma de México: Facultad de IngenieríaDocumento3 páginasUniversidad Nacional Autónoma de México: Facultad de IngenieríaAlfredo CordovaAún no hay calificaciones
- Cuadro Comparativo-Programas de Diseño GráficoDocumento3 páginasCuadro Comparativo-Programas de Diseño GráficoRosalìa Chungata PeraltaAún no hay calificaciones