Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Papel del colágeno en la osteogénesis imperfecta
Cargado por
manuel herradora0 calificaciones0% encontró este documento útil (0 votos)
30 vistas3 páginasLa osteogénesis imperfecta es un trastorno genético que debilita los huesos, haciéndolos más frágiles. Esto ocurre porque hay un defecto en el gen que produce colágeno, una proteína fundamental para la estructura ósea. Las personas con osteogénesis imperfecta nacen con este defecto y, como resultado, sus huesos tienen menos colágeno o colágeno defectuoso, lo que los hace más débiles y propensos a fracturarse.
Descripción original:
metabolismo oseo
Título original
bioquimica osea y muscular
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoLa osteogénesis imperfecta es un trastorno genético que debilita los huesos, haciéndolos más frágiles. Esto ocurre porque hay un defecto en el gen que produce colágeno, una proteína fundamental para la estructura ósea. Las personas con osteogénesis imperfecta nacen con este defecto y, como resultado, sus huesos tienen menos colágeno o colágeno defectuoso, lo que los hace más débiles y propensos a fracturarse.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
30 vistas3 páginasPapel del colágeno en la osteogénesis imperfecta
Cargado por
manuel herradoraLa osteogénesis imperfecta es un trastorno genético que debilita los huesos, haciéndolos más frágiles. Esto ocurre porque hay un defecto en el gen que produce colágeno, una proteína fundamental para la estructura ósea. Las personas con osteogénesis imperfecta nacen con este defecto y, como resultado, sus huesos tienen menos colágeno o colágeno defectuoso, lo que los hace más débiles y propensos a fracturarse.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
Papel del colágeno en la osteogénesis imperfecta.
La osteogénesis imperfecta es un trastorno de origen
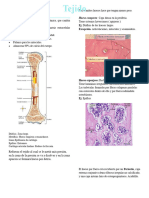
Estructura y composición ósea El remodelado óseo es el proceso necesario para: genético que impide que el cuerpo fabrique unos huesos
1) mantener las características mecánicas del
fuertes. Las personas con osteogénesis imperfecta
esqueleto, 2) sustituir y reparación del tejido óseo
deteriorado, 3) mantener la homeostasis mineral y
pueden tener unos huesos que se rompen fácilmente, por
Osteoblastos
en el equilibrio ácido básico y 4) producir factores lo que esta afección también se conoce coloquialmente
Celulas Osteoclastos
de crecimiento que favorecen la función medula como enfermedad de los huesos de cristal. La
Osteocitos
ósea. Dura toda la vida y conocer los procesos osteogénesis imperfecta ocurre debido a un defecto en el
Hueso celulares involucrados en su control resulta
Colageno tipo I gen que fabrica una proteína llamada colágeno. El
Matriz premisa indispensable para el tratamiento de la
extracelular
Proteinas osteoporosis. colágeno es un componente fundamental de los huesos.
Proteoglucanos
El remodelado resulta de la interacción entre las Las personas con osteogénesis imperfecta nacen con esta
Diferente células fundamentales del hueso: se inicia con la
-Hueso
afección. O no tienen suficiente colágeno en los huesos o
tipo de
resorción por los osteoclastos de un volumen de
tejidos compacto Hidroxiapatita su colágeno no funciona como debería funcionar. Esto
-Hueso
hueso dañado, identificado por los osteocitos
Proporciona la
(verdaderos sensores mecánicos del hueso),
hace que sus huesos sean más débiles y frágiles que los
esponjoso dureza
-Medula seguido por la formación de hueso nuevo por los huesos normales. La enfermedad también puede
Ósea osteoblastos, todo lo cual ocurre en la provocar deformaciones óseas. (Un hueso deformado no
-Periostio denominada unidad de remodelación. tiene una forma normal).
Función de las Fosfatasas alcalinas y ácidas en el proceso de remodelado.
La fosfatasa alcalina es una enzima que libera fosfato inorgánico a partir de ésteres fosfóricos, necesario
para la mineralización. Existen varias isoenzimas y, entre ellas la ósea, se ha considerado un buen
marcador de la actividad osteoblástica.
Regulacion Hormonal La matriz orgánica del hueso está constituida por colágeno tipo I en un 90%. Durante el proceso de
degradación extracelular se liberan péptidos de los extremos carboxi y aminoterminal de las moléculas de
protocolágeno, que son los que pasan al torrente sanguíneo. Los marcadores bioquímicos de remodelado
óseo miden estos productos generados durante el proceso de formación o degradación de la matriz ósea.
Para la medición de la actividad formadora del hueso existen varios marcadores clínicamente útiles:
fosfatasa alcalina, osteocalcina y los péptidos de extensión del protocolágeno I.
Paratohormona: Calcitonina:es producida
Producida por las por la tiroides, ayuda as La actividad de la fosfatasa alcalina procede de diversos tejidos, tales como hígado, hueso, placenta, etc.,
glandulas paratiroideas, controlar la cantidad de siendo las isoformas ósea y hepática las más frecuentes (90%). Ambas se encuentran en la misma
controla nivel de calcio calcio que circula en el
en sangre torrente sanguíneo proporción en el individuo sano y se diferencian en el patrón de glucosilación, existiendo una actividad
cruzada en un 10-20%, según estudios con anticuerpos monoclonales.
Relación metabolismo del calcio-metabolismo del hueso
Vitamina D3: Producida Aproximadamente el 99% del calcio corporal se localiza en el hueso y cerca del 80% del fósforo también está en el hueso. Los tres
en la piel a traves de los tipos principales de células intervienen en la formación y resorción del hueso, los osteoblastos sintetizan colágeno y promueven el
rayos ultravioleta. ayuda depósito de sales cálcicas, los osteoclastos son responsables de la resorción del hueso. Tan sólo el 1% del calcio y fosfato óseo está
al cuerpo a absorver
calcio en equilibrio con el líquido extracelular debido a la actividad de los osteocitos constituyendo una especie de amortiguador o bufer
para controlar las modificaciones a corto plazo de calcemia y fosfatemia; el otro 99% sólo es accesible mediante resorción
osteoclástica cuando se desarrolla la remodelación del hueso, y también está controlado hormonalmente.
Mecanismo de contracción del musculo esquelético.
En los últimos años se ha mantenido que la contracción muscular es el resultado
Osteoporosis. de la interacción molecular que se produce entre las proteínas (actina y miosina)
La osteoporosis es un proceso en el que la disminución de la que forman los filamentos contráctiles, lo que lleva a un deslizamiento de los
densidad ósea debilita los huesos, lo que aumenta la Fuentes energéticas del musculo. filamentos finos sobre los filamentos gruesos. La disposición de los filamentos
probabilidad de fractura. finos, anclados en las líneas Z, determina que su deslizamiento se produzca hacia
Las pacientes con osteoporosis desitométrica no suelen Ciclo de cori el centro del sarcómero, aproximando las líneas Z y acortando la longitud
presentar hallazgos físicos específicos. La presencia de sarcomérica (aproximadamente 1 ¡tm) . Como cada miofibrilla está formada por
fracturas vertebrales puede asociarse a cifosis, protrusión numerosos sarcómeros, el resultado final de la contracción es el acortamiento de
abdominal y pérdida de peso. Tradicionalmente, se asume las núofibrillas, la fibra muscular y el músculo. El deslizamiento de unos
que el dolor dorsal o lumbar sólo aparece tras una fractura filamentos sobre otros no modifica su longitud). Cuando se produce la
aguda, no obstante, en algunos de los grandes ensayos contracción, la banda A se mantiene constante mientras que las bandas 1 y H se
clínicos controlados con fármacos antirresortivos se ha estrechan, lo que indica que sólo se incrementa el grado de solapamiento entre
demostrado una reducción del dolor y del número de días en los filamentos permaneciendo constante su longitud. El deslizamiento de los
reposo. filamentos explica el acortamiento del sarcómero, pero ¿cómo se deslizan los
Los tratamientos antirresortivos son capaces de inducir una filamentos? El movimiento de los filamentos finos hacia el centro del sarcómero
reducción precoz (en semanas o pocos meses) en las se debe a que, entre las cabezas de los puentes de unión de la miosina (fracción
concentraciones de marcadores de resorción en más del 90% S-1 de la meromiosina pesada) y la actina, se forman y se destruyen, de manera
de los pacientes tratados, lo que puede suponer una repetida, unas uniones denominadas enlaces cruzados. La cabeza de un puente
disminución de hasta el 40-60% de los valores basales para de unión, una vez adosada a la actina, sufre un cambio de conformación (gira 45°)
antirresortivos potentes como los aminobisfosfonatos. que empuja al filamento fino hacia el centro del sarcómero. A continuación, el
Algunos autores han propuesto determinar las enlace cruzado se rompe, la cabeza recupera su configuración primaria, vuelve a
concentraciones basales de marcadores de resorción y tras unirse con la actina en otro punto más a lejado de ella, y sufre un nuevo cambio
algunos meses de tratamiento para valorar la adherencia y de conformación empujando de nuevo al filamento fino más hacia el centro. La
respuesta al tratamiento. No existen suficientes datos, energía para este proceso se obtiene de la hidrólisis del ATP. El ATP se adhiere a
especialmente desde el punto de vista de coste-beneficio, la doble cabeza, la cual, debido a su gran actividad A TP-asa, lo hidro liza en
para recomendar esa aproximación. Un estado proresortivo adenosindifosfato (ADP) y fósforo inorgánico (P;). El ADP y el P; permanecen
favorece la acción resortiva (p. ej hiperparatiroidismo, PR- unidos a la cabeza. La hidrólisis del ATP suministra energía a la miosina
PTH en enfermedades oncológicas) transformándola en miosina «activada». En esta situación, la cabeza de la miosina
• Un estado antiresortivo bloquea o antagoniza la acción de se une perpendicularmente (90°) con la actina. Como consecuencia de la unión,
la resortiva (p ej. Estrógenos) la miosina sufre un cambio de conformación que se traduce en un giro de la
• Sin embargo, el hueso sano depende del balance entre cabeza (aproximadamente 45°), el cual crea un impulso mecánico que tira del
resorción y adsorción a través del mecanismo de filamento de actina llevándolo hacia el centro del sarcómero, generando una
remodelación. tensión o fuerza (fig. 3-3c). La energía que produce el impulso es la que se
encontraba almacenada en la cabeza, proveniente de la hidrólisis del ATP, y que
como consecuencia de la unió n con la actina se libera. Así mismo, la unió n de la
actina con la miosina produce la liberación del ADP y del P¡, que permanecían
Rigor Mortis unidos a la cabeza de la miosina, permitiendo que una nueva molécula de ATP se
adhiera a la cabeza (fig. 3-3d). La unión de ATP produce la rotura del enlace,
El rigor mortis constituye la fase inicial en la transformación del músculo Aeróbico
separándose la actina de la miosina y transformándose esta última en miosina
en carne. Consiste simplemente en la unión irreversible de miosina y
«desactivada» (fig. 3-3e). Esta separación permite que el ATP unido a la cabeza
actina para formar actomiosina. Esta unión puede ir acompañada o no
sea de nuevo hidrolizado, con lo cual la miosina vuelve a «activarse» y a esta r
de contracción muscular, pero se manifiesta en la rigidez cadavérica que
dispuesta para unirse de nuevo a otro lugar de la actina más alejado del anterior,
le caracteriza. Después de la muerte se produce: - Falta de regulación
de este modo el ciclo vuelve a comenzar y el fi lamento fino es desplazado
nerviosa y hormonal - Falta de aporte de nutrientes - Falta de aporte de
nuevamente hacia el centro del sarcómero. La fuerza o tensión que desarrolla el
oxígeno - Alteración del equilibrio osmótico La consecuencia más
músculo va a estar relacionada con el número de enlaces que se forman entre la
inmediata del sangrado es el fallo en el aporte de oxígeno transportado
actina y la miosina. En este esquema, el ATP desempeña un papel crucial ya que,
por la sangre a los músculos y por tanto la caída del potencial de
por un lado, con su disociación proporciona la energía para el movimiento del
oxidación-reducción. En consecuencia, el sistema enzimático citocromo
no puede funcionar y la síntesis de ATP por esta vía es imposible. Por filamento fino y, por otro lado, provoca la ruptura de la unión actina-
acción de la ATPasa de la miosina disminuye el nivel de ATP, liberando miosina. Ello determina q ue cuando el nivel de ATP en la célula
simultáneamente fosfato inorgánico que estimula la conversión del desciende por debajo de un límite (muerte del animal), los enlaces
glucógeno en ácido láctico. La síntesis de ATP por glicólisis anaerobia no cruzados se transforman en permanentes (hasta la autólisis)
permite mantener el nivel de ATP, y al descender éste hasta casi apareciendo la rigidez cadavérica o «rigor mortis>>.
desaparecer se forma actomiosina y se produce la inextensibilidad
característica del rigor mortis
Universidad Nacional Autónoma de Nicaragua
Unan-León
Carrera de Medicina
Bioquímica Medica II
Tema: Bioquímica Osteomuscular.
Nombre y Apellido: Mélida Esmeralda Cabrera González
Numero de lista: #34
Nombre del docente: Lic. Nelvar Zapata
Fecha: 13/12/2021
¡A la libertad por la universidad!
También podría gustarte
- HistologiaDocumento4 páginasHistologiaYaysiris ShawAún no hay calificaciones
- Transmision Automatica-Aw-4 Indice: Transmision Y Caja de Cambios 21 - 181Documento122 páginasTransmision Automatica-Aw-4 Indice: Transmision Y Caja de Cambios 21 - 181Yokomo133100% (10)
- Analisis de La Obra de Gaspar Octavio HernandezDocumento12 páginasAnalisis de La Obra de Gaspar Octavio HernandezAlejandra Tobar100% (1)
- 4 Po-Ss-Tc-0015-2016 Poc Eq de Protección Personal en La DG de Pep PDFDocumento34 páginas4 Po-Ss-Tc-0015-2016 Poc Eq de Protección Personal en La DG de Pep PDFLuiz Venegas100% (1)
- Ficha Tecnica (Soldadora)Documento3 páginasFicha Tecnica (Soldadora)Jonathan Teran Ruiz100% (1)
- Diapositivas Del Tejido ÓseoDocumento12 páginasDiapositivas Del Tejido ÓseoviruzzAún no hay calificaciones
- Remodelado óseo y osteoporosisDocumento1 páginaRemodelado óseo y osteoporosisJHONAR ALEX OSWALDO VASQUEZ LLANOSAún no hay calificaciones
- Expo. OsteoporosisDocumento24 páginasExpo. OsteoporosisCarolina MartinezAún no hay calificaciones
- Osteologia: Tejido ÓseoDocumento39 páginasOsteologia: Tejido ÓseoFabrix TGAún no hay calificaciones
- Tejido óseo, matriz y hormonasDocumento76 páginasTejido óseo, matriz y hormonasMIGUEL ANGEL SOSA ESQUIVELAún no hay calificaciones
- Infografía HuesoDocumento10 páginasInfografía HuesoAlanAún no hay calificaciones
- Cuadro Comparativo Celulas TejidoseoDocumento4 páginasCuadro Comparativo Celulas Tejidoseoaleanafdezbe05Aún no hay calificaciones
- TEJIDO ÓseoDocumento37 páginasTEJIDO ÓseoDomenica AlvarezAún no hay calificaciones
- Tejido ÓseoDocumento18 páginasTejido ÓseoemilieAún no hay calificaciones
- Fisiología ÓseaDocumento25 páginasFisiología ÓseaSofía GarcíaAún no hay calificaciones
- Cicatrización de Huesoso y Injertos OseosDocumento12 páginasCicatrización de Huesoso y Injertos OseosmonicaordonezAún no hay calificaciones
- Resumenes de TyoDocumento46 páginasResumenes de TyoKevenzeyoAún no hay calificaciones
- Fisiología ósea y regulación hormonalDocumento1 páginaFisiología ósea y regulación hormonalRossy AttieAún no hay calificaciones
- Lectura. Taller. Bioquimica, Enfermedades y Lesiones Del Sistema Osteomioarticular YuliDocumento5 páginasLectura. Taller. Bioquimica, Enfermedades y Lesiones Del Sistema Osteomioarticular Yuliyulieth dominguezAún no hay calificaciones
- Katiuska Coronel Matriz Organica OseaDocumento12 páginasKatiuska Coronel Matriz Organica OseaKatiuska CoronelAún no hay calificaciones
- Celulas OseasDocumento1 páginaCelulas OseasSérgio Back Junior100% (1)
- Diapos de Patologia Del Hueso, Articulaciones y Tumores de Partes BlandasDocumento66 páginasDiapos de Patologia Del Hueso, Articulaciones y Tumores de Partes BlandasSilva Brigitte EsthefanyAún no hay calificaciones
- Mapa Conceptual Del Sistema Oseo 6Documento3 páginasMapa Conceptual Del Sistema Oseo 6Javiera Cerda100% (1)
- T.C ÓseoDocumento10 páginasT.C Óseoninas50544Aún no hay calificaciones
- OSTEOPOROSISDocumento28 páginasOSTEOPOROSISdrcristhianhoyosAún no hay calificaciones
- Biomecanica Osea ResumenDocumento10 páginasBiomecanica Osea ResumenSamanta LestrangeAún no hay calificaciones
- Tejido OseoDocumento2 páginasTejido OseomayAún no hay calificaciones
- Tejido OseoDocumento7 páginasTejido OseoFlorencia PinoAún no hay calificaciones
- Mapa ConceptualDocumento2 páginasMapa ConceptualVivianna SofíaAún no hay calificaciones
- Tejido Oseo PDFDocumento2 páginasTejido Oseo PDFLee Chong100% (1)
- Celulas OseasDocumento6 páginasCelulas Oseasmkts75Aún no hay calificaciones
- Anatomía Semana 2Documento11 páginasAnatomía Semana 2Asusena Morales RojasAún no hay calificaciones
- Tema I - Fisiología OseaDocumento6 páginasTema I - Fisiología OseaPedro David Ninaquispe MariñosAún no hay calificaciones
- Histologia OseaDocumento1 páginaHistologia OseaJavier Ulises Santos NavaAún no hay calificaciones
- Unidad 8: Patologia OseaDocumento14 páginasUnidad 8: Patologia OseaFortinAún no hay calificaciones
- Marcadores bioquímicos del remodelamiento óseoDocumento17 páginasMarcadores bioquímicos del remodelamiento óseoBárbara Henríquez ArriagadaAún no hay calificaciones
- Tejido OseooDocumento35 páginasTejido OseooDarling Escobar UretaAún no hay calificaciones
- Metabolismo Óseo y Ejercicior1Documento17 páginasMetabolismo Óseo y Ejercicior1Yasneidy Nicolás GarcíaAún no hay calificaciones
- Sistema EsqueléticoDocumento12 páginasSistema Esqueléticoa381596Aún no hay calificaciones
- Ficha Tejido OseoDocumento4 páginasFicha Tejido OseoJimmy MoralesAún no hay calificaciones
- Tejido OseoDocumento3 páginasTejido OseoestebanayelenguadalupeAún no hay calificaciones
- Factores Reguladores de La Resorción ÓseaDocumento16 páginasFactores Reguladores de La Resorción ÓseaADRIANA PASTRANAAún no hay calificaciones
- 2.1 Generalidades de OsteologíaDocumento47 páginas2.1 Generalidades de OsteologíaGarcía Sánchez EmmanuelAún no hay calificaciones
- Presentación Diapositiva Marca Creativa Doodle Blanco y MarrónDocumento14 páginasPresentación Diapositiva Marca Creativa Doodle Blanco y MarrónLuana MedinaAún no hay calificaciones
- Fisiologia de HuesoDocumento21 páginasFisiologia de HuesoMaritzaAún no hay calificaciones
- Aparato LocomotorDocumento19 páginasAparato LocomotorNayely Sánchez DíazAún no hay calificaciones
- Oseo y TransporteDocumento19 páginasOseo y TransporteLuis Angel Garcia ColinesAún no hay calificaciones
- UNIDAD 8 - Tejido ÓseoDocumento6 páginasUNIDAD 8 - Tejido ÓseoGonza MamaníAún no hay calificaciones
- #2, Burbano Maria José, Velasco JossetDocumento19 páginas#2, Burbano Maria José, Velasco JossetMaria jose Burbano GonzalezAún no hay calificaciones
- Generalidades Del Sistema OseoDocumento2 páginasGeneralidades Del Sistema OseoSantiago BernateAún no hay calificaciones
- Tejido Óseo 1 1Documento4 páginasTejido Óseo 1 1301Perez Pérez Daniela SofíaAún no hay calificaciones
- 9 Histo2biomed2023 OseoDocumento28 páginas9 Histo2biomed2023 OseoNatalia G. SevillanoAún no hay calificaciones
- Anatomia y Fisiologia Sem 02 - 2022 IiiDocumento10 páginasAnatomia y Fisiologia Sem 02 - 2022 IiiMaría Stefani Velasquez TorresAún no hay calificaciones
- Mapa Conceptual AntropologiaDocumento1 páginaMapa Conceptual AntropologiaEßsperanza Møraleß50% (2)
- Tejido ÓseoDocumento6 páginasTejido ÓseoPalta EspinaAún no hay calificaciones
- OsteologíaDocumento3 páginasOsteologíaJoao AmauryAún no hay calificaciones
- Patología ÓseaDocumento150 páginasPatología ÓseaSantyagoAriasAún no hay calificaciones
- 3° A Y B SISTEMA OSEODocumento6 páginas3° A Y B SISTEMA OSEOPRINCESA AIDA ADRIEL CASTILLO ZULOETAAún no hay calificaciones
- Otros Estudiantes También Vieron: Células OseasDocumento25 páginasOtros Estudiantes También Vieron: Células OseasLizeth Gloria Jara PabloAún no hay calificaciones
- anatomia sem 2 (2)Documento10 páginasanatomia sem 2 (2)Nataly BermudezAún no hay calificaciones
- Bone Graft Healing Marx - En.esDocumento12 páginasBone Graft Healing Marx - En.esmonicaordonezAún no hay calificaciones
- Sistema EsqueléticoDocumento119 páginasSistema Esqueléticoyir.valdor15Aún no hay calificaciones
- Induccion-Conduccion (1)Documento20 páginasInduccion-Conduccion (1)manuel herradoraAún no hay calificaciones
- Intoxicación Criminal Por GlifosatoDocumento25 páginasIntoxicación Criminal Por Glifosatomanuel herradoraAún no hay calificaciones
- Its Electiva FinalDocumento95 páginasIts Electiva Finalmanuel herradoraAún no hay calificaciones
- EPOCDocumento5 páginasEPOCmanuel herradoraAún no hay calificaciones
- Terminología QuirurgicaDocumento30 páginasTerminología Quirurgicamanuel herradoraAún no hay calificaciones
- Piel y HeridasDocumento51 páginasPiel y Heridasmanuel herradoraAún no hay calificaciones
- periodos clinicos del parto.2023.Documento50 páginasperiodos clinicos del parto.2023.manuel herradoraAún no hay calificaciones
- Presentación grupal de Embarazo EctópicoDocumento12 páginasPresentación grupal de Embarazo Ectópicomanuel herradoraAún no hay calificaciones
- Electiva Apn 2022Documento14 páginasElectiva Apn 2022manuel herradoraAún no hay calificaciones
- Criminalistica ForenseDocumento75 páginasCriminalistica Forensemanuel herradoraAún no hay calificaciones
- Antidepre 23Documento45 páginasAntidepre 23manuel herradoraAún no hay calificaciones
- Seminario Bioquimica 1Documento14 páginasSeminario Bioquimica 1manuel herradora0% (1)
- Ecv DR Guzman ActualizadaDocumento108 páginasEcv DR Guzman Actualizadamanuel herradoraAún no hay calificaciones
- Anticonceptivos ElectivaDocumento91 páginasAnticonceptivos Electivamanuel herradoraAún no hay calificaciones
- Diabetes 23Documento24 páginasDiabetes 23manuel herradoraAún no hay calificaciones
- El Peritaje Forense AlacDocumento27 páginasEl Peritaje Forense Alacmanuel herradoraAún no hay calificaciones
- Balance HidromineralDocumento23 páginasBalance Hidromineralmanuel herradoraAún no hay calificaciones
- MALARIADocumento13 páginasMALARIAmanuel herradoraAún no hay calificaciones
- 7 Canal EndemicoDocumento25 páginas7 Canal Endemicomanuel herradoraAún no hay calificaciones
- Conferencia DigestiónDocumento33 páginasConferencia Digestiónmanuel herradoraAún no hay calificaciones
- 4.1 - Diseños de Estudios EpidemilógicosDocumento46 páginas4.1 - Diseños de Estudios Epidemilógicosmanuel herradoraAún no hay calificaciones
- Tiroides y embarazo: importancia del yodo para la salud materno-fetalDocumento6 páginasTiroides y embarazo: importancia del yodo para la salud materno-fetalmanuel herradoraAún no hay calificaciones
- Cuadro Sinóptico de Llaves Simple Divertido y ColoridoDocumento1 páginaCuadro Sinóptico de Llaves Simple Divertido y Coloridomanuel herradoraAún no hay calificaciones
- Diferenciacion 20 AnaplasiaDocumento2 páginasDiferenciacion 20 Anaplasiamanuel herradoraAún no hay calificaciones
- Microbiologia 1Documento11 páginasMicrobiologia 1manuel herradoraAún no hay calificaciones
- Pruebas TamizajeDocumento24 páginasPruebas Tamizajemanuel herradoraAún no hay calificaciones
- Guia Practica Riesgo PsicDocumento3 páginasGuia Practica Riesgo Psicmanuel herradoraAún no hay calificaciones
- Ciencias Naturales (JoseDocumento22 páginasCiencias Naturales (Josemanuel herradoraAún no hay calificaciones
- ATROFIADocumento3 páginasATROFIAmanuel herradoraAún no hay calificaciones
- Accidente de TráficoDocumento2 páginasAccidente de Tráficomanuel herradoraAún no hay calificaciones
- Tabla de Contenido Con HipervinculosDocumento4 páginasTabla de Contenido Con HipervinculosEVA ALVARADOAún no hay calificaciones
- Solicitud suministro eléctrico municipalidad MolinaDocumento2 páginasSolicitud suministro eléctrico municipalidad MolinaSebastian Campos LinerosAún no hay calificaciones
- Propuesta BolivarDocumento10 páginasPropuesta BolivarTello CardonaAún no hay calificaciones
- Pasos para Instalar Ubuntu 8.04Documento37 páginasPasos para Instalar Ubuntu 8.04nelson1019018670100% (3)
- Contaminacion de Aires en Puente PiedraDocumento7 páginasContaminacion de Aires en Puente PiedraEderson Bracamonte Blas100% (1)
- Trabajo de AscensoDocumento102 páginasTrabajo de AscensoMayra LealAún no hay calificaciones
- Crecimiento población y desarrollo económicoDocumento6 páginasCrecimiento población y desarrollo económicoDavid Ignacio Berastain HurtadoAún no hay calificaciones
- CUADERNO DE ACTIVIDADES PRÁCTICAS #1 DE LA CÁTEDRA ANATOMÍA Edicion 2018Documento47 páginasCUADERNO DE ACTIVIDADES PRÁCTICAS #1 DE LA CÁTEDRA ANATOMÍA Edicion 2018david rivas100% (1)
- Actualización planos planta AIRTECDocumento7 páginasActualización planos planta AIRTECDither VillegasAún no hay calificaciones
- Mauricio DuceDocumento29 páginasMauricio DuceMarcelo Andrés Acuña SilvaAún no hay calificaciones
- Refrigeracion Domestica TerminadoDocumento5 páginasRefrigeracion Domestica TerminadoLucas Andres Yanac DurandAún no hay calificaciones
- Cómo prepararse para el futuro: la lección del caminante del desiertoDocumento2 páginasCómo prepararse para el futuro: la lección del caminante del desiertoSheilin VillanuevaAún no hay calificaciones
- Tuvo María más hijos además de JesúsDocumento13 páginasTuvo María más hijos además de Jesússabino oAún no hay calificaciones
- Iii. - Función Social y Rol o Papel DesempeñadoDocumento42 páginasIii. - Función Social y Rol o Papel DesempeñadoNicole Lewis100% (1)
- Guia 9° Religion Primer Periodo Virtudes MoralesDocumento2 páginasGuia 9° Religion Primer Periodo Virtudes MoralesJULIAN SNEIDER100% (1)
- Participación Social y ComunitariaDocumento12 páginasParticipación Social y ComunitariaNicole Lobos VillatoroAún no hay calificaciones
- EMKA Catalogo General 2017-2018 ESDocumento620 páginasEMKA Catalogo General 2017-2018 ESzidanek69Aún no hay calificaciones
- Plan LectorDocumento6 páginasPlan LectorginopedrofgAún no hay calificaciones
- Exposicion Nia 200-299Documento49 páginasExposicion Nia 200-299Luis Alfredo HCAún no hay calificaciones
- Modelos de InvestariosDocumento54 páginasModelos de InvestariosJuan Francisco Gabriel Valtierra GarciaAún no hay calificaciones
- Problemas de Aplicación de La Ley de GaussDocumento3 páginasProblemas de Aplicación de La Ley de GaussRachel GutierrezAún no hay calificaciones
- 4epcn SV Es Ev Ud02 andDocumento3 páginas4epcn SV Es Ev Ud02 andjulia0% (1)
- Nefropata 1600 SNGDocumento2 páginasNefropata 1600 SNGMiriam Flores ArredondoAún no hay calificaciones
- Unidad 6 - Vibraciones en Maquinas - Jhonny CordovaDocumento4 páginasUnidad 6 - Vibraciones en Maquinas - Jhonny CordovaJhonny CordovaAún no hay calificaciones
- Tesis de Felicidad en Villa El SalvadorDocumento104 páginasTesis de Felicidad en Villa El SalvadorAlvaro CanréAún no hay calificaciones
- Comentario de Texto Adriana CavareroDocumento6 páginasComentario de Texto Adriana CavareroFran Tortajada VillalbaAún no hay calificaciones