0% encontró este documento útil (0 votos)
877 vistas16 páginasCalorimetria (Informe 10)
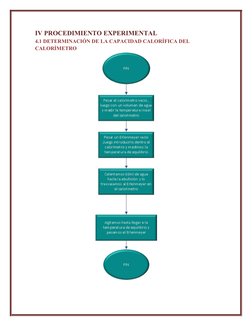
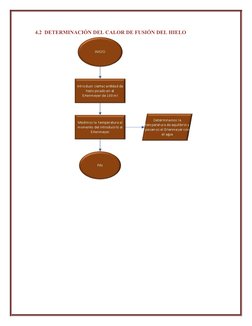
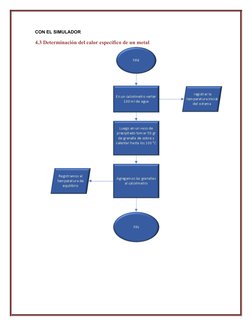
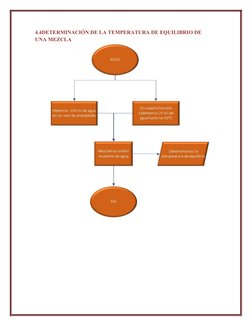
Este documento presenta los objetivos, fundamentos teóricos, materiales, procedimientos y cálculos para realizar experimentos de calorimetría. Los objetivos incluyen demostrar la ley de conservación de la energía mediante la determinación de capacidades caloríficas, calores de fusión y temperaturas de equilibrio. Los fundamentos teóricos explican conceptos como calorimetría, calor sensible, equivalente en agua y calor latente. El procedimiento experimental describe cómo medir las capacidades caloríficas del calorímetro y un metal, y
Cargado por
Fernando Macias San MiguelDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
877 vistas16 páginasCalorimetria (Informe 10)
Este documento presenta los objetivos, fundamentos teóricos, materiales, procedimientos y cálculos para realizar experimentos de calorimetría. Los objetivos incluyen demostrar la ley de conservación de la energía mediante la determinación de capacidades caloríficas, calores de fusión y temperaturas de equilibrio. Los fundamentos teóricos explican conceptos como calorimetría, calor sensible, equivalente en agua y calor latente. El procedimiento experimental describe cómo medir las capacidades caloríficas del calorímetro y un metal, y
Cargado por
Fernando Macias San MiguelDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd