Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Reporte 3
Cargado por
Andres Lechuga0 calificaciones0% encontró este documento útil (0 votos)
6 vistas5 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
6 vistas5 páginasReporte 3
Cargado por
Andres LechugaCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 5
Universidad Autónoma de Ciudad Juárez
Instituto de Ciencias Biomédicas – Microbiología I
Metabolismo bacteriano
Andrés Lechuga Medina –189880 – al189880@alumnos.uacj.mx
Viernes 18 de marzo del 2022
Resumen. Los microorganismos pueden presentar cierto metabolismo, que permiten su
crecimiento, reproducción y supervivencia ante ciertos medios, utilizando las enzimas que
producen. Para poder observar la acción enzimática bacteriana, se realizó su cultivo en
diversos medios, como lo fue en medios glucosa, maltosa, sacarosa, lactosa y manitol
para observar la fermentación por parte de E. coli, también en medio de MR-VP para
observar la fermentación ácido-mixta y del 2,3-butanediol con Enterobacter sp.,
obteniendo de esta resultados positivos, también la prueba de oxidasa cultivando en agar
nutritivo P. aeruginosa y utilizando también S. aureus en la prueba, siendo solo la primera
oxidasa positiva, en la prueba de catalasa se tomó también S. aureus y P. aeruginosa,
siendo ambas catalasa positivas, para observar la reducción de nitratos se utilizó la
bacteria B. subtilis, la cual presentó un resultado positivo al agregar el respectivo reactivo,
para almidón se sembró en un agar-almidón B. subtilis y E. coli, siendo solo la primera
una bacteria que produce amilasa, ya que hidrolizó el almidón, en la prueba de la caseína
se sembró en su respectivo agar y en la prueba de gelatina en un tubo con gelatina, en el
primero se sembró B. subtilis y E. coli, que ninguna hidrolizó a la caseína, mientras que se
sembró E. coli en gelatina, la cual tampoco hidrolizó esta. Estas pruebas permiten la
identificación de bacterias por medio de sus características metabólicas, siendo una
prueba de identificación adicional.
Palabras clave: Metabolismo, microorganismo, enzimas.
Introducción. exoenzimas, permitiendo que por
ejemplo los carbohidratos se introduzcan
Los microorganismos necesitan ciertos
en forma de monómeros o dímeros. Al
nutrientes para crecer, ya que por medio
ser introducidas estos compuestos en el
de su metabolismo permiten la
microorganismo, se ver afectados por
incorporación y transformación de
enzimas en el interior, conocidas como
compuestos a su alrededor al introducir
endoenzimas (Madigan, et al., 2015;
estos al interior de cada bacteria
Schlegel & Zaborosch, 1997).
(Madigan, et al., 2015).
Por medio del metabolismo que presenta
Cuando se habla de degradación en
un microorganismo, se puede llevar a
compuestos más sencillos, se habla de
cabo su identificación, ya que cada una
catabolismo, mientras que si se realizan
presenta características diferentes
compuestos más grandes es un
debido al diferente genética de estas, por
metabolismo sintético o anabolismo
lo mismo existen diversos
(Madigan, et al., 2015).
microorganismos modificados
Las macromoléculas hidrolizadas en el genéticamente, para que su metabolismo
exterior de la célula son afectadas por pueda ser aprovechado en diversas
enzimas segregadas conocidas como áreas (Ahmad, et al., 2010).
Objetivos. por 48 h a 37°C, se colocaron 10 gotas
de KOH al 40% y 15 gotas de alfa-naftol
Desarrollar técnicas comunes para
dentro del campo estéril del mechero, se
observar la acción enzimática bacteriana
mezcló suavemente y se observó el
en diferentes sustratos, datos son
cambio en la coloración.
esenciales para la identificación.
Respiración de carbohidratos.
Metodología.
Prueba de la oxidasa.
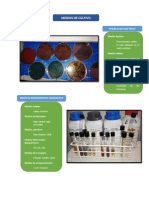
Fermentación de carbohidratos.
En una placa de agar nutritivo se cultivó
En 5 tubos con tapón con caldo con
P. aeruginosa con la técnica de estría
carbohidratos (glucosa, maltosa,
cruzada con ayuda de un asa
sacarosa, lactosa y manitol) preparados
previamente esterilizada dentro del
con campana de Durham y rojo de fenol
campo estéril del mechero, se puso a
se sembró E. coli dentro del área estéril
incubar por 48 horas a 37°C, dentro del
del mechero, utilizando un asa
campo estéril del mechero se tomó un
previamente esterilizada en el mechero,
papel estéril y en este se colocó una gota
flameando cada tubo con caldo y el tubo
de oxalato de dimetil-p-fenilendiamino,
de E. coli al abrirlo y antes de cerrarlo.
sobre esta gota se frotó una colonia
Se colocaron los tubos a incubar por 24 h
aislada joven tomada con el asa estéril y
a 37°C para observar los cambios de
se observó el cambio en la coloración,
coloración en el medio y generación de
también se observó la reacción con S.
gas en forma de burbuja en la campana
aureus.
de Durham.
Prueba de la catalasa.
Fermentación ácido-mixta (prueba del
rojo de metilo). En una placa de agar nutritivo se cultivó
P. aeruginosa con la técnica de estría
Se tomó un tubo de medio rojo de metilo-
cruzada con ayuda de un asa
Voges Proskauer, se abrió dentro del
previamente esterilizada dentro del
campo estéril del mechero, se flameó, al
campo estéril del mechero, se puso a
igual que el tubo con Enterobacter sp., se
incubar por 48 horas a 37°C, se tomó un
tomó una asada de la bacteria con el asa
portaobjetos sobre se colocó una colonia
previamente esterilizada en el mechero y
aislada tomada el asa estéril y se agregó
se inoculó el tubo con el caldo, se incubó
una gota de H2O2 para observar la
por 48 h a 37°C, se colocaron 5 gotas de
reacción dentro del campo estéril del
rojo de metilo dentro del campo estéril
mechero, también se observó la reacción
del mechero y se observó el cambio en la
con S. aureus.
coloración.
Reducción de nitratos.
Fermentación 2,3-butanediol (prueba de
Voges Proskauer). Un tubo con caldo nitrato y campana de
Durham se inoculó con B. subtilis dentro
Se tomó un tubo de medio rojo de metilo-
del campo estéril del mechero y con un
Voges Proskauer, se abrió dentro del
asa esterilizada, flameando el tubo con la
campo estéril del mechero, se flameó, al
bacteria y del medio después de abrirlo,
igual que el tubo con Enterobacter sp., se
se incubó por 48 h a 37°C. Después, se
tomó una asada de la bacteria con el asa
observó el cambio en el medio, se
previamente esterilizada en el mechero y
agregaron 4 gotas de ácido sulfanílico y
se inoculó el tubo con el caldo, se incubó
4 gotas de alfa-naftil-amina dentro del de rojo-rosa a amarillo en el caso de
campo estéril del mechero y se observó maltosa y manitol, este cambio indica un
el cambio en la coloración. vire de un pH de aproximadamente 8.5 a
un pH de 6.5 indicado por el rojo de fenol
Hidrólisis de grandes moléculas.
en el medio, el cambio a amarillo indica
Hidrólisis de almidón. que E. coli dio positivo a fermentación de
carbohidratos, al observar la campana de
Se tomó una placa de agar-almidón Durham se observó la formación de una
dividida en 3, dentro del campo estéril del burbuja por la formación de gas,
mechero se tomó una asada de B. observándose una mayor formación en el
subtilis y se inoculó 1/3 de la placa, se caso de la sacarosa y el manitol y una
esterilizó el asa y se tomó una asada de menor formación en el tubo de lactosa.
E. coli para inocular otro tercio de la
placa, dejando 1/3 como control, se Fermentación ácido-mixta (prueba del
incubó a 37°C por 48 h, se colocaron rojo de metilo).
unas gotas de almidón sobre cada tercio
Al agregar el rojo de metilo hubo un
de la placa y se observó si el lugol
cambio en la coloración de blanco turbio
cambió o no de coloración por la
a rojo, indicando que hay un pH ácido y
presencia o ausencia del almidón en el
que hubo una fermentación ácido-mixta
medio.
por parte de la Enterobacter sp.
Hidrólisis de caseína.
Fermentación 2,3-butanediol (prueba de
Se tomó una placa de agar-leche Voges Proskauer).
descremada dividida en, dentro del
Al agregar los respectivos reactivos se
campo estéril del mechero se tomó una
produjo una coloración negra, la cual
asada de B. subtilis y se inoculó 1/2 de la
debió ser roja para indicar un positivo, sin
placa, se esterilizó el asa y se tomó una
embargo, posiblemente los reactivos
asada de E. coli para inocular la otra
estaban caducos, por lo que se toma el
mitad, se incubó a 37°C por 48 h, y se
color negro como un positivo.
observaron o no halos transparentes
formados por las bacterias. Respiración de carbohidratos.
Hidrólisis de gelatina. Prueba de la oxidasa.
Se tomó un tubo con agar gelatina, se Después de agregar el reactivo oxidasa
abrió dentro del campo estéril del en el papel y sobre este la colonia, se
mechero, se flameó, se tomó con el asa observó un cambio de coloración a azul
recta una asada de E. coli y se inoculó el por parte de las P. aeruginosa, indicando
tubo con el agar con una punción, se un resultado positivo, al realizar la
incubó por 48 h a 37°C y se observó el prueba en S. aureus no se produjo
cambio en el medio. cambio en la coloración, indicando que
es una bacteria oxidasa-negativa.
Resultados.
Prueba de la catalasa.
Fermentación de carbohidratos.
Al realizar la prueba en S. aureus y P.
En los tubos se observó el cambio de
aeruginosa se observó efervescencia por
coloración de rojo-naranja a amarillo en
la liberación de O2 del H2O2 indicando
el caso de glucosa, sacarosa y lactosa y
que son bacterias catalasa positivas.
Reducción de nitratos. fermentan la glucosa para producir el
2,3-butanediol (Varela, 2002).
La bacteria B. subtilis redujo los nitratos
a nitritos ya que, al agregar los reactivos, La S. aureus se presenta como oxidasa-
se produjo un cambio de coloración del negativa, por lo que da negativo a esta
medio a rosa en unos segundos, pero se prueba, mientras que la P. aeruginosa es
llegó al color rojo después de unos oxidasa-positiva, ya que da un cambio en
minutos, siendo cada vez más intensa la la coloración al entrar en contacto con el
coloración. reactivo oxidasa en la prueba (Shields &
Cathcart, 2010).
Hidrólisis de grandes moléculas.
La S. aureus produce enzima catalasa,
Hidrólisis de almidón.
por ello permite la rápida degradación de
Al agregar el lugol este reaccionó con el H2O2 en H2O y una rápida liberación de
almidón del medio en el tercio del control, O2, ocurriendo lo mismo con P.
produciendo un color morado, al aeruginosa, por lo que ambas bacterias
colocarlo en el tercio con E. coli, se son catalasa-positivas (Ibrahim, 2014;
observa la misma coloración, indicando Aryal, 2018).
que no hidroliza el almidón, al agregarlo
La mayoría de las bacterias pueden
en el tercio con B. subtilis el lugol
utilizar los nitratos como fuente de
mantuvo su coloración amarillenta,
nitrógeno, en el caso de la vía del nitrito
indicando que se hidrolizó el almidón.
es debido a la reducción asimiladora,
Hidrólisis de caseína. como se observa en la B. subtilis, a
pesar de que no se observó gas en la
En este caso la placa se deshidrató, sin campana, el vire a color rojo indica esta
embargo, la B. subtilis y la E. coli no reducción (Varela, 2002).
presentaron un halo transparente, o sea,
no hubo cambio en el medio, indicando Los B. subtilis cuentan con la enzima
que no hidrolizaron la caseína. amilasa, ya que esta hidroliza el almidón,
por lo que no se observa el cambio de
Hidrólisis de gelatina. coloración a morado al agregar el lugol,
El medio con E. coli no presentó una lo cual no se observa con el E. coli, que
licuefacción de la gelatina, por lo que no hidrolizó el almidón, ya que no
esta bacteria no la hidroliza. produce la enzima amilasa (Los
endoesporas, 2013).
Discusión.
La hidrólisis de la gelatina y la caseína
E. coli fermenta glucosa y lactosa son observadas por su licuefacción y la
produciendo gas (Reyes, 2011), tanto generación de un halo transparente en el
esta bacteria como las que pertenecen al medio, respectivamente, lo cual no fue
grupo de las enterobacterias observado con E. coli en la gelatina ni
(Enterobacter sp.) fermentan las con P. aeruginosa y E. coli en la placa de
hexosas, razón por la cual la E. coli fue caseína (Salgado, et al., 2010).
positiva en la fermentación de los
carbohidratos, así como la Enterobacter Conclusión.
sp. fue positiva en la fermentación ácido- Las bacterias pueden presentar
mixta y en la fermentación del 2,3- características en su metabolismo que
butanediol, ya que la Enterobacter sp. pueden ser similares en algunos casos,
sin embargo, pueden también presentar Aryal, S. (2018). Biochemical Test of
diferentes enzimas que pueden permitir Pseudomonas aeruginosa. Microbiology
su diferenciación con diferentes pruebas. Info.com. Recuperado de:
Esto también puede permitir el https://microbiologyinfo.com/biochemical-
aprovechamiento de cierta acción test-and-identification-of-pseudomonas-
enzimática para dar su aplicación en aeruginosa/
diferentes aspectos donde se requiera la
Los endoesporas. (2013). Morfología del
obtención o uso de cierta esta enzima.
Bacillus Subtilis en Crecimiento Fractal
Referencias. No Lineal. Concurso universitario Feria
de las Ciencias.
Madigan, M., Martinko, J., Bender, K.,
Buckley, D. & Stahl, D. (2015). Brock.
Biología de los microorganismos. 14ª
edición. Martín, M. Pearson educación.
Madrid.
Schlegel, H. & Zaborosch, C. (1997).
Microbiología general. Ediciones Omega,
S.A. Barcelona.
Ahmad, N., Lawrence, W. & Plorde, J.
(2010). Sherris. Microbiología médica.
Quinta edición. Mc Graw-Hill educación.
Reyes, A. (2011). Escherichia coli. E.E.
Microbiología General. UV.
Varela, G. (2002). FISIOLOGIA Y
METABOLISMO BACTERIANO. Instituto
de Higiene. Universidad de la República.
Salgado, I., Durán, C., Cruz, M.,
Carballo, M. & Martínez, A. (2010).
BACTERIAS RIZOSFÉRICAS CON
POTENCIALIDADES FISIOLÓGICAS
PARA ELIMINAR MATERIA ORGÁNICA
DE AGUAS RESIDUALES. Universidad
de La Habana & UNAM.
Shields, P. & Cathcart, L. (2010).
Oxidase Test Protocol. American Society
for Microbiology.
Ibrahim, H. (2014). Staphylococcus
aureus Can Produce Catalase Enzyme
When Adding to Human WBCs as a
Source of H2O2 Productions in Human
Plasma or Serum in the Laboratory.
National Ribat University, Khartoum,
Sudan.
También podría gustarte
- Métodos analíticos de microbiología general y aplicadaDe EverandMétodos analíticos de microbiología general y aplicadaCalificación: 5 de 5 estrellas5/5 (1)
- Informe 6 Micro Ind (Esterilidad Comercial)Documento7 páginasInforme 6 Micro Ind (Esterilidad Comercial)Daniel Giraldo0% (1)
- Formato General InformesDocumento7 páginasFormato General InformesJose Meza ManceraAún no hay calificaciones
- Técnicas ómicas aplicadas al estudio de la microbiotaDe EverandTécnicas ómicas aplicadas al estudio de la microbiotaAún no hay calificaciones
- Iso 11133 2 Es PDFDocumento34 páginasIso 11133 2 Es PDFKatherine Consuegra50% (2)
- Informe 6 MicroDocumento6 páginasInforme 6 MicroalisonAún no hay calificaciones
- Informe #6 MicroDocumento14 páginasInforme #6 MicroSamuel Peralta OjedaAún no hay calificaciones
- Acción de Microorganismos Sobre CarbohidratosDocumento5 páginasAcción de Microorganismos Sobre CarbohidratosCésar Arteaga100% (1)
- Articulo de Clostridium SporogenesDocumento8 páginasArticulo de Clostridium SporogenesCeciiPadillaAún no hay calificaciones
- Informe 1 EnterobacteriaceaeDocumento13 páginasInforme 1 EnterobacteriaceaeYESSICALISBETHTAAún no hay calificaciones
- Trabajo-Ensayo-Pruebas - Bioquímicas - Identificación - BacteriasDocumento6 páginasTrabajo-Ensayo-Pruebas - Bioquímicas - Identificación - BacteriasCRISTIAN DE LA TORRE BENDEZUAún no hay calificaciones
- Metabolismo BacterianoDocumento5 páginasMetabolismo BacterianoOctavio Cardenas Orozco0% (1)
- Familia EnterobacteriaceaeDocumento38 páginasFamilia EnterobacteriaceaePEDRO HONORATO CHAMBA ORDINOLAAún no hay calificaciones
- L2 A2 Práctica 5Documento11 páginasL2 A2 Práctica 5Zyanya Galilea Estrada MenesesAún no hay calificaciones
- Informe de MicrobiologíaDocumento8 páginasInforme de MicrobiologíaCifuentes MartinezAún no hay calificaciones
- Guia de Laboratorio Aislamiento e Identificacion de Clostridium SPPDocumento5 páginasGuia de Laboratorio Aislamiento e Identificacion de Clostridium SPPLEIDE VANESSA GONZALEZ RUEDAAún no hay calificaciones
- Reporte Catalasa y CoagulasaDocumento11 páginasReporte Catalasa y CoagulasaMarlenAún no hay calificaciones
- Informe 2 Micrococcus y StaphyloccusDocumento14 páginasInforme 2 Micrococcus y StaphyloccusYESSICALISBETHTA100% (2)
- Accion de Los Microorganismos Sobre Diversos Sustratos - Hisbi Mendoza Brayan Jahir-Micr. e Inmunología - ZootecniaDocumento6 páginasAccion de Los Microorganismos Sobre Diversos Sustratos - Hisbi Mendoza Brayan Jahir-Micr. e Inmunología - ZootecniaCESAR ANTONIO NOMBERTO LEIVAAún no hay calificaciones
- Informe #1 Recuento en PlacaDocumento12 páginasInforme #1 Recuento en Placajavier hoyosAún no hay calificaciones
- Práctica N10 Nutricion y Toxicologia AlimentariaDocumento8 páginasPráctica N10 Nutricion y Toxicologia AlimentariaJV JhonnyAún no hay calificaciones
- Practica 8 Microbiologia ImprimirDocumento4 páginasPractica 8 Microbiologia ImprimirMaria Camila Melo BaronaAún no hay calificaciones
- C 2 Prática 3Documento11 páginasC 2 Prática 3Renzo TrujilloAún no hay calificaciones
- Parte 2Documento16 páginasParte 2Emily ParraAún no hay calificaciones
- Cultivo y Aislamiento BacteriasDocumento5 páginasCultivo y Aislamiento BacteriasJosé Romero CojalAún no hay calificaciones
- Caracterización Bioquimica de Enterobacterias y BacilosDocumento15 páginasCaracterización Bioquimica de Enterobacterias y BacilosAlejandra Mosquera CabreraAún no hay calificaciones
- Géneros Micrococcus y StaphylococcusDocumento24 páginasGéneros Micrococcus y StaphylococcusPEDRO HONORATO CHAMBA ORDINOLAAún no hay calificaciones
- Informe Final de Microbiologia (1) 2Documento11 páginasInforme Final de Microbiologia (1) 2Lina FernandaAún no hay calificaciones
- 215 - Guia para La Identificacion de Las BacteriaDocumento24 páginas215 - Guia para La Identificacion de Las BacteriaCinthia Lizaraso VelapatiñoAún no hay calificaciones
- Morfologia Bacteria Bacillus PseudofirmusDocumento7 páginasMorfologia Bacteria Bacillus PseudofirmusNoelia NoelsAún no hay calificaciones
- OVA - Semana 06Documento7 páginasOVA - Semana 06JersonAlbertoUrbinaFloresAún no hay calificaciones
- Informe Practica 3Documento10 páginasInforme Practica 3Dayanna Alexandra Duran BarreiroAún no hay calificaciones
- Informe de Anabolismo y CatabolismoDocumento19 páginasInforme de Anabolismo y CatabolismoVanessa SánchezAún no hay calificaciones
- Staphylococcus AureusDocumento5 páginasStaphylococcus AureusCamilaLAún no hay calificaciones
- Informe Practica 3 Preparacion de MediosDocumento10 páginasInforme Practica 3 Preparacion de MediosmanoloAún no hay calificaciones
- 11 Practica MICRO 2DA FASE 23Documento14 páginas11 Practica MICRO 2DA FASE 23MARTIN ALONSO DEL CAUTIVO ZAVALA LINARESAún no hay calificaciones
- Informe 7Documento7 páginasInforme 7Lau RiveraAún no hay calificaciones
- Higiene 2Documento8 páginasHigiene 2luis velascoAún no hay calificaciones
- Práctica 10Documento8 páginasPráctica 10vegangoAún no hay calificaciones
- Guia Micro 3Documento29 páginasGuia Micro 3alsid009Aún no hay calificaciones
- Lab 6 Flora Del Tracto GastrointestinalDocumento6 páginasLab 6 Flora Del Tracto GastrointestinalAlizon Martinez AlvaradoAún no hay calificaciones
- Informe Siembra e Identificacion de MesofilosDocumento6 páginasInforme Siembra e Identificacion de MesofilosCristian David Zuluaga PatiñoAún no hay calificaciones
- Bacteriología Informe 3Documento19 páginasBacteriología Informe 3Brayan Anthony Ortiz MedranoAún no hay calificaciones
- COPROCULTIVODocumento21 páginasCOPROCULTIVOJamilette Ramos SaverioAún no hay calificaciones
- Laboratorio MicrobiologiaDocumento10 páginasLaboratorio MicrobiologiaJennifeer Daniela MOLINA POVEDAAún no hay calificaciones
- Articulo de Clostridium SporogenesDocumento8 páginasArticulo de Clostridium SporogenesKali Gonzalez PetroAún no hay calificaciones
- Informe #1 de MicrobiologiaDocumento5 páginasInforme #1 de MicrobiologiaMAIRA ALEJANDRA ROJAS CAROAún no hay calificaciones
- Informe Metabolismo MicrobianoDocumento8 páginasInforme Metabolismo MicrobianoJorge Ddc67% (3)
- Practica de LaboratorioDocumento11 páginasPractica de LaboratorioAlonso de la FuenteAún no hay calificaciones
- Práctica 6Documento11 páginasPráctica 6FERNANDA NAYLI POMASUNCO HUILLCAAún no hay calificaciones
- Portafolio MicrobiologíaDocumento44 páginasPortafolio MicrobiologíaEduardo Andres Villar AguirreAún no hay calificaciones
- Informe Metabolismo BacterianoDocumento16 páginasInforme Metabolismo Bacterianoluna martinezAún no hay calificaciones
- Métodos de Identificación Bacteriana (Buchar, J Guerra, J) (g1)Documento7 páginasMétodos de Identificación Bacteriana (Buchar, J Guerra, J) (g1)José Antonio OsunaAún no hay calificaciones
- MEGAREPORTEDocumento42 páginasMEGAREPORTEANGEL RAMON PACHECO PLASCENCIAAún no hay calificaciones
- Informe LevadurasDocumento5 páginasInforme LevadurasYendrek Velazquez100% (1)
- Microbiologia de Alimentos: Practica Nº 14-Aislamiento e Identificacionde Clostridium PerfringensDocumento5 páginasMicrobiologia de Alimentos: Practica Nº 14-Aislamiento e Identificacionde Clostridium PerfringensRomulo Aycachi Inga100% (4)
- Preinfrome 4y5AISLAMIENTO POR ESTRIA E IDENTIFICACIÓN BIOQUIMICA DE UN MICROORGANISMODocumento8 páginasPreinfrome 4y5AISLAMIENTO POR ESTRIA E IDENTIFICACIÓN BIOQUIMICA DE UN MICROORGANISMOMelissa Grisales BarraganAún no hay calificaciones
- Preparacion - de - Medios de Medios de CultivoDocumento10 páginasPreparacion - de - Medios de Medios de CultivoJorge OsorioAún no hay calificaciones
- Laboratorio Virtual Bacteriologia Interactiva Grupo 4Documento4 páginasLaboratorio Virtual Bacteriologia Interactiva Grupo 4Andrea Catalina PERDOMO RODRIGUEZAún no hay calificaciones
- Análisis funcional y microbiológico de derivados lácteos y cárnicosDe EverandAnálisis funcional y microbiológico de derivados lácteos y cárnicosAún no hay calificaciones
- Análisis de Alimentos. Fundamentos y TécnicasDe EverandAnálisis de Alimentos. Fundamentos y TécnicasAún no hay calificaciones
- Mesófilos AerobiosDocumento3 páginasMesófilos AerobiosVALERIA MONTSERRAT RODRIGUEZ ACEVEDOAún no hay calificaciones
- Aislamiento de MicroorganismosDocumento6 páginasAislamiento de MicroorganismosNatt MejaiAún no hay calificaciones
- Reporte#8 MonteroMaríaJoséDocumento5 páginasReporte#8 MonteroMaríaJoséMajo Ust12Aún no hay calificaciones
- Cuestionario 4 Parte 2Documento3 páginasCuestionario 4 Parte 2Brigith SandovalAún no hay calificaciones
- AntibiogramaDocumento7 páginasAntibiogramaJuan Ignacio Cardenas RodriguezAún no hay calificaciones
- Control Higienico SanitarioDocumento29 páginasControl Higienico SanitarioWenRo Villa AraAún no hay calificaciones
- N°6 Medios de CultivoDocumento3 páginasN°6 Medios de CultivoJansen PCAún no hay calificaciones
- EnrequesinientoDocumento26 páginasEnrequesinientoVerito AlexaAún no hay calificaciones
- Manual Procedimientos 3 Monitoreo Bacteriologico Limpieza deDocumento33 páginasManual Procedimientos 3 Monitoreo Bacteriologico Limpieza deDiego fernando Roncancio AriasAún no hay calificaciones
- La Produccion de Alimento Vivo y Su Importancia en AcuaculturaDocumento19 páginasLa Produccion de Alimento Vivo y Su Importancia en AcuaculturaJose David CastroAún no hay calificaciones
- Agar NutritivoDocumento8 páginasAgar NutritivoBrando Kevin Palomino MorenoAún no hay calificaciones
- PALABRASDocumento2 páginasPALABRASJosselin CárdenasAún no hay calificaciones
- Re-10-Lab-303 Microbiologia de Alimentos GastronomíaDocumento21 páginasRe-10-Lab-303 Microbiologia de Alimentos Gastronomíacoco anzeAún no hay calificaciones
- Practica 2 - CoprocultivoDocumento9 páginasPractica 2 - CoprocultivoEduardo Valles100% (1)
- Conceptos Basicos en MicrobiologiaDocumento54 páginasConceptos Basicos en MicrobiologiaYass ManshamAún no hay calificaciones
- 9 Lab 4 STAPHYLOCOCCUS AUREUSDocumento45 páginas9 Lab 4 STAPHYLOCOCCUS AUREUSrenegabrielAún no hay calificaciones
- Informe de Anabolismo y CatabolismoDocumento19 páginasInforme de Anabolismo y CatabolismoVanessa SánchezAún no hay calificaciones
- Microbiología de Alimentos Archives - Microkit - Medios de CultivoDocumento18 páginasMicrobiología de Alimentos Archives - Microkit - Medios de CultivoRous Arely X. CorderoAún no hay calificaciones
- Tecnicas de SiembraDocumento6 páginasTecnicas de SiembraCompañia Europea De EspectaculosAún no hay calificaciones
- Practica 9 Aislamiento RhizobiumDocumento5 páginasPractica 9 Aislamiento RhizobiumRichard Gordillo50% (2)
- Pseudomonas AeruginosaDocumento2 páginasPseudomonas AeruginosaCAún no hay calificaciones
- Guia Medios de CultivoDocumento9 páginasGuia Medios de CultivoJOSE ELIZARDO LLORENTE RODRIGUEZAún no hay calificaciones
- Agar MycoselDocumento3 páginasAgar MycoselDaniel CabreraAún no hay calificaciones
- Presentacion LecheDocumento22 páginasPresentacion LecheOsmarly J' Castillo CAún no hay calificaciones
- Cuadro de AgaresDocumento4 páginasCuadro de AgaresNaruginAún no hay calificaciones
- CeparioDocumento5 páginasCeparioJavier Montoya100% (1)
- CapnocytophagaDocumento2 páginasCapnocytophaganydiacastillom2268Aún no hay calificaciones
- b02147 Rev 01-Cerebro Corazon Infusion AgarDocumento2 páginasb02147 Rev 01-Cerebro Corazon Infusion Agarandent masonAún no hay calificaciones
- Informe de Practica N° 6aislamiento e Identificación de Lactobacillus Delbruechii y L. PlantarumDocumento9 páginasInforme de Practica N° 6aislamiento e Identificación de Lactobacillus Delbruechii y L. PlantarumLuis Manuel Bances VergaraAún no hay calificaciones