0% encontró este documento útil (0 votos)
337 vistas21 páginasPráctica de Coprocultivo en Bacteriología
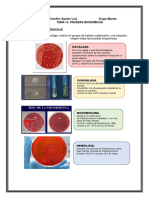
El documento describe una práctica de laboratorio sobre coprocultivo que incluye la técnica de siembra, la lectura del medio TSI modificado y la observación microscópica de bacterias. El objetivo es observar y analizar aspectos relacionados con el coprocultivo para identificar bacterias patógenas como E. coli, Salmonella y Shighella presentes en las heces.
Cargado por
Jamilette Ramos SaverioDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
337 vistas21 páginasPráctica de Coprocultivo en Bacteriología
El documento describe una práctica de laboratorio sobre coprocultivo que incluye la técnica de siembra, la lectura del medio TSI modificado y la observación microscópica de bacterias. El objetivo es observar y analizar aspectos relacionados con el coprocultivo para identificar bacterias patógenas como E. coli, Salmonella y Shighella presentes en las heces.
Cargado por
Jamilette Ramos SaverioDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd