0% encontró este documento útil (0 votos)
348 vistas4 páginasProcesos de Destilación y Balances de Materia
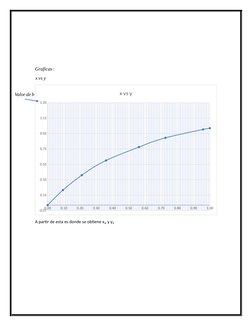
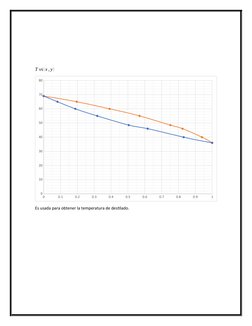
Este documento presenta los conceptos y ecuaciones clave para los procesos de separación por destilación. Explica cómo calcular las fracciones molares y de peso de los componentes líquidos y gaseosos, así como las presiones parciales y leyes que rigen la destilación, incluidas las ecuaciones de Rault, Raleigh y Antoine. También cubre los balances de materia, calor y gráficas utilizadas para determinar las condiciones de operación de un proceso de destilación.
Cargado por
Xanath PotDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
348 vistas4 páginasProcesos de Destilación y Balances de Materia
Este documento presenta los conceptos y ecuaciones clave para los procesos de separación por destilación. Explica cómo calcular las fracciones molares y de peso de los componentes líquidos y gaseosos, así como las presiones parciales y leyes que rigen la destilación, incluidas las ecuaciones de Rault, Raleigh y Antoine. También cubre los balances de materia, calor y gráficas utilizadas para determinar las condiciones de operación de un proceso de destilación.
Cargado por
Xanath PotDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd