Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Transplantes y Rechazo
Cargado por
Double L.ADescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Transplantes y Rechazo
Cargado por
Double L.ACopyright:
Formatos disponibles
TRANSPLANTES Y RECHAZO
TRANSPLANTE
HISTORIA
Los trasplantes de órganos constituyen uno de los más grandes logros terapéuticos del siglo
XX, vinculado históricamente al desarrollo cultural de la humanidad y a su deseo irrefrenable
de perpetuarse.
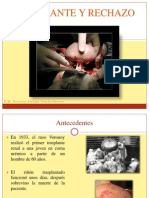
En 1936, cuando el ruso Yu Yu Voronoy realizó el primer trasplante renal en humanos al aplicar
las anastomosis vasculares desarrolladas en Lyon, Francia, por Mathieu Jaboulay y Alexis
Carrel,
En 1954, en el Hospital Peter Bent Brigham de Boston, EUA, cuando realizaron el primer
trasplante exitoso entre gemelos idénticos, y cuando el urólogo Hartwell Harrison realizó la
nefrectomía del donador y el cirujano plástico Joseph Murray realizó el implante en el
receptor, enfrentando así las barreras inmunológicas.
Aunque a mediados del decenio de 1950-59 a las barreras inmunológicas para el trasplante
entre individuos no idénticos se les consideraba insuperables, un número importante de
sucesos en el laboratorio condujo a un mayor avance en el campo de la inmunología de los
trasplantes. Un logro histórico sobre la inducción de tolerancia neonatal fue obtenido por
Brent y Medawar, al demostrar que los ratones adultos podían tolerar injertos de piel, pero
dicho método no fue práctico en humanos. Su uso en los laboratorios fue incrementándose
con la confianza en que pronto solucionaría el rechazo del injerto en la clínica. Tan atractivo
resultó este método de supresión que otras propuestas, como los esteroides, fueron
desechados. Fue Avrion Mitchison quien estableció con firmeza el papel de la inmunidad
celular como un importante efector en los mecanismos del trasplante. El papel crucial del timo
en la mediación de la inmunidad celular y el rechazo de los injertos fue establecido por JFAP
Miller, al demostrar que los ratones que habían sido timectomizados durante el periodo
neonatal sufrían un agotamiento de linfocitos y, como resultado, carecían de capacidad para
rechazar aloinjertos de piel. El descubrimiento de los antígenos de leucocito humano o HLA
(Human Leukocyte Antigens), al final del decenio de 1950-59, puede ser atribuida a los
estudios independientes de Rose Payne en Stanford, Jon van Rood en Leiden y Jean Dausset,
en París.
¿QUE ES EL TRANSPLANTE?
Trasplantar es sustituir un órgano o tejido enfermo por otro que funcione adecuadamente.
Actualmente se llevan a cabo miles de trasplantes cada año en todo el mundo, y constituyen
sin duda una alternativa real a muchas enfermedades.
Los órganos más frecuentemente trasplantados son:
Riñón
Hígado
corazón
pulmón.
Cada uno de ellos con características especiales. También se trasplantan tejidos (hueso, piel,
válvulas cardiacas) o células, como las células pancreáticas y las células madre.
Si el injerto se coloca en su localización anatómica normal, el procedimiento se conoce como
Transplante ortotópico; si se coloca en un sitio diferente, el procedimiento se denomina
transplante heterotópico.
TIPOS DE TRANSPLANTE
TRASPLANTE SINGÉNICO: donante y receptor son gemelos idénticos.
TRASPLANTE ALOGÉNICO: donante y receptor son distintos genéticamente, pero de la
misma especie. Es el tipo más frecuente.
TRASPLANTE AUTÓLOGO: las células o tejidos trasplantados proceden del propio
receptor del trasplante.
XENOTRASPLANTE: el donante y el receptor son de especies animales distintas
Las moléculas que resultan extrañas al organismo receptor se llaman aloantígenos en los
aloinjertos y xenoantígenos en los xenoinjertos.
Los linfocitos o anticuerpos que reaccionan ante estas moléculas se denominan alorreactivos y
xenorreactivos, respectivamente.
LOS MECANISMOS DE LA INMUNIDAD ESPECÍFICA incluyen la participación de elementos
celulares linfoides cuyas membranas están provistas de receptores para antígenos, elementos
clave para que estas células sean capaces de identificar, conjugar y activarse metabólicamente
por el exclusivo epitopo correspondiente a cada una de ellas. Como resultado de esta
activación biológica, dichas células responden al estímulo antigénico específico ya sea
sintetizando moléculas de anticuerpos (inmunidad humoral) o induciendo la producción de
células efectoras (inmunidad celular), ambas con la capacidad de reaccionar en forma estricta
con el epitopo que determinó la activación inicial del sistema.
TIPOS ESPACIFICOS DE TRANSPLANTES:
1. TRASPLANTE RENAL
Es la terapéutica de elección para la mayoría de los enfermos con insuficiencia renal
terminal en diálisis. Consiste en implantar en un receptor uno, o a veces los dos
riñones. El donante renal puede ser un cadáver o, dado que el riñón es un órgano par,
también puede ser un vivo, emparentado o no emparentado. El riñón injertado puede
iniciar la diuresis en el mismo acto quirúrgico, o retrasarla durante un periodo de días
o semanas hasta que se recupere de la necrosis tubular aguda (NTA).
2. TRASPLANTE HEPÁTICO
El hígado es un órgano técnicamente muy complejo de trasplantar. Requiere un equipo
numeroso y bien coordinado. Las indicaciones más frecuente son, por este orden,
cirrosis no biliar (59%), tumores (19.9%), re-trasplante (5.6%) y colestasis crónica (5%).
En niños la indicación más frecuente fue la atresia de vías biliares (los datos se refieren
a estadísticas del año 2007). En el caso del trasplante hepático, también hay casos de
donante vivo, aunque son poco frecuentes.
3. TRASPLANTE CARDIACO
El trasplante cardiaco (TC) es un tratamiento muy complejo que en los últimos años se
ha convertido en una opción válida para determinados pacientes con cardiopatías
graves. Existen dos modos de realizar unTC:
TC ortotópico, en el cual el corazón del receptor se extrae y se reemplaza por el
corazón del donante en su correcta posición anatómica.
TC heterotópico en el cual el corazón del donante se coloca en paralelo al
corazón del receptor, anastomosándose a éste de tal manera que permite que
la sangre pase a través de uno y/o ambos corazones. Este procedimiento está
prácticamente en desuso y sólo se utiliza en excepciones
4. TRASPLANTE DE PULMÓN
Las indicaciones más frecuentes para este tipo de trasplantes son la EPOC (30%) , la
Fibrosis Pulmonar (26%), y la Fibrosis Quística (17%). Otras indicaciones menos
frecuente son: las bronquiectasias, la hipertensión pulmonar y el retrasplante. La
modalidad de trasplante cardiopulmonar presenta una gran complejidad técnica.
5. TRASPLANTE ALOGÉNICO DE MÉDULA ÓSEA (TMO)
El trasplante alogénico de médula ósea (TMO), consiste en la perfusión intravenosa al
receptor, de médula ósea aspirada del donante. Al ser el aspirado rico en células
inmunocompetentes, el mecanismo de rechazo es bidireccional, pues ambos sistemas
inmunes (el del receptor y el del donante, constituido por los linfocitos presentes en la
suspensión medular transfundida) reconocen como extraños al oponente.
RECHAZO DEL TRANSPLANTE
El rechazo es el proceso por el cual el sistema inmunitario reconoce al órgano
trasplantado (injerto) como extraño, se sensibiliza contra él y reacciona para tratar de
destruirlo. Esta reacción inmunológica está provocada por antígenos extraños del
injerto, no existentes en el receptor. Con excepción del sistema del grupo sanguíneo
ABO, los antígenos del MHC son los más importantes en el desencadenamiento del
rechazo. La trascendencia relativa de los factores humorales o celulares en el rechazo
depende del tipo de órgano trasplantado y del momento cronológico en el que se
encuentre el injerto.
TIPOS DE RECHAZO
RECHAZO HIPERAGUDO.
Puede ocurrir en minutos o pocas horas en individuos previamente sensibilizados,
como pueden ser pacientes que ya han rechazado un órgano trasplantado
previamente, pacientes que han sufrido transfusiones o mujeres que durante el
embarazo han desarrollado anticuerpos frente a antígenos del feto. Ocurre porque en
el receptor del órgano hay anticuerpos circulando preformados contra los antígenos
del órgano trasplantado. Por eso la respuesta es tan inmediata, y generalmente el
órgano sufre necrosis isquémica en el momento de la implantación, y nunca llega a ser
funcional.
RECHAZO AGUDO.
Ocurre pocos días después de efectuado el trasplante, aunque a veces puede ocurrir
meses o años más tarde, al suspender el tratamiento inmunosupresor. Se produce
porque se ponen en marcha los mecanismos de inmunidad humoral y celular. Se
produce edema, daño endotelial e infiltración por linfocitos. También puede haber
fenómenos de trombosis. Suele responder al tratamiento inmunosupresor.
RECHAZO CRÓNICO.
Ocurre a largo plazo porque los tratamientos inmunosupresores fallan en su cometido
de detener la respuesta inmune. A nivel microscópico se producen cambios parecidos
a los del recha zo agudo (cambios inflamatorios y necrosis) que acaban por dañar la
función del órgano trasplantado. Constituye el verdadero reto de la terapia
inmunosupresora.
COMPLEJO PRINCIPAL DE HISTOCOMPATIBILIDAD
En el organismo humano existen proteínas polimorfas, es decir, con pequeñas
diferencias entre un individuo y otro en lo referente a la secuencia de aminoácidos.
Las proteínas con un mayor número de “formas” diferentes son las del sistema HLA. El
alto grado de polimorfismo de estas proteínas de los órganos trasplantados más su
función fisiológica hace que sean desconocidas por el organismo del receptor y
desencadenen una respuesta de rechazo.
El rechazo de tejidos trasplantados entre dos individuos de la misma especie es
consecuencia del reconocimiento de los llamados “antígenos trasplantados”. Estos
antígenos, expresados en la superficie de las células y tejidos, tienen dos funciones:
Estimular la respuesta de rechazo
Actuar como blanco de moléculas para varios mecanismos efectores del
rechazo.
Los genes codifican para los antígenos trasplantados; por lo tanto, la compatibilidad
del tejido está determinada por el órgano trasplantado. Estos genes se conocen como
antígenos de histocompatibilidad.
A partir de diversos estudios, se descubrió que los injertos de piel rechazados en
ratones están bajo el control de más de 20 loci de genes. Sin embargo, se comprobó
que sólo un grupo tenía una influencia mayor, que era el que determinaba el rechazo
agudo entre los 7 y 10 días, y sus constituyentes comenzaron a conocerse como genes
principales de histocompatibilidad.
Por el contrario, los otros genes se refieren como genes menores de
histocompatibilidad, ya que, por lo general, ocasionan un rechazo lento o crónico del
injerto de la piel entre los 20 y los 200 días.
No obstante, ciertos efectos combinados de genes menores de histocompatibilidad
pueden llevar al rechazo agudo.
Otros tantos estudios han demostrado que los genes principales de
histocompatibilidad son parte de un gran complejo de genes que ahora se conoce
como complejo principal de histocompatibilidad o MHC (Major Histocompatibility
Complex). De manera original el MHC en humanos fue caracterizado mediante el
estudio de los glóbulos blancos, de ahí el nombre de antígenos de leucocito humano
(HLA).
Las moléculas del sistema HLA son de tres tipos distintos:
clase I están codificadas en los locus A, B y C
clase II, en los locus DR, DP y DQ
clase III, en los locus C2, C4 y Bf.
Las moléculas de clase I, presentes en casi todas las células del organismo (excepto en
eritrocitos), están constituidas por una molécula fija en la membrana y otra más
pequeña no polimorfa unida a ella. Su función fisiológica es la de presentar péptidos
de antígenos intracelulares, por lo general de origen vírico, a los linfocitos T
citotóxicos. Su presencia en la membrana tiene además un efecto inhibidor de la
actividad citotóxica inespecífica o NK (Natural Killer).
Las moléculas de clase II se expresan sólo en algunas células del organismo, de manera
específica en linfocitos B, macró macrófagos, células dendríticas y algunos endotelios;
presentan dos moléculas fijas en la membrana, una beta y otra alfa. Su función
fisiológica es la de presentar los péptidos en que son fraccionadas las proteínas
exógenas extrañas, lo que permite que los receptores de los linfocitos T o TCr (T-cell
receptor) los reconozcan.
Las moléculas de clase III codifican para los componentes del complemento, varias
enzimas, cininas tales como el factor de necrosis tumoral (TNF-α y TNF-β), y algunas
otras proteínas importantes en la presentación y procesamiento de los antígenos. Sin
embargo, hay muchas otras funciones de estas moléculas que todavía no se definen.
En cierta forma, las moléculas de HLA son como las “bandejas” en que los antígenos se
presentan a los linfocitos T. Esta función determina el tipo peculiar de respuesta que se
desencadena.
La razón del polimorfismo de las moléculas HLA no se conoce, pero podría estar
relacionada con el hecho de que un determinado antígeno fuera presentado por unas
moléculas HLA con más eficacia que por otras. El polimorfismo de las moléculas
presentadoras aumentaría las probabilidades de que algunos de los miembros de la
especie respondieran con mayor eficacia que otros a un determinado agente
infeccioso, con lo que se aseguraría la supervivencia.
FASE DE RECONOCIMIENTO ALOGÉNICO
Hay grandes probabilidades de que el reconocimiento alogénico se produzca por la
migración al ganglio linfático del recep tor de células dendríticas o leucocitos pasajeros,
con función de célula presentadora de antígeno, en donde la APC del donante es
reconocida por algunos linfocitos T y les proporciona dos señales:
1) la primera, mediante la interacción del receptor específico del linfocito T (TCR) con
el HLA clase II del donante, cuyos mensajes intracelulares dependen de un complejo de
cinco cadenas peptídicas, el complejo CD3, que se encuentra junto al TCR a lo largo de
la membrana celular
2) la segunda, que es simultánea por la interacción de las moléculas CD80 (conocida
también como B7-1) o CD86 (conocida también como B7-2) de la célula presentadora
antígenos con CD28 (señal estimuladora) o CTLA-4 (señal inhibitoria) del linfocito T del
receptor.12
Otra señal coestimulante se genera con la unión de CD40 de las APC con el ligando
CD40 (CD40L) de los linfocitos T activados. El conjunto de ambas señales desencadena
la activación de varios factores de transcripción, entre ellos el NFAT, que al unirse a la
zona reguladora del gen de la interleucina 2 (IL-2) activa su producción, y
3) La IL-2 secretada junto con la expresión de receptores para la IL-2 (IL-2R) induce la
tercera señal, necesaria para iniciar la duplicación celular y el proceso de expansión
clonal.
En general, los linfocitos que reconocen los antígenos HLAclase I son CD8+, y los que
reconocen los HLA-clase II son CD4+. La activación de los linfocitos en función de las
señales recibidas y del estado previo da lugar a varios tipos celulares:
1) células secretoras de IL-2, IFN-ã y TNF-â, también llamadas inflamatorias (TH1);
2) células secretoras de IL-4, IL-5, IL-6 e IL-10, llamadas colaboradoras (TH2) y
posiblemente involucradas en la memoria inmunológica,
3) linfocitos T citotóxicos (CTL). Algunos autores han sugerido que las clonas TH1 (IL-2,
INF-ã) y TH2 (IL-10, IL-4) establecerían un equilibrio de inhibiciones mutuas que
regularía la aparición del rechazo, pero los datos al respecto son aún contradictorios.
Todavía existen puntos sin aclarar en este proceso: no está bien definida la
trascendencia del reconocimiento indirecto en el desarrollo de la respuesta; tampoco
se sabe por qué unos receptores producen anticuerpos anti-HLA y otros no lo hacen, a
pesar de repetidas sensibilizaciones.
ALOANTICUERPOS
Cuando los antígenos HLA de un individuo entran en contacto con el sistema
inmunológico de otro individuo de HLA distintopor embarazo, transfusión o trasplante,
en alrededor de 25% de los casos el receptor desencadena una respuesta con
producción de anticuerpos.
En el caso de que en el momento de la implantación un receptor posea aloanticuerpos
contra el donante, se produce una reacción de rechazo aguda en la que se activa la
cascada del complemento y da lugar a:
1) lisis celular a través del complejo de ataque C56789;
2) destrucción por opsonización por C3b, y
3) atracción de polimorfonucleares mediada por C3a y C5a.
Cada uno de los alelos del sistema HLA es una proteína con varios epitopos, es decir
con varias zonas capaces de estimular respuestas por anticuerpos específicos. Algunos
de estos epitopos son comunes a varios alelos. De los alelos que comparten epitopos
se dice que están en reacción cruzada o CREG (Cross Reacting Group). Así, es posible
que un receptor que ha sido trasplantado con un órgano con la incompatibilidad B51
presente anticuerpos contra B51 pero también contra B35, B52 y B18. Ello se debe a la
existencia de epitopos comunes entre B51, B52, B35 y B18. Un concepto similar es el
de subdivisión de antígenos (o split), que se utiliza para denominar a cada uno de los
antígenos en que se ha dividido un antígeno definido de manera inicial como antígeno
amplio (o broad). De hecho es una situación especial de reacción cruzada en la que el
número de epitopos compartidos es más importante que el de los no compartidos.
A veces, existen anticuerpos linfocitotóxicos autorreactivos que no van dirigidos contra
alelos HLA. Estos anticuerpos pueden ocasionar reacciones de pruebas cruzadas
(Cross- Match) positivas que no indican una mayor probabilidad de pérdida del órgano.
Estos autoanticuerpos suelen ser del tipo IgM y pueden eliminarse tratando el suero
con ditiotreitol (DTT). La única forma inequívoca de asegurar su presencia es mediante
la realización de una autoprueba cruzada. En algunos receptores, los anticuerpos
permanecen a lo largo del tiempo,mientras que en otros desaparecen a los pocos
meses de cesar el estímulo antigénico que los originó. Por tradición, se han
almacenado los sueros históricos de los receptores en lista de espera para realizar
pruebas cruzadas no sólo con el suero actual sino también con el histórico. El valor
pronóstico de la existencia de una prueba cruzada positiva con un suero histórico, pero
negativo con el suero del día del trasplante (histórico positivo, actual negativo) ha
variado a lo largo del tiempo y en la actualidad suscita algunas controversias.
REACCIONES INJERTO CONTRA HUÉSPED
En los trasplantes de médula ósea se produce una situación especial: la posibilidad de
desarrollo de la enfermedad de injerto contra huésped (EICH) debido a la presencia de
células T inmunocompetentes procedentes del donante en un receptor alogénico que
no es capaz de eliminarlas. Esta incapacidad puede deberse a las diferencias genéticas
existentes entre el donante y el receptor o a la inmunoincompetencia del receptor (ya
sea por inmadurez o por inmunosupresión). En estos casos, las células T
inmunocompetentes trasplantadas junto con la médula ósea pueden atacar los tejidos
del receptor. La EICH es una de las principales complicaciones del trasplante de médula
ósea y provoca lesiones importantes, sobre todo a nivel cutáneo e intestinal.
TOLERANCIA EN EL TRASPLANTE
La tolerancia en el trasplante puede definirse de dos maneras complementarias: la
tolerancia clínica o funcional, que es la supervivencia de un órgano o tejido ajeno
(alogénico o xenogénico) en un receptor normal en ausencia de inmunosupresión, y la
tolerancia inmunológica, que es la ausencia de una respuesta inmunitaria detectable a
un órgano o tejido funcional en ausencia de inmunosupresión.23
Se han efectuado experimentos en los que se ha inducido la tolerancia a aloantígenos
en modelos animales. La mayoría se fundamenta en remedar los mecanismos
fisiológicos de inducción de tolerancia a los antígenos propios. Para ello, se destruyen
las células maduras del sistema inmunológico y se obliga a las células inmaduras a
madurar en presencia del aloantígeno.
El aloantígeno puede ser administrado en forma de péptidos solubles, por transfección
génica a las células de la médula ósea del receptor, dentro del timo, etc. Todos estos
mecanismos son relativamente ineficaces en seres humanos.24
Por otra parte, también es cierto que algunos pocos de los receptores de trasplantes
que dejan de tomar inmunosupresores años después de realizado el injerto mantienen
la funcionalidad del injerto. Por el momento no se sabe cómo predecir qué receptores
no rechazarán el injerto aunque abandonen la inmunosupresión ni cuáles son los
factores que determinan la ausencia de rechazo.
A principios de los años noventa, la teoría del microquimerismo recibió mucha
publicidad. Esta teoría se basa en el hallazgo de células dendríticas del donante en el
bazo y la piel de receptores de trasplante con órganos que han mantenido la
funcionalidad durante muchos años. Se emitió la hipótesis de que estas células
actuarían como supresoras de la respuesta de rechazo. Es posible sin embargo que la
presencia de estas células no sea la determinante de la aceptación del órgano sino que
sea más bien una consecuencia de la buena aceptación de éste.
Esta controversia está sustentada en reportes de rechazos de injertos en presencia de
microquimerismo y supervivencia del injerto en ausencia de microquimerismo.
La respuesta linfocitaria depende no sólo de la interacción del antígeno con el TCR sino
también de las señales accesorias que recibe el linfocito T a través de la célula
presentadora del antígeno durante esta interacción. Estas señales pueden determinar
que el linfocito T prolifere, muera por apoptosis o pase a un estado de anergia clonal,
con incapacidad para responder al mismo antígeno en el futuro.
También podría gustarte
- Inmunologia de TransplanteDocumento10 páginasInmunologia de TransplanteJISEAún no hay calificaciones
- Inhibición AlogénicaDocumento4 páginasInhibición AlogénicaFERNANDO PINCAY OCAMPOAún no hay calificaciones
- Introduccion A Los Trasplantes - Inmunologia 2do SemestreDocumento12 páginasIntroduccion A Los Trasplantes - Inmunologia 2do SemestreJOSE GUTIERREZAún no hay calificaciones
- Trasplantes PDFDocumento3 páginasTrasplantes PDFxxchimi HoranxxAún no hay calificaciones
- Inmunologia de TransplanteDocumento18 páginasInmunologia de TransplanteCarolina RedondoAún no hay calificaciones
- Rechazo A TrasplanteDocumento51 páginasRechazo A TrasplanteHector PorrasAún no hay calificaciones
- Tios de Transntes, Indicacatural de Lura T.Documento22 páginasTios de Transntes, Indicacatural de Lura T.Bel HkAún no hay calificaciones
- Inmunología Del TrasplanteDocumento26 páginasInmunología Del TrasplanteGilberto GuqAún no hay calificaciones
- Trasplante y RechazoDocumento24 páginasTrasplante y RechazoSoni HE100% (1)
- Inmun TransplanteDocumento52 páginasInmun TransplanteLaura PonceAún no hay calificaciones
- Revisión Bibliográfrica de IsoinjertoDocumento5 páginasRevisión Bibliográfrica de IsoinjertoPamela MaciasAún no hay calificaciones
- Boa 8 Inmunogenetica AbnerDocumento24 páginasBoa 8 Inmunogenetica AbnerLeydi saballosAún no hay calificaciones
- Laboratorios de Histocompatiblidad y Transporte de OrganosDocumento5 páginasLaboratorios de Histocompatiblidad y Transporte de OrganosKaren RuizAún no hay calificaciones
- Seminario 10Documento11 páginasSeminario 10Jasmine OrihuelaAún no hay calificaciones
- TrasplantesDocumento26 páginasTrasplantesDaniela Lopez IturbeAún no hay calificaciones
- Desconocimiento de Los Trasplantes de ÓrganosDocumento7 páginasDesconocimiento de Los Trasplantes de ÓrganosSamy Castillo100% (1)
- PRACTICA 7 de InmunologiaDocumento8 páginasPRACTICA 7 de InmunologiaHECTOR ESTRELLA TOPETEAún no hay calificaciones
- Respuesta Inmune Trabajo FinalDocumento7 páginasRespuesta Inmune Trabajo FinalPatricia Martinez PerezAún no hay calificaciones
- Rechazo de TrasplantesDocumento14 páginasRechazo de TrasplantesZully Denisse Castillo CamaAún no hay calificaciones
- Inmunología Del Trasplante ArticuloDocumento4 páginasInmunología Del Trasplante ArticuloKarina OliveroAún no hay calificaciones
- Rechazo Trasplantes de ÓrganosDocumento4 páginasRechazo Trasplantes de ÓrganosNayareth UlloaAún no hay calificaciones
- Trasplante RechazoDocumento11 páginasTrasplante RechazoMikhail FrandiAún no hay calificaciones
- MicrobiologíaDocumento7 páginasMicrobiologíaSher ValerioAún no hay calificaciones
- Inmunologia de Los TrasplantesDocumento40 páginasInmunologia de Los TrasplantesHeissol OlivasAún no hay calificaciones
- Trasplantes MVC.Documento106 páginasTrasplantes MVC.Boby NavarroAún no hay calificaciones
- El Sistema InmunológicoDocumento40 páginasEl Sistema InmunológicoIvo Zivkovic100% (1)
- Pruebas de HistocompatibilidadDocumento9 páginasPruebas de HistocompatibilidadSofia SimsAún no hay calificaciones
- Trasplante Renal 2014Documento32 páginasTrasplante Renal 2014Vitrena StoreAún no hay calificaciones
- Inmunología de Trasplantes y Rechazo de Injerto - NikosDocumento19 páginasInmunología de Trasplantes y Rechazo de Injerto - Nikosel bellaco del anime nuñezAún no hay calificaciones
- TRASPLANTESDocumento11 páginasTRASPLANTESZaidymar RiveroAún no hay calificaciones
- XENOTRANSPLANTE ComprimidoDocumento20 páginasXENOTRANSPLANTE ComprimidoIngrid Castillo HilarioAún no hay calificaciones
- Cap 21Documento4 páginasCap 21Jannet RVAún no hay calificaciones
- Trasplante de Células Madre, Progenitoras O Hematopoyéticas (Trasplante de Médula Ósea)Documento3 páginasTrasplante de Células Madre, Progenitoras O Hematopoyéticas (Trasplante de Médula Ósea)Camila Córdova LópezAún no hay calificaciones
- Seminario s6 Informe Patología.Documento10 páginasSeminario s6 Informe Patología.Viviana LopezAún no hay calificaciones
- Pruebas de Histocompatibilidad PDFDocumento5 páginasPruebas de Histocompatibilidad PDFSergioAún no hay calificaciones
- Transplante de OrganosDocumento14 páginasTransplante de OrganosEdisonAún no hay calificaciones
- Tejido Inmunitario HistoDocumento23 páginasTejido Inmunitario HistoAlma Rosa OrtizAún no hay calificaciones
- MARCO TEORICO Transplante de OrganosDocumento16 páginasMARCO TEORICO Transplante de OrganosLucia AristimuñoAún no hay calificaciones
- RESUMEN#7 Inmunidad Del TrasplanteDocumento4 páginasRESUMEN#7 Inmunidad Del TrasplanteJessicaAún no hay calificaciones
- Tema 21 Inmunología de Los Trasplantes de ÓrganosDocumento19 páginasTema 21 Inmunología de Los Trasplantes de ÓrganosFernando Gual BarrosoAún no hay calificaciones
- Biotecnología y BiomedicinaDocumento41 páginasBiotecnología y BiomedicinaAlcander D MindAún no hay calificaciones
- Trasplante y Rechazo KubyDocumento24 páginasTrasplante y Rechazo KubyDiana Carolina Puentes CareAún no hay calificaciones
- Trasplante de Medula OseaDocumento5 páginasTrasplante de Medula OseaMarco Tulio Fonseca EntzanaAún no hay calificaciones
- Inmunología de Los TrasplantesDocumento10 páginasInmunología de Los TrasplantesJoselyn Santiago HernándezAún no hay calificaciones
- Trasplante de OrganosDocumento46 páginasTrasplante de OrganosWadys EsmeraldaAún no hay calificaciones
- Prevención y Tratamiento Del Rechazo, y Trasplante Xenógeno.Documento7 páginasPrevención y Tratamiento Del Rechazo, y Trasplante Xenógeno.Vicky StylesAún no hay calificaciones
- Rechazo de TrasplanteDocumento19 páginasRechazo de TrasplanteyoshaAún no hay calificaciones
- Inmunobiología Del Trasplante.Documento14 páginasInmunobiología Del Trasplante.Ruby Dayanna Colorado CastroAún no hay calificaciones
- TrasplantesDocumento9 páginasTrasplantesGabriela OchoaAún no hay calificaciones
- Clase 21 - 10 PDFDocumento4 páginasClase 21 - 10 PDFTomás Grillo PizzichiniAún no hay calificaciones
- Complejo Mayor de HistocompatibilidadDocumento4 páginasComplejo Mayor de HistocompatibilidadEduvijis PichardoAún no hay calificaciones
- Trasplante de Médula ÓseaDocumento6 páginasTrasplante de Médula ÓseaPerla Alejandra Sierra CondeAún no hay calificaciones
- Inmunomodulación Por TransfusiónDocumento26 páginasInmunomodulación Por Transfusiónjuan manuelAún no hay calificaciones
- Clasificación de TrasplantesDocumento11 páginasClasificación de TrasplantesBeltrán Martí100% (3)
- Dinámica Trasplante de Órganos UnidoDocumento38 páginasDinámica Trasplante de Órganos UnidoEstrellita Odar CastilloAún no hay calificaciones
- Caso Inmuno ° 11Documento3 páginasCaso Inmuno ° 11Emily J. RomeroAún no hay calificaciones
- Tema 15Documento7 páginasTema 15Jenny FarinangoAún no hay calificaciones
- Trasplante y RechazoDocumento42 páginasTrasplante y RechazoMayra RetamozoAún no hay calificaciones
- Rechazo de TrasplantesDocumento18 páginasRechazo de TrasplantesRoxana Escobar SantanderAún no hay calificaciones
- Fundamentos del diagnóstico y tratamiento del cáncer en adultos: Una aproximación inicial para el médico no especialista en cáncerDe EverandFundamentos del diagnóstico y tratamiento del cáncer en adultos: Una aproximación inicial para el médico no especialista en cáncerAún no hay calificaciones
- Parte 5. - RiñonDocumento4 páginasParte 5. - RiñonDouble L.AAún no hay calificaciones
- 6 Semana Teoria Microbiologia MedicaDocumento42 páginas6 Semana Teoria Microbiologia MedicaDouble L.AAún no hay calificaciones
- 6 Semana Teoria Microbiologia Medica PDFDocumento42 páginas6 Semana Teoria Microbiologia Medica PDFDouble L.AAún no hay calificaciones
- 4 Semana Teoria Microbiologia PDFDocumento39 páginas4 Semana Teoria Microbiologia PDFDouble L.AAún no hay calificaciones
- Libro CONTAMINACION MALACALZADocumento22 páginasLibro CONTAMINACION MALACALZADouble L.AAún no hay calificaciones
- Enfermedad Trofoblastica y AbortoDocumento77 páginasEnfermedad Trofoblastica y AbortoJaime Cervantes HernandezAún no hay calificaciones
- Valoracion Del Adulto Mayor Artrosis Grupo-4Documento35 páginasValoracion Del Adulto Mayor Artrosis Grupo-4Agustin TigseAún no hay calificaciones
- Aumentacion LcaDocumento31 páginasAumentacion LcaJuan Camilo MateusAún no hay calificaciones
- Tipos de Drogas y Sus EfectosDocumento11 páginasTipos de Drogas y Sus Efectosefren2710Aún no hay calificaciones
- Demencia Frontotemporal: Integrantes: Johana Astorga - Gabriela Benavides-Carla Leyton - Silvia Rodriguez GerontologíaDocumento21 páginasDemencia Frontotemporal: Integrantes: Johana Astorga - Gabriela Benavides-Carla Leyton - Silvia Rodriguez GerontologíaLibros Universitarios UcshAún no hay calificaciones
- AntiplaquetariosDocumento3 páginasAntiplaquetariosjuanc 42011Aún no hay calificaciones
- Aptitud Verbal Pamer 1Documento21 páginasAptitud Verbal Pamer 1Zarela Irina Leiba ArroyoAún no hay calificaciones
- Higiene U Patologia Del MagisterioDocumento20 páginasHigiene U Patologia Del MagisterioPamela Cepeda Ángeles100% (2)
- Ansiedad en La AdolecenciaDocumento10 páginasAnsiedad en La AdolecenciaErick Ivan B MonteroAún no hay calificaciones
- Test Ob1 Peru13Documento4 páginasTest Ob1 Peru13Melissa Espinoza PeñaAún no hay calificaciones
- Factores de Riesgo-ParqueaderoDocumento4 páginasFactores de Riesgo-ParqueaderoISRAELAún no hay calificaciones
- Clasificación de Los Aditivos en La Alimentación AnimalDocumento2 páginasClasificación de Los Aditivos en La Alimentación AnimalZulema Danaé Pimentel HernándezAún no hay calificaciones
- Apuntes 1er ParcialDocumento24 páginasApuntes 1er ParcialAdele FarynaAún no hay calificaciones
- Conservadores en La Industria AlimenticiaDocumento9 páginasConservadores en La Industria Alimenticiasusan_flores_69Aún no hay calificaciones
- Caja de Herramientas Imprescindibles Si Eres Trans PDFDocumento20 páginasCaja de Herramientas Imprescindibles Si Eres Trans PDFmaejvgAún no hay calificaciones
- Definición de VirusDocumento24 páginasDefinición de VirusAntonia Argaluza SabioncelloAún no hay calificaciones
- Protocolo 2 SALUDDocumento4 páginasProtocolo 2 SALUDAxan GómezAún no hay calificaciones
- Qué Es La BiologíaDocumento20 páginasQué Es La BiologíaMaría MartínezAún no hay calificaciones
- Sistemas de Entrenamiento de La ResistenciaDocumento4 páginasSistemas de Entrenamiento de La ResistenciaDavid MontoroAún no hay calificaciones
- Matriz de Riesgos SoldaduraDocumento24 páginasMatriz de Riesgos SoldaduraAnderson Cogollo Figueroa50% (6)
- CuidadosdeyugularesDocumento38 páginasCuidadosdeyugularesYair Angel MaqueraAún no hay calificaciones
- Anatomía Del CorazónDocumento65 páginasAnatomía Del CorazónLiliana Beatriz MendezAún no hay calificaciones
- Carambola PropiedadesDocumento19 páginasCarambola PropiedadesAngel Ramón GilAún no hay calificaciones
- Material Educativo (Módulo de Biología Aplicada A Las Ciencias Agrarias Y Ambientales UNA 2017)Documento41 páginasMaterial Educativo (Módulo de Biología Aplicada A Las Ciencias Agrarias Y Ambientales UNA 2017)Mario CruzAún no hay calificaciones
- Trabajo de FarmacologíaDocumento10 páginasTrabajo de FarmacologíaNATALIA ALEGREAún no hay calificaciones
- Capsula 001 PresentacionDocumento4 páginasCapsula 001 PresentacionTezka ChimalAún no hay calificaciones
- La TartrazinaDocumento5 páginasLa TartrazinaMarco Antonio FernandezAún no hay calificaciones
- Clase 5. Cardiopatía CongénitaDocumento3 páginasClase 5. Cardiopatía CongénitaDr. José LapentaAún no hay calificaciones
- Sistemologia de La MentiraDocumento8 páginasSistemologia de La MentiraCpm Caballo BlancoAún no hay calificaciones
- Cuestionario NeuroDocumento4 páginasCuestionario NeuroJosé L Narváez MoreiraAún no hay calificaciones