Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Leyes de Konowalov
Cargado por
Jaime Velazquez EsquivelDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Leyes de Konowalov
Cargado por
Jaime Velazquez EsquivelCopyright:
Formatos disponibles
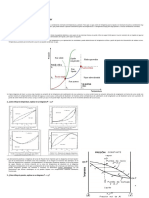
Regla de Konowalov
https://es.wikipedia.org/wiki/Regla_de_Konowaloff
En una solución de un líquido en otro líquido, el vapor en equilibrio con el líquido es más rico
en el componente más volátil. Esta es una consecuencia de la ley de Raoult para soluciones
ideales, que relaciona la composición de cada sustancia en fase líquida con su presión de
vapor, y de la ley de las presiones parciales de Dalton, que relaciona la presión parcial de
cada gas con su composición molar en la mezcla gaseosa.
http://amigosdelacultura14.blogspot.com/2018/08/quimica_46.html
La regla de Konowaloff afirma que en una solución de líquido en líquido, el vapor en
equilibrio con el líquido es más rico en el componente más volátil. Esta es una conclusión de
la ley de Raoult para soluciones ideales, que relaciona la composición de cada sustancia en
fase líquida con su presión de vapor, y de la ley de las presiones parciales de John Dalton,
que relaciona la presión parcial de cada gas con su composición molar en la mezcla gaseosa.
En realidad la regla de Konowalov (Konowaloff) es una consecuencia de la Ley de Raoult y la
Ley de Dalton:
La ley de Raoult:
p 1 = p y1
La ley de Dalton:
p 2= p y 2
p = P°1x 1 + P°2 - P°2 x1 = P°2 + (P°1- P°2) x1 = P°2 + (P°1- P°2) x1
Despejando y 1 (la fracción molar en fase gaseosa):
y1 = P1° x1 / P = P1° x1 / (P°2 + (P°1- P°2) x1)
Si P1° > P°2 El componente 1 es mas volátil que el componente 2 y
P1° > (P°2 + (P°1- P°2) x1)
Por lo tanto y1 > x1
La cual es la regla de Konowalov
Diagramas o nomogramas de Depriester
Permiten calcular la constante de equilibrio (Ki = yi/xi) para componentes en sistemas ideales
en la fase líquida, es decir, que no dependen de la composición en esa fase.
Se aplica para hidrocarburos ligeros y existen diferentes nomogramas tanto para altas y bajas
temperaturas.
Se aplican para calcular equilibrio líquido-vapor, es decir, la composición del vapor bajo ciertas
presión y temperatura. Casos especiales son el cálculod e punto de burbuja y el cálculo de
punto de rocío.
https://esmeraldavidal.files.wordpress.com/2014/12/constante-de-equilibrio-ki-3-p.pdf
https://termoapunefm.files.wordpress.com/2011/10/tema_iv.pdf
Ver Smith, pag. 580-584
Otras referencias:
Termodinámica Química para Ingenieros, 1974. Pag 447-452
R. E. Balshizer, M. R. Samuels, J. D. Eliassen
Editoral Pentice/Hall Internacional
Phase Equilibria in Chemical Engineering 1985
Stanley M. Walas
Butterworth Publishers
También podría gustarte
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- FQ V Reporte 8Documento11 páginasFQ V Reporte 8Jaime Velazquez Esquivel100% (1)
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- Ley de Dalton y HenryDocumento62 páginasLey de Dalton y HenryLaura ReyesAún no hay calificaciones
- Ley de Henry Ejercicio 3Documento10 páginasLey de Henry Ejercicio 3willignton100% (2)
- Capitulo 2 Termoquimica 2Documento120 páginasCapitulo 2 Termoquimica 2Steven AriasAún no hay calificaciones
- Potencial Quimico y Equilibrio2022Documento28 páginasPotencial Quimico y Equilibrio2022VirkmundAún no hay calificaciones
- Propiedades Coligativas Ec. MargulesDocumento57 páginasPropiedades Coligativas Ec. MargulesricardoAún no hay calificaciones
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- Equilibrio Gas LiquidoDocumento5 páginasEquilibrio Gas LiquidoRenzo Acevedo Cano100% (1)
- Informe 2 Curva Eq. X-YDocumento12 páginasInforme 2 Curva Eq. X-YJuan Jose LlamoccaAún no hay calificaciones
- Ley de Raoult y HenryDocumento4 páginasLey de Raoult y HenrySofia Cabarcas100% (1)
- Equilibrio Liquido VapoDocumento4 páginasEquilibrio Liquido Vaporompecaminos02Aún no hay calificaciones
- Líquidos Volátiles - AVR. CB103Documento23 páginasLíquidos Volátiles - AVR. CB103brunasanchez20044Aún no hay calificaciones
- Soluciones IdealesDocumento9 páginasSoluciones Idealescampanas0Aún no hay calificaciones
- Ley de Raoult y HenryDocumento4 páginasLey de Raoult y HenryLuis BuelvasAún no hay calificaciones
- Informe Final Liquido - VaporDocumento8 páginasInforme Final Liquido - VaporMauricio Alejandro PadillaAún no hay calificaciones
- Cap. 10. ELV de Presiones Bajas A ModeradasDocumento44 páginasCap. 10. ELV de Presiones Bajas A ModeradasEduardo LeijaAún no hay calificaciones
- Soluciones IdealesDocumento7 páginasSoluciones Idealesruthayram26Aún no hay calificaciones
- Propiedades Sustancias Puras 2Documento49 páginasPropiedades Sustancias Puras 2jazmin solis hernandezAún no hay calificaciones
- Rault y HenryDocumento4 páginasRault y HenryAlex CoquisAún no hay calificaciones
- Clase 5Documento40 páginasClase 5Frans Erquinio CangalayaAún no hay calificaciones
- Guia de Estudios 1Documento7 páginasGuia de Estudios 1Alfredo AlfaroAún no hay calificaciones
- Equilibrio L - VDocumento12 páginasEquilibrio L - VTakeshi Tanohuye TanohuyeAún no hay calificaciones
- Propiedades Estado Sustancias PurasDocumento50 páginasPropiedades Estado Sustancias PurasNicolas TorresAún no hay calificaciones
- Equilibrio Liquido VaporDocumento8 páginasEquilibrio Liquido VaporARNOLD BRAVO RAMIREZAún no hay calificaciones
- 1 Preexamen Termodinamica de Procesos IIDocumento24 páginas1 Preexamen Termodinamica de Procesos IIPaul Ruiz BaldeonAún no hay calificaciones
- Ejercicios de Primera Ley de TermodinamicaDocumento10 páginasEjercicios de Primera Ley de TermodinamicaJohan RicardoAún no hay calificaciones
- LOpU1 Pre1 GascónCastilloAsafJoshuaDocumento4 páginasLOpU1 Pre1 GascónCastilloAsafJoshuaAsaf Joshua Gascón CastilloAún no hay calificaciones
- Hoja de Ejercicios No 8 UNI 2014 I Sistemas Multifasicos Parte II PDFDocumento7 páginasHoja de Ejercicios No 8 UNI 2014 I Sistemas Multifasicos Parte II PDFfranz_esc20Aún no hay calificaciones
- Ley de RaoultDocumento6 páginasLey de RaoultGiuseppe Luigi Nuñez AguilarAún no hay calificaciones
- CLASE3VIRT SolucionesDocumento50 páginasCLASE3VIRT Solucionesadeodato padillaAún no hay calificaciones
- Cuestionario de Todas Las UnidadesDocumento10 páginasCuestionario de Todas Las UnidadesBrayan SilveraAún no hay calificaciones
- Resumen - Procesos de Separación Vapor LíquidoDocumento11 páginasResumen - Procesos de Separación Vapor LíquidoNICOLAS CASTELLANOS TAMAYOAún no hay calificaciones
- Trabajo de Fisico - QuimicaDocumento35 páginasTrabajo de Fisico - QuimicaDEYSI VELASQUEZAún no hay calificaciones
- Equilibrio de FasesDocumento7 páginasEquilibrio de FasesKido JazzAún no hay calificaciones
- Formulas Parcial 2Documento3 páginasFormulas Parcial 2iparraguirrealejoAún no hay calificaciones
- Equilibrio Liquido VaporDocumento6 páginasEquilibrio Liquido VaporAlexChacónAún no hay calificaciones
- SistemaDocumento14 páginasSistemarobertoAún no hay calificaciones
- Condensadores de Vapor MezcladosDocumento3 páginasCondensadores de Vapor MezcladosAnaGomezAún no hay calificaciones
- Volatilidad RelativaDocumento2 páginasVolatilidad RelativaStefanni Marisol Irrazábal LeguizamónAún no hay calificaciones
- Elv Etanol AguaDocumento18 páginasElv Etanol AguaJuan Montalvo CerronAún no hay calificaciones
- BinariosDocumento100 páginasBinariosOscar RodriguezAún no hay calificaciones
- 15 de Julio de 2022 Balances de Materia y EnergíaDocumento22 páginas15 de Julio de 2022 Balances de Materia y EnergíaCristopher Ariel LopezAún no hay calificaciones
- Informe T BurbujaDocumento14 páginasInforme T BurbujaRicardo Felipe Cortes CruzAún no hay calificaciones
- Capitulo 2 Termoquimica 2Documento97 páginasCapitulo 2 Termoquimica 2adrianaAún no hay calificaciones
- Tarea Equilibrio 2.2Documento2 páginasTarea Equilibrio 2.2henguzAún no hay calificaciones
- Equilibrio Físico Unidad 3 FisicoquimicaDocumento17 páginasEquilibrio Físico Unidad 3 FisicoquimicaBenjmin Martinez SantosAún no hay calificaciones
- Practica 4 Lab Int 2Documento14 páginasPractica 4 Lab Int 2YulissaAún no hay calificaciones
- RAOULTDocumento20 páginasRAOULTMaite Roque CastroAún no hay calificaciones
- Lectura Interesante Diagramas de FaseDocumento16 páginasLectura Interesante Diagramas de FaseTatiana BarbosaAún no hay calificaciones
- Diferencia Entre Gas y VaporDocumento8 páginasDiferencia Entre Gas y VaporJosé TorrezAún no hay calificaciones
- Informe 2-Mezcla MulticomponentesDocumento19 páginasInforme 2-Mezcla MulticomponentesSalustria Cabezas SánchezAún no hay calificaciones
- Marco Teorico TxyDocumento4 páginasMarco Teorico TxyCraven HorrorsAún no hay calificaciones
- Pre1.OUl Alviso - Camacho.AlejandroDocumento4 páginasPre1.OUl Alviso - Camacho.AlejandroMiguel FloresAún no hay calificaciones
- Practico 3 - Sustancias Puras - Elias BarzonDocumento6 páginasPractico 3 - Sustancias Puras - Elias BarzonLuz Valentina Crispin MolloAún no hay calificaciones
- Pre1.TM Miguel Eduardo FloresDocumento5 páginasPre1.TM Miguel Eduardo FloresMiguel FloresAún no hay calificaciones
- Resumen Cap 6Documento4 páginasResumen Cap 6Mariby SilvaAún no hay calificaciones
- Disolucion de No ElectrolitosDocumento36 páginasDisolucion de No Electrolitosflorencia ignaciaAún no hay calificaciones
- Tema II: Sustancia PuraDocumento7 páginasTema II: Sustancia PuraDana Natasha ScheideggerAún no hay calificaciones
- Practica 3eq5Documento5 páginasPractica 3eq5Jaime Velazquez EsquivelAún no hay calificaciones
- D de Flujo Obtencion de FenoftaleinaDocumento2 páginasD de Flujo Obtencion de FenoftaleinaJaime Velazquez EsquivelAún no hay calificaciones
- Esquemas de OrganelosDocumento6 páginasEsquemas de OrganelosJaime Velazquez Esquivel100% (1)
- Leyes de La ElectrolisisDocumento20 páginasLeyes de La ElectrolisisJaime Velazquez EsquivelAún no hay calificaciones