Documentos de Académico
Documentos de Profesional
Documentos de Cultura
01 Toll-Like Receptors - Roles in Disease and Therapy - UpToDate PDF
Cargado por
MarceloTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
01 Toll-Like Receptors - Roles in Disease and Therapy - UpToDate PDF
Cargado por
MarceloCopyright:
Formatos disponibles
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
Reimpresión oficial de UpToDate ®
www.uptodate.com © 2020 UpToDate, Inc. y / o sus filiales. Todos los derechos reservados.
Receptores tipo Toll: Roles en la enfermedad y la terapia.
Autor: Douglas McDonald, MD, PhD
Editor de sección: Jordan S Orange, MD, PhD
Subdirector: Anna M Dirt Road, MD
Todos los temas se actualizan a medida que hay nuevas pruebas disponibles y nuestro proceso de revisión por pares está completo.
Revisión de literatura actualizada hasta: abril de 2020. | Última actualización de este tema: 20 de mayo de 2019.
INTRODUCCIÓN
Los receptores tipo Toll (TLR) son moléculas de superficie celular e intracelulares en células eucariotas que detectan y responden a
antígenos microbianos. Derivan su nombre de la homología a la molécula Drosophila Toll, un componente importante del patrón dorsal-
ventral y la defensa antifúngica [ 1,2 ]. Los TLR son parte del sistema inmune innato, que es un sistema filogenéticamente antiguo
presente en invertebrados y conservado a través de la evolución de los vertebrados. Las respuestas inmunes innatas se inician
rápidamente por exposición a microbios y preceden al desarrollo de respuestas inmunes adaptativas [ 3 ]. La inmunidad innata se revisa
por separado. (Consulte "Una descripción general del sistema inmune innato" y "Inmunidad del recién nacido" ).
PAPEL EN LA INMUNIDAD INNADA
Los TLR son un tipo de receptor de reconocimiento de patrones (PRR), que son receptores específicos para componentes moleculares de
microorganismos que no son producidos por el huésped. Los ligandos para TLR se denominan patrones moleculares asociados a
patógenos (PAMP), que son componentes de microbios patógenos. En los vertebrados, los TLR inician funciones protectoras que operan
independientemente de la inmunidad adaptativa. También juegan un papel crítico en las respuestas inmunes adaptativas al dirigir la
diferenciación de las células T vírgenes en las células T efectoras. Otros ejemplos de PRR incluyen receptores similares al dominio de
oligomerización de nucleótidos (NOD) (NLR) y los receptores similares al gen retinoico inducible por ácido I (RIG-I) (RLR). (Consulte "Una
descripción general del sistema inmune innato", sección sobre "Receptores de reconocimiento de patrones (PRR)" ).
ESTRUCTURA Y FUNCIÓN DE TLR
Las diferentes especies tienen diferentes números de TLR distintos. Al menos 10 han sido descubiertos en los seres humanos [ 1,2,4 ].
Con la excepción de TLR1, TLR2 y TLR6, los TLR inician la señalización por homodimerización (por ejemplo, dos TLR idénticos reunidos).
TLR2 forma heterodímeros con TLR1 (TLR2 / 1) o TLR6 (TLR2 / 6). La estructura / organización del receptor, los ligandos y la
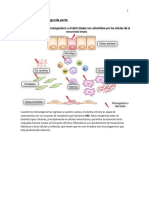
señalización se resumen en la tabla ( tabla 1 ) y la figura ( figura 1 ).
La estructura de todos los TLR es similar. Todos tienen un dominio de unión y reconocimiento de ligando extracelular que contiene
repeticiones ricas en leucina. Todos tienen un solo dominio transmembrana. El dominio citoplasmático (señalización) es homólogo al
receptor de interleucina-1 (IL-1) y se llama receptor toll / IL-1 o dominio TIR.
La vía común final para la señalización de TLR involucra los factores de transcripción, el factor nuclear (NF) para el potenciador de la
cadena ligera kappa (k) en las células B (NF-kB) y la activación de la proteína-1 (AP-1). Estos factores de transcripción regulan una
multitud de genes, incluidos los que codifican importantes citocinas proinflamatorias, como el factor de necrosis tumoral alfa (TNF-alfa), IL-
1-beta, IL-6, IL-8 e IL-12. Algunos TLR también activan la producción de interferones tipo 1 (alfa y beta) al inducir los factores reguladores
de interferón (IRF) IRF3, IRF5 e IRF7.
Distribución celular y tisular : los TLR se expresan diferencialmente en varias poblaciones de leucocitos [ 2,5 ]. Los monocitos y los
macrófagos expresan todos los TLR, excepto TLR3. Las células dendríticas mieloides (MDC) expresan TLR2 / 1, TLR3, TLR4, TLR5 y
TLR8, mientras que las células dendríticas plasmacitoides (PDC) expresan TLR7 y TLR9. TLR2 / 6, TLR4 y TLR8 se encuentran en los
mastocitos. Las células B expresan TLR3, TLR7, TLR9 y TLR10, mientras que las células T expresan TLR3 y TLR9. Una variedad de
tipos de tejidos puede expresar uno o más TLR. Como ejemplo, las superficies basolaterales de las células epiteliales intestinales
expresan TLR5, mientras que los fibroblastos y los queratinocitos expresan TLR3 en la superficie celular [ 6 ].
La localización celular de los TLR varía. TLR2 / 1, TLR2 / 6, TLR4, TLR5, TLR10 y TLR11 se localizan en las superficies celulares,
mientras que TLR3, TLR7, TLR8 y TLR9 se localizan dentro de los endosomas. La expresión de la superficie celular de los TLR, como
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sele… 1/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
TLR4, que reconoce el lipopolisacárido (LPS), tiene la hipótesis de permitir el reconocimiento de las moléculas extracelulares liberadas
por los patógenos. La expresión endosómica de TLR3, TLR7, TLR8 y TLR9 permite el reconocimiento de ácidos nucleicos microbianos
después de su absorción y degradación en los fagolisosomas. TLR3, TLR7, TLR8 y TLR9 interactúan con una proteína de membrana del
retículo endoplásmico (ER) llamada UNC93B (homólogo B de UNC93), que es esencial para una señalización adecuada [ 7] Además, la
expresión endosomal de TLR3, TLR7, TLR8 y TLR9 puede evitar la activación por los ácidos nucleicos del huésped y el desarrollo de
autoinmunidad.
Señalización : todos los TLR, excepto TLR3, utilizan la proteína de respuesta primaria de diferenciación mieloide intermedia de
señalización proximal citoplásmica 88 (MyD88), ya sea por sí misma (TLR5, TLR7, TLR8 y TLR9) o junto con la molécula adaptadora toll /
interleukin-1 (IL -1) proteína adaptadora que contiene el dominio del receptor (TIR) (TIRAP / MyD88 tipo adaptador [MAL], TLR2 / 1, TLR2
/ 6 y TLR4) ( figura 1 ) [ 1,2,8 ]. También hay una vía independiente de MyD88 a través de la molécula TIR que contiene el adaptador que
induce el interferón beta inductor del adaptador (IFN-beta) (TRIF), que es utilizado por TLR3 y TLR4 (TLR4 también utiliza la molécula
adaptadora intermedia relacionada con TRIF [TRAM ]).
El adaptador MyD88 se conecta a través de las quinasas 1 y 4 asociadas al receptor de interleucina-1 (IL-1) (IRAK1, IRAK4), el factor 6
asociado al receptor del factor de necrosis tumoral (TNF) (TRAF6) y el factor de crecimiento transformante (TGF) -beta -proteína quinasa
activada 1 (TAK1) a las proteínas quinasas activadas por mitógeno (MAPK). Esta compleja cascada de quinasas culmina en la activación
de la familia de factores de transcripción heterodiméricos conocidos como activación de la proteína 1 (AP-1). Estos factores de
transcripción regulan una amplia gama de genes que influyen en la supervivencia, activación y proliferación celular.
El adaptador TAK1 también conduce a la activación del inhibidor de la quinasa NF-kB (IKK) y la activación resultante de NF-kB. Esta es
otra familia de factores de transcripción heterodiméricos que regulan muchos genes con papeles importantes en las respuestas inmunes,
así como en la fisiología de una amplia gama de otros tipos de células. Estos incluyen citocinas, quimiocinas y factores de crecimiento,
receptores de linfocitos, moléculas de adhesión, reactivos de fase aguda y otros factores de transcripción. La ligadura de TLR3 conduce a
la activación de TRAF3 seguido de la quinasa 1 de unión a tanque (TBK1) e IKK, que a su vez activan el factor regulador de interferón 3
(IRF3), lo que conduce a la producción de interferones tipo 1. TLR7, TLR8 y TLR9 señalan a través de una vía dependiente de MyD88
que utiliza IRAK1 / 4, IKK-alpha, TRAF3 / 6 y osteopontina intracelular (iOPN), que activa IRF7,9 ] Además, se ha demostrado que la
producción de IFN-alfa inducida por TLR7 depende de la activación de IRF5 [ 10 ].
Regulación - tanto la expresión de TLR en la superficie celular como las consecuencias intracelulares de la ligadura de TLR están
reguladas por una variedad de factores. Estos incluyen la exposición a productos microbianos, otros ligandos TLR y citocinas. El supresor
de las proteínas de señalización de citocinas (SOCS) y la degradación mediada por ubiquitina de las proteínas de señalización están
involucradas en la regulación negativa de la señalización de TLR [ 11,12 ]. Dentro del tracto gastrointestinal, los factores que mantienen la
tolerancia a la flora hospedante comensal mientras detectan / contienen bacterias patógenas con respuestas inflamatorias apropiadas no
se comprenden completamente. Se anticiparía que la detección de PAMP comunes en bacterias patógenas y no patógenas activaría la
misma respuesta inflamatoria. Sin embargo, la detección de bacterias comensales dentro de los intestinos puede inducir tolerancia. La
señalización de TLR puede contribuir a la homeostasis intestinal al regular la proliferación de células epiteliales intestinales y la integridad
epitelial [ 13].] La expresión y localización de TLR en el epitelio intestinal puede relacionarse directamente con su papel en el
mantenimiento de la homeostasis versus la inflamación inducida. Por ejemplo, dentro del epitelio intestinal, la activación de TLR9 a través
de la membrana apical induce tolerancia, mientras que la activación de TLR9 a través de la membrana basolateral induce una respuesta
inflamatoria a través de la vía canónica NF-kB. La expresión espacial diferencial de los receptores de reconocimiento de patrones (PRR)
en los epitelios puede constituir un mecanismo crítico para distinguir las bacterias no patológicas de las patológicas. La regulación de la
función TLR es muy compleja y todavía se entiende de manera incompleta y está más allá del alcance de esta revisión [ 14-17 ].
TLR ESPECÍFICOS
Los ligandos, la expresión celular, las moléculas de señalización utilizadas y los efectos celulares resultantes de la ligadura para cada uno
de los TLR se resumen en la tabla ( tabla 1 ). Información adicional se presenta a continuación.
● TLR2 / 1 : el heterodímero de TLR2 con TLR1 se une a los componentes de la pared celular de bacterias y micobacterias. TLR2 / 1
se une a lipopéptidos / lipoproteínas de triacilo y algunos lipopéptidos de diacilo [ 18-20 ]. También interactúa con las porinas de
Neisseria [ 21 ]. TLR2 / 1 se expresa en las células dendríticas mieloides (MDC) y las señales a través de la vía de la proteína 88 de
respuesta primaria de diferenciación mieloide canónica (MyD88) con la proteína adaptadora que contiene el dominio toll / interleukin-1
(IL-1) (TIR) (TIRAP) ) TLR2 / 1 también existe en una forma soluble que puede inhibir la señalización a través del receptor unido a la
membrana [ 22 ].
● TLR2 / 6 : el heterodímero de TLR2 con TLR6 muestra una preferencia por el reconocimiento de los lipopéptidos de diacilo, aunque
puede reconocer algunos lipopéptidos de triacilo [ 18-20 ]. TLR2 / 6 se expresa en mastocitos, y también señala a través de la vía
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sele… 2/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
canónica MyD88 con el TIRAP.
● TLR3 - TLR3 se une a ARN bicatenario (dsRNA), que se produce en la replicación de muchos virus [ 23 ]. TLR3 también puede
unirse al dsRNA sintético, como el ácido polinosínico-policitidílico (poliI: C) [ 24 ]. TLR3 se encuentra dentro de los endolisosomas
(compartimientos intracelulares unidos a la membrana formados por la fusión de vesículas de restos virales internalizados y
lisosomas que contienen enzimas degradantes) de MDC, células B, células T y células asesinas naturales (NK) [ 25 ]. TLR3 señala a
través de una vía independiente de MyD88 (interferón inductor de adaptador que contiene dominio TIR [TRIF]) e induce la producción
de interferón beta tipo 1 (IFN-beta) además de citocinas inflamatorias.
● TLR4 : el ligando principal para TLR4 es el lipopolisacárido (LPS) de las bacterias Gram negativas [ 26 ]. La interacción de LPS con
TLR4 ocurre en un complejo con la proteína de unión a LPS (LBP), CD14 y una molécula llamada factor de diferenciación mieloide-2
(MD-2) ( figura 1 ). Los ligandos adicionales incluyen la proteína de fusión del virus sincitial respiratorio (VSR), proteínas de choque
térmico de organismos, como Chlamydia pneumoniae , y componentes de la matriz extracelular, como fibronectina, ácido hialurónico
y sulfato de heparán [ 27-29 ]. TLR4 se expresa en MDC y mastocitos y puede enviar señales a través de MyD88 con TIRAP.
También puede inducir IFN tipo 1 a través de la vía independiente de MyD88 a través de la molécula adaptadora relacionada con
TRIF (TRAM).
● TLR5 - TLR5 reconoce la flagelina bacteriana [ 30 ]. Se expresa en MDC y transduce señales a través de MyD88.
● TLR7 y TLR8 - TLR7 y TLR8 son muy similares en su unión y señalización de ligando [ 31-33 ]. Ambos se unen al ARN
monocatenario (ssRNA) de virus, como la gripe y el virus de inmunodeficiencia humana-I (VIH-I). También reconocen las
imidazoquinolinas (moléculas orgánicas heterocíclicas sintéticas), como el imiquimod , y los análogos de guanosina, como la
loxoribina. TLR7 se expresa en MDC, células dendríticas plasmacitoides (PDC) y linfocitos B. TLR8 se expresa en MDC y mastocitos.
Ambos señalan directamente a través de MyD88.
● TLR9 - TLR9 interactúa con motivos de dinucleótidos de guanina citosina no metilados (CpG) en el ADN microbiano [ 34 ]. TLR9 se
expresa dentro de los endolisosomas de PDC, células B y células T y señales directamente a través de MyD88. La activación de PDC
(también conocidas como células productoras de IFN) a través de TLR7 y TLR9 conduce a la producción de grandes cantidades de
IFN-alfa, que desempeña un papel fundamental en la inmunidad innata antiviral. Además, las PDC, en virtud de su producción de
IFN-alfa e IL-12, son potentes inductores de diferenciación de células T vírgenes en células T efectoras T helper tipo 1 (Th1).
● TLR10 - TLR10 es un PRR modulador con funciones en gran medida inhibitorias [ 35,36] Se cree que TLR10 ejerce funciones
inhibitorias a través de la competencia con la unión del ligando a los TLR. Además, TLR10 puede competir por la formación de
heterodímeros con TLR2. La activación de TLR10 también conduce a una mayor expresión del antagonista del receptor de IL-1 (IL-
1RA), lo que disminuye la inflamación. Recientemente, se descubrió que TLR10 es un receptor para la unión de gp41 del VIH, lo que
lleva a la activación de la producción de NF-kB e IL-8 en macrófagos, monocitos y células epiteliales mamarias, lo que sugiere que
puede ser un sensor innato de infección por VIH. La unión de gp41 de VIH a TLR10 conduce a la regulación positiva de la expresión
de TLR10. Sin embargo, una mayor expresión de TLR10 puede dar lugar a una infección por VIH mejorada al permitir la entrada en
monocitos, macrófagos y células epiteliales [ 37 ].
RESPUESTAS CELULARES INDUCIDAS POR TLR
La respuesta a varias combinaciones de TLR depende de la célula que expresa ese TLR, las cantidades relativas y los tipos de TLR
presentes, así como otros estímulos y el programa de desarrollo de la célula objetivo.
● La ligadura TLR de células mononucleares puede potenciar la actividad microbicida de las células fagocíticas. Como ejemplo, la
ligadura TLR2 / 1 o TLR2 / 6 por componentes de la pared celular de Mycobacterium tuberculosis induce la producción de óxido
nítrico en ratones y otros mecanismos bactericidas en humanos [ 38 ]. La misma combinación ligando / receptor también puede
conducir a la apoptosis en los macrófagos [ 39 ]. Este mecanismo podría limitar la propagación de microbios que se replican
intracelularmente.
● La activación TLR de las células epiteliales puede inducir la producción de péptidos antimicrobianos (defensinas) que brindan
protección contra una amplia variedad de patógenos. La activación de TLR en las células epiteliales intestinales puede contribuir a la
homeostasis intestinal al regular la proliferación celular intestinal y la integridad epitelial. Dependiendo de la localización celular de los
TLR en los epitelios intestinales (es decir, la membrana apical), la activación del TLR puede inducir tolerancia, mientras que la
activación de los TLR dentro de la membrana basolateral induce una respuesta inflamatoria a las bacterias invasivas [ 40-42 ].
● La activación de TLR en células dendríticas conduce a la presentación de antígenos, a la producción de IL-12 y a la regulación
positiva de moléculas coestimuladoras (CD80, CD86), que dirige la diferenciación de células T vírgenes en células T efectoras Th1
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sele… 3/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
específicas de antígeno [ 43 ]. (Ver "La respuesta inmune celular adaptativa: células T y citocinas" .)
● La activación de TLR (TLR3, TLR7, TLR8, TLR9) da como resultado la producción de interferones tipo 1, que desempeña un papel
crucial en la inmunidad innata antiviral. Diferentes ligandos TLR pueden conducir a respuestas de citoquinas algo diferentes o pueden
inducir interferón tipo 1 y provocar la activación de tipos de respuestas inmunes cualitativamente diferentes (por ejemplo, T helper tipo
1 [Th1] versus T helper tipo 2 [Th2] diferenciación de células T) [ 2 ] La respuesta a varias combinaciones de TLR también depende
de las cantidades relativas y los tipos de TLR en la superficie celular, así como otros estímulos y el programa de desarrollo de la
célula objetivo.
Debido a que los patógenos coevolucionaron con sus huéspedes, nosotros (el huésped) hemos adquirido mecanismos sofisticados
para resistir la infección, incluidos los TLR. A su vez, los patógenos han desarrollado estrategias para eludir muchos de estos
mecanismos. Por ejemplo, el virus vaccinia codifica moléculas con homología con los dominios toll / interleukin-1 (IL-1) (TIR) y puede
inhibir la señalización a través de TLR3 y TLR4 [ 44,45 ].
DEFECTOS DE SEÑALIZACIÓN TLR EN LA INMUNODEFICIENCIA PRIMARIA
Se han identificado defectos en las moléculas que transducen señales de TLR y conducen a la inmunodeficiencia primaria ( tabla 2 ).
Trastornos específicos : el grado de deterioro inmunológico está relacionado con el lugar en el que se produce el defecto en la vía de
señalización TLR ( figura 2 ). Los defectos que ocurren proximalmente en la vía TLR, como la deficiencia en la proteína de respuesta
primaria de diferenciación mieloide 88 (MyD88) o la quinasa 4 asociada al receptor de interleucina-1 (IL-1) (IRAK4) conducen a la
susceptibilidad a un número limitado de patógenos (típicamente bacterias piógenas), ya que estos defectos solo afectan la función de TLR
e IL-1R.
En contraste, los defectos distales que involucran factores de transcripción (es decir, el complejo del factor nuclear [NF] -kB) conducen a
susceptibilidades infecciosas más amplias (p. Ej., Bacterias, virus, hongos y organismos oportunistas), así como anormalidades del
desarrollo (es decir, displasia ectodérmica) . Esto se debe a los diversos mecanismos inmunes y de desarrollo que señalan a través de
NF-kB, incluidas las vías de inmunidad innata (es decir, TLR), inmunidad adaptativa (es decir, receptor de células T, receptor de células B
y CD40) y desarrollo ectodérmico (es decir , receptor de ectodisplasina A).
Deficiencia de MyD88 / IRAK4 : todos los TLR, excepto TLR3, usan la proteína 88 de respuesta primaria de diferenciación mieloide
intermedia de señalización proximal citoplásmica (MyD88), ya sea sola o junto con la proteína adaptadora de peaje de molécula
adaptadora / receptor de IL-1 (TIRAP) . La deficiencia de MyD88 se describió inicialmente en nueve niños que padecían infecciones
bacterianas piógenas recurrentes y graves [ 46 ]. Estos niños eran susceptibles a infecciones invasivas con Streptococcus pneumoniae ,
Staphylococcus aureus y Pseudomonas aeruginosa, pero tenía resistencia normal a otras bacterias, virus, hongos y parásitos comunes.
Tres niños murieron antes de la edad de 1 año, mientras que otros seis estaban vivos a la edad de 3 a 16 años en el momento de la
publicación. La susceptibilidad a la infección mejoró con la edad en los pacientes afectados, aunque los niveles de MyD88 no cambiaron,
lo que sugiere que la maduración del sistema inmunitario adaptativo puede compensar la función defectuosa de TLR. El defecto muestra
herencia autosómica recesiva. La deficiencia de MyD88 es clínicamente indistinguible de la deficiencia de la quinasa 4 asociada al
receptor de IL-1 (IRAK4), ya que IRAK4 se asocia con MyD88 en la transducción de señales [ 47 ].
La deficiencia de IRAK4 (MIM 607676) perjudica la señalización de los TLR que se asocian solo con el adaptador MyD88 ( figura 3 ).
Estos incluyen TLR2 / 1, TLR2 / 6, TLR5, TLR7, TLR8 y TLR9. TLR4 envía señales a través de MyD88, pero también puede hacer uso de
la vía de molécula adaptadora (TRAM) / TRIF relacionada con el adaptador que induce el adaptador toll / receptor IL-1 (TIR). TLR3 no se
ve afectado. La señalización por el receptor de IL-1 y la activación del receptor de células T también están deterioradas [ 48] Las células
mononucleares de sangre periférica de pacientes con deficiencia de IRAK4 o MyD88 no producen citocinas proinflamatorias, como el
factor de necrosis tumoral alfa (TNF-alfa), IL-1 e IL-6 cuando se estimulan a través de los receptores IL-1 o IL-18 o TLRs. La falta de
respuesta a la IL-1 da como resultado respuestas de fiebre deterioradas a la infección bacteriana. La falta de fiebre significativa y el nivel
inesperadamente bajo de proteína C reactiva (PCR) en el contexto de una infección bacteriana grave puede ser una pista de la posibilidad
de deficiencia de IRAK4 o de MyD88.
Las características clínicas y de laboratorio de la deficiencia de IRAK4 son indistinguibles de la deficiencia de MyD88, ya que IRAK4 se
asocia con MyD88 en la transducción de señales ( figura 3 ). Los pacientes con deficiencia de IRAK4 tienen infecciones graves
recurrentes (celulitis, artritis, meningitis, osteomielitis, abscesos orgánicos y sepsis), causadas principalmente por S. aureus , S.
pneumoniae y P. aeruginosa [ 47,49,50 ]. Una serie describió a 48 pacientes que experimentaron infecciones bacterianas recurrentes,
principalmente del tracto respiratorio superior y la piel [ 51].] Ninguno tenía infecciones virales, fúngicas o parasitarias graves. Las
infecciones invasivas iniciales ocurrieron antes de los dos años en el 88 por ciento. Las infecciones neumocócicas invasivas causaron la
mayor morbilidad y mortalidad y fueron la causa de muerte en el 33 por ciento. En pacientes con deficiencia de IRAK4 o defectos MyD88,
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sele… 4/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
la susceptibilidad a las infecciones parece mejorar con la edad, independientemente de la terapia [ 47,52 ]. En la serie más grande, no se
informaron muertes infecciosas en pacientes mayores de 8 años ni infecciones invasivas después de los 14 años [ 47 ].
Las inmunoglobulinas séricas son normales, los niveles de anticuerpos específicos contra los antígenos de polisacárido pueden ser bajos
o normales, y los subconjuntos de células B y la función in vitro son normales. Las respuestas de las células T a los mitógenos y los
antígenos recordatorios también son normales. Se puede observar eosinofilia periférica e inmunoglobulina E (IgE) en suero elevada.
El diagnóstico se puede hacer midiendo la producción de citocinas por leucocitos que han sido activados por varios ligandos TLR (ensayo
de función TLR, disponible en al menos un laboratorio comercial) [ 53 ]. La ausencia de resultados funcionales de MyD88 o IRAK4 en
ausencia de producción proinflamatoria en pacientes afectados. La ausencia de producción de citocinas inducida por TLR en estos
pacientes debe ser seguida por una secuenciación de genes para identificar el defecto genético preciso. Los paneles de genes dirigidos
ahora están disponibles comercialmente y son rentables.
El cuidado meticuloso de la piel para minimizar la colonización bacteriana de la piel también es un elemento esencial del manejo del
paciente, ya que estos pacientes siguen siendo susceptibles a las infecciones de la piel. La terapia antibiótica u otra es dictada por la
sensibilidad específica del patógeno y el foco de la infección. Se puede considerar la profilaxis antibiótica y / o la terapia de reemplazo de
inmunoglobulina . La mayoría de los pacientes con deficiencia de MyD88 o IRAK4 se mantienen con profilaxis antibiótica con amoxicilina o
sulfametoxazol-trimetoprima indefinidamente.
Para aproximadamente el 50 por ciento de los pacientes con deficiencia de MyD88 o IRAK4 que no tienen respuestas de anticuerpos
adecuadas a la vacuna antineumocócica de polisacáridos (es decir, Pneumovax), la terapia de reemplazo de inmunoglobulina es útil, al
menos hasta la adolescencia cuando disminuyen los riesgos de infección invasiva [ 47 ]. (Ver "Terapia de inmunoglobulina en
inmunodeficiencia primaria" .)
Deficiencia de UNC93B1, mutaciones de TLR3, deficiencia de TRIF, deficiencia de TRAF3 y deficiencia de TBK1 : UNC93B1
(homólogo de UNC93 B1) es una proteína del retículo endoplásmico (ER) que participa en el transporte de TLR7 y TLR9 con detección de
nucleótidos desde el ER a los endolisosomas. La señalización a través de TLR3, TLR7, TLR8 y TLR9 normalmente induce la producción
de interferones tipo 1 después de la unión al ARN viral ( figura 3 ). La deficiencia de UNC93B1 o TLR3 (MIM 610551 y MIM 613002)
conduce a la susceptibilidad a la encefalitis por virus del herpes simple tipo 1 (HSV-1) debido a la disminución de la producción de
interferones en el sistema nervioso central [ 54-57] Se ha demostrado que las formas autosómica dominante y autosómica recesiva de
deficiencia de interferón inductor del adaptador (TRIF) que contiene el receptor toll / interleukin-1 (IL-1) causan susceptibilidad a la
encefalitis por HSV-1 [ 58 ]. La deficiencia autosómica dominante del factor 3 asociado al receptor del factor de necrosis tumoral (TNF)
(TRAF3), que conduce a una función TRAF3 reducida pero no ausente, es otra causa de susceptibilidad a la encefalitis por HSV-1 [ 59 ].
Finalmente, las mutaciones heterocigotas en la quinasa 1 de unión a tanque (TBK1) también dan como resultado susceptibilidad a la
encefalitis por HSV-1 [ 60 ]. Este grupo de pacientes con señalización defectuosa de TLR3 demuestra el papel esencial de TLR3 en el
sistema nervioso central en la prevención de la encefalitis por HSV-1. (Ver"Encefalitis por virus del herpes simple tipo 1", sección sobre
"Susceptibilidad del huésped" .)
Defectos NEMO : el modificador esencial de NF-kB (NEMO), también llamado inhibidor de la quinasa de NF-kB quinasa (IKK), está
codificado por un gen en el cromosoma X ( IKBKG ). Se requiere NEMO para la función adecuada de IKK, que inactiva el inhibidor de las
proteínas NF-kB (I-kappa [k] -B) ( figura 3) En ausencia de actividad IKK, I-kB permanece unido a NF-kB, manteniéndolo en el citoplasma
en una forma inactiva y evitando su translocación al núcleo para ejercer sus actividades reguladoras de la transcripción. Por lo tanto, en
ausencia de la función NEMO, la señalización de NF-kB se bloquea, cerrando muchas vías, incluidas las funciones inmunes innatas (es
decir, TLR, receptores de tipo oligomerización de unión a nucleótidos [NOD] [NLR], gen inducible por ácido retinoico -I [RIG-I] -receptores
[RLRs]), funciones inmunes adaptativas (receptor de células T, receptor de células B, CD40) y vías de desarrollo (es decir, receptor de
ectodisplasina A en ectodermo y activador de receptor de NF-kB [RANGO ] en osteoclastos) ( figura 2) La ausencia completa de la función
NEMO es letal en los embriones masculinos, y la deficiencia parcial en las mujeres conduce a una afección llamada incontinentia pigmenti
[ 61 ]. (Ver "Incontinentia pigmenti" .)
Las mutaciones que permiten la función parcial de NEMO (es decir, mutaciones hipomórficas) causan inmunodeficiencia de gravedad
variable en los hombres, que van desde infecciones sinopulmonares recurrentes hasta susceptibilidad extrema a todas las clases de
patógenos, incluidas micobacterias y organismos oportunistas. Debido a que NF-kB también transduce señales de los sistemas
receptores importantes para el desarrollo de la piel y sus apéndices, la mayoría de los pacientes con mutaciones hipomórficas también
tienen displasia ectodérmica, un trastorno conocido como displasia ectodérmica con inmunodeficiencia (ED-ID) ( figura 2 ). La displasia
ectodérmica se caracteriza por dientes cónicos o ausentes; cabello fino y escaso; e hipohidrosis debido a la disminución de las glándulas
sudoríparas. Las mutaciones NEMO se discuten por separado. (Ver "Inmunodeficiencias combinadas" ).
Defectos de I-kappa-B : se ha encontrado que múltiples pacientes tienen mutaciones en la subunidad alfa del complejo I-kB, una
forma autosómica dominante de ED-ID ( figura 3 ). El fenotipo es muy similar a la deficiencia de NEMO, lo que lleva a susceptibilidades
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sele… 5/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
variables a agentes infecciosos con (o sin) displasia ectodérmica. Las pruebas de la función TLR en pacientes con sospecha de deterioro
de la función NF-kB pueden ser informativas. El grado de deterioro de la función TLR puede variar de insignificante a gravemente
afectado, dependiendo de la mutación en IKBKG o NFKBIA [ 61 ]. (Ver "Inmunodeficiencias combinadas" ).
Deficiencia DOCK8 - Dedicator de 8 deficiencia de citocinesis (DOCK8) es una inmunodeficiencia combinada caracterizado por
niveles marcadamente elevados de inmunoglobulina E (IgE), hipereosinofilia, trastornos atópicos, infecciones sinopulmonares recurrentes,
candidiasis cutánea, y las infecciones virales de la piel [ 62 ]. Estos pacientes tienen linfopenia de células T y memoria serológica
deteriorada. DOCK8 es un factor de intercambio de nucleótidos de guanina y una proteína adaptadora importante en la señalización de
TLR9 y la activación de la proteína del síndrome de Wiskott-Aldrich (WASp) impulsada por el receptor de células T y la reorganización del
citoesqueleto [ 63 ]. La deficiencia de DOCK8 produce una proliferación de células B inducida por TLR9 deteriorada y una producción de
inmunoglobulina, lo que conduce a respuestas de anticuerpos protectores mal sostenidas figura 4) Los pacientes también tienen una
reducción significativa en el número de células dendríticas plasmacitoides circulantes (PDC). Las PDC de los pacientes con deficiencia de
DOCK8 parecen producir menos IFN-alfa en respuesta a la activación de TLR9, lo que quizás contribuye a su susceptibilidad a las
infecciones virales [ 64,65 ]. (Ver "Inmunodeficiencias combinadas" ).
Deficiencia de HOIL-1 / HOIP : la ubiquitina ligasa-1 IRP2 oxidada con hemo (HOIL-1) es un componente del complejo de
ensamblaje de cadena de ubiquitinación lineal (LUBAC) que es esencial para la estabilización de la activación de LUBAC y NF-kB aguas
abajo de la IL -1 receptor. La deficiencia de HOIL-1 es un trastorno autosómico recesivo que causa la activación alterada de IL-1 de NF-kB
en fibroblastos de pacientes. Por el contrario, los monocitos de estos pacientes son hipersensibles a IL-1 ( figura 5 ). Esta condición
resulta en una asociación única de inmunodeficiencia, autoinflamación, fiebre periódica y amilopectinosis muscular. Mutaciones
homocigotas en la proteína que interactúa HOIL-1 ( HOIP), el gen que codifica el componente catalítico de LUBAC, conduce a
alteraciones celulares similares y una condición clínica casi idéntica a la deficiencia de HOIL-1 [ 66,67 ]. (Ver "Síndromes de fiebre
periódica y otras enfermedades autoinflamatorias: una visión general", sección sobre 'Deficiencia de LUBAC' ).
Inmunodeficiencia variable común - Los defectos en el funcionamiento de TLR7 y TLR9, normalmente prominente en las células B
y las células dendríticas, se han identificado en pacientes con inmunodeficiencia variable común. Estos hallazgos pueden ser importantes
para comprender en última instancia la alteración de la maduración de las células B que caracteriza este trastorno. La activación de
STAT3 inducida por TLR9 en células B juega un papel importante en la maduración de células B en células B de memoria. Un informe
reciente que examinó a siete pacientes con IDCV demostró una activación reducida de STAT3 inducida por TLR9, que puede ser la base
de respuestas de anticuerpos deterioradas en algunos pacientes con IDVC [ 68 ]. (Ver "Patogenia de la inmunodeficiencia variable común"
.)
Se ha demostrado que las mutaciones heterocigotas en NF-kB1 (también conocido como p105 / p50), que conducen a la
haploinsuficiencia de la función NF-kB1 y la activación deteriorada de la vía canónica NF-kB, causan inmunodeficiencia variable común e
hipogammaglobulinemia [ 69,70] Estos pacientes padecían infecciones sinopulmonares recurrentes, enfermedad pulmonar obstructiva
crónica (EPOC), bronquiectasias, linfadenopatía, infecciones cutáneas, citopenias autoinmunes, enfermedad inflamatoria intestinal,
carcinomas y adenocarcinomas. Además, las mutaciones heterocigotas en NF-kB2 (también conocido como p100 / p52), que causan
haploinsuficiencia de la función NF-kB2 y la activación alterada de la vía no canónica de NF-kB, conducen a hipogammaglobulinemia,
infecciones recurrentes, autoinmunidad e insuficiencia suprarrenal. La activación defectuosa de los TLR no se ha descrito en la
haploinsuficiencia NF-kB1 o NF-kB2 ( figura 2 ).
Cuándo sospechar : las inmunodeficiencias resultantes de defectos con vías TLR son extremadamente raras. Los escenarios clínicos
en los que debe considerarse un defecto de la vía TLR incluyen los siguientes:
● Un bebé o niño que desarrolla infecciones invasivas piógenas (meningitis, adenitis, abscesos) causadas por S. pneumoniae , S.
aureus o P. aeruginosa , particularmente si hay fiebre mínima o nula. La deficiencia de IRAK4 o MyD88 debe considerarse en esta
situación, después de que se hayan excluido las formas más comunes de inmunodeficiencia ( figura 2 ). (Ver 'Deficiencia de MyD88 /
IRAK4' más arriba).
● El paciente con encefalitis por HSV-1 podría tener un defecto dentro de la vía TLR3, aunque la evaluación de la función TLR no es
útil, porque la función TLR generalmente es normal en las células sanguíneas y se requiere la evaluación de fibroblastos. En cambio,
la secuenciación de genes a través de paneles de genes específicos o la secuenciación completa del exoma puede ser el enfoque
más eficiente. (Ver 'Deficiencia de UNC93B1, mutaciones de TLR3, deficiencia de TRIF, deficiencia de TRAF3 y deficiencia de TBK1'
más arriba).
● El paciente con displasia ectodérmica e infecciones recurrentes (bacterianas, virales o micobacterianas) probablemente tenga una
mutación dentro de NEMO o I-kB-alfa, ya que esta combinación de hallazgos es relativamente específica para estas
inmunodeficiencias. Sin embargo, no todos los pacientes con mutaciones en estas proteínas tienen displasia ectodérmica. Se ha
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sele… 6/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
demostrado que la producción de citocinas proinflamatorias inducidas por TLR se reduce de manera variable en muchos, pero no en
todos los individuos afectados. (Ver 'defectos NEMO' arriba y ' defectos I-kappa-B' arriba).
Evaluación inicial - La evaluación inicial de todos los pacientes que sufren de infecciones recurrentes comienza con una historia
detallada de infecciones pasadas, incluyendo la frecuencia y severidad, los sitios específicos de infecciones, y la revisión de los datos de
cultivos disponibles para identificar los organismos causantes. Debido a que muchas inmunodeficiencias son rasgos recesivos, el clínico
debe preguntar sobre la consanguinidad dentro de la familia, aunque la falta de consanguinidad no descarta la posibilidad de mutaciones
heterocigotas compuestas. Una historia familiar de infección recurrente que solo afecta a hombres enfoca la evaluación en los trastornos
ligados al cromosoma X.
Los hallazgos del examen físico pueden proporcionar pistas importantes sobre posibles trastornos inmunes (p. Ej., Falta de amígdalas en
la agammaglobulinemia ligada al cromosoma X o displasia ectodérmica en defectos NEMO / I-kB-alfa).
La evaluación de laboratorio debe comenzar con un conteo sanguíneo completo y diferencial para evaluar el número de neutrófilos y
linfocitos. Se deben medir los niveles de inmunoglobulina, junto con una evaluación de la producción de anticuerpos específicos (títulos de
tétanos y neumocócicos). La evaluación de la función del complemento (CH50, AH50) también es apropiada. Se debe realizar la
inmunofenotipificación de los linfocitos, incluida la evaluación de las poblaciones de linfocitos T de memoria y linfocitos de memoria B,
junto con la proliferación de linfocitos T en respuesta a mitógenos y antígenos. Las pruebas inmunológicas se revisan con más detalle por
separado. (Ver "Evaluación de laboratorio del sistema inmune" ).
Si estas evaluaciones no logran identificar una posible inmunodeficiencia, se indican más pruebas especializadas.
Remisión y pruebas para la función TLR : las pruebas adicionales las realiza mejor un inmunólogo experimentado que esté
familiarizado con este grupo raro de inmunodeficiencias. La prueba de la función TLR está disponible a través de laboratorios comerciales
de referencia [ 71 ]. Se puede aplicar una variedad de métodos in vitro. La mayoría mide la producción de citocinas inflamatorias (p. Ej.,
IL-6, IL-1 o factor de necrosis tumoral [TNF]) después de la estimulación con uno o más ligandos TLR (p. Ej., Lipopolisacárido bacteriano
[LPS], un agonista de TLR4) [ 72 ].
Las pruebas de la función TLR son muy sensibles al estado de las células. La sangre se debe enviar lo antes posible después de la
recolección, especialmente si se va a enviar a larga distancia (enviar a temperatura ambiente, proteger del calor o el frío). Si es posible, el
paciente debe estar clínicamente bien durante al menos unas semanas antes de la prueba y no recuperarse activamente de ninguna
enfermedad grave. Un control de envío de un donante sano no relacionado debe acompañar a la muestra. Las pruebas anormales deben
confirmarse repitiendo las pruebas. Las pruebas anormales persistentes deben ser seguidas por pruebas genéticas específicas.
Importancia de los polimorfismos TLR : un área de investigación en rápida expansión es el estudio epidemiológico de los muchos
polimorfismos de un solo nucleótido (SNP) que se han identificado en varios genes TLR. Algunos informes iniciales indicaron que ciertas
variantes de TLR2 y TLR4 se asociaron con una señalización alterada después de unir sus ligandos naturales [ 73,74 ]. Los SNP en TLR1
se han asociado con candidemia, y los SNPS en TLR4 se han asociado con aspergilosis invasiva entre los receptores de trasplantes de
células hematopoyéticas [ 75,76 ]. (Ver "Epidemiología y manifestaciones clínicas de la aspergilosis invasiva", sección "Factores de
riesgo" ).
Sin embargo, informes posteriores han cuestionado estos hallazgos y han declarado que algunos de estos polimorfismos no tienen
consecuencias funcionales [ 72,77,78 ]. No está claro cuál es la correcta. Quizás la respuesta depende del estímulo específico, la
respuesta que se mide u otras variables.
ASOCIACIONES ENTRE TLR Y OTRAS ENFERMEDADES
Aterosclerosis : se ha acumulado una gran cantidad de evidencia de que varios agentes infecciosos tienen vínculos epidemiológicos
con la enfermedad cardíaca aterosclerótica [ 79 ]. Estos incluyen Chlamydia pneumoniae , Helicobacter pylori , citomegalovirus (CMV),
virus Epstein-Barr (EBV), virus del herpes simple tipo 1 (HSV-1) y hepatitis B y C [ 80 ]. La infección crónica y el nivel de lipopolisacárido
sérico (LPS) se han identificado como factores de riesgo en un estudio prospectivo sobre el desarrollo de la enfermedad cardíaca
aterosclerótica [ 81 ].
Las placas ateroscleróticas humanas contienen células endoteliales y macrófagos que expresan TLR1 / 2 y TLR4 [ 82 ]. La lipoproteína de
baja densidad mínimamente modificada es un agonista de TLR4 [ 83 ]. Se une independientemente del CD14 y el factor de diferenciación
mieloide-2 (MD-2) y puede inducir la producción de quimiocinas, como la interleucina-8 (IL-8). Los datos en animales sugieren
fuertemente los roles de los TLR (particularmente TLR4) en el reconocimiento de moléculas extrañas (microbianas) y propias (matriz
extracelular, proteínas de choque térmico), activando células endoteliales y reclutando y activando monocitos y macrófagos para formar
focos inflamatorios que podrían conducir a la formación de placas ateromatosas [ 80 ].
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sele… 7/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
Alergia y asma : la mayoría de los estudios han encontrado que la exposición a productos bacterianos se ha asociado con la protección
contra el desarrollo de enfermedades alérgicas, y los TLR pueden ser parte integral de los mecanismos involucrados. Sin embargo, el
trabajo posterior sugiere que esta relación puede no ser tan directa.
● Se encontró una asociación entre la exposición a la endotoxina, que forma complejos con TLR4, y la protección contra la
sensibilización alérgica en múltiples estudios. Como ejemplo, un informe de 61 niños con sibilancias registró niveles
significativamente más bajos de endotoxina en el polvo doméstico de aquellos con el mayor grado de sensibilización de
inmunoglobulina E (IgE) a los alérgenos ambientales [ 84 ]. Otro estudio mostró que el ácido lipoteicoico, otro componente de las
paredes celulares bacterianas, interactúa con TLR2 para regular negativamente el receptor de IgE (Fc-epsilon-RI) en los mastocitos [
85 ].
● Por el contrario, un modelo diferente mostró que la activación de TLR4 en la superficie de las células epiteliales pulmonares parecía
promover el desarrollo de respuestas alérgicas a las vías respiratorias y asma [ 86 ]. En un modelo de ratón, se descubrió que las
combinaciones naturales de alérgenos de ácaros del polvo y LPS desencadenan células epiteliales a través de TLR4, lo que conduce
al reclutamiento de eosinófilos y la producción de las citocinas T helper tipo 2 (Th2), interleucina-5 (IL-5) y interleucina-13 (IL-13) [ 86
]. La inhalación simultánea de un antagonista de TLR4 eliminó completamente el efecto. Sin embargo, la dosis del agonista TLR
también juega un papel importante. En otro estudio, se observó que las dosis bajas de endotoxina que actúan sobre TLR4 aumentan
la inflamación Th2 en un modelo de asma de ratón, mientras que las dosis altas inducen una respuesta T helper tipo 1 (Th1) [87 ].
● La importancia de la exposición temprana a una microbiota rica y diversa en la prevención de la atopia es un área activa de
investigación. Los componentes microbianos (endotoxina) proporcionan una activación robusta de los TLR, que dan forma a las
respuestas inmunitarias [ 88 ]. La pérdida de la diversidad de microbiota, por otro lado, puede predisponer al desarrollo de atopia y
asma. La diversidad de microbiomas puede verse influenciada por las infecciones y el uso de antibióticos [ 89,90 ]. Los modelos de
ratón sugieren que la activación TLR de las células dendríticas CD103 + en el intestino puede desempeñar un papel importante en la
inducción del desarrollo de las células reguladoras T, lo que lleva a la inducción de tolerancia [ 91 ]. Además, el aumento de la
expresión de TLR2 y TLR4 en las células reguladoras T puede estar asociado con funciones supresoras aumentadas [ 92 ].
● Un metaanálisis de los polimorfismos TLR2, TLR4 y TLR9 encontró efectos relativamente menores sobre el riesgo de asma con la
posible excepción de la alteración TLR2 Arg753Gln, que puede tener una asociación significativa con el riesgo de asma [ 93 ].
Por lo tanto, la activación de las respuestas inmunes innatas a través de los TLR parece tener un impacto crítico en las primeras etapas
de la enfermedad alérgica, aunque la naturaleza de esta influencia requiere más estudio.
TERAPIAS BASADAS EN TLR
Hay varias terapias nuevas en uso o desarrollo que utilizan el conocimiento emergente de la biología TLR.
Agonistas de TLR7 - agonistas de TLR7 se han encontrado para ser clínicamente útil en el retraso del crecimiento de tumores malignos
y la inhibición de la replicación viral. Sin embargo, el mecanismo preciso de acción de estos agentes sigue siendo desconocido.
Imiquimod : Imiquimod es un agonista sintético de TLR7 que ha demostrado ser muy efectivo como monoterapia para el carcinoma
basocelular cuando se aplica tópicamente. También se usa en el tratamiento de las queratosis actínicas y las verrugas genitales. (Ver
"Condiloma acuminado (verrugas anogenitales): tratamiento de verrugas vulvares y vaginales", sección "Imiquimod" y "Tratamiento y
pronóstico del carcinoma basocelular con bajo riesgo de recurrencia" y "Tratamiento de la queratosis actínica" ).
Isatoribina : la isatoribina es otro agonista sintético de TLR7. En 12 adultos con infección crónica por hepatitis C que no recibieron
tratamiento, siete inyecciones diarias de isatoribina redujeron la carga viral sanguínea medida por la reacción en cadena de la polimerasa
[ 94 ]. La terapia fue bien tolerada, aunque el efecto antiviral fue modesto.
TLR9 y ADN CpG : la administración conjunta de oligodesoxinucleótidos (ODN) que contienen motivos de dinucleótidos de guanina
citosina (CpG) durante la inmunización mejora las respuestas inmunes T helper tipo 1 (Th1) en modelos animales [ 95 ]. Estos ODN imitan
secuencias de ADN bacteriano e interactúan con TLR9. (Ver 'TLR específicos' más arriba).
Los ODN también se están estudiando en ensayos en humanos. La inyección subcutánea de ODN solo en voluntarios sanos conduce a
aumentos fácilmente medibles de los niveles séricos de citoquinas de tipo Th1 (interleucina-12 [IL-12], interferón-alfa [IFN-alfa]), así como
a las citocinas generalmente asociadas con T helper tipo 2 (Th2) activación (interleucina-6 [IL-6]) [ 96 ].
Vacunación : en un estudio de un ODN agregado a una vacuna contra la hepatitis B (Engerix-B), los receptores de la vacuna con
ODN agregado tuvieron respuestas de anticuerpos de la superficie de la hepatitis B significativamente más rápidas y altas en comparación
con los controles que recibieron la vacuna sola [ 97 ]. Los receptores de la vacuna con ODN también tuvieron una tasa significativamente
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sele… 8/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
mayor de reacciones adversas. Estos fueron calificados como leves a moderados. (Ver "Vacunación contra el virus de la hepatitis B en
adultos" y "Vacunación contra el virus de la hepatitis B en bebés, niños y adolescentes" .)
Los recién nacidos y los lactantes son más susceptibles a la infección, particularmente por agentes patógenos intracelulares. El desarrollo
de vacunas que utilizan agonistas de TLR en nanopartículas es prometedor para inducir respuestas inmunitarias similares a las de los
adultos en los recién nacidos, quizás mejorando la protección inmunológica en esta población vulnerable [ 98 ].
Terapia contra el cáncer : los ODN CpG también se están estudiando como agentes para la terapia contra el cáncer. Estos se
administraron en combinación con rituximab en un ensayo de fase 1 en 20 pacientes con linfoma no Hodgkin recidivante [ 99 ]. La terapia
fue bien tolerada. Se detectaron niveles aumentados de ARNm para genes inducibles por interferón en las células mononucleares de
sangre periférica de pacientes después de recibir ODN.
ODN también se ha estudiado como adyuvante para una vacuna contra el cáncer. Los pacientes con cáncer de colon metastásico recién
diagnosticado y niveles elevados de antígeno carcinoembrionario en suero (CEA) recibieron un régimen que combina quimioterapia con
una vacuna contra el cáncer [ 100 ]. La vacuna estaba compuesta por un péptido derivado de CEA con uno de los tres adyuvantes: ODN,
factor estimulante de colonias de granulocitos (G-CSF) o células dendríticas autólogas. Las vacunas eran de inmunogenicidad
aparentemente equivalente. Ocho de 17 (47 por ciento) pacientes desarrollaron respuestas citotóxicas de células T anti-CEA, a pesar de
haber recibido quimioterapia inmunosupresora concomitante.
La carga del agonista TLR7 resiquimod en nanopartículas es prometedora para mejorar la respuesta inmune contra las células tumorales.
Se ha demostrado que la inyección subcutánea de nanopartículas cargadas con resiquimod en ratones con tumor se acumula en los
ganglios linfáticos que drenan el tumor donde pueden activar las células dendríticas, lo que conduce a una respuesta de células T
citotóxicas [ 101 ].
La inmunoterapia con alérgenos - acoplamiento de un ODN a un alérgeno se ha evaluado como sea posible la inmunoterapia para
la enfermedad atópica [ 102-104 ]. Esta estrategia utiliza TLR9 como un potente inductor de respuestas de células T Th1, reduciendo así
las respuestas Th2 o atópicas:
● En un ensayo aleatorizado, 19 adultos alérgicos a la ambrosía recibieron inyecciones subcutáneas de un alérgeno mayor de polen de
ambrosía (Amb a 1) acoplado a un ODN [ 102 ]. Las inyecciones fueron bien toleradas, y los investigadores demostraron in vitro un
cambio en el perfil de secreción de citocinas de células T de sangre periférica de Th2 ("alérgico") a Th1 ("no alérgico").
● En dos ensayos separados, doble ciego, controlados con placebo de 57 adultos [ 103 ] y 25 adultos [ 104 ] con alergia a la ambrosía,
los sujetos fueron asignados aleatoriamente al tratamiento usando preparaciones similares de alérgeno de polen de ambrosía junto
con ODN, administrado por inyección subcutánea. En ambos ensayos, los pacientes informaron beneficios clínicos para hasta dos
temporadas sucesivas de polen de ambrosía después de un ciclo de solo seis inyecciones.
RESUMEN
● Los receptores tipo Toll (TLR) pertenecen a una clase de moléculas conocidas como receptores de reconocimiento de patrones
(PRR). Los ligandos para estos receptores son componentes de microbios patógenos llamados patrones moleculares asociados a
patógenos (PAMP). Los TLR son parte del sistema inmune innato, aunque también modulan mecanismos que afectan el desarrollo de
respuestas inmunes adaptativas. (Ver 'Papel en la inmunidad innata' más arriba).
● Los TLR se expresan en leucocitos y varias células de tejido sólido. La localización celular de los TLR varía. TLR2 / 1, TLR2 / 6,
TLR4, TLR5, TLR10 y TLR11 se localizan en las superficies celulares, mientras que TLR3, TLR7, TLR8 y TLR9 se localizan dentro de
los endosomas. (Ver 'Distribución celular y tisular' más arriba).
● La estructura de todos los TLR es similar. La estructura del receptor, la organización, los ligandos y la señalización se resumen en la
tabla ( tabla 1 ) y la figura ( figura 1 ). La vía común final para la señalización de TLR involucra factores de transcripción que regulan
una multitud de genes, incluidos los que codifican importantes citocinas proinflamatorias e interferones tipo 1. (Ver 'Estructura y
función de TLR' más arriba).
● Los defectos en las moléculas de señalización proximal dentro de las vías de señalización TLR, incluida la proteína de respuesta
primaria de diferenciación mieloide 88 (MyD88) y la quinasa 4 asociada al receptor de interleucina-1 (IRAK4), se han implicado en la
inmunodeficiencia primaria a un espectro estrecho de microbios, lo que resulta en susceptibilidad a Infecciones bacterianas piógenas.
UNC93B1 (homólogo B1 de UNC93), TLR3, receptor de peaje / interleucina-1 (IL-1) (TIR) receptor que contiene el adaptador de
interferón beta (IFN-beta) (TRIF) inductor de adaptador que contiene el dominio (TIR), factor de necrosis tumoral (TNF) El factor 3
(TRAF3) y las mutaciones de la quinasa 1 de unión al tanque (TBK1) se han identificado en pacientes con susceptibilidad selectiva a
la encefalitis por virus del herpes simple tipo 1 (HSV-1). En contraste, los defectos en los componentes más distales de las vías de
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sele… 9/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
señalización TLR (es decir, el modulador esencial del factor nuclear [NF] -kappa-B [NEMO],HOIP ]) están asociados con
susceptibilidades infecciosas más amplias (bacterias, micobacterias, virus, hongos, organismos oportunistas). El deudor de la
deficiencia de citocinesis 8 (DOCK8) deteriora múltiples funciones celulares en una variedad de tipos de células, lo que conduce a
una inmunodeficiencia combinada. (Ver 'defectos de señalización TLR en inmunodeficiencia primaria' más arriba).
● Las terapias basadas en TLR en desarrollo o en uso incluyen los agonistas de TLR7, imiquimod e isatoribina. Además, se ha
encontrado que los oligodesoxinucleótidos (ODN) que contienen motivos de dinucleótidos de guanina citosina (CpG),
presumiblemente a través de la unión a TLR9, aumentan las respuestas inmunes T helper tipo 1 (Th1) y se han aplicado a la
vacunación, la terapia contra el cáncer y la inmunoterapia para la alergia enfermedad. (Ver 'Terapias basadas en TLR' más arriba).
EXPRESIONES DE GRATITUD
El personal editorial de UpToDate quisiera agradecer a Francisco A Bonilla, MD, PhD, quien contribuyó a una versión anterior de esta
revisión del tema.
El personal editorial de UpToDate desea agradecer a E Richard Stiehm, MD, quien contribuyó como Editor de Sección a una versión
anterior de esta revisión del tema.
El uso de UpToDate está sujeto al Acuerdo de suscripción y licencia .
Referencias
1. Schnare M, Rollinghoff M, Qureshi S. Receptores tipo Toll: centinelas de defensa del huésped contra la infección bacteriana. Int Arch
Allergy Immunol 2006; 139: 75.
2. Kumar H, Kawai T, Akira S. Receptores tipo Toll e inmunidad innata. Biochem Biophys Res Commun 2009; 388: 621.
3. Gazzinelli RT, Denkers EY. El protozoo se encuentra con vías de señalización del receptor tipo Toll: implicaciones para el parasitismo
del huésped. Nat Rev Immunol 2006; 6: 895.
4. Kaisho T, Akira S. Función y señalización del receptor tipo Toll. J Allergy Clin Immunol 2006; 117: 979.
5. Zarember KA, Godowski PJ. Expresión tisular de receptores humanos tipo Toll y regulación diferencial de ARNm de receptores tipo
Toll en leucocitos en respuesta a microbios, sus productos y citocinas. J Immunol 2002; 168: 554.
6. Gewirtz AT, Navas TA, Lyons S, et al. Vanguardia: la flagelina bacteriana activa TLR5 expresado basolateralmente para inducir la
expresión del gen proinflamatorio epitelial. J Immunol 2001; 167: 1882.
7. Brinkmann MM, Spooner E, Hoebe K, et al. La interacción entre la proteína de membrana ER UNC93B y TLR3, 7 y 9 es crucial para
la señalización de TLR. J Cell Biol 2007; 177: 265.
8. Beutler BA. TLR e inmunidad innata. Blood 2009; 113: 1399.
9. Shinohara ML, Lu L, Bu J, et al. La expresión de osteopontina es esencial para la producción de interferón alfa por las células
dendríticas plasmacitoides. Nat Immunol 2006; 7: 498.
10. Schoenemeyer A, Barnes BJ, Mancl ME, et al. El factor regulador de interferón, IRF5, es un mediador central de la señalización del
receptor 7 de tipo toll. J Biol Chem 2005; 280: 17005.
11. Yoshimura A, Ohishi HM, Aki D, Hanada T. Regulación de la señalización TLR y la inflamación por las proteínas de la familia SOCS.
J Leukoc Biol 2004; 75: 422.
12. Takeda K, Akira S. TLR vías de señalización. Semin Immunol 2004; 16: 3.
13. Ignacio A, Morales CI, Câmara NO, Almeida RR. Detección innata de la microbiota intestinal: modulación de enfermedades
inflamatorias y autoinmunes. Front Immunol 2016; 7:54.
14. Akira S, Takeda K. Señalización de receptor tipo Toll. Nat Rev Immunol 2004; 4: 499.
15. Kawai T, Akira S. TLR señalización. Cell Death Differ 2006; 13: 816.
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 10/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
16. Liew FY, Xu D, Brint EK, O'Neill LA. Regulación negativa de las respuestas inmunes mediadas por receptores tipo toll. Nat Rev
Immunol 2005; 5: 446.
17. Takeda K, Akira S. Receptores tipo Toll en inmunidad innata. Int Immunol 2005; 17: 1.
18. Ozinsky A, Underhill DM, Fontenot JD, et al. El repertorio para el reconocimiento de patrones de patógenos por el sistema inmune
innato se define por la cooperación entre los receptores tipo toll. Proc Natl Acad Sci USA 2000; 97: 13766.
19. Buwitt-Beckmann U, Heine H, Wiesmüller KH, y col. Reconocimiento independiente de TLR1 y TLR6 de lipopéptidos bacterianos. J
Biol Chem 2006; 281: 9049.
20. Omueti KO, Beyer JM, Johnson CM, et al. El intercambio de dominios entre los receptores humanos de tipo toll 1 y 6 revela una
región requerida para la discriminación de los lipopéptidos. J Biol Chem 2005; 280: 36616.
21. Massari P, Henneke P, Ho Y, et al. Vanguardia: la estimulación inmune por las porinas neisseriales depende del receptor 2 y
depende de MyD88. J Immunol 2002; 168: 1533.
22. LeBouder E, Rey-Nores JE, Rushmere NK, et al. Las formas solubles del receptor Toll-like (TLR) 2 capaces de modular la
señalización de TLR2 están presentes en el plasma humano y la leche materna. J Immunol 2003; 171: 6680.
23. Schröder M, Bowie AG. TLR3 en inmunidad antiviral: ¿jugador clave o espectador? Tendencias Immunol 2005; 26: 462.
24. Tanabe M, Kurita-Taniguchi M, Takeuchi K, et al. Mecanismo de regulación positiva del receptor 3 similar a Toll humano secundario a
la infección de cepas atenuadas por el virus del sarampión. Biochem Biophys Res Commun 2003; 311: 39.
25. Pisegna S, Pirozzi G, Piccoli M, y col. La activación de p38 MAPK controla la regulación positiva mediada por TLR3 de la
citotoxicidad y la producción de citocinas en células NK humanas. Blood 2004; 104: 4157.
26. Muroi M, Tanamoto K. Regiones estructurales de MD-2 que determinan la actividad agonista-antagonista del lípido IVa. J Biol Chem
2006; 281: 5484.
27. Kurt-Jones EA, Popova L, Kwinn L, et al. Los receptores de reconocimiento de patrones TLR4 y CD14 median la respuesta al virus
sincitial respiratorio. Nat Immunol 2000; 1: 398.
28. Sasu S, LaVerda D, Qureshi N, et al. Chlamydia pneumoniae y la proteína 60 de choque térmico por clamidia estimulan la
proliferación de células musculares lisas vasculares humanas a través del receptor tipo toll 4 y la activación de la proteína quinasa
activada por mitógeno p44 / p42. Circ Res 2001; 89: 244.
29. Johnson GB, Brunn GJ, Platt JL. Activación de receptores de tipo Toll de mamíferos por agonistas endógenos. Crit Rev Immunol
2003; 23:15.
30. Hayashi F, Smith KD, Ozinsky A y col. La respuesta inmune innata a la flagelina bacteriana está mediada por el receptor Toll-like 5.
Nature 2001; 410: 1099.
31. Heil F, Ahmad-Nejad P, Hemmi H, y cols. El estímulo específico del receptor Toll-like 7 (TLR7) loxoribina descubre una fuerte
relación dentro de la subfamilia TLR7, 8 y 9. Eur J Immunol 2003; 33: 2987.
32. Heil F, Hemmi H, Hochrein H, y col. Reconocimiento específico de especie de ARN monocatenario a través de los receptores 7 y 8
de tipo toll. Science 2004; 303: 1526.
33. Lund JM, Alexopoulou L, Sato A y col. Reconocimiento de virus de ARN monocatenario por el receptor Toll-like 7. Proc Natl Acad Sci
USA 2004; 101: 5598.
34. Krug A, Towarowski A, Britsch S, y col. La expresión del receptor tipo Toll revela el ADN de CpG como un estímulo microbiano único
para las células dendríticas plasmacitoides que se sinergiza con el ligando CD40 para inducir altas cantidades de IL-12. Eur J
Immunol 2001; 31: 3026.
35. Hasan U, Chaffois C, Gaillard C, y col. El TLR10 humano es un receptor funcional, expresado por las células B y las células
dendríticas plasmacitoides, que activa la transcripción génica a través de MyD88. J Immunol 2005; 174: 2942.
36. Oosting M, Cheng SC, Bolscher JM, et al. El TLR10 humano es un receptor antiinflamatorio de reconocimiento de patrones. Proc
Natl Acad Sci USA 2014; 111: E4478.
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 11/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
37. Henrick BM, Yao XD, Zahoor MA, et al. TLR10 detecta las proteínas del VIH-1 y mejora significativamente la infección por el VIH-1.
Front Immunol 2019; 10: 482.
38. Thoma-Uszynski S, Stenger S, Takeuchi O, et al. Inducción de la actividad antimicrobiana directa a través de receptores de peaje de
mamíferos. Science 2001; 291: 1544.
39. Aliprantis AO, Yang RB, Weiss DS, et al. La vía de señalización apoptótica activada por Toll-like receptor-2. EMBO J 2000; 19: 3325.
40. Ayabe T, Ashida T, Kohgo Y, Kono T. El papel de las células de Paneth y sus péptidos antimicrobianos en la defensa innata del
huésped. Tendencias Microbiol 2004; 12: 394.
41. Birchler T, Seibl R, Büchner K, et al. El receptor 2 tipo Toll humano media la inducción del péptido antimicrobiano beta-defensina 2
humana en respuesta a la lipoproteína bacteriana. Eur J Immunol 2001; 31: 3131.
42. Lehrer RI, Ganz T. Defensinas de animales vertebrados. Curr Opin Immunol 2002; 14:96.
43. Akira S, Takeda K, Kaisho T. Receptores tipo Toll: proteínas críticas que unen la inmunidad innata y adquirida. Nat Immunol 2001; 2:
675.
44. Bowie A, Kiss-Toth E, Symons JA, et al. A46R y A52R del virus vaccinia son antagonistas de la IL-1 del huésped y la señalización
del receptor de tipo toll. Proc Natl Acad Sci USA 2000; 97: 10162.
45. Harte MT, Haga IR, Maloney G, et al. La proteína A52R de poxvirus se dirige a complejos de señalización del receptor tipo Toll para
suprimir la defensa del huésped. J Exp Med 2003; 197: 343.
46. von Bernuth H, Picard C, Jin Z, et al. Infecciones bacterianas piógenas en humanos con deficiencia de MyD88. Science 2008; 321:
691.
47. Picard C, von Bernuth H, Ghandil P, et al. Características clínicas y resultados de pacientes con deficiencia de IRAK-4 y MyD88.
Medicine (Baltimore) 2010; 89: 403.
48. McDonald DR, Goldman F, Gomez-Duarte OD, et al. Deterioro de la activación del receptor de células T en pacientes con deficiencia
de quinasa 4 asociada al receptor de IL-1. J Allergy Clin Immunol 2010; 126: 332.
49. Ku CL, Yang K, Bustamante J, et al. Trastornos hereditarios de la señalización del receptor Toll-like humano: implicaciones
inmunológicas. Immunol Rev 2005; 203: 10.
50. Picard C, Puel A, Bonnet M, et al. Infecciones bacterianas piógenas en humanos con deficiencia de IRAK-4. Science 2003; 299:
2076.
51. Ku CL, von Bernuth H, Picard C, et al. Predisposición selectiva a infecciones bacterianas en niños con deficiencia de IRAK-4: los
TLR dependientes de IRAK-4 son redundantes en la inmunidad protectora. J Exp Med 2007; 204: 2407.
52. Bousfiha A, Picard C, Boisson-Dupuis S, et al. Inmunodeficiencias primarias de inmunidad protectora a infecciones primarias. Clin
Immunol 2010; 135: 204.
53. El ensayo de función del receptor Toll-like (# 0051589). www.aruplab.com (Acceso el 31 de marzo de 2017).
54. Zhang SY, Jouanguy E, Ugolini S, et al. Deficiencia de TLR3 en pacientes con encefalitis herpética simple. Science 2007; 317: 1522.
55. Casrouge A, Zhang SY, Eidenschenk C, y col. Encefalitis por virus del herpes simple en la deficiencia humana UNC-93B. Science
2006; 314: 308.
56. Jouanguy E, Zhang SY, Chapgier A, et al. Inmunodeficiencias primarias humanas de interferones tipo I. Bioquímica 2007; 89: 878.
57. Zhang SY, Jouanguy E, Sancho-Shimizu V, et al. Inducción humana dependiente del receptor Toll-like de interferones en inmunidad
protectora contra virus. Immunol Rev 2007; 220: 225.
58. Sancho-Shimizu V, Pérez de Diego R, Lorenzo L, et al. Encefalitis herpética simple en niños con deficiencia autosómica recesiva y
dominante de TRIF. J Clin Invest 2011; 121: 4889.
59. Pérez de Diego R, Sancho-Shimizu V, Lorenzo L, et al. La deficiencia de la molécula adaptadora TRAF3 humana conduce a una
respuesta del receptor Toll-like 3 deteriorada y a la susceptibilidad a la encefalitis por herpes simple. Inmunidad 2010; 33: 400.
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 12/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
60. Herman M, Ciancanelli M, Ou YH, y col. Las mutaciones heterocigotas de TBK1 deterioran la inmunidad TLR3 y subyacen a la
encefalitis herpética simple de la infancia. J Exp Med 2012; 209: 1567.
61. Picard C, Casanova JL, Puel A. Enfermedades infecciosas en pacientes con deficiencia de IRAK-4, MyD88, NEMO o IκBα. Clin
Microbiol Rev 2011; 24: 490.
62. Zhang Q, Davis JC, Lamborn IT, et al. Inmunodeficiencia combinada asociada con mutaciones DOCK8. N Engl J Med 2009; 361:
2046.
63. Janssen E, Tohme M, Hedayat M, et al. Un complejo DOCK8-WIP-WASp une los receptores de células T al citoesqueleto de actina.
J Clin Invest 2016; 126: 3837.
64. Jabara HH, McDonald DR, Janssen E, et al. DOCK8 funciona como un adaptador que une la señalización TLR-MyD88 con la
activación de células B. Nat Immunol 2012; 13: 612.
65. Keles S, Jabara HH, Reisli I, et al. Depleción de células dendríticas plasmocitoides en la deficiencia de DOCK8: rescate de
infecciones herpéticas graves con terapia con IFN-α 2b. J Allergy Clin Immunol 2014; 133: 1753.
66. Boisson B, Laplantine E, Prando C, et al. Inmunodeficiencia, autoinflamación y amilopectinosis en humanos con deficiencia
heredada de HOIL-1 y LUBAC. Nat Immunol 2012; 13: 1178.
67. Boisson B, Laplantine E, Dobbs K, et al. La deficiencia humana de HOIP y LUBAC subyace a la autoinflamación, la
inmunodeficiencia, la amilopectinosis y la linfangiectasia. J Exp Med 2015; 212: 939.
68. Borzutzky A, Rauter I, Fried A, y col. Activación de STAT3 impulsada por TLR9 defectuosa en células B de pacientes con IDCV. Clin
Immunol 2018; 197: 40.
69. Fliegauf M, Bryant VL, Frede N, et al. Haploinsufficiency de la subunidad NF-κB1 p50 en la inmunodeficiencia variable común. Am J
Hum Genet 2015; 97: 389.
70. Chen K, Coonrod EM, Kumánovics A, et al. Las mutaciones de la línea germinal en NFKB2 implican la vía no canónica de NF-κB en
la patogénesis de la inmunodeficiencia variable común. Am J Hum Genet 2013; 93: 812.
71. Varios laboratorios comerciales ofrecen pruebas para la función TLR. Ejemplos en los Estados Unidos incluyen ViracorIBT y ARUP.
72. von Aulock S, Schröder NW, Gueinzius K, et al. El polimorfismo del receptor 4 heterogéneo tipo toll no influye en la liberación de
citocinas inducida por lipopolisacáridos en la sangre total humana. J Infect Dis 2003; 188: 938.
73. Bochud PY, Hawn TR, Aderem A. Vanguardia: un polimorfismo del receptor 2 tipo Toll asociado con la lepra lepromatosa no puede
mediar la señalización micobacteriana. J Immunol 2003; 170: 3451.
74. Schmitt C, Humeny A, Becker CM y col. Polimorfismos de TLR4: genotipado rápido y respuesta reducida al lipopolisacárido de alelos
mutantes TLR4. Clin Chem 2002; 48: 1661.
75. Plantinga TS, Johnson MD, Scott WK, et al. Los polimorfismos del receptor 1 tipo Toll aumentan la susceptibilidad a la candidemia. J
Infect Dis 2012; 205: 934.
76. Bochud PY, Chien JW, Marr KA y col. Toll-like receptor 4 polimorfismos y aspergilosis en el trasplante de células madre. N Engl J
Med 2008; 359: 1766.
77. van der Graaf C, Kullberg BJ, Joosten L, et al. Consecuencias funcionales del polimorfismo del receptor-4 Asp299Gly Toll-like.
Cytokine 2005; 30: 264.
78. Imahara SD, Jelacic S, Junker CE, O'Keefe GE. El polimorfismo TLR4 +896 no está asociado con la hipo-respuesta de
lipopolisacárido en los leucocitos. Genes Immun 2005; 6:37.
79. Espinola-Klein C, Rupprecht HJ, Blankenberg S, et al. Impacto de la carga infecciosa en la extensión y el pronóstico a largo plazo de
la aterosclerosis. Circulación 2002; 105: 15.
80. Michelsen KS, Doherty TM, Shah PK, señalización Arditi M. TLR: un puente emergente de la inmunidad innata a la aterogénesis. J
Immunol 2004; 173: 5901.
81. Kiechl S, Egger G, Mayr M y col. Infecciones crónicas y el riesgo de aterosclerosis carotídea: resultados prospectivos de un gran
estudio de población. Circulación 2001; 103: 1064.
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 13/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
82. Edfeldt K, Swedenborg J, Hansson GK, Yan ZQ. Expresión de receptores tipo toll en lesiones ateroscleróticas humanas: una posible
vía para la activación de la placa. Circulación 2002; 105: 1158.
83. Walton KA, Hsieh X, Gharavi N, et al. Receptores implicados en la síntesis de interleucina-8 oxidada por 1-palmitoil-2-araquidonoil-
sn-glicero-3-fosforilcolina mediada por Un papel para el receptor 4 tipo Toll y una proteína anclada con glucosilfosfatidilinositol. J Biol
Chem 2003; 278: 29661.
84. Gereda JE, Leung DY, Thatayatikom A, et al. Relación entre la exposición a la endotoxina del polvo doméstico, el desarrollo de
células T tipo 1 y la sensibilización a alérgenos en lactantes con alto riesgo de asma. Lancet 2000; 355: 1680.
85. Yoshioka M, Fukuishi N, Iriguchi S, et al. El ácido lipoteicoico regula negativamente la expresión de FcepsilonRI en mastocitos
humanos a través del receptor Toll-like 2. J Allergy Clin Immunol 2007; 120: 452.
86. Hammad H, Chieppa M, Perros F, et al. El alergeno de los ácaros del polvo doméstico induce asma a través del receptor Toll-like 4
que activa las células estructurales de las vías respiratorias. Nat Med 2009; 15: 410.
87. Dong L, Li H, Wang S, Li Y. Diferentes dosis de lipopolisacáridos regulan la inflamación pulmonar de los ratones asmáticos a través
de la vía TLR4 en los macrófagos alveolares. J Asthma 2009; 46: 229.
88. Riiser A. El microbioma humano, el asma y la alergia. Alergia Asma Clin Immunol 2015; 11:35.
89. Rodríguez JM, Murphy K, Stanton C, et al. La composición de la microbiota intestinal a lo largo de la vida, con énfasis en la vida
temprana. Microb Ecol Health Dis 2015; 26: 26050.
90. Levin AM, Sitarik AR, Havstad SL, et al. Efectos conjuntos del embarazo, factores socioculturales y ambientales sobre la estructura y
diversidad del microbioma intestinal en la vida temprana. Sci Rep 2016; 6: 31775.
91. Farache J, Koren I, Milo I, et al. Las bacterias luminales reclutan células dendríticas CD103 + en el epitelio intestinal para tomar
muestras de antígenos bacterianos para su presentación. Inmunidad 2013; 38: 581.
92. Schaub B, Liu J, Höppler S, y col. Deterioro de las células T reguladoras en la sangre del cordón umbilical de madres atópicas. J
Allergy Clin Immunol 2008; 121: 1491.
93. Tizaoui K, Kaabachi W, Hamzaoui K, Hamzaoui A. Asociación de polimorfismos de un solo nucleótido en genes receptores de peaje
con riesgo de asma: una revisión sistemática y un metanálisis. Alergia Asma Immunol Res 2015; 7: 130.
94. Horsmans Y, Berg T, Desager JP, et al. La isatoribina, un agonista de TLR7, reduce la concentración de virus plasmático en la
infección crónica por hepatitis C. Hepatología 2005; 42: 724.
95. Maletto BA, Rópolo AS, Liscovsky MV, et al. Los oligodesoxinucleótidos CpG funcionan como un adyuvante eficaz en ratones BALB /
c envejecidos. Clin Immunol 2005; 117: 251.
96. Krieg AM, Efler SM, Wittpoth M, y col. Inducción de inmunidad innata similar a TH1 sistémica en voluntarios normales después de la
administración subcutánea pero no intravenosa de CPG 7909, un agonista de oligodesoxinucleótido CpG de clase B sintético TLR9.
J Immunother 2004; 27: 460.
97. Cooper CL, Davis HL, Morris ML, et al. CPG 7909, un oligodesoxinucleótido agonista de TLR9 inmunoestimulante, como adyuvante
de la vacuna contra el VHB Engerix-B en adultos sanos: un estudio doble ciego de fase I / II. J Clin Immunol 2004; 24: 693.
98. Dowling DJ, Scott EA, Scheid A y col. Las nanopartículas agonistas del receptor 8 de tipo Toll imitan los efectos inmunomoduladores
de la vacuna BCG viva y mejoran las respuestas inmunes innatas y adaptativas neonatales. J Allergy Clin Immunol 2017; 140: 1339.
99. Friedberg JW, Kim H, McCauley M, et al. Inmunoterapia combinada con un oligonucleótido CpG (1018 ISS) y rituximab en pacientes
con linfoma no Hodgkin: aumento de la expresión génica inducible por interferón alfa / beta, sin toxicidad significativa. Blood 2005;
105: 489.
100. Weihrauch MR, Ansén S, Jurkiewicz E, et al. La Fase I / II combinó quimioinmunoterapia con péptido CAP-1 restringido a HLA-A2
derivado de antígeno carcinoembrionario e irinotecán, 5-fluorouracilo y leucovorina en pacientes con cáncer colorrectal metastásico
primario. Clin Cancer Res 2005; 11: 5993.
101. Mottas I, Bekdemir A, Cereghetti A, et al. El suministro de nanopartículas anfifílicas mejora la eficacia anticancerígena de un ligando
TLR7 a través de la activación inmune local. Biomateriales 2019; 190-191: 111.
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 14/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
102. Simons FE, Shikishima Y, Van Nest G, et al. Redirección inmunitaria selectiva en humanos con alergia a la ambrosía mediante la
inyección de Amb a 1 vinculado al ADN inmunoestimulador. J Allergy Clin Immunol 2004; 113: 1144.
103. Tulic MK, Fiset PO, Christodoulopoulos P, et al. Amb a 1-inmunoestimulador conjugado de oligodesoxinucleótido inmunoterapia
disminuye la respuesta inflamatoria nasal. J Allergy Clin Immunol 2004; 113: 235.
104. Creticos PS, Schroeder JT, Hamilton RG, y col. Inmunoterapia con una vacuna agonista del receptor 9 similar a la ambrosía para la
rinitis alérgica. N Engl J Med 2006; 355: 1445.
Tema 3985 Versión 12.0
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 15/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
GRÁFICOS
Características esenciales de los receptores de peaje
Expresión Señalización de
Receptor Ligandos Productos
celular intermedios
TLR1 + Lipopéptido de triacilo (bacterias grampositivas, micobacterias), porinas de Neisseria M / M, MDC TIRAP, MyD88 IC
TLR2 , Borrelia burgdorferi OspA
TLR2 + Lipopéptido de diacilo M / M, MC TIRAP, MyD88 IC
TLR6
TLR3 dsRNA (virus) B, T, NK TRIF IC, tipo 1 IFN
TLR4 LPS (bacterias gramnegativas), proteína de fusión RSV, Chlamydia hsp60 , matriz M / M, MDC, MC TRANVÍA, TRIF o TIRAP, IC, tipo 1 IFN
extracelular MyD88
TLR5 Flagelina (bacteria) M / M, MDC MyD88 IC
TLR7 ssRNA (virus), imidazoquinolinas M / M, MDC, PDC, MyD88 IC, tipo 1 IFN
B
TLR8 ssRNA (virus), imidazoquinolinas M / M, MDC, MC MyD88 IC, tipo 1 IFN
TLR9 ADN CpG (bacterias) M / M, PDC, B, T MyD88 IC, tipo 1 IFN
TLR10 (desconocido) M / M, B MyD88
TLR: receptor tipo toll; OspA: proteína A de la superficie externa; M / M: macrófagos / monocitos; MDC: célula dendrítica mieloide; TIRAP: proteína adaptadora que contiene
el dominio toll / interleukin-1 receptor (TIR); MyD88: proteína de respuesta primaria de diferenciación mieloide 88; IC: citoquinas inflamatorias que incluyen factor de
necrosis tumoral (TNF), interleucina-1-beta (IL-1-beta), interleucina-6 (IL-6), interleucina-12 (IL-12); MC: mastocitos; dsRNA: ARN bicatenario; B: célula B; T: célula T; NK:
célula asesina natural; TRIF: interferón beta inductor de adaptador que contiene dominio TIR (IFN-beta); IFN: interferón; LPS: lipopolisacárido; VSR: virus sincitial
respiratorio; hsp60: proteína de choque térmico 60; TRAM: molécula adaptadora relacionada con TRIF; ssRNA: ARN monocatenario; PDC: células dendríticas plasmacitoides;
ADN de CpG: motivos de dinucleótidos de citosina guanina (en ADN bacteriano) .
Graphic 61291 Versión 10.0
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 16/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
Receptores tipo Toll: vías de organización y señalización.
Señalización de TLR en células dendríticas convencionales, macrófagos y células dendríticas plasmacitoides. TLR2 (TLR2 en
asociación con TLR1 o TLR6), TLR4, TLR5 y TLR11 se localizan en la superficie celular para el reconocimiento de ligandos. TLR3,
TLR7 y TLR9 se localizan en el endosoma, que se transporta al endosoma a través de la proteína transportadora localizada en el
retículo endoplásmico (ER) UNC93B para el reconocimiento del ligando en la luz del endosoma. Todos los TLR, excepto TLR3,
reclutan MyD88, mientras que TLR1, TLR2, TLR4 y TLR6 reclutan el adaptador adicional TIRAP, que vincula el dominio TIR con
MyD88. TLR3 y TLR4 reclutan TRIF. TLR4 requiere el adaptador de enlace adicional TRAM, que vincula el dominio TIR de TLR4
con TRIF. Las células dendríticas o los macrófagos estimulados con los ligandos TLR1, TLR2, TLR5, TLR6 y TLR11 inician la vía
dependiente de MyD88, mientras que los ligandos TLR3 inician la ruta dependiente de TRIF. TLR4 activa las rutas dependientes
de MyD88 y TRIF. En la vía dependiente de MyD88, MyD88 recluta a la familia de proteínas IRAK y TRAF6. A su vez, TRAF6
activa TAK1. El TAK1 activado activa el complejo IKK, que activa las subunidades NF-kappa-B. El TAK1 activado también activa
la ruta MAPK. En la ruta dependiente de TRIF, TRIF interactúa con RIP1 y TRAF6. TRAF6 activado y RIP1 activan NF-kappa-B y
proteínas quinasas activadas por mitógeno (MAPK). TRIF también interactúa con TRAF3 y activa TBK1 / IKKi, que activa IRF3 e
IRF7. Las células dendríticas plasmocitoides estimuladas con ligandos TLR7 y TLR9 activan NF-kappa-B y MAPK a través de la
vía dependiente de MyD88. Para inducir interferones tipo 1, MyD88 se asocia con la familia de proteínas IRAK. IRAK1 e IKK-
alpha activan IRF7. IRAK1 también interactúa con TRAF3 y activa IRF7. Las subunidades NF-kappa-B activadas y las IRF se
translocan al núcleo. NF-kappa-B y MAPK inician la transcripción de genes de citocinas inflamatorias, mientras que los IRF
inician la transcripción de interferones tipo 1.
TLR: receptor tipo toll; MyD88: proteína de respuesta primaria de diferenciación mieloide 88; IRAK: quinasa asociada al receptor de
interleucina-1; TRAF: factor asociado al receptor del factor de necrosis tumoral (TNF); TAK: proteína quinasa activada por beta-factor de
crecimiento transformante (TGF); IKK: inhibidor de la NF-kappa-B quinasa; MAP: proteína activada por mitógeno; NFkB: factor nuclear
(NF) -kappa-B; TIRAP: proteína adaptadora que contiene el dominio toll / interleukin-1 (IL-1) (TIR); TRIF: adaptador que contiene el
dominio TIR que induce interferón (IFN); TRAM: molécula adaptadora relacionada con TRIF; RIP: proteína que interactúa con el
receptor; TBK: quinasa de unión al activador de NF-kappa-B asociada a la familia TRAF; IKKi: I-kappa-B quinasa i; IRF: factor regulador
de interferón; IFN: interferones; UNC93B: homólogo UNC93 B; IKK-alfa: inhibidor del factor nuclear kappa-B quinasa subunidad alfa.
Reproducido de: Kumar H, Kawai T, Akira S. Receptores tipo Toll e inmunidad innata. Biochem Biophys Res Commun 2009; 388: 621.
Ilustración utilizada con el permiso de Elsevier Inc. Todos los derechos reservados.
Graphic 57602 Versión 5.0
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 17/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
Receptores tipo Toll (TLR) y defectos de señalización que conducen a inmunodeficiencia primaria
Defecto genético Herencia Complicaciones infecciosas Características clínicas no infecciosas.
Inmunodeficiencia innata
IRAK4 o MyD88 CON Infecciones graves recurrentes (celulitis, artritis, Se presenta en la infancia; puede mejorar con la edad si
meningitis, osteomielitis, abscesos orgánicos y sepsis), el paciente sobrevive.
que afectan principalmente el tracto respiratorio superior
y la piel.
Organismos más comunes: Staphylococcus aureus ,
Streptococcus pneumoniae , Pseudomonas aeruginosa.
La falta de fiebre significativa en el contexto de una
infección bacteriana grave puede ser una pista.
TLR3 CON Encefalitis por VHS.
TRIF , AR Encefalitis por VHS.
TRAF3 A Encefalitis por VHS.
TBK1 A Encefalitis por VHS.
UNC93B1 CON Encefalitis por VHS.
Inmunodeficiencia combinada
NEMO / IKK-gamma Ligado a X Ba, MB, V, F, op. Incontinencia pigmentos en lactantes.
La gravedad y el rango de complicaciones infecciosas es Las mutaciones hipomórficas en bebés varones a
variable. menudo tienen (ED-ID).
I-kappa-B-alfa A Ba, MB, V, F, op. ED-ID.
NF-kappa-B1 A Ba recurrente, V. Hipogammaglobulinemia.
NF-kappa-B2 A Ba, MB, V, F, op. Hipogammaglobulinemia.
Autoinmunidad.
Insuficiencia suprarrenal.
HOIL-1 CON Ba piógeno (p. Ej., S. pneumoniae o Haemophilus Autoinflamación (episodios recurrentes de fiebre).
HOIP influenzae ). Hepatoesplenomegalia.
Amilopectinosis muscular.
DOCK8 CON Ba piógena, V, F. Hiperinmunoglobulina E autosómica recesiva.
Hipereosinofilia.
IRAK4: quinasa 4 asociada al receptor de interleucina-1; MyD88: proteína de respuesta primaria de diferenciación mieloide 88; AR: autosómico recesivo; TLR3: receptor 3 de
tipo toll; HSV: virus del herpes simple; TRIF: toll / interleukin-1 (IL-1) receptor (TIR) que contiene el adaptador que induce el interferón beta inductor del adaptador (IFN-
beta); AD: autosómico dominante; TRAF3: factor 3 asociado al receptor del factor de necrosis tumoral (TNF); TBK1: quinasa de unión a tanque 1; UNC93B1: homólogo
UNC93 B1; NEMO: modulador esencial del factor nuclear (NF) -kappa-B; IKK-gamma: inhibidor de la NF-kappa-B quinasa-gamma; Ba: bacterias; MB: micobacterias; V: viral;
F: hongos; Op: infecciones oportunistas; ED-ID: displasia ectodérmica con inmunodeficiencia; NF: factor nuclear; HOIL-1: proteína 2 de unión al elemento sensible al hierro
oxidada con hemo 2 (IRP2) ubiquitina ligasa 1,HOIP : el gen que codifica el componente catalítico de LUBAC; DOCK8: dedicador de la citocinesis 8.
Graphic 112782 Versión 1.0
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 18/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
Vías de señalización dependientes de NF-kappa-B
CD40 señala a través de NF-kappa-B2, la vía no canónica NF-kappa-B. Todos los demás receptores
utilizan la vía canónica NF-kappa-B1.
TLR: receptor tipo toll; MyD88: proteína de respuesta primaria de diferenciación mieloide 88; IRAK: quinasa
asociada al receptor de interleucina-1; NLR: receptores similares a los del dominio de oligomerización de
nucleótidos (NOD); RLR: receptores de tipo retinoico inducible por ácido gen I (RIG-I); TCR: receptor de
células T; BCR: receptor de células B; CD40: grupo de diferenciación 40, una proteína coestimuladora que
se encuentra en las células presentadoras de antígeno, que se requiere para su activación; EDAR: receptor
de ectodisplasina A; NF-kappa-B: factor nuclear (NF) para el potenciador de la cadena ligera kappa en
células B.
Graphic 112546 Versión 1.0
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 19/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
Defectos de la vía del receptor tipo Toll (TLR)
Cuando mutan o son deficientes, las moléculas de señalización que se muestran en rojo resultan en inmunodeficiencia.
TLR: receptor tipo toll; MyD88: proteína de respuesta primaria de diferenciación mieloide 88; IRAK: quinasa asociada al receptor de interleucina-1; TRAF: factor asociado al
receptor del factor de necrosis tumoral (TNF); TAK1: proteína quinasa 1 activada por el factor de crecimiento transformante (TGF) beta; IRF: factor regulador de interferón; NEMO:
modulador esencial del factor nuclear (NF) -kappa-B; IKK: inhibidor de la quinasa del factor nuclear (NF) -kappa-B; NF-kappa-B: factor nuclear (NF) para el potenciador de la
cadena ligera kappa en células B; MAPK: proteínas quinasas activadas por mitógeno; AP1: proteína activadora 1; MAL: MyD88 como adaptador; TRAM: molécula adaptadora
relacionada con TRIF; TRIF: toll / interleukin-1 (IL-1) receptor (TIR) que contiene el adaptador que induce el interferón beta inductor del adaptador (IFN-beta); TBK1: quinasa de
unión a tanque 1; IKKi: I-kappa-B quinasa i; UNC93B: homólogo UNC93 B; RIP1: proteína quinasa-1 que interactúa con el receptor; BTK: Bruton tirosina quinasa; OPNi:
osteopontina i.
Graphic 112557 Versión 1.0
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 20/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
Papel de DOCK8 en la señalización TLR9 en linfocitos B
DOCK8: dedicador de la citocinesis 8; TLR9: receptor tipo toll 9; MyD88: proteína de respuesta
primaria de diferenciación mieloide 88; Pyk2: tirosina quinasa rica en prolina 2; Lyn: miembro de
la familia Src de proteínas tirosina quinasas, expresadas en células hematopoyéticas; Syk: tirosina
quinasa asociada al bazo; STAT3: transductor de señal y activador de la transcripción 3.
Graphic 112547 Versión 1.0
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 21/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
Efecto de las mutaciones HOIL-1 y HOIP en fibroblastos y monocitos
HOIL-1: ubiquitina ligasa-1 IRP2 oxidada con hemo; HOIP: proteína que interactúa HOIL-1; IL-1R: receptor de interleucina-1; MyD88:
proteína de respuesta primaria de diferenciación mieloide 88; IRAK: quinasa asociada al receptor de interleucina-1; NEMO: modulador
esencial del factor nuclear (NF) -kappa-B; IKK: inhibidor de la quinasa del factor nuclear (NF) -kappa-B; NF-kappa-B: factor nuclear
(NF) para el potenciador de la cadena ligera kappa en células B.
Graphic 112550 Versión 1.0
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 22/23
20/5/2020 Toll-like receptors: Roles in disease and therapy - UpToDate
Divulgaciones del contribuyente
Douglas McDonald, MD, PhD Nothing to disclose Jordan S Orange, MD, PhD Patent Holder: Children's Hospital of Philadelphia [Genetic diagnosis].
Consultant/Advisory Boards: ADMA Biologics [Therapeutic immune globulin (IVIG)]; CSL Behring [Therapeutic immune globulin (IVIG, SCIG)]; Grifols
[Therapeutic immune globulin (IVIG, SCIG)]; Takeda [Therapeutic immune globulin (IVIG, SCIG)]; Enzvyant [Thymic Transplantation]. Anna M Feldweg,
MD Nothing to disclose
Las divulgaciones de los colaboradores son revisadas por conflictos de intereses por el grupo editorial. Cuando se encuentran, se abordan examinando a
través de un proceso de revisión multinivel y a través de los requisitos de referencias que se proporcionarán para respaldar el contenido. Se requiere el
contenido de referencia apropiado de todos los autores y debe cumplir con los estándares de evidencia de UpToDate.
Política de conflicto de intereses
https://www.uptodate.com/contents/toll-like-receptors-roles-in-disease-and-therapy/print?search=receptores tipo toll&source=search_result&sel… 23/23
También podría gustarte
- El Papel de Los TLR en La Activación de NeutrófilosDocumento6 páginasEl Papel de Los TLR en La Activación de NeutrófilosVic VargasAún no hay calificaciones
- Papel de Los Receptores Tipo Toll en La Inmunidad InnataDocumento6 páginasPapel de Los Receptores Tipo Toll en La Inmunidad InnataG-orgina Coello0% (1)
- Respuesta Inmune Innata - 1ra ParteDocumento18 páginasRespuesta Inmune Innata - 1ra Parteirving hilarioAún no hay calificaciones
- El Papel de Los Receptores de Reconocimiento de Patrones en La Inmunidad InnataDocumento46 páginasEl Papel de Los Receptores de Reconocimiento de Patrones en La Inmunidad InnataKArdo23Aún no hay calificaciones
- Actividad Receptores de PRRDocumento11 páginasActividad Receptores de PRRAndres PelayoAún no hay calificaciones
- Más allá del ADN: La Revolución Epigenética: Desde Mecanismos Celulares hasta Factores Ambientales: Cómo la Epigenética Moldea Nuestro Destino Biológico y las Implicaciones para la Salud, el Comportamiento y el Futuro de la InvestigaciónDe EverandMás allá del ADN: La Revolución Epigenética: Desde Mecanismos Celulares hasta Factores Ambientales: Cómo la Epigenética Moldea Nuestro Destino Biológico y las Implicaciones para la Salud, el Comportamiento y el Futuro de la InvestigaciónAún no hay calificaciones
- Receptores Tipo Toll (TLR)Documento36 páginasReceptores Tipo Toll (TLR)Brenda Collantes VidalAún no hay calificaciones
- Odontoblasto 2Documento12 páginasOdontoblasto 2MISHELL ESTEFANIA GUAMAN LAVERDEAún no hay calificaciones
- RESPUESTA INNATADocumento4 páginasRESPUESTA INNATAAndrea Mariel PeñaAún no hay calificaciones
- Patrones Moleculares Asociados A PatogenosDocumento6 páginasPatrones Moleculares Asociados A PatogenosLUCERO MILITZA SANCHEZ AVILESAún no hay calificaciones
- Resumen Inmunidad Secretora GRUPO 3Documento10 páginasResumen Inmunidad Secretora GRUPO 3De La Cruz JordanAún no hay calificaciones
- Receptores Tipo Toll - TareasDocumento12 páginasReceptores Tipo Toll - TareasDayana Torrico VAún no hay calificaciones
- Inmunidad de MucosasDocumento13 páginasInmunidad de MucosasIGNACIO SALVADOR FERNANDEZ GIRONAún no hay calificaciones
- Seminario 2. Inmunidad Innata. Parte 2.Documento29 páginasSeminario 2. Inmunidad Innata. Parte 2.lilianabarbagallo.estilistaAún no hay calificaciones
- Receptores Tipo TollDocumento5 páginasReceptores Tipo TollMayra Nedelka VegaAún no hay calificaciones
- Pattern Recognition Receptors (Receptores Que Reconocen Patrones (PRRS) )Documento4 páginasPattern Recognition Receptors (Receptores Que Reconocen Patrones (PRRS) )Paul Suarez MaldonadoAún no hay calificaciones
- Receptores Tipo Toll - TareasDocumento12 páginasReceptores Tipo Toll - TareasDayana Torrico VAún no hay calificaciones
- Resumen - Generalidades Del Reconocimiento Por La Inmunidad InnataDocumento7 páginasResumen - Generalidades Del Reconocimiento Por La Inmunidad InnataRanciovichAún no hay calificaciones
- Inmunidad InnataDocumento17 páginasInmunidad InnataWraysthell CordovaAún no hay calificaciones
- Capítulo I - Respuesta Inmune. de La Fisiología A La MedicinaDocumento26 páginasCapítulo I - Respuesta Inmune. de La Fisiología A La Medicinaicaro chaineAún no hay calificaciones
- Receptores y Marcadores LinfocitariosDocumento16 páginasReceptores y Marcadores LinfocitariosSilvana JsbAún no hay calificaciones
- Respuesta metabólica al trauma resumenDocumento16 páginasRespuesta metabólica al trauma resumenSofi MorenoAún no hay calificaciones
- Inmunología - T10.Abril_GómezDocumento5 páginasInmunología - T10.Abril_Gómezlgomez04Aún no hay calificaciones
- Sistema Inmune MucosasDocumento7 páginasSistema Inmune Mucosasabelhenarejos-1Aún no hay calificaciones
- TNF-a: Enzyme)Documento31 páginasTNF-a: Enzyme)Anabel ToledoAún no hay calificaciones
- Fisiopatología de La SepsisDocumento16 páginasFisiopatología de La Sepsismanuel.arevaloAún no hay calificaciones
- Resumen Inmunologia IDocumento194 páginasResumen Inmunologia IFernando FloresAún no hay calificaciones
- inmuno borradorDocumento8 páginasinmuno borradorjuan guamanAún no hay calificaciones
- Tolerancia Inmunológica en El EmbarazoDocumento10 páginasTolerancia Inmunológica en El EmbarazoRichard Rivera0% (1)
- Fagocitosis por neutrófilos y macrófagosDocumento5 páginasFagocitosis por neutrófilos y macrófagosAlain BallinasAún no hay calificaciones
- Resumen Respuesta InmunitariaDocumento9 páginasResumen Respuesta InmunitariaMishVencesAún no hay calificaciones
- Preguntas Linfocitos TDocumento3 páginasPreguntas Linfocitos TALAN FERNANDO GONZALEZ SERRANOAún no hay calificaciones
- 3 - PAMPs y RRPDocumento3 páginas3 - PAMPs y RRPGino MartinezAún no hay calificaciones
- 3 Innate ImmunityDocumento57 páginas3 Innate ImmunityJuan MoranAún no hay calificaciones
- Presentacion Receptores Citosolicos y de MembranaDocumento41 páginasPresentacion Receptores Citosolicos y de Membranaisabella vAún no hay calificaciones
- Resumen sobre el sistema inmune de la mucosa oralDocumento3 páginasResumen sobre el sistema inmune de la mucosa oralLucas FloresAún no hay calificaciones
- Taller InmunologiaDocumento15 páginasTaller Inmunologiaanon_230054309Aún no hay calificaciones
- Respuesta Al TraumaDocumento27 páginasRespuesta Al TraumaMaria Camila SarriaAún no hay calificaciones
- Citocinas PDFDocumento5 páginasCitocinas PDFCris Dev100% (1)
- Receptores Tipo Toll PDFDocumento7 páginasReceptores Tipo Toll PDFNiria GamboaAún no hay calificaciones
- Efectores de La Inmunodad AdquiridaDocumento43 páginasEfectores de La Inmunodad AdquiridaOmar PopocaAún no hay calificaciones
- La Enfermedad Del Sueño Tiene Sus Orígenes en La Región Afrotropical Del ContinenteDocumento4 páginasLa Enfermedad Del Sueño Tiene Sus Orígenes en La Región Afrotropical Del ContinentejordanAún no hay calificaciones
- 09 - Células Que Participan en Las Enfermedades Alérgicas (I)Documento12 páginas09 - Células Que Participan en Las Enfermedades Alérgicas (I)Carlos Luis Sarango ParralesAún no hay calificaciones
- Receptores Del Tipo RIGDocumento7 páginasReceptores Del Tipo RIGReyner CovarrubiasAún no hay calificaciones
- Lo Q Tengo Q DecirDocumento2 páginasLo Q Tengo Q DecirarianaAún no hay calificaciones
- Receptores de MEmbranaDocumento8 páginasReceptores de MEmbranak-coglyAún no hay calificaciones
- Receptores Tipo Toll (TLR) Estructura, Clasificación y Sus LigandosDocumento8 páginasReceptores Tipo Toll (TLR) Estructura, Clasificación y Sus LigandosGuisely Sempertegui BenavidezAún no hay calificaciones
- Genes Contra VirusDocumento21 páginasGenes Contra ViruslorenadelherAún no hay calificaciones
- Inmunidad Natural o InnataDocumento2 páginasInmunidad Natural o InnataOlga Esther Salazar OsunaAún no hay calificaciones
- Tipo de Comunicación Celular en La SepsisDocumento3 páginasTipo de Comunicación Celular en La SepsisluisamariaAún no hay calificaciones
- Pathophysiology of Sepsis - UpToDateDocumento18 páginasPathophysiology of Sepsis - UpToDateRosas ReyesAún no hay calificaciones
- Fisiologia Del Sistema InmuneDocumento41 páginasFisiologia Del Sistema InmuneAndrea Lizeth Guerra JimenezAún no hay calificaciones
- Receptores Citosólicos para Pamp y DampDocumento4 páginasReceptores Citosólicos para Pamp y DampPame FloresAún no hay calificaciones
- Células, Tejidos y Órganos Del Sistema InmuneDocumento12 páginasCélulas, Tejidos y Órganos Del Sistema InmuneRocío StürtzAún no hay calificaciones
- Inmuno 2Documento36 páginasInmuno 2Al CaralzAún no hay calificaciones
- Electrofisiologia Cardiaca 1Documento9 páginasElectrofisiologia Cardiaca 1Grease Cubas AlzamoraAún no hay calificaciones
- Propiedades Del Corazon de SapoDocumento23 páginasPropiedades Del Corazon de SapoHTHTHHAún no hay calificaciones
- Demanda indemnización daños TrujilloDocumento14 páginasDemanda indemnización daños TrujilloMarcelo100% (1)
- La Inseguridad en Lindas RosasDocumento2 páginasLa Inseguridad en Lindas RosasMarceloAún no hay calificaciones
- Estructura del ADN y síntesis de proteínasDocumento31 páginasEstructura del ADN y síntesis de proteínaszharith montenegroAún no hay calificaciones
- Biologia Celular y Molecular Taller 1Documento9 páginasBiologia Celular y Molecular Taller 1MICHEL CAMILA GARZ?N PULIDOAún no hay calificaciones
- Anemia 2Documento31 páginasAnemia 2WELMAAún no hay calificaciones
- Practica 5 Grupo Sanguíneo y Factor RHDocumento3 páginasPractica 5 Grupo Sanguíneo y Factor RHAldo De Peralta Geronimo Feria100% (1)
- Semana 3 - Práctica Bases Moleculares 2Documento16 páginasSemana 3 - Práctica Bases Moleculares 2Nashyel André Echevarria SalcedoAún no hay calificaciones
- Informe de Práctica de Bioseguridad 5to C.Documento15 páginasInforme de Práctica de Bioseguridad 5to C.Johanna Saeteros100% (1)
- Mehu525 - U2 - T14 - Púrpura TrombocitopénicaDocumento15 páginasMehu525 - U2 - T14 - Púrpura TrombocitopénicaDiana Castillo CastilloAún no hay calificaciones
- Virus y PatogeniaDocumento166 páginasVirus y Patogeniaprometeo2014Aún no hay calificaciones
- Vacunacion Covid-19 Vs Vacunacion InfluenzaDocumento13 páginasVacunacion Covid-19 Vs Vacunacion InfluenzacrisAún no hay calificaciones
- Líquidos de Precaución UniversalDocumento14 páginasLíquidos de Precaución Universalanyelli manuela gomez pinilla100% (1)
- ANTIVIRALESDocumento22 páginasANTIVIRALEScaza_nova032282100% (2)
- Abstracts2010 PDFDocumento193 páginasAbstracts2010 PDFriversgardenAún no hay calificaciones
- Capitulo 5Documento20 páginasCapitulo 5Gracia ReinosoAún no hay calificaciones
- 43b6a88358640e97d20e526f1b43d511Documento23 páginas43b6a88358640e97d20e526f1b43d511Paula Rastrilla GutierrezAún no hay calificaciones
- Kasumin - Ficha Tecnica 3mT39uL PDFDocumento2 páginasKasumin - Ficha Tecnica 3mT39uL PDFDIEGO LEON ORTIZ IBARRAAún no hay calificaciones
- EritropoyesisDocumento20 páginasEritropoyesisNicolas Luna Enriquez100% (1)
- BartonellosisDocumento88 páginasBartonellosisapi-3717137100% (3)
- Clase 3 Cromosomas Metodos Clinicos Laboratorio 2021-I UnfvDocumento59 páginasClase 3 Cromosomas Metodos Clinicos Laboratorio 2021-I UnfvMatias Mariano Garcia LazaroAún no hay calificaciones
- Preguntas anatomía y fisiologíaDocumento5 páginasPreguntas anatomía y fisiologíaNatalia RaquelAún no hay calificaciones
- C5.2 - Patrones Morfológicos de La InflamaciónDocumento19 páginasC5.2 - Patrones Morfológicos de La InflamaciónTatiana Benito RojasAún no hay calificaciones
- Valores de LaboratorioDocumento6 páginasValores de Laboratoriojossy123456Aún no hay calificaciones
- Inmunologia Tema 10,11,12Documento12 páginasInmunologia Tema 10,11,12ArlettA.MendozaAún no hay calificaciones
- Caso Clínico 03Documento18 páginasCaso Clínico 03Lorena Olazabal ValeraAún no hay calificaciones
- Micro ParcialDocumento19 páginasMicro ParcialSilvia Varela EspinozaAún no hay calificaciones
- Detergentes y Desinfectantes en La Industria AlimentariaDocumento15 páginasDetergentes y Desinfectantes en La Industria Alimentariadavid nilton tipula supo0% (1)
- Cocos PiógenosDocumento18 páginasCocos PiógenosIsaí PQ100% (1)
- Microbiología Del CompostajeDocumento3 páginasMicrobiología Del CompostajeMelizaMontielAún no hay calificaciones
- Taller Quiz Antibioticos y MecanismosDocumento8 páginasTaller Quiz Antibioticos y MecanismosAdriana VargasAún no hay calificaciones
- Curva de CrecimientoDocumento4 páginasCurva de CrecimientoJuan Sandoval100% (1)
- COVID Clase Dra YokoDocumento7 páginasCOVID Clase Dra YokoPERCY WILLIAMS AGUILAR BURGOSAún no hay calificaciones