Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Sintesis de Fluoresceína
Cargado por
Pau FlurscheimTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Sintesis de Fluoresceína
Cargado por
Pau FlurscheimCopyright:
Formatos disponibles
UNIVERSIDAD DEL VALLE DE MÉXICO - CAMPUS LOMAS VERDES
PRÁCTICA . 13. SÍNTESIS DE FLUORESCEÍNA
Contreras Contreras Vania Paulina, Marin Villalobos Adriana Mariel, Valencia Ortiz
Fernanda, Santos Mayen Ximena, Flurscheim López Ana Paula, Cardona Rosario
Beatriz
Asignatura:Laboratorio de Aplicaciones Farmacéuticas de las Reacciones Orgánicas
Licenciatura en QFBT
Periodo 2019-1
Fecha de entrega: lunes 25 de noviembre de 2019
Docente:M. en C. Alberto Ramírez Murcia
Resumen:
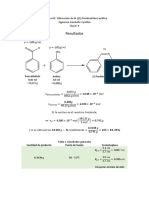
En esta práctica se sintetizó la fluoresceína a partir del Resorcinol y Anhídrido Ftálico Usando
ácido sulfúrico como catalizador que al obtenerla fue cristalizada, teniendose en cuenta las
observaciones en cada etapa determinando masa, punto de fusión y se analizó su IR después
de ser filtrada.
Palabras clave: resorcinol, fluoresceina, anhídrido Ftalico.
Reacción:
Palabras clave: resorcinol, fluoresceína, anhídrido ftálico, luz UV.
Introducción: Es, asimismo, un colorante indicador
La fluoresceína es una sustancia ftálico que aparece de color amarillo-verde
pulverulenta, de color amarillo rojizo. Es un de la película lagrimal normal, y de color
colorante orgánico insoluble en agua, verde brillante en un medio más alcalino,
soluble en alcohol (etanoico) y aguas tal como el humor acuoso, y se usa
alcalinizadas. Su sal sódica, soluble en terapéuticamente como una ayuda para el
2
agua, es conocida como uranina. Esta sal diagnóstico de las lesiones corneales y
es ampliamiente utilizada como marcador trauma corneal.
fluorescente en diversos ensayos químicos
Los factores que afectan la fluorescencia
y biológicos, debido a que exhibe
incluyen:
fluorescencia.
Pertenece al grupo de los xantenos que ● Concentración de la sustancia
produce un color fluorescente verde ● pH de la solución
intenso en soluciones alcalinas (con pH ● Presencia de otras sustancias
mayor a 7). ● Longitud de onda de la luz
excitante.
Cuando se expone a la luz, la fluoresceína
absorbe ciertas longitudes de onda y emite A un pH de 8 (mayor alcalinidad), la
luz fluorescente de longitud de onda larga. fluoresceína alcanza su máxima
intensidad.
Mecanismo de reacción:
Esta reacción se considera una acilación
de Friedel-craft modificada.
La reacción es formalmente una serie de
sustituciones aromáticas electrofílicas, con
grupos salientes hidroxilo que recogen
protones (1), sin embargo, la catálisis de
ácido de Lewis obviamente juega un papel
en el mecanismo. Creo que aumenta la
electrofilicidad del anhídrido ftálico en el
primer paso, y facilita la eliminación de los
grupos hidroxilo. Para el mecanismo sin la
participación del cloruro de zinc (II).
Esta reacción funciona de manera similar a
la reacción de Nencki (2) Para obtener la
forma de la molécula que se muestra como
el producto de su reacción, se necesita
aumentar el pH para abrir el anillo de Resultados:
lactona. (3) Esta es la fluoresceína A, la
forma de la molécula que realmente
fluoresce.
Objetivo General:
Obtener el pigmento fluoresceína a partir
de resorcinol y anhídrido ftálico
Metodología:
Imagen 1. derritiendo la fluoresceína
Análisis de resultados:
Es un polvo amarillo que se disuelve en
solución alcalina produciendo intensa
fluorescencia verde. La solución alcalina
aparece amarilla a la luz transmitida y
verde a la luz reflejada. La fluorescencia
está asociada con la presencia de un
puente de oxígeno entre los dos anillo
Imagen 2. Fluoresceína dando la estructura de fluorano. La
fluoresceína es el 4,4- dihidroxifluorano.
Los álcalis causan la hidrólisis del anillo
lactónico y la formación del ion colorante,
que tiene una estructura comparable a del
anión fenolftaleína.
Cuando la fluoresceína sódica se estimula
mediante luz azul (465 nm a 490 nm)
muestra una fluorescencia amarillo
verdosa (520 a 530 nm).
Conclusión:
La fluoresceína también puede emplearse
como indicador ácido base, ya que como
se mencionó, el color depende del pH. Tal
diferencia es más evidente si se analizaron
Imagen 3.Fluoresceína a través de espectros de absorción respectivos en la
lampara de UV región del ultravioleta visible
Referencias:
Judith F. Rubinson & Kenneth, A.
Rubinson., 2000. Química Analítica
Contemporánea. 1ª edición. Prentice Hall,
México. Flascka, H.A., Barnard, Jr. A. J.,
Sturrock, P.E., 1986. Química Analítica
Cuantitativa. Vol II. 6ª edición. C.E.C.S.A.,
México. Harris Daniel C., 2001 Análisis
Químico Cuantitativo. 2ª edición. Editorial
Reverté, S.A. México.
Imagen 4. Muestra de Fluoresceína con
prueba con hidróxido de sodio
También podría gustarte
- 8 Informe de Laboratorio - Síntesis de FluoresceínaDocumento7 páginas8 Informe de Laboratorio - Síntesis de FluoresceínaLaura TrujilloAún no hay calificaciones
- Síntesis de FluoresceínaDocumento3 páginasSíntesis de FluoresceínaDayana MoralesAún no hay calificaciones
- Fenolftaleina y Fluoresceina Informe CorregidoDocumento6 páginasFenolftaleina y Fluoresceina Informe CorregidoJuan PabloAún no hay calificaciones
- Informe FluoresceinaDocumento4 páginasInforme FluoresceinaLinda Venegas100% (1)
- BenzoínaDocumento13 páginasBenzoínadany_289Aún no hay calificaciones
- Mezclas AlcalinasDocumento13 páginasMezclas Alcalinasunifiqt2013Aún no hay calificaciones
- Práctica 2 Sintesis de DibenzalacetonaDocumento3 páginasPráctica 2 Sintesis de DibenzalacetonaSaul RuizAún no hay calificaciones
- Obtención de DibenzalacetonaDocumento11 páginasObtención de DibenzalacetonaKaz Melo100% (1)
- Practica 4 Condensación de Claisen-Schmidt. Obtencion de DibenzalacetonaDocumento18 páginasPractica 4 Condensación de Claisen-Schmidt. Obtencion de DibenzalacetonaLizeth Paola TellezAún no hay calificaciones
- 2 NitrotiofenoDocumento5 páginas2 NitrotiofenoBrayan HEAún no hay calificaciones
- Estructura Quimica de Las Ftalainas y Sus Miembros Mas ImportantesDocumento2 páginasEstructura Quimica de Las Ftalainas y Sus Miembros Mas ImportantesbrenchhhAún no hay calificaciones
- Ácido FenoxiaceticoDocumento2 páginasÁcido FenoxiaceticoGammaCSAún no hay calificaciones
- Previo Sintesis de B-NerolinaDocumento13 páginasPrevio Sintesis de B-NerolinaRicardo Martinez Jimenez50% (2)
- Obtencion de N - Z - Fenilmetilen AnilinaDocumento5 páginasObtencion de N - Z - Fenilmetilen AnilinaJuanDavidPBAún no hay calificaciones
- Concentración de Acidez Total de La Salsa ValentinaDocumento10 páginasConcentración de Acidez Total de La Salsa ValentinaCarlos AguilarAún no hay calificaciones
- Obtención de Bromuro de N-ButiloDocumento3 páginasObtención de Bromuro de N-ButiloVivis Alejandro100% (1)
- Reporte 5 OrgánicaDocumento4 páginasReporte 5 OrgánicaIsabel ZuñigaAún no hay calificaciones
- Sintesis de DibenzalAcetonaDocumento9 páginasSintesis de DibenzalAcetonaAndrea Rodriguez100% (1)
- Reporte Práctica 4-Síntesis de 2.3-DifenilquinoxalinaDocumento10 páginasReporte Práctica 4-Síntesis de 2.3-DifenilquinoxalinaAndy AldamaAún no hay calificaciones
- FLUORESCEÍNADocumento12 páginasFLUORESCEÍNALuisa SierraAún no hay calificaciones
- 3,5 Dicarbetoxi 2,6 Dimetil 4 Fenil 1,4 DihidropiridinaDocumento17 páginas3,5 Dicarbetoxi 2,6 Dimetil 4 Fenil 1,4 DihidropiridinaIngrid Daniela0% (1)
- B NerolinaDocumento10 páginasB NerolinaDiana MoedanoAún no hay calificaciones
- Condensación AldólicaDocumento7 páginasCondensación AldólicaGianfrancoAún no hay calificaciones
- Sintesis y Analisis de La Sal de Mohr PDFDocumento7 páginasSintesis y Analisis de La Sal de Mohr PDFDavid BernisAún no hay calificaciones
- Practica 4 Sintesis de Alcohol Bencilico y Acido BenzoicoDocumento5 páginasPractica 4 Sintesis de Alcohol Bencilico y Acido BenzoicoLiz RivasAún no hay calificaciones
- Obtención Del Furfural y Reacción de CannizaroDocumento2 páginasObtención Del Furfural y Reacción de CannizaroMichel Barrera100% (1)
- Mecanismos de Reaccion Fenolftaleina y FluoresceinaDocumento2 páginasMecanismos de Reaccion Fenolftaleina y FluoresceinaLuis SantiagoAún no hay calificaciones
- Mecanismos de Reacción FENOLFTALEINA Y FLUORESCEINADocumento2 páginasMecanismos de Reacción FENOLFTALEINA Y FLUORESCEINAGammaCS67% (3)
- Obtencion de 2,4-DinitroclorobencenoDocumento10 páginasObtencion de 2,4-Dinitroclorobenceno.:("*"BLacK BuLLeT"*"):.100% (4)
- Rep 1. B MetoxinaftalenoDocumento10 páginasRep 1. B MetoxinaftalenoGeorgina100% (1)
- Síntesis de TiofenoDocumento2 páginasSíntesis de TiofenoDiana L100% (1)
- 2 Síntesis de Alcohol Bencílico y Ácido BenzoicoDocumento3 páginas2 Síntesis de Alcohol Bencílico y Ácido BenzoicoBren CooperAún no hay calificaciones
- Preparación de Dibenzalacetona A Partir de Benzaldehído y AcetonaDocumento11 páginasPreparación de Dibenzalacetona A Partir de Benzaldehído y AcetonaArturo Velasco100% (1)
- Mecanismos de Reaccion FENOLFTALEINA Y FLUORESCEINA PDFDocumento2 páginasMecanismos de Reaccion FENOLFTALEINA Y FLUORESCEINA PDFKarla Castelan MuñozAún no hay calificaciones
- PRÁCTICA No. 4: OBTENCIÓN DE 5,5-DIFENILHIDANTOINADocumento7 páginasPRÁCTICA No. 4: OBTENCIÓN DE 5,5-DIFENILHIDANTOINADiana HMAún no hay calificaciones
- Práctica4. Síntesis de BenciloDocumento8 páginasPráctica4. Síntesis de BenciloSamantha Calvillo100% (1)
- Síntesis de Fenolftaleína y FluoresceínaDocumento6 páginasSíntesis de Fenolftaleína y FluoresceínaPilar Maya0% (3)
- Acido Fenoxiacetico Previo y ReporteDocumento5 páginasAcido Fenoxiacetico Previo y Reportebrayan gutierrezAún no hay calificaciones
- Investigación Previa Obtención de Hidantoinas OrgánicaDocumento8 páginasInvestigación Previa Obtención de Hidantoinas OrgánicaDaniel Romano100% (1)
- Sintesis de FenolftaleinaDocumento11 páginasSintesis de FenolftaleinaRaquel Yoselin Guzman Rosas100% (1)
- Cualitativa Ácido-BaseDocumento6 páginasCualitativa Ácido-BaseAlvarado Fernández Juan CarlosAún no hay calificaciones
- Práctica 3. OBTENCIÓN DEL BROMURO DE n-BUTILODocumento6 páginasPráctica 3. OBTENCIÓN DEL BROMURO DE n-BUTILOLeidy Laura HRAún no hay calificaciones
- Practica 2 Obtención de CumarinaDocumento9 páginasPractica 2 Obtención de CumarinaMauricio Rodríguez100% (2)
- 1,1 Bi 2 NaftolDocumento8 páginas1,1 Bi 2 NaftolDago OrtizAún no hay calificaciones
- Error de Valoración Debido Al IndicadorDocumento2 páginasError de Valoración Debido Al IndicadorMaría Alejandra MaidanaAún no hay calificaciones
- Sintesis de 2 4 Dinitrofenilhidrazina PDFDocumento2 páginasSintesis de 2 4 Dinitrofenilhidrazina PDFJohairaAún no hay calificaciones
- Reacciones de Sustitución Electrofílica AromáticaDocumento4 páginasReacciones de Sustitución Electrofílica Aromáticadrylocust100% (1)
- Acido Picrico Obtencion CataDocumento3 páginasAcido Picrico Obtencion CataCatalino de la MAún no hay calificaciones
- Síntesis de Alcohol Bencilico y Ácido BenzoicoDocumento35 páginasSíntesis de Alcohol Bencilico y Ácido BenzoicoGabrielVazquezOlvera100% (2)
- Informe 2 B NerolinaDocumento3 páginasInforme 2 B NerolinaVictor PerezAún no hay calificaciones
- Práctica 3. "OBTENCIÓN DE FURFURAL"Documento7 páginasPráctica 3. "OBTENCIÓN DE FURFURAL"Los cuatesAún no hay calificaciones
- Azocompuestos Anaranjado de MetiloDocumento8 páginasAzocompuestos Anaranjado de MetiloChristian MontielAún no hay calificaciones
- Sintesis de DiabenzalacetonaDocumento13 páginasSintesis de DiabenzalacetonaGustavo Javier Pérez ContrerasAún no hay calificaciones
- Practica Furfural FinalDocumento5 páginasPractica Furfural Finalfcbarcelona-08hotmail.comAún no hay calificaciones
- Síntesis de Tetrafenil Plomo Mediante Reactivo de GrignardDocumento4 páginasSíntesis de Tetrafenil Plomo Mediante Reactivo de Grignardtazgnr96Aún no hay calificaciones
- Prev 6Documento6 páginasPrev 6Gabriela HernandezAún no hay calificaciones
- Reporte Practica 3 Furfural. .Documento2 páginasReporte Practica 3 Furfural. .marbellapedroza100% (1)
- Informe 4. Condensacion de Claisen-Schmidt y KnoevenagelDocumento8 páginasInforme 4. Condensacion de Claisen-Schmidt y KnoevenagelDiego Molina RoaAún no hay calificaciones
- 8 Informe de Laboratorio - Síntesis de FluoresceínaDocumento8 páginas8 Informe de Laboratorio - Síntesis de FluoresceínaLaura TrujilloAún no hay calificaciones
- Práctica 13 SÍNTESIS DE FLUORESCEINADocumento8 páginasPráctica 13 SÍNTESIS DE FLUORESCEINAangel salmeronfAún no hay calificaciones
- Practica 2: Extracción de ADNDocumento4 páginasPractica 2: Extracción de ADNPau FlurscheimAún no hay calificaciones
- Practica 2: Influencia Del PH y Pka en La Ionización y Solubilidad de FármacosDocumento5 páginasPractica 2: Influencia Del PH y Pka en La Ionización y Solubilidad de FármacosPau Flurscheim100% (1)
- Practica 4. Investigación de Una ViolaciónDocumento4 páginasPractica 4. Investigación de Una ViolaciónPau FlurscheimAún no hay calificaciones
- Reporte 3. Recolección de Suero SanguíneoDocumento5 páginasReporte 3. Recolección de Suero SanguíneoPau FlurscheimAún no hay calificaciones
- Practica 7: Triglicéridos GPO-PODDocumento3 páginasPractica 7: Triglicéridos GPO-PODPau Flurscheim100% (1)
- Proyecto Integrador "Etapa 1"Documento4 páginasProyecto Integrador "Etapa 1"Pau FlurscheimAún no hay calificaciones
- Practica 5 Elisa IndirectaDocumento5 páginasPractica 5 Elisa IndirectaPau FlurscheimAún no hay calificaciones
- Artículo "Análisis de Prácticas Médicas"Documento2 páginasArtículo "Análisis de Prácticas Médicas"Pau FlurscheimAún no hay calificaciones
- Línea Del TiempoDocumento4 páginasLínea Del TiempoPau FlurscheimAún no hay calificaciones
- Practica 4. Aglutinacion de LatexDocumento3 páginasPractica 4. Aglutinacion de LatexPau FlurscheimAún no hay calificaciones
- Practica ELISPOTDocumento5 páginasPractica ELISPOTPau FlurscheimAún no hay calificaciones
- Resumen "Educación Médica"Documento4 páginasResumen "Educación Médica"Pau FlurscheimAún no hay calificaciones
- Reporte 8 Tecnologia Farmaceutica PDFDocumento5 páginasReporte 8 Tecnologia Farmaceutica PDFPau FlurscheimAún no hay calificaciones
- Práctica 10 - Síntesis de 3-Metil-1-Fenil-1,2-Dihidropirazol-5-OnaDocumento7 páginasPráctica 10 - Síntesis de 3-Metil-1-Fenil-1,2-Dihidropirazol-5-OnaPau FlurscheimAún no hay calificaciones
- Hospital Regional de Alta Especialidad de La Península de YucatánDocumento8 páginasHospital Regional de Alta Especialidad de La Península de YucatánPau FlurscheimAún no hay calificaciones
- Mapa Conceptual "Ética, Moral y Bioética"Documento3 páginasMapa Conceptual "Ética, Moral y Bioética"Pau FlurscheimAún no hay calificaciones
- Organización en La Gestión de Instituciones de SaludDocumento3 páginasOrganización en La Gestión de Instituciones de SaludPau Flurscheim40% (5)
- Proceso Administrativo en SaludDocumento3 páginasProceso Administrativo en SaludPau FlurscheimAún no hay calificaciones
- Proyecto Integrador Etapa 1 "Hospital Regional de Alta Especialidad de La Península de Yucatán"Documento11 páginasProyecto Integrador Etapa 1 "Hospital Regional de Alta Especialidad de La Península de Yucatán"Pau FlurscheimAún no hay calificaciones
- Reporte 12Documento6 páginasReporte 12Pau FlurscheimAún no hay calificaciones
- Reporte AmebiasisDocumento15 páginasReporte AmebiasisPau FlurscheimAún no hay calificaciones
- Punto de Ebullición, Destilación Simple Y FraccionadaDocumento3 páginasPunto de Ebullición, Destilación Simple Y FraccionadaPau FlurscheimAún no hay calificaciones
- Producción de Ácido Pirúvico Durante La Fermentación de La Glucosa Por La LevaduraDocumento4 páginasProducción de Ácido Pirúvico Durante La Fermentación de La Glucosa Por La LevaduraPau FlurscheimAún no hay calificaciones
- Practica 5Documento3 páginasPractica 5Pau FlurscheimAún no hay calificaciones
- Análisis Cuantitativo de EnzimasDocumento3 páginasAnálisis Cuantitativo de EnzimasPau FlurscheimAún no hay calificaciones
- Practica 12Documento4 páginasPractica 12Pau FlurscheimAún no hay calificaciones
- Curvas de TitulaciónDocumento4 páginasCurvas de TitulaciónPau FlurscheimAún no hay calificaciones
- Previo 9Documento4 páginasPrevio 9Pau FlurscheimAún no hay calificaciones
- Practica 1. Efecto Del Tamaño de Partícula y de Temperatura Sobre La Velocidad de La ReacciónDocumento5 páginasPractica 1. Efecto Del Tamaño de Partícula y de Temperatura Sobre La Velocidad de La ReacciónPau Flurscheim100% (1)
- Practica 12 Obtención de La 3,5-Dietoxicarbonil-2,4,6-Trimetil-1,4dihidropiridinaDocumento4 páginasPractica 12 Obtención de La 3,5-Dietoxicarbonil-2,4,6-Trimetil-1,4dihidropiridinaPau Flurscheim0% (1)
- Sensor Es PDFDocumento139 páginasSensor Es PDFAndrés Sebastián MorenoAún no hay calificaciones
- Ladrillo Erecos U - 33Documento1 páginaLadrillo Erecos U - 33Andres MoralesAún no hay calificaciones
- Guia 1 Periodo 2Documento3 páginasGuia 1 Periodo 2ELIANAAún no hay calificaciones
- CoquizacionDocumento6 páginasCoquizacionDarii RengifoAún no hay calificaciones
- SuperconductoresDocumento4 páginasSuperconductoreswar_angel100% (2)
- 7 Unidad VII. QMA-103Documento10 páginas7 Unidad VII. QMA-103Omar SantosAún no hay calificaciones
- Laboratorio 3 CompuDocumento15 páginasLaboratorio 3 Compusunjullay100% (1)
- Socavación, Revestimiento de Electrodos, Penetracion, Inclusiones de Escoria, PorosidadDocumento5 páginasSocavación, Revestimiento de Electrodos, Penetracion, Inclusiones de Escoria, PorosidadJose Miguel DelgadoAún no hay calificaciones
- Extracción Liquido-LiquidoDocumento23 páginasExtracción Liquido-LiquidoelpadreAún no hay calificaciones
- Trabajo QuimicaDocumento7 páginasTrabajo QuimicaJuhesneydi Rojas Figueroa0% (4)
- Introduccion Perforacion de HidrocarburoDocumento186 páginasIntroduccion Perforacion de HidrocarburoEnrique RabanalAún no hay calificaciones
- Cuestionario Titulación Josie RivasDocumento3 páginasCuestionario Titulación Josie RivasJavier José RomeroAún no hay calificaciones
- SeberesDocumento1 páginaSeberesmaria castilloAún no hay calificaciones
- Tesis de Secado PDFDocumento160 páginasTesis de Secado PDFjohanna gutierrezAún no hay calificaciones
- Electricidad Automotriz BásicaDocumento24 páginasElectricidad Automotriz BásicaGustavo RivasAún no hay calificaciones
- El ElectroscopioDocumento8 páginasEl ElectroscopioFelipe Chavez CortesAún no hay calificaciones
- Problemas Del Libro de Quimica 6.1-6.20Documento14 páginasProblemas Del Libro de Quimica 6.1-6.20Michael FieldsAún no hay calificaciones
- Propiedades Quimicas de Los Alcanos y CicloalcanosDocumento9 páginasPropiedades Quimicas de Los Alcanos y CicloalcanosJohanna Barrientos50% (6)
- Niveles de Organización de La Materia VivaDocumento5 páginasNiveles de Organización de La Materia VivaLaura Patricia Espinosa FuentesAún no hay calificaciones
- Informe No. 2 Quimica 1Documento5 páginasInforme No. 2 Quimica 1Ángel OrozcoAún no hay calificaciones
- ASTM D3080M 11.en - EsDocumento9 páginasASTM D3080M 11.en - EsMercedes Villacis TroncosoAún no hay calificaciones
- Tarea 8 Dinámica TrabajoDocumento2 páginasTarea 8 Dinámica Trabajokevin gasteluAún no hay calificaciones
- Tabla de Configuración ElectrónicaDocumento5 páginasTabla de Configuración ElectrónicaCarlos Primera64% (195)
- Manuel Se Uso Calorímetro Parr 6200: Preparación para La Muestra y Carga de La Bomba de OxígenoDocumento3 páginasManuel Se Uso Calorímetro Parr 6200: Preparación para La Muestra y Carga de La Bomba de OxígenoOctavio LpgAún no hay calificaciones
- 2014A Roberto Paz - Silabo Mecanica de Fluidos e Hidraulica BDocumento10 páginas2014A Roberto Paz - Silabo Mecanica de Fluidos e Hidraulica BChristian DanyAún no hay calificaciones
- CALORIMETRIADocumento10 páginasCALORIMETRIAOmar Barrera CastroAún no hay calificaciones
- Aw de Los Alimentos y Ajuste de Isotermas de SorcionDocumento20 páginasAw de Los Alimentos y Ajuste de Isotermas de SorcionChrystian ParedesAún no hay calificaciones
- Presión de Vapor - CavitaciónDocumento6 páginasPresión de Vapor - CavitaciónRafa MolinaAún no hay calificaciones
- Semana IDocumento70 páginasSemana ICLAUDIOAún no hay calificaciones
- Criogenia AlimentariaDocumento7 páginasCriogenia AlimentariaDavid Parado0% (1)