Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practica 7
Cargado por
fcbarcelona-08hotmail.comDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Practica 7
Cargado por
fcbarcelona-08hotmail.comCopyright:
Formatos disponibles
INSTITUTO POLITÉCNICO NACIONAL
Escuela Nacional de Ciencias Biológicas
Químico Farmacéutico Industrial
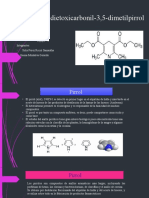
Práctica #7.- Síntesis de 3,5-Dietoxicarbonil-2,6-dimetil-4-
fenildihidropiridina.
5FV1 6/12/2017
Equipo 9.- Herrera Macedo Rafael Purón Hernández Eduardo
Profesores.- Bañuelos Ávila Rosa María
Pulido Flores Cesar Augusto
Objetivos = 6.1852 𝑔 𝑑𝑖ℎ𝑖𝑑𝑟𝑜𝑝𝑖𝑟𝑖𝑑𝑖𝑛𝑎 𝑡𝑒ó𝑟𝑖𝑐𝑜
Obtener un heterociclo de 6 miembros con Rendimiento práctico
un heteroatomo (nitrógeno) por medio del
Se obtuvieron 3.50 g de dihidropiridina.
método de Hantzsch.
Sintetizar el 3,5-Dietoxicarbonil-2,6-dimetil- 𝒓𝒆𝒏𝒅𝒊𝒎𝒊𝒆𝒏𝒕𝒐 𝒆𝒙𝒑𝒆𝒓𝒊𝒎𝒆𝒏𝒕𝒂𝒍
% 𝒓𝒆𝒏𝒅𝒊𝒎𝒊𝒆𝒏𝒕𝒐 = 𝒙𝟏𝟎𝟎
4-fenildihidropiridina a partir de 𝒓𝒆𝒏𝒅𝒊𝒎𝒊𝒆𝒏𝒕𝒐 𝒕𝒆ó𝒓𝒊𝒄𝒐
benzaldehído, acetato de etilo e hidróxido 𝟑. 𝟓𝟎 𝒈
de amonio. % 𝒓𝒆𝒏𝒅𝒊𝒎𝒊𝒆𝒏𝒕𝒐 = 𝒙𝟏𝟎𝟎 = 𝟓𝟔. 𝟔𝟑 %
𝟔. 𝟏𝟖 𝒈
Identificar el 3,5-Dietoxicarbonil-2,6-dimetil-
4-fenildihidropiridina obtenido mediante de
su punto de fusión y una cromatografía en
capa fina. Punto de fusión
Resultados El producto obtenido se identificó mediante su punto
de fusión, el cual fue de 123-124 °C
Calculo del rendimiento
Cromatografía en capa fina
Rf producto = 0.48
Rf referencia = 0.42
Benzaldehido Acetoacetato de
etilo Dihidropiridina
PM= 106.1 PM= 329 g/mol
g/mol PM= 130.14 g/mol
Rendimiento teórico
Benzaldehido
1 𝑚𝑜𝑙 Figura 1. Prueba
2𝑔( ) = 0.0188 𝑚𝑜𝑙 de identificación del
106.1𝑔
producto mediante
Acetoacetato cromatografía en
2 𝑚𝑜𝑙 capa fina.
5.3 𝑔 ( ) = 0.04072 𝑚𝑜𝑙
260.28𝑔
Reactivo limitante: Benzaldehido Ecuación general de la reacción
1 𝑚𝑜𝑙 𝑑𝑖ℎ𝑖𝑑𝑟𝑜𝑝𝑖𝑟𝑖𝑑𝑖𝑛𝑎 329 𝑔 𝑑𝑖ℎ𝑖𝑑𝑟𝑜𝑝𝑖𝑟𝑖𝑑𝑖𝑛𝑎
0.0188 𝑚𝑜𝑙 ( )( )
1 𝑚𝑜𝑙 𝑏𝑒𝑛𝑧𝑎𝑙𝑑𝑒ℎ𝑖𝑑𝑜 1 𝑚𝑜𝑙 𝑑𝑖ℎ𝑖𝑑𝑟𝑜𝑝𝑖𝑟𝑖𝑑𝑖𝑛𝑎
Análisis Obtención de 3,5-Dietoxicarbonil-2,6-dimetil-4-
fenildihidropiridina
Mecanismo de reacción
La obtención del producto se realizó mediante la
reacción de Hantzsch, la cual se lleva a partir de la
formación de un compuesto carbonilico
insaturado, y un compuesto 1,5-dicarbonilico.
Se hicieron reaccionar 2mL de benzaldehído, 5.2
mL de acetoacetato de etilo, 5 mL de etanol (que
nos servirá como nuestro catalizador básico) y 3 mL
de hidróxido de amonio y se calentó a reflujo
mediante 2 horas con el fin de proporcionar las
condiciones necesarias para que reaccionen y se
obtenga nuestro compuesto deseado.
Primeramente reacciono 1 mol de acetoacetato de
etilo con una molécula de hidróxido de amonio el
cual por medio de una condensación cruzada tipo
knoevenagel se obtuvo un compuesto carbonilico
insaturado.
Posteriormente otro mol de acetoacetato de etilo
reacciono con una molécula de benzaldehído que
mediante una adición nucleofilica 1,4 de Michael se
obtuvo un compuesto 1,5-dicarbonilico.
Posteriormente mediante se condensaron el
compuesto carbonilico insaturado con el
compuesto 1,5-dicarbonilico mediante la reacción de
hantzsch.
Una vez que termino el reflujo se colocó en un vaso
con agua/hielo y se observó el precipitado de
nuestro producto; se filtró y de esta manera se
separó nuestro producto obtenido.
Posteriormente se recristalizó con etanol con el fin
de eliminar impurezas y de esta manera obtener el
producto lo más puro posible.
Se filtró el producto y se dejó secar para
posteriormente determinar el rendimiento e
identificarlo mediante una cromatografía en capa
fina y por medio de su punto de fusión.
Cromatografía en capa fina
Una vez obtenido el producto, se realizó una prueba
de identificación mediante una cromatografía, en
donde se colocó en la capa fina al producto y a una
referencia (3,5-Dietoxicarbonil-2,6-dimetil-4-
fenildihidropiridina puro), y se eluyó con
hexano/acetato de etilo (1:2), posteriormente se
observó en luz UV a 254 nm, al comparar los Rf de
ambos, se observó que el producto obtenido Nifedipina
corresponde al 3,5-Dietoxicarbonil-2,6-dimetil-4-
fenildihidropiridina debido a que presenta un Rf de
0.48, este se encuentra muy cerca del valor de
referencia el cual es un Rf de 0.42.
Punto de fusión.
Se identificó el producto obtenido mediante su punto
de fusión, el cual fue de 123-124 ºC, este difiere un
poco con el teórico el cual es de 130.5-131.5 ºC.
Cuestionario
1. Se sabe que los compuestos Nicardipina
carbonilicos forman iminas en presencia
de NH3 ¿cree usted que este hecho
afecte el curso normal de la síntesis
efectuada? Explique.
No afectaría debido a que esta reacción se observa
un equilibrio tautomerico imina-enamina.
2. ¿Qué riesgo se correría durante la
síntesis si se empleara alcohol metílico
en lugar de etanol?
6. ¿Cuál es la concentración del hidróxido
El alcohol metílico formaría un grupo metoxi en el de amonio concentrado?
carbono donde se sustituye el benzaldehído.
La mayor concentración que se obtiene al solubilizar
el amoniaco en agua para dar hidróxido de amonio
3. Durante el proceso de recristalización, es del 40 %.
¿de qué sustancias se separa el
producto obtenido? Conclusiones
De Iminas, hidróxido de aminio que no haya La obtención del producto se llevó a cabo a
reaccionado y de 2-benzilideno-3-oxobutanoato de mediante la reacción de hantzsch.
etilo. El producto se identificó mediante una
cromatografía en capa fina, en la cual
presentó un Rf de 0.48, un valor muy
4. ¿a qué atribuye que en la síntesis
cercano al reportado para la referencia.
efectuada el rendimiento reportado solo
sea de 60%? Al medir su punto de fusión se comprobó
que el producto obtenido es el deseado
A la presencia de subproductos como iminas y la (3,5-Dietoxicarbonil-2,6-dimetil-4-
formación de 2-benzilideno-3-oxobutanoato de etilo. fenildihidropiridina).
5. Dar la estructura de nifedipina y Bibliografía
nicardipina.
Morrison, R. T. y Boyd, R. N.; "Química
Orgánica", 5ª Edición, Editorial Pearson
Addison-Wesley, 1990, pags. 1184-1192
Seyhan Ege. Química organica estructura y
reactividad, 2ª edición, editorial reverte. Pag.
1064-1071.
También podría gustarte
- Pract 6 Hetero FinalDocumento3 páginasPract 6 Hetero FinalCecilia ValdiviaAún no hay calificaciones
- Síntesis de 2,3-DifenilquinoxalinaDocumento2 páginasSíntesis de 2,3-DifenilquinoxalinaMónica MedinaAún no hay calificaciones
- Fisiología Celular. Práctica 7 Modulación de Una Función Celular Por Señales QuímicasDocumento15 páginasFisiología Celular. Práctica 7 Modulación de Una Función Celular Por Señales QuímicasFanton DíazAún no hay calificaciones
- Síntesis de 23 Dimetil IndolDocumento2 páginasSíntesis de 23 Dimetil IndolCristian NadamasAún no hay calificaciones
- Preparación Del Sistema Indol. Síntesis de 2 Fenilindol 1Documento2 páginasPreparación Del Sistema Indol. Síntesis de 2 Fenilindol 1Evelyn Jim 3295Aún no hay calificaciones
- Reporte Practica 5 2 Fenil IndolDocumento2 páginasReporte Practica 5 2 Fenil IndolmarbellapedrozaAún no hay calificaciones
- Síntesis de 2,4 Dietoxicarbonil 3,5 DimetilpirrolDocumento5 páginasSíntesis de 2,4 Dietoxicarbonil 3,5 DimetilpirrolBereNiceJareauAún no hay calificaciones
- Cuestionario Preparación de IndolesDocumento3 páginasCuestionario Preparación de IndolesAle-Bere GarcíaAún no hay calificaciones
- Práctica 8. Verde 1h-BencimidazolDocumento25 páginasPráctica 8. Verde 1h-BencimidazolAndresDuran0% (1)
- Be NC Imidazol 2Documento2 páginasBe NC Imidazol 2Adriana ArzateAún no hay calificaciones
- Pra 9. Sintesis de 23 DifenilquinoxalinaDocumento4 páginasPra 9. Sintesis de 23 DifenilquinoxalinaAldo TrejoAún no hay calificaciones
- Cuestionario NicotinaDocumento4 páginasCuestionario NicotinaMonica Alva100% (1)
- Práctica 8 Farmacología Secreción Tubular Activa de Ácido P-AminohipúricoDocumento6 páginasPráctica 8 Farmacología Secreción Tubular Activa de Ácido P-AminohipúricoDaniela Abigail Juárez CarmonaAún no hay calificaciones
- CuestionarioDocumento2 páginasCuestionarioSaid MossoAún no hay calificaciones
- P-7-Cuestionario SÍNTESIS DE 7-HIDROXI-4-METILCUMARINADocumento3 páginasP-7-Cuestionario SÍNTESIS DE 7-HIDROXI-4-METILCUMARINAKaren SalasAún no hay calificaciones
- Síntesis de 2 4-Dietoxicarbonil-3, 5-DimetilpirrolDocumento6 páginasSíntesis de 2 4-Dietoxicarbonil-3, 5-Dimetilpirrolleonardo porras narvaezAún no hay calificaciones
- Cuestionario de La Práctica 4 - Síntesis de 1-Fenil-3-Metilpirazol-5-OnaDocumento2 páginasCuestionario de La Práctica 4 - Síntesis de 1-Fenil-3-Metilpirazol-5-OnaKaren SalasAún no hay calificaciones
- Síntesis de 2,4-Dietoxicarbonil 3,5 DimetilpirrolDocumento25 páginasSíntesis de 2,4-Dietoxicarbonil 3,5 DimetilpirrolEdgar ArmandoAún no hay calificaciones
- Síntesis Sustentable de 2,3-DifenilquinoxalinaDocumento34 páginasSíntesis Sustentable de 2,3-Difenilquinoxalinaalejandro mayenAún no hay calificaciones
- Práctica 7 - Síntesis de BenzotriazolDocumento8 páginasPráctica 7 - Síntesis de BenzotriazolMonserrat GHAún no hay calificaciones
- Obtencion de Furano-2 - Carboxialdehido (Furfural)Documento2 páginasObtencion de Furano-2 - Carboxialdehido (Furfural)jorgeAún no hay calificaciones
- Cuestionario BencimidazolDocumento3 páginasCuestionario BencimidazolAndresDuranAún no hay calificaciones
- Sintesis Sustentable de 2.3-DifenilquinoxalinaDocumento4 páginasSintesis Sustentable de 2.3-DifenilquinoxalinaAndresDuranAún no hay calificaciones
- Práctica 6 Influencia de La Variación Del PH Urinario en La Cantidad Excretada de Salicilatos Grupo: 6FV1 Equipo: 5 IntegrantesDocumento7 páginasPráctica 6 Influencia de La Variación Del PH Urinario en La Cantidad Excretada de Salicilatos Grupo: 6FV1 Equipo: 5 IntegrantesDaniela Abigail Juárez CarmonaAún no hay calificaciones
- 2,4 Dietoxicarbonil 3,5 DimetilpirrolDocumento10 páginas2,4 Dietoxicarbonil 3,5 Dimetilpirrolgerardo Gaona montalva0% (2)
- Reporte P8 Fisiologia CelularDocumento15 páginasReporte P8 Fisiologia CelularGonzález Chávez MarianaAún no hay calificaciones
- Síntesis de 2-4 Dietoxicarbil 3-5 Dimetilpirrol.Documento3 páginasSíntesis de 2-4 Dietoxicarbil 3-5 Dimetilpirrol.Héctor Balmori0% (1)
- Práctica 1. Arco Reflejo en HumanosDocumento4 páginasPráctica 1. Arco Reflejo en HumanosLuis Armando Velázquez CorralesAún no hay calificaciones
- Práctica 9 Síntesis 2,3-Difenilquinoxalina Qfi 2019 - 1Documento26 páginasPráctica 9 Síntesis 2,3-Difenilquinoxalina Qfi 2019 - 1Dani CrAún no hay calificaciones
- AlvaavlaavlaavlaavlaDocumento2 páginasAlvaavlaavlaavlaavlaMiguel SaavedraAún no hay calificaciones
- Práctica 8 Síntesis de 1H-BencimidazolDocumento3 páginasPráctica 8 Síntesis de 1H-BencimidazolJuan del CarmenAún no hay calificaciones
- PRÁCTICA N5 Guaifenesina Por Cromatografia de GasesDocumento4 páginasPRÁCTICA N5 Guaifenesina Por Cromatografia de GasesVal RomeroAún no hay calificaciones
- Sintesis 5,5 DifenilhidantoínaDocumento5 páginasSintesis 5,5 DifenilhidantoínaAdrian Quintanilla100% (1)
- Modulacion de Una Funcion Celular Por Señales QuimicasDocumento7 páginasModulacion de Una Funcion Celular Por Señales Quimicasjohnhdz2pAún no hay calificaciones
- Preparación de N-Óxido de 4-Nitro-2-PicolinaDocumento15 páginasPreparación de N-Óxido de 4-Nitro-2-PicolinaMónica MedinaAún no hay calificaciones
- Potencial de Difusion y LesionDocumento11 páginasPotencial de Difusion y Lesionpamela0% (1)
- Cuestionario de La Práctica 3 - Síntesis de 3,5-DimetilisoxazolDocumento3 páginasCuestionario de La Práctica 3 - Síntesis de 3,5-DimetilisoxazolKaren SalasAún no hay calificaciones
- 2-Nitrotiofeno PrevioDocumento5 páginas2-Nitrotiofeno PrevioLyn Quinn Mim100% (1)
- Sintesis 3,5-DIETOXICARBONIL,-2,6-DIMETIL-4-FENILDIHIDROPIRIDINADocumento6 páginasSintesis 3,5-DIETOXICARBONIL,-2,6-DIMETIL-4-FENILDIHIDROPIRIDINARocioAún no hay calificaciones
- Practica 9 de Química Fármacos HeterociclicosDocumento3 páginasPractica 9 de Química Fármacos HeterociclicosFanton DíazAún no hay calificaciones
- P-11 - Cuestionario EXTRACCIÓN DE CAFEÍNA A PARTIR DE UNA FORMA FARMACEUTICADocumento3 páginasP-11 - Cuestionario EXTRACCIÓN DE CAFEÍNA A PARTIR DE UNA FORMA FARMACEUTICAKaren SalasAún no hay calificaciones
- Practica 4 Sintesis de 1-Fenil-3metilpirazol-5-OnaDocumento2 páginasPractica 4 Sintesis de 1-Fenil-3metilpirazol-5-OnaJackCrack1221Aún no hay calificaciones
- PRÁCTICA No. 4: OBTENCIÓN DE 5,5-DIFENILHIDANTOINADocumento7 páginasPRÁCTICA No. 4: OBTENCIÓN DE 5,5-DIFENILHIDANTOINADiana HMAún no hay calificaciones
- Sintesis de 5,5difenilhidantoinafinalDocumento4 páginasSintesis de 5,5difenilhidantoinafinalAntonio Gamiño GarciaAún no hay calificaciones
- Extracción de CafeinaDocumento2 páginasExtracción de CafeinaHéctor Balmori100% (1)
- P13 Preparación de N-Oxido de 4-Nitro - 2-PicolinaDocumento6 páginasP13 Preparación de N-Oxido de 4-Nitro - 2-PicolinaQuique MLAún no hay calificaciones
- Propiedad Del Musculo LisoDocumento15 páginasPropiedad Del Musculo LisoGino Eduardo Taboada Lozano50% (2)
- Preparación de BencimidazolDocumento2 páginasPreparación de BencimidazolHéctor BalmoriAún no hay calificaciones
- Musculo Esqueletico y Transmision SinapticaDocumento18 páginasMusculo Esqueletico y Transmision SinapticaBeelem Ü CentenoAún no hay calificaciones
- Obtención de Furano-2-Carboxaldehido (Furfural)Documento3 páginasObtención de Furano-2-Carboxaldehido (Furfural)Alan DavidAún no hay calificaciones
- Practica 7. Sintesis de 7-Hidroxi-4-Metil CumarinaDocumento2 páginasPractica 7. Sintesis de 7-Hidroxi-4-Metil CumarinaAdrian DiazAún no hay calificaciones
- Síntesis de Pirazolona 1Documento3 páginasSíntesis de Pirazolona 1Mónica MedinaAún no hay calificaciones
- Práctica N°8 Musculo EsqueleticoDocumento13 páginasPráctica N°8 Musculo EsqueleticoLinda Mussa VargasAún no hay calificaciones
- Práctica 3: Extracción en Fase Sólida. Separación de Colorantes SintéticosDocumento3 páginasPráctica 3: Extracción en Fase Sólida. Separación de Colorantes SintéticosGuillermo CasillasAún no hay calificaciones
- Reporte FurfuralDocumento9 páginasReporte FurfuralMary FallAún no hay calificaciones
- P-12 - Cuestionario - SÍNTESIS 5,5-DIFENILHIDANTOÍNADocumento2 páginasP-12 - Cuestionario - SÍNTESIS 5,5-DIFENILHIDANTOÍNAKaren Salas100% (1)
- Practica 5. Potencial de Accion y Simulacion Por ComputadoraDocumento22 páginasPractica 5. Potencial de Accion y Simulacion Por ComputadoraMonicaAún no hay calificaciones
- Practica 3Documento4 páginasPractica 3fcbarcelona-08hotmail.comAún no hay calificaciones
- Practica 6Documento2 páginasPractica 6Gonzalo UribeAún no hay calificaciones
- Practica 6Documento2 páginasPractica 6Gonzalo UribeAún no hay calificaciones
- Practica 2 FitoquimicaDocumento1 páginaPractica 2 Fitoquimicafcbarcelona-08hotmail.comAún no hay calificaciones
- Reporte 6 MétodosDocumento3 páginasReporte 6 Métodosfcbarcelona-08hotmail.comAún no hay calificaciones
- Farmacos AntineoplasicosDocumento50 páginasFarmacos Antineoplasicosfcbarcelona-08hotmail.com100% (3)
- CalcitoninaDocumento14 páginasCalcitoninafcbarcelona-08hotmail.comAún no hay calificaciones
- Práctica 1. Soluciones FarmacéuticasDocumento6 páginasPráctica 1. Soluciones Farmacéuticasfcbarcelona-08hotmail.comAún no hay calificaciones
- Reporte 7 MétodosDocumento2 páginasReporte 7 Métodosfcbarcelona-08hotmail.comAún no hay calificaciones
- Practica 8 Metodos de SeparaciónDocumento2 páginasPractica 8 Metodos de Separaciónfcbarcelona-08hotmail.comAún no hay calificaciones
- Reporte 3 MétodosDocumento3 páginasReporte 3 Métodosfcbarcelona-08hotmail.comAún no hay calificaciones
- Reporte 7 MétodosDocumento2 páginasReporte 7 Métodosfcbarcelona-08hotmail.comAún no hay calificaciones
- Reporte 2 MétodosDocumento2 páginasReporte 2 Métodosfcbarcelona-08hotmail.comAún no hay calificaciones
- Curva Tipo de Azucares ReductoresDocumento2 páginasCurva Tipo de Azucares Reductoresfcbarcelona-08hotmail.com100% (1)
- Practica 12Documento3 páginasPractica 12fcbarcelona-08hotmail.comAún no hay calificaciones
- Fosfolipidos y ColesterolDocumento2 páginasFosfolipidos y Colesterolfcbarcelona-08hotmail.com0% (1)
- Aislamiento de Origen VegetalDocumento3 páginasAislamiento de Origen Vegetalfcbarcelona-08hotmail.comAún no hay calificaciones
- Efecto Concentracion y PHDocumento2 páginasEfecto Concentracion y PHfcbarcelona-08hotmail.comAún no hay calificaciones
- Obtencion de Glucogeno de Hígado de Rata y Caracterizacion QuimicaDocumento3 páginasObtencion de Glucogeno de Hígado de Rata y Caracterizacion Quimicafcbarcelona-08hotmail.comAún no hay calificaciones
- Concentracion Sustrato e InhibicionDocumento2 páginasConcentracion Sustrato e Inhibicionfcbarcelona-08hotmail.comAún no hay calificaciones
- Practica 12Documento3 páginasPractica 12fcbarcelona-08hotmail.comAún no hay calificaciones
- Precipitacion de ProteinasDocumento2 páginasPrecipitacion de Proteinasfcbarcelona-08hotmail.comAún no hay calificaciones
- Practica 13Documento3 páginasPractica 13fcbarcelona-08hotmail.comAún no hay calificaciones
- Practica 10Documento3 páginasPractica 10fcbarcelona-08hotmail.comAún no hay calificaciones
- Practica 11 FinalDocumento4 páginasPractica 11 Finalfcbarcelona-08hotmail.com100% (1)
- Practica 8Documento3 páginasPractica 8fcbarcelona-08hotmail.comAún no hay calificaciones
- Practica 8Documento4 páginasPractica 8fcbarcelona-08hotmail.comAún no hay calificaciones
- GFPI-F-023 Formato Planeacion Seguimiento y Evaluacion Etapa ProductivaDocumento4 páginasGFPI-F-023 Formato Planeacion Seguimiento y Evaluacion Etapa ProductivaNicolasAún no hay calificaciones
- Qué Es Chavín de HuántarDocumento10 páginasQué Es Chavín de HuántarMj RodrigoAún no hay calificaciones
- Ejercicio 2Documento14 páginasEjercicio 2Julio Palomino Blanco83% (6)
- Cuestionario SenaDocumento5 páginasCuestionario SenaYenyfer VirguezAún no hay calificaciones
- Coordenadas Cilindricas y Esfericas e Integrales MultiplesDocumento9 páginasCoordenadas Cilindricas y Esfericas e Integrales MultiplesSandra GamezAún no hay calificaciones
- Tarea1 Katherine GonzalezDocumento3 páginasTarea1 Katherine Gonzalezkagonzalez95Aún no hay calificaciones
- EmotionShare Manifesto EsDocumento57 páginasEmotionShare Manifesto EsVictor Euclides Briones MoralesAún no hay calificaciones
- Interacción de Medicamentos Ansioliticos & Antidepresivos Con Farmacos Utilizados en COVID-19Documento57 páginasInteracción de Medicamentos Ansioliticos & Antidepresivos Con Farmacos Utilizados en COVID-19YADIRA YOLANDA SIFUENTES LUNAAún no hay calificaciones
- Plantas Medicinales ChiapasDocumento18 páginasPlantas Medicinales ChiapasGabriel D. SánchezAún no hay calificaciones
- AutorizacionDocumento1 páginaAutorizacionMarta❤️?Aún no hay calificaciones
- TP 1 Cultura PrecolombinaDocumento22 páginasTP 1 Cultura PrecolombinaEugee Estela100% (1)
- Resumen Capítulo 9 "Elementos de Economía Política" Krause - Zanotti - RavierDocumento4 páginasResumen Capítulo 9 "Elementos de Economía Política" Krause - Zanotti - RavierNachoAún no hay calificaciones
- 2ac-Bio-Acuerdo PedagogicoDocumento1 página2ac-Bio-Acuerdo PedagogicoDany FreireAún no hay calificaciones
- Ley 9 2007 LAJADocumento34 páginasLey 9 2007 LAJASilvia Ramírez DivaretAún no hay calificaciones
- Taller Conversion y Resistencias 3Documento4 páginasTaller Conversion y Resistencias 3Gustavo ValenciaAún no hay calificaciones
- Investigacion - Unidad 6 Gestion de Proyectos de SoftwareDocumento9 páginasInvestigacion - Unidad 6 Gestion de Proyectos de Softwarejuan pabloAún no hay calificaciones
- Programa de PF 1 2011Documento3 páginasPrograma de PF 1 2011ttypt_tallermayAún no hay calificaciones
- Configurar MercuryDocumento8 páginasConfigurar Mercuryjorgeamigo2Aún no hay calificaciones
- TAPENTADOLDocumento17 páginasTAPENTADOLJeniffer Baque HidalgoAún no hay calificaciones
- Alla AfueraDocumento12 páginasAlla AfueraAlejo SivoriAún no hay calificaciones
- Teoria de Decisiones (Arboles y Veim)Documento8 páginasTeoria de Decisiones (Arboles y Veim)KM Zaal25% (4)
- El Modelo de Regresión Lineal Clásico Con Dos VariablesDocumento18 páginasEl Modelo de Regresión Lineal Clásico Con Dos VariablesKevo Pérez GarcíaAún no hay calificaciones
- Dieciocho Maneras de Preparar El Cerdo Navideño PirateadoDocumento10 páginasDieciocho Maneras de Preparar El Cerdo Navideño PirateadoIsrael GPAún no hay calificaciones
- Actividad 4 Sistema de Vigil EpiDocumento12 páginasActividad 4 Sistema de Vigil EpiKatherine GAún no hay calificaciones
- Informe de Inventario de Pozos Subterranesos - Aaa MantaroDocumento44 páginasInforme de Inventario de Pozos Subterranesos - Aaa MantaroCarlos OscanoaAún no hay calificaciones
- El MultimetroDocumento5 páginasEl Multimetrodaniel pajaresAún no hay calificaciones
- Triptico Tubo de RubensDocumento2 páginasTriptico Tubo de RubensTheLiga BoOy100% (1)
- Carmen Silva 3° Año Actividad 3 LaminarioDocumento3 páginasCarmen Silva 3° Año Actividad 3 LaminarioAlejandro Villanueva100% (1)
- Cuadernillo Camareras de Piso Low PDFDocumento76 páginasCuadernillo Camareras de Piso Low PDFMars HeimdalAún no hay calificaciones
- Protocolos Ministerio de - Salud Protocolo de Exposicion Al Ruido PrexorDocumento1 páginaProtocolos Ministerio de - Salud Protocolo de Exposicion Al Ruido PrexorHarry Fasanando PinedoAún no hay calificaciones