Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Presentación 3
Cargado por
Daniela Vazquez0 calificaciones0% encontró este documento útil (0 votos)
9 vistas18 páginasTítulo original
Presentación3
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PPTX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
9 vistas18 páginasPresentación 3
Cargado por
Daniela VazquezCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 18
Introducción
• La Bordetella es el género de pequeñas bacterias gram negativas del
filo proteobacteria. Son organismos cocobacilos de difícil cultivo y,
con la excepción de B. petrii, son aeróbicos obligados. Tres especies
son patógenos humanos, B. pertussis, B. parapertussis y B.
bronchiseptica; dos de los cuales (B. bronchiseptica y B. pertussis)
presentan motilidad
• Al contrario de lo que sucede con B. pertussis o B. parapertussis, los
humanos no son naturales transportadores de B. bronchiseptica, que
típicamente infecta aparato respiratorio de pequeños mamíferos
(gatos, perros , conejos, etc)
• es la quinta causa en el mundo de muertes pre-venibles por vacunación en
niños menores de 5 años; representa el 11% de estas, de acuerdo con
datos de la Organización Mundial de la Salud (OMS). Sin embargo, pese a
la existencia de vacunas eficaces y seguras contra esta enfermedad desde
hace muchas décadas, globalmente aún se producen numerosos brotes
de tosferina, tanto en países subdesarrollados como en los
desarrollados. Se calcula que mundialmente ocurren alrededor de 20 a
40 millones de casos cada año, de los cuales en promedio fallecen
300.000 niños. Este cálculo y el subregistro de casos, que probablemente
es grande, se deben a múltiples razones que se describirán más adelante.
La mayoría de estas muertes se presenta en países en vías de
desarrollo, principalmente en infantes que aún no han recibido su
primera dosis de vacuna.
• Las descripciones de tosferina datan del año 1500; sin embargo, se
acredita a Guillermo de Baillou como quien presentó la primera
descripción del cuadro clínico, con base en los casos en una epidemia
en París en 1578. En 1670, Thomas Sydenham comenzó a utilizar el
nombre.
Clasificación taxonómica
• Reino: Bacteria
• Clase: Beta Proteobacteria
• Orden: Burkholderiales
• Familia: Alcaligenaceae
• Género: Bordetella
• Espesies. Bordetella pertussis,
• Bordetella parapertussis,
• Bordetella bronchiseptica, Bordetella ansorpii,
• Bordetella avium, Bordetella hinzii,
• Bordetella holmesii, Bordetella petrii,
• Bordetella trematum.
Fisiologia y estructura
• Las Bordetella son bacterias parásitas obligadas y sobreviven poco tiempo en el
medio exterior, teniendo un tropismo peculiar por las vías respiratorias, aunque
son flora saprofita de ciertos animales. Son bacterias cocobacilares, es decir son
microorganismos que combinan una forma morfológica de bacilo (bastón), y de
coco (esférica). No son esporuladas, tienen flagelos peritricos, aunque algunos
son inmóviles. Varían en tamaño entre 0,5 µm y 1 µm de largo y 0,2 a 0,4 µm de
ancho. Su metabolismo de respiración aeróbica le permite catabolizar
carbohidratos y formar energía a partir de aminoácidos.
• La toxina pertussis el linfocitos la sensibilización a la histamina y la mayor
secreción de insulina y tiene una acción similar a la toxina del colera.
• Ambas son proteínas secretadas y se encuentran fuera de la célula de
BORDETELLA PERTUSSIS.
Patogenia e inmunidad
PATOGENIA.-
La infección y la enfermedad ocasionadas por siguen cuatro pasos: (1) fijación, (2) evasión de los
mecanismos de defensa del hospedero, (3) daño local y (4) manifestaciones sistémicas. La hemaglutinina
filamentosa (HAF) y las fimbrias (FIM) son adhesinas mayores y determinan-tes de la virulencia de . La
HAF es una estructura filamentosa propia de la pared bacteriana que es necesaria para la colonización
traqueal; es muy inmunogénica, por lo que forma parte de los componentes de ciertas vacunas acelulares. Sin
embargo, estructuras como la pertactina (PRN) y la toxina de pertussis (TP) también actúan como adhesinas. La
toxina adenilato-ciclasa (TAC) y la TP son los componentes responsables de evadir los mecanismos de defensa
del hospedero. La TAC es una toxina secretada por la bacteria que cataliza la conversión de adenosín trifosfato
(ATP) a adenosín bifosfato cíclico (cAMP), lo que inhibe la migración y la activación de los fagocitos, además de
que suprime la activación de linfocitos T y la quimiotaxis. La toxina pertussis, uno de los factores de virulencia
más importantes de también tiene como objetivo inactivar el sistema inmune innato en el pulmón. La TP tiene
dos componentes, la subunidad A (enzimáticamente-te activa) y la subunidad B (de unión al receptor). libera
TP en forma inactiva. Cuando la subunidad B se une al receptor de la membrana celular, la subunidad A se
activa, quizás mediante la acción de glutatión y ATP. La TP cataliza la ribosilación del ADP de las proteínas G,
lo que previene que la proteína G interaccione con el receptor acoplado en la membrana celular,
interfiriendo así la comunicación intracelular. Por este mecanismo de acción, la TP inhibe la quimiotaxis y
retarda el reclutamiento temprano de neutrófilos y macrófagos en el tracto respiratorio, promoviendo la
infección por .La lesión pulmonar inicial de la tosferina se caracteriza por la hiperplasia linfoide de los ganglios
linfáticos peribronquiales y traqueobronquiales, seguida por la descamación del epitelio bronquial, con
infiltración difusa por macrófagos. A diferencia de otras enfermedades bacterianas, son pocas las
manifestaciones sistémicas que produce ya que no entra al torrente sanguíneo ni se disemina.
• INMUNIDAD.-
Después del contacto del individuo con , se produce una respuesta inmune tanto
humoral como celular. Entre los anticuerpos producidos se encuentran al-gunas
hemaglutininas y anticuerpos bactericidas, así como anticuerpos específicos
(inmunoglobulinas A, E, G y M) hacia algunos antígenos del microorganismo.
Es variable la duración de la inmunidad que confieren tanto la enfermedad
como la inmunización mediante vacunas de células enteras o acelulares. Sin
embargo, usualmente la duración de la inmunidad producto de la infección natural
es mayor que la obtenida por vacunación. No existe un marcador serológico
preciso para la inmunidad protectora contra . Los individuos que padecen la
enfermedad natural en su primer año de vida usualmente presentan descenso
de la inmunidad protectora 7 a 20 años después de haberla sufrido. La inmunidad
protectora conferida mediante vacunación, ya sea con vacunas de células
enteras o acelulares, usual-mente dura en los niños entre 4 y 12 años. Se sabe
que la inmunidad mediada por células es necesaria para la recuperación como
producto de la infección natural y para la inmunidad protectora a largo plazo,
pero se conoce poco sobre el papel exacto de dicha inmunidad celular. Pero sí se
sabe que después de la infección natural en el ser humano, la PT, la HAF y la
pertactina estimulan la síntesis de linfocitos TH1.
EPIDEMIOLOGIA
• La epidemiología de la enfermedad ha cambiado mucho después de la introducción de las vacunas
de células enteras hace más de 50 años. Las vacunas compuestas por células completas muertas de
fueron desarrolladas poco tiempo después de aislar la bacteria y los primeros resultados de
protección los reportó Madsen en 1925. Estudios realizados por el Congreso Médico Británico
en las décadas de los años cuarenta y cincuenta demostraron una buena correlación entre la
potencia de las vacunas de pertussis y su eficacia clínica en niños. Como consecuencia de ellos, la
inmunización contra pertussis se introdujo como parte del esquema de vacunación en muchos
países alrededor del mundo, en combinación con los toxoides del tétanos y la difteria (DPT). En
la era prevacunal, la mortalidad por tosferina era sumamente alta. Igualmente, era particularmente
alta, en muchos países, la carga de la enfermedad antes de la introducción de las dosis de refuerzo
de vacunación a los 15-18 meses y 4-6 años. Una vez introducida la quinta dosis de vacunación
en muchos países alrededor del mundo, hubo un descenso significativo del número de casos. Pese a
ello, los brotes de tosferina ocurren usualmente cada 3 a 5 años, en parte por la acumulación de
grupos susceptibles. En la década de los años 90 hubo un resurgimiento importante de la
tosferina en muchos países del mundo, incluyendo un aumento del número de hospitalizaciones,
reportes de casos, y muertes. Este cambio epidemiológico se observó en Estados Unidos, Canadá,
Europa y muchos otros países.[3,4,7-13] Dicho aumento se debió a varias razones. En comparación
con años anteriores, cuando el niño era una de las fuentes de transmisión más importantes, en las
últimas décadas se determinó que tanto los adolescentes como los adultos eran la fuente de
Lo anterior se explica en gran parte por un descenso de la inmunidad protectora
con los años. Así, la madre es la principal fuente de transmisión para los infantes.
Por ello, se han hecho esfuerzos para mejorar la sospecha diagnóstica de la
enfermedad por parte del personal médico y los sistemas de vigilancia
epidemiológica y técnicas de laboratorio. No obstante, la baja sospecha clínica de
la enfermedad por parte de los médicos que atienden niños, y sobre todo adultos,
ha contribuido al subregistro de la tosferina. De interés, recientemente se ha
planteado si cambios genéticos en las cepas de que circulan hoy en día en
comparación con las que se utilizaron para la elaboración de las vacunas
actuales, podrían ju-gar también un papel en dicho resurgimiento. Lo anterior se
basa en hallazgos hechos en Argentina, Brasil, Finlandia y otros países. En
Latinoamérica, se desconoce la carga exacta de enfermedad por tosferina ya que
existe un subregistro importante de la enfermedad por diferentes razones; sin
embargo, durante el último quinquenio varios países del continente han
reportado brotes importantes de tosferina y aumento del número de casos,
hospitalizaciones y fallecidos. Ejemplos de países con dichos brotes incluyen,
entre otros, Costa Rica, Panamá y Argentina. Esto ha llevado a que algunos de
estos países hayan incorporado nuevas estrategias de vacunación a grupos de alto
Principales enfermedades clínicas
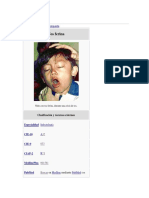
• El período de incubación de varía entre 5 y 21 días, pero usualmente es de 7 días y
raramente se extiende más allá de 10 días. Presentaciones atípicas pue-den ocurrir en
los niños pequeños o previamente vacunados y en los niños mayores y adolescentes.
Clásicamente se ha dividido el curso clínico en tres estadios o fases: catarral,
paroxística y convaleciente. Fase catarral. Es la etapa más temprana del cuadro
clínico y puede durar de 7 a 10 días, con rango entre 5 y 21 días. Clínicamente puede
ser indistinguible de una infección respiratoria superior de origen viral. En esta
fase es común la presencia de rinorrea, lagrimeo, inyección conjuntival, mal esta-do
general, febrícula y tos leve. La tos gradualmente empieza a agravarse conforme se
aproxima la fase paroxística. En niños mayores, adolescentes y adultos con
inmunidad parcial, puede no presentarse la fase catarral y ser menos graves las
manifestaciones de la fase paroxística, sin los hallazgos típicos.[25] En esta fase la
sospecha clínica de tos-ferina es sumamente baja porque el niño no suele
presentar paroxismos. En esta fase el diagnóstico clínico temprano usualmente se
sospecha solo ante la presencia de otros miembros en el hogar con tos paroxística o
persistente, o de brotes de tosferina en la comunidad o en el país.
• Fase paroxística. Usualmente puede durar de 1 a 6 semanas, pero puede persistir hasta
por 10 semanas. Se caracteriza por paroxismos o accesos de tos. Luego del paroxismo, se
presenta una inspiración prolongada que se acompaña de un grito de tono alto,
particularmente en infantes y niños pequeños. En esta población, además, se pueden
presentar episodios de apnea. Los paroxismos se presentan con mayor frecuencia en las
noches y típicamente pueden ocurrir de 15 a 30 en 24 horas, dependiendo de la gravedad.
Pueden presentarse espontánea-mente o precipitarse por estímulos externos. La frecuencia
de los ataques aumenta durante la primera o segunda semana, se mantienen con la misma
intensidad por 3 a 4 semanas para finalmente disminuir de forma gradual en 1 a 2
semanas. Además, en esta fase, los paroxismos se pueden acompañar de enrojecimiento
facial, cianosis, sudoración y ser seguidos de vómitos postusígenos y cansancio. Durante la
fase catarral tardía y al inicio de la paroxística, los pacientes pueden manifestar algunos
signos de enfermedad sistémica, además del hallazgo hematológico típico de la
enfermedad, llamado reacción leucemoide con predominio linfocítico. El recuento
leucocitario puede exceder las 50.000 células/µL, y consiste en una linfocitosis relativa con
células T o B y menos aumento de los neutrófilos. Tanto la leucocitosis como la linfocitosis
son signos de mal pronóstico clínico. Fase convaleciente. Es la etapa final de la
enfermedad. Los paroxismos disminuyen en frecuencia y la tos gradualmente se va
resolviendo en 2 a 3 semanas o hasta meses después. De ahí también el nombre de la tos
de los cien días. Las manifestaciones clínicas de los infantes difieren de las que se ven en
adolescentes y adultos. En estos últimos dos grupos etarios, la tosferina puede presentarse
como cuadros de tos persistente de varias semanas de evolución, que no se diagnostican
como de tosferina o el diagnóstico se hace tardíamente.
• Complicaciones.-
• Las hospitalizaciones, complicaciones y muertes atribuidas a la tosferina suelen ser más comunes
en infantes menores de 6 meses y principalmente en los menores de 2 meses.[27,28] Entre las
complicaciones más frecuentes en este grupo se destacan: apnea, neumonía, pérdida de peso
por dificultades para la alimentación y vómitos postusígenos, convulsiones, hemorragias
retinianas, incontinencia urinaria y prolapso rectal. Complicaciones más graves en niños incluyen
neumotórax, hematomas subdurales, hipertensión pulmonar, síndrome de dificultad respiratoria y
muerte. Aunque en el adulto raramente se producen, se reportan también complicaciones como
neumonías, hemorragias retinianas, neumotórax y hasta ruptura de las arterias carótidas. En la
fisiopatología de la hipertensión pulmonar en infantes con tosferina juegan un rol primordial la
leucocitosis grave o extrema, la hipoxemia, el aumento de la resistencia vascular y la
vasoconstricción pulmonar.[29,30] La presencia de los mismos en el infante aumenta la
probabilidad de falla cardíaca, choque y muerte. Pese a la disponibilidad de nuevas opciones en
terapia intensiva para estos pacientes, el pronóstico sigue siendo malo. Algunas de estas
novedades terapéuticas incluyen la administración de óxido nítrico, la oxigenación extracorpórea
a través de membrana (ECMO), la exanguinotransfusión, la plasmaféresis y, más recientemente, la
leucodepleción. Muchas de estas técnicas, asocia-das a veces con algunas complicaciones, ni
siquiera están disponibles en países de América Latina, pues sus costos son elevados y para
utilizarlas se requieren centros y personal especializados. En recién nacidos prematuros, la tosferina
pue-de presentarse con apneas. Se asocian a los paroxismos de tos, pero pueden ocurrir también de
forma espontánea, a consecuencia de estimulación vagal. La neumonía por tosferina puede ser
primaria o consecuencia de una infección bacteriana secundaria; en el primer caso se asocia a
leucocitosis extrema, hasta de 60.000 leucocitos/µL e hipertensión pulmonar. Los vómitos
usualmente ocurren en la mitad de los niños menores de 12 meses, pero de igual forma se
Tratamiento prevención y control
Tratamiento.-
Aunque la vacunación continúa siendo la mejor herramienta para prevenir la
tosferina y sus complicaciones, la terapia con antibióticos forma parte importante del
manejo médico de estos pacientes. El tratamiento inicial de todo niño con
tosferina debe incluir un adecuado soporte así como intentar prevenir las
complicaciones y posibles secuelas. Los infantes menores de 3 meses son los que a
menudo requieren ser hospitalizados, mientras que aquellos con edades entre 3 y 6
meses deben ser evaluados y de acuerdo con la gravedad de sus paroxismos pue-de
elegirse el manejo ambulatorio. La hospitalización se requiere muchas veces para la
administración de oxígeno, vigilancia de las crisis de cianosis, observación del avance
de la enferme-dad y manejo de los posibles eventos que pongan en peligro la vida
del paciente. Esto por cuanto el curso de la enfermedad puede cambiar bruscamente
en cuestión de horas o pocos días.
• En comparación con otras bacterias, presenta una excelente sensibilidad a los
macrólidos y también se ha demostrado susceptibilidad a otros medicamentos.
Las complicaciones de la tosferina no ocurren por problemas de resistencia a los
antibióticos, como sí sucede en otros escenarios clínicos como los debidos a
infecciones por gérmenes Grampositivos o Gramnegativos resistentes a uno o
múltiples antibióticos. Se deben utilizar los antibióticos cuando haya un caso
sospechoso o confirmado en niños meno-res de 1 año durante las primeras 6
semanas de aparición de la tos. Si bien es cierto que el curso de la enfermedad
puede autolimitarse sin el tratamiento, y que después de tres a cuatro semanas de
tos hasta en el 90% de los afectados desaparece la bacteria de la nasofaringe,
el tratamiento busca erradicar la bacteria de este sitio para disminuir el riesgo de
exposición. Lo anterior debido a que los individuos no vacunados o los no
tratados pueden portar la bacteria en la nasofaringe hasta por 6 semanas. Durante
muchos años el tratamiento para la tos-ferina consistía en la administración de
eritromicina oral a la dosis de 40-50 mg/kg/día en 4 tomas diarias y por 14 días. Sin
embargo, debido a lo prolongado del mismo y a los efectos secundarios
gastrointestinales, era común el abandono del tratamiento. Por eso, hoy en día, los
dos medicamentos de elección son la azitromicina y la claritromicina, y se dejan
como medicamentos de tercera o cuarta línea de tratamiento la eritromicina y
las sulfas, cuando no es posible administrar las dos primeras. Tratamiento
• . En neonatos, la azitromicina es el medicamento indicado, a la dosis de 10
mg/kg/día por vía oral (VO), una vez al día, por 5 días.[37] Con la claritromicina hay
poca experiencia y el uso de eritromicina se ha asociado a un incremento en
el riesgo de hipertrofia del píloro. Las sulfas están contraindicadas en este grupo
etario. En infantes de 1 a 5 meses, la azitromicina está indicada a la dosis de 10
mg/kg/día por vía oral por 5 días, y la claritromicina a la dosis de 15 mg/kg/día
oral, en 2 tomas diarias, por 7 días. Para infantes mayores de 6 meses y niños, se
debe administrar azitromicina a la dosis de 10 mg/kg/día en el día 1 y de 5
mg/kg/día del día 2 al 5, dosis máxima diaria de 500 mg. Para este mismo grupo
etario, la dosis de claritromicina se mantiene la misma que para el primer grupo, sin
exceder de 1 gramo diario. La dosis de trimetoprimsulfametoxazol (TMP-SMX)
recomendada para infantes mayores de 2 meses es de 8 mg/kg/día (TMP) o 40
mg/kg/día (SMZ), en 2 tomas diarias, por 14 días. Para adultos, la dosis
recomendada de azitromicina es de 500 mg por v.o. con el estómago vacío en dosis
única diaria durante 3 días, o 500 mg por v.o. el primer día y luego 250 mg del día 2
al 5, dependiendo de la presentación comercial existente en el medio; la
claritromicina se debe administrara la dosis de 1 gramo diario por vía oral, siempre
sobre los alimentos, en una o 2 tomas diarias, de acuerdo con la presentación
comercial, durante 7 días; a su vez la dosis de eritromicina es de 2 gramos diarios
por vo., en 4 tomas diarias, por 14 días, y la de TMP-SMX es de 1,6 gramos de SMX, 2
tomas diarias por 14 días.
Prevención.-
La herramienta que por muchos años ha demostrado ser más exitosa y costo-efectiva para
prevenir la tosferina es la vacunación. Pese a coberturas aceptables de vacunación contra
tosferina en niños, aún existen brotes importantes de la enfermedad y esta es causa de gran
morbimortalidad como se ha mencionado antes. En las Américas, las tasas de cobertura con
tres dosis de vacuna DPT oscilan alrededor del 90%.La historia de vacunación para tosferina
se remonta a muchas décadas atrás con la creación de vacunas de células enteras, que
son suspensiones de muertas, usualmente por temperaturas altas. En los Estados Unidos,
las primeras vacunas de células enteras fueron licenciadas en 1914.[38] Después de la
década de los años 30, hubo avances en la elaboración de las vacunas disponibles para
aquella época y las primeras vacunas combinadas con difteria y tétanos (DPT)
aparecieron al final de la década de los años 40. Posteriormente hubo cierta preocupación
acerca de la posibilidad de eventos adversos graves secundarios a la vacunación como, por
ejemplo, el síndrome de muerte súbita infantil o manifestaciones neurológicas, lo que llevó a
que declinaran las tasas de vacunación en algunos países europeos y en Japón durante los
años setenta. Esto llevó al desarrollo de brotes importantes en varios países, hasta que
finalmente, con la introducción de los dos refuerzos después de la serie primaria del primer
año de vida, el número de casos bajó considerablemente en los países que incorporaron
estas vacunas. El gran número de reacciones locales y sistémicas con la administración de la
vacuna de células completas estimuló el desarrollo de nuevas vacunas acelulares. Japón fue
pionero en la utilización de estas últimas desde 1981, después de lo cual otros países
como Estados Unidos, Canadá y algunos de Europa fueron incorporando las vacunas
• En América Latina, la vacuna DPT de células en-teras ha sido la oficial en los
esquemas nacionales de inmunización durante varias décadas. Sin embargo,
ya México y Costa Rica sustituyeron en sus esquemas oficiales la vacuna de
células enteras por vacunas acelulares como parte de sus prioridades. Lo
anterior garantiza buena eficacia, seguridad, menor reactogenicidad y menos
efectos secundarios asocia-dos a la DPaT comparada con la DPT, entre ellos
la encefalopatía aguda y las convulsiones febriles. Clásicamente, los efectos
secundarios más comunes observados con las vacunas de células enteras
han sido dolor, edema, induración y enrojecimiento en el sitio de aplicación,
fiebre, llanto y convulsiones. Por estas razones, las vacunas de células
enteras no están aprobadas para adolescentes ni adultos. Después del éxito
obtenido con la incorporación de las vacunas acelulares y de los
cambios epidemiológicos de la tosferina desde la década de los años 90, por
incremento de los casos en adolescentes y adultos, se diseñaron vacunas
para estos nuevos grupos etarios. Con la conformación de la (GPI), un
panel de expertos mundiales enfocados en la prevención de la tosferina,
adquirieron gran importancia las recomendaciones para la preven-ción de
esta enfermedad en dichos grupos de alto riesgo.
Bibliografía
WHO. Challenges in global immunization and the Global Im-munization Vision and Strategy 2006-2015. Wkly Epidemiol
Rec. 2006; 81(19): 190-5.2.
Centers for Disease Control and Prevention (CDC). Va-ccine preventable deaths and the Global Immunization Vi-sion
and Strategy, 2006-2015. MMWR Morb Mortal Wkly Rep. 2006; 55(18): 511-5.3.
Tan T, Trindade E, Skowronski D. Epidemiology of pertus-sis. Pediatr Infect Dis J. 2005; 24(5 Suppl): S10-8.4. Halperin SA,
Wang EE, Law B, Mills E, Morris R, Déry P, et al.
epidemiological features of pertussis in hospitalized patients in Canada, 1991-1997: report of the Immunization
Monitoring Program--Active (IMPACT). Clin Infect Dis. 1999; 28(6): 1238-43.5.
Major RH. A history of Medicine. Springfield, III: Charles C Thomas; 1954: 423.6.
Loeffelhoz MJ, Sanden GN. Bordetella pertussis. In: Mu-rray PR, Baron E, Jorgensen J, et al, editors.
Manual of Clini-cal Microbiology. 9th edition. Washington: ASM Press; 2007. p. 803-14.7.
Wortis N, Strebel PM, Wharton M, Bardenheier B, Hardy IR. Pertussis deaths: report of 23 cases in the United States, 1992
and 1993.
Pediatrics. 1996; 97(5): 607-12.8. Vitek CR, Pascual FB, Baughman AL, Murphy TV. Increa-se in deaths from pertussis
among young infants in the Uni-ted States in the 1990s. Pediatr Infect Dis J. 2003; 22(7): 628-34.9.
Mikelova LK, Halperin SA, Scheifele D, Smith B, Ford-Jones E, Vaudry W, et al.
Predictors of death in infants hos-pitalized with pertussis: a case-control study of 16 pertussis deaths in Canada. J Pediatr.
2003; 143(5): 576-81. 10. Celentano LP, Massari M, Paramatti D, Salmaso S, Tozzi AE. EUVAC-NET Group. Resurgence of
pertussis in Europe.
Pediatr Infect Dis J. 2005; 24(9): 761-5. 11. Tam TW, Bentsi-Enchill A.
The return of the 100-day cough: resurgence of pertussis in the 1990s. CMAJ. 1998; 159(6): 695-6.12. Bisgard KM,
También podría gustarte
- Los bacteriófagos: Los virus que combaten infeccionesDe EverandLos bacteriófagos: Los virus que combaten infeccionesAún no hay calificaciones
- Bordetella: Bacterias Patógenas HumanasDocumento4 páginasBordetella: Bacterias Patógenas HumanasAnyi Gomez GomezAún no hay calificaciones
- Infección Tuberculosa Latente, la base del icebergDe EverandInfección Tuberculosa Latente, la base del icebergAún no hay calificaciones
- Sindrome Coqueluchoide Tos FerinaDocumento6 páginasSindrome Coqueluchoide Tos FerinaVictoria FloresAún no hay calificaciones
- Neumonía en la infancia: Realidades y mitosDe EverandNeumonía en la infancia: Realidades y mitosAún no hay calificaciones
- Tos FerinaDocumento4 páginasTos FerinaMaria Belen Dueñas JaramilloAún no hay calificaciones
- La pandemia del covid-19. Efectos sobre la saludDe EverandLa pandemia del covid-19. Efectos sobre la saludCalificación: 5 de 5 estrellas5/5 (1)
- Tos ferina: causas, síntomas y prevención con vacunaDocumento20 páginasTos ferina: causas, síntomas y prevención con vacunacrysmari hernandezAún no hay calificaciones
- Seminario Microbiologia (Bordetella Pertussis)Documento7 páginasSeminario Microbiologia (Bordetella Pertussis)Alejandro VelizAún no hay calificaciones
- Enfrentando el COVID-19 con los beneficios del cannabis medicinalDe EverandEnfrentando el COVID-19 con los beneficios del cannabis medicinalAún no hay calificaciones
- Articulo de Difteria Proyeccion PDFDocumento4 páginasArticulo de Difteria Proyeccion PDFFiorella Alexandra HRAún no hay calificaciones
- La Guia Medica para Resfriados y Gripe: Como prevenir y tratar los resfriados, la gripe, la sinusitis, la bronquitis, el estreptococo y la pulmonia a cualquier edadDe EverandLa Guia Medica para Resfriados y Gripe: Como prevenir y tratar los resfriados, la gripe, la sinusitis, la bronquitis, el estreptococo y la pulmonia a cualquier edadCalificación: 4 de 5 estrellas4/5 (2)
- Tos FerinaDocumento7 páginasTos FerinaHaissamSulaymanAún no hay calificaciones
- TosferinaDocumento9 páginasTosferinaNayraJenniferCQAún no hay calificaciones
- Bordetella PertusisDocumento4 páginasBordetella PertusisCaedu DiazAún no hay calificaciones
- NeumocistosisDocumento0 páginasNeumocistosismatildameisterAún no hay calificaciones
- Difteria Tetanos PertussiDocumento13 páginasDifteria Tetanos PertussiLourdes PerdomoAún no hay calificaciones
- HaemophilusDocumento4 páginasHaemophilusAle KlunderAún no hay calificaciones
- Enfermedad Por Haemophilus Influenzae Tipo BDocumento4 páginasEnfermedad Por Haemophilus Influenzae Tipo BalexisAún no hay calificaciones
- U2T8 - Género Haemophilus y Género BordetellaDocumento11 páginasU2T8 - Género Haemophilus y Género BordetellaLeonella UtreraAún no hay calificaciones
- TOS FERINA-Pediatria Integral-2018 XXII PDFDocumento11 páginasTOS FERINA-Pediatria Integral-2018 XXII PDFEsteban Martin Chiotti Kaneshima100% (1)
- Bordetella Pertussis LetiDocumento9 páginasBordetella Pertussis LetiLeticia Nevado GarciaAún no hay calificaciones
- Tos Convulsa, Faringoamigdalitis DifteriaDocumento10 páginasTos Convulsa, Faringoamigdalitis DifteriamirkopsAún no hay calificaciones
- Bacilos Gram Negativo y Bacterias Especiales PDFDocumento29 páginasBacilos Gram Negativo y Bacterias Especiales PDFAndres CanelAún no hay calificaciones
- Sindrome CoqueluchiDocumento57 páginasSindrome CoqueluchiunirdeliaAún no hay calificaciones
- TEMA II: Traqueobronquitis Infecciosa Canina.: SinonimiaDocumento8 páginasTEMA II: Traqueobronquitis Infecciosa Canina.: SinonimiaGuillermo VarelaAún no hay calificaciones
- INTRODUCCIÓN KatitaDocumento8 páginasINTRODUCCIÓN KatitaKatherine Sofia Peralta ContrerasAún no hay calificaciones
- Caso Clinico SalmonelosisDocumento4 páginasCaso Clinico SalmonelosisRENZZO AMARO MOZO MARQUINAAún no hay calificaciones
- Tos FerinaDocumento13 páginasTos FerinaAldheir Anacleto IreneAún no hay calificaciones
- Tuberculosis Pulmonar y Extra PulmonarDocumento28 páginasTuberculosis Pulmonar y Extra PulmonarLuis David SuarezAún no hay calificaciones
- Etiopatogenia y Fisiopatología de La TuberculosisDocumento9 páginasEtiopatogenia y Fisiopatología de La Tuberculosislulita1202Aún no hay calificaciones
- TUBERCULOSISDocumento35 páginasTUBERCULOSISSteven Catunta ChoqueAún no hay calificaciones
- Caso Clinico Materno InfantilDocumento61 páginasCaso Clinico Materno InfantilMeza Galvis Ruben Dario100% (1)
- HTTPSWWW - Aeped.essitesdefaultfilesdocumentos11 Tosferina PDFDocumento13 páginasHTTPSWWW - Aeped.essitesdefaultfilesdocumentos11 Tosferina PDFAleger YamiAún no hay calificaciones
- Epidemiologia Etiologica MTindreDocumento16 páginasEpidemiologia Etiologica MTindreOyuki SonozakiAún no hay calificaciones
- Tos FerinaDocumento8 páginasTos FerinalindaAún no hay calificaciones
- Pre TosferinaDocumento32 páginasPre TosferinaPedro RodriguezAún no hay calificaciones
- Haemophilus, BordetellagarnerellaDocumento35 páginasHaemophilus, BordetellagarnerellaAlejandro Ascencio LéctorAún no hay calificaciones
- Traqueobronquitis Infeccion Canina - VancouverDocumento18 páginasTraqueobronquitis Infeccion Canina - VancouverClau Nati López Silva Santisteban100% (1)
- Bronquiolitis guía clínicaDocumento15 páginasBronquiolitis guía clínicaAnonymous 8sngurFsAún no hay calificaciones
- M. catarrhalis patógeno respiratorioDocumento9 páginasM. catarrhalis patógeno respiratorioDavid GarciaAún no hay calificaciones
- 2005 VACUNA TOS FERINADocumento9 páginas2005 VACUNA TOS FERINADaniel Enrique Muro CabrejosAún no hay calificaciones
- Neumonia Por Pneumocystis Jiroveci en Pacientes Con VihDocumento7 páginasNeumonia Por Pneumocystis Jiroveci en Pacientes Con VihGregorio ChavezAún no hay calificaciones
- COQUELUCHEDocumento13 páginasCOQUELUCHEomelisAún no hay calificaciones
- HAEMOPHILUS WordDocumento4 páginasHAEMOPHILUS Worddana guzmanAún no hay calificaciones
- Tuberculosis y EpilepsiaDocumento17 páginasTuberculosis y EpilepsiaJoseAngel19Aún no hay calificaciones
- TUBERCULOSISDocumento64 páginasTUBERCULOSISdayanaAún no hay calificaciones
- Cefalosporinas Orales en Infecciones PediatricasDocumento8 páginasCefalosporinas Orales en Infecciones PediatricasHarwin JHoel Salazar UrbanoAún no hay calificaciones
- Expo de Seminaro 2Documento20 páginasExpo de Seminaro 2Melissa ReyesAún no hay calificaciones
- Datos Curiosos y Vanguardistas Tos FerinaDocumento12 páginasDatos Curiosos y Vanguardistas Tos FerinaRandy E. AquinoAún no hay calificaciones
- Micologia y VirologiaDocumento6 páginasMicologia y VirologiaDavid BarbAún no hay calificaciones
- Tos Ferina - PlantillaDocumento7 páginasTos Ferina - PlantillaThania Bartra ZamoraAún no hay calificaciones
- Criterios de Diagnóstico y Tratamiento de La Tuberculosis InfantilDocumento20 páginasCriterios de Diagnóstico y Tratamiento de La Tuberculosis Infantilcarpenoctum100% (7)
- Etiopatogenia de La TBCDocumento6 páginasEtiopatogenia de La TBCAmelia BarrantesAún no hay calificaciones
- NeumocistosisDocumento38 páginasNeumocistosisMitch PerazaAún no hay calificaciones
- EscrofurodermiaDocumento20 páginasEscrofurodermiaJohana ParraAún no hay calificaciones
- CoquelucheDocumento9 páginasCoquelucheHermes VJAún no hay calificaciones
- 7.0 - Enfermedades BACTERIANAS SISTEMICASDocumento43 páginas7.0 - Enfermedades BACTERIANAS SISTEMICASMark JaraAún no hay calificaciones
- Expo de DesarrolloDocumento14 páginasExpo de DesarrolloDaniela VazquezAún no hay calificaciones
- Enfermedad Trofoblástica-GinecoDocumento15 páginasEnfermedad Trofoblástica-GinecoDaniela VazquezAún no hay calificaciones
- Como Encontrar Un TemaDocumento9 páginasComo Encontrar Un TemaDaniela VazquezAún no hay calificaciones
- Trabajo de DesarrolloDocumento3 páginasTrabajo de DesarrolloDaniela VazquezAún no hay calificaciones
- Conceptual 2Documento2 páginasConceptual 2Daniela VazquezAún no hay calificaciones
- Grupo SocialDocumento9 páginasGrupo SocialDaniela VazquezAún no hay calificaciones
- Diagrama RadicalDocumento1 páginaDiagrama RadicalDaniela Vazquez0% (1)
- DocumentoDocumento1 páginaDocumentoDaniela VazquezAún no hay calificaciones
- Lluvia de IdeasDocumento3 páginasLluvia de IdeasDaniela VazquezAún no hay calificaciones
- Notas de Clases TLRDocumento18 páginasNotas de Clases TLRDaniela VazquezAún no hay calificaciones
- Guion de Charla ITSDocumento6 páginasGuion de Charla ITSDaniela VazquezAún no hay calificaciones
- APLASTAMIENTODocumento1 páginaAPLASTAMIENTODaniela VazquezAún no hay calificaciones
- Diagrama RadialDocumento1 páginaDiagrama RadialDaniela VazquezAún no hay calificaciones
- De Acuerdo A La Encuesta Que Se Realizó A La Señora NatividadDocumento1 páginaDe Acuerdo A La Encuesta Que Se Realizó A La Señora NatividadDaniela VazquezAún no hay calificaciones
- TareasDocumento5 páginasTareasDaniela VazquezAún no hay calificaciones
- Teorí A Hablar de EnfermeríaDocumento1 páginaTeorí A Hablar de EnfermeríaDaniela VazquezAún no hay calificaciones
- MezclasDocumento2 páginasMezclasDaniela VazquezAún no hay calificaciones
- Centro Universitario MesoamericanoDocumento4 páginasCentro Universitario MesoamericanoDaniela VazquezAún no hay calificaciones
- Investigacion DocumentalDocumento6 páginasInvestigacion DocumentalDaniela VazquezAún no hay calificaciones
- Cuadro SipnoticoDocumento2 páginasCuadro SipnoticoDaniela VazquezAún no hay calificaciones
- Vias de AdministracionDocumento4 páginasVias de AdministracionDaniela VazquezAún no hay calificaciones
- Bacteria BacillusDocumento5 páginasBacteria BacillusDaniela VazquezAún no hay calificaciones
- Tipos de ComunicacionDocumento11 páginasTipos de ComunicacionDaniela VazquezAún no hay calificaciones
- Guion Charla Planificacion FamiliarDocumento4 páginasGuion Charla Planificacion FamiliarDaniela VazquezAún no hay calificaciones
- Bolsa AmarrillaDocumento1 páginaBolsa AmarrillaDaniela VazquezAún no hay calificaciones
- Cuadro SipnoticoDocumento2 páginasCuadro SipnoticoDaniela VazquezAún no hay calificaciones
- Joaquín Miguel Gutiérrez": C. Alumnos Del 3° Semestre Grupo "A"Documento1 páginaJoaquín Miguel Gutiérrez": C. Alumnos Del 3° Semestre Grupo "A"Daniela VazquezAún no hay calificaciones
- Actividades 2Documento13 páginasActividades 2Daniela VazquezAún no hay calificaciones
- Guion de Charla-DengueDocumento6 páginasGuion de Charla-DengueDaniela VazquezAún no hay calificaciones
- ProblemáticaDocumento2 páginasProblemáticaDaniela VazquezAún no hay calificaciones
- Freddy CorneaDocumento1 páginaFreddy CorneaJose MarceloAún no hay calificaciones
- Envejecimiento Del Sistema CardiovascularDocumento33 páginasEnvejecimiento Del Sistema CardiovascularMemo ZepedaAún no hay calificaciones
- GASTROENTERITISDocumento6 páginasGASTROENTERITISJULIETA LIZBETH MORALES ALVAREZAún no hay calificaciones
- Tol - Glucosaperfil Lpidico 2019Documento55 páginasTol - Glucosaperfil Lpidico 2019Leslie Silva TamayoAún no hay calificaciones
- Temario BiodescodificacionDocumento12 páginasTemario Biodescodificacionbersaca7100% (1)
- COLESTEROLDocumento6 páginasCOLESTEROLtruenaturalsAún no hay calificaciones
- Formato DNT Adulto MayorDocumento3 páginasFormato DNT Adulto MayorCentro De Salud PacchaAún no hay calificaciones
- Tesis Fistula ArteriovenosaDocumento28 páginasTesis Fistula ArteriovenosaEliber TorrealbaAún no hay calificaciones
- Valvulopatías 2Documento3 páginasValvulopatías 2franco collantes cortezAún no hay calificaciones
- Aborto Septico.Documento18 páginasAborto Septico.yosneuroAún no hay calificaciones
- Anatomia Radiológica Del ToraxDocumento3 páginasAnatomia Radiológica Del ToraxJesus Benitez Flores100% (1)
- Boleta de LaboratorioDocumento1 páginaBoleta de LaboratorioMarialejandra SuescumAún no hay calificaciones
- Lesiones de Nervios Periféricoss-1Documento25 páginasLesiones de Nervios Periféricoss-1Yasna Belen Valdebenito EbnerAún no hay calificaciones
- Clasificación Por Temas de Los Trastornos Del DSM IVDocumento2 páginasClasificación Por Temas de Los Trastornos Del DSM IVMaría Florencia CabreraAún no hay calificaciones
- Bloqueo de RamaDocumento18 páginasBloqueo de RamaAriadna GomezAún no hay calificaciones
- Aspiracion Por TraqueostomiaDocumento3 páginasAspiracion Por TraqueostomiaJorge Ivan EstradaAún no hay calificaciones
- Formato de Historia ClínicaDocumento7 páginasFormato de Historia ClínicaSandra HernándezAún no hay calificaciones
- JUGO-BIODESCODIFICACION (Recuperado Automáticamente)Documento16 páginasJUGO-BIODESCODIFICACION (Recuperado Automáticamente)alannis ramosAún no hay calificaciones
- Cochrane - Autoayuda TCADocumento25 páginasCochrane - Autoayuda TCARafael MUDUAún no hay calificaciones
- Densidad OseaDocumento7 páginasDensidad OseaAlejo RoseroAún no hay calificaciones
- CeftriaxonaDocumento2 páginasCeftriaxonaAlejandra OlivaresAún no hay calificaciones
- Paracetamol (Acetaminofén)Documento6 páginasParacetamol (Acetaminofén)carloslenninsqAún no hay calificaciones
- FICHAS TECNICAS CcssDocumento5 páginasFICHAS TECNICAS CcssPérez MarcoAún no hay calificaciones
- Presentacion TesisDocumento69 páginasPresentacion TesisVictor JoseAún no hay calificaciones
- Caso Julio y DiagnosticosDocumento4 páginasCaso Julio y DiagnosticosCatalina ParaguayAún no hay calificaciones
- 5 Momentos Cateter Venoso Periferico PDFDocumento1 página5 Momentos Cateter Venoso Periferico PDFDIANA LAURA PEREZ DELGADOAún no hay calificaciones
- PariDocumento4 páginasPariIsabella Cia YllescazAún no hay calificaciones
- Colocacion de Sonda Nasogastrica JonathanDocumento29 páginasColocacion de Sonda Nasogastrica JonathanVictor Daniel Pelagio Quintana100% (1)
- KOOSDocumento2 páginasKOOSMauroCeballosAún no hay calificaciones
- TALLER Infección Respiratoria AgudaDocumento4 páginasTALLER Infección Respiratoria AgudaJuan Fernando EspitiaAún no hay calificaciones
- Entrenamiento Científico con pesas: Fitness InteligenteDe EverandEntrenamiento Científico con pesas: Fitness InteligenteCalificación: 5 de 5 estrellas5/5 (3)
- Los 12 chakras: Desbloquea tus dones espiritualesDe EverandLos 12 chakras: Desbloquea tus dones espiritualesCalificación: 4 de 5 estrellas4/5 (14)
- La Dieta Antiinflamatoria: Haz estos cambios simples y económicos en tu dieta y comienza a sentirte mejor dentro de 24 horas! (Spanish Edition)De EverandLa Dieta Antiinflamatoria: Haz estos cambios simples y económicos en tu dieta y comienza a sentirte mejor dentro de 24 horas! (Spanish Edition)Calificación: 5 de 5 estrellas5/5 (4)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Neurocuántica: La nueva frontera de la neurocienciaDe EverandNeurocuántica: La nueva frontera de la neurocienciaCalificación: 5 de 5 estrellas5/5 (1)
- El libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)De EverandEl libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)Calificación: 3 de 5 estrellas3/5 (2)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Fundamentos y prácticas de comunicación no violenta: El primer manual práctico de comunicación no violenta (CNV) en españolDe EverandFundamentos y prácticas de comunicación no violenta: El primer manual práctico de comunicación no violenta (CNV) en españolCalificación: 3.5 de 5 estrellas3.5/5 (13)
- Mega Gluteos : Entrenamiento Científico de GlúteosDe EverandMega Gluteos : Entrenamiento Científico de GlúteosCalificación: 5 de 5 estrellas5/5 (1)
- Terapia cognitiva: Conceptos básicos y profundizaciónDe EverandTerapia cognitiva: Conceptos básicos y profundizaciónCalificación: 5 de 5 estrellas5/5 (1)
- Curación a través de Un Curso de MilagrosDe EverandCuración a través de Un Curso de MilagrosCalificación: 4.5 de 5 estrellas4.5/5 (4)
- Dejar ir. El camino a la liberaciónDe EverandDejar ir. El camino a la liberaciónCalificación: 4.5 de 5 estrellas4.5/5 (22)
- Exfoliantes corporales: La guía definitiva de cómo hacer sus propios exfoliantes naturales para el cuerpo, con recetas sencillas y ecológicasDe EverandExfoliantes corporales: La guía definitiva de cómo hacer sus propios exfoliantes naturales para el cuerpo, con recetas sencillas y ecológicasCalificación: 5 de 5 estrellas5/5 (1)
- TDAH en Adultos. Cómo Reconocer y Tratar a un Adulto con TDAH en 30 Fáciles PasosDe EverandTDAH en Adultos. Cómo Reconocer y Tratar a un Adulto con TDAH en 30 Fáciles PasosCalificación: 4 de 5 estrellas4/5 (8)
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Notas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesDe EverandNotas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesAún no hay calificaciones
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- 7 Pasos Para Superar Una Crisis: Cómo atravesar un duelo o una pérdida y salir fortalecidoDe Everand7 Pasos Para Superar Una Crisis: Cómo atravesar un duelo o una pérdida y salir fortalecidoCalificación: 5 de 5 estrellas5/5 (5)
- La curación de los chakras y el equilibrio energético: Mediante la atención plena, el yoga y el ayurvedaDe EverandLa curación de los chakras y el equilibrio energético: Mediante la atención plena, el yoga y el ayurvedaCalificación: 5 de 5 estrellas5/5 (9)
- Muchas Vidas, Muchos Sabios (Many Lives, Many Masters): (Many Lives, Many Masters)De EverandMuchas Vidas, Muchos Sabios (Many Lives, Many Masters): (Many Lives, Many Masters)Calificación: 4 de 5 estrellas4/5 (475)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Cómo Entender y Descifrar a los Hombres: Descubre Cómo Leer la Mente de los Hombres y Obtén la Relación que Siempre has QueridoDe EverandCómo Entender y Descifrar a los Hombres: Descubre Cómo Leer la Mente de los Hombres y Obtén la Relación que Siempre has QueridoCalificación: 4.5 de 5 estrellas4.5/5 (17)
- El cerebro del niño explicado a los padresDe EverandEl cerebro del niño explicado a los padresCalificación: 4.5 de 5 estrellas4.5/5 (147)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Mega Piernas: Entrenamiento Científico de PiernasDe EverandMega Piernas: Entrenamiento Científico de PiernasCalificación: 4 de 5 estrellas4/5 (4)