0% encontró este documento útil (0 votos)
144 vistas25 páginasCap. 15 Aromáticos
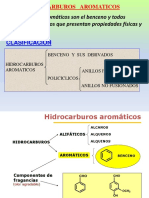
El documento describe la historia del descubrimiento del benceno y su estructura aromática. Explica que el benceno tiene una configuración electrónica inusual que lo hace más estable que otros compuestos insaturados. También discute la regla de Hückel para la aromaticidad y proporciona ejemplos de compuestos aromáticos como la piridina y el pirrol.
Cargado por
César GastélumDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PPTX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
144 vistas25 páginasCap. 15 Aromáticos
El documento describe la historia del descubrimiento del benceno y su estructura aromática. Explica que el benceno tiene una configuración electrónica inusual que lo hace más estable que otros compuestos insaturados. También discute la regla de Hückel para la aromaticidad y proporciona ejemplos de compuestos aromáticos como la piridina y el pirrol.
Cargado por
César GastélumDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PPTX, PDF, TXT o lee en línea desde Scribd