Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Factor V Leiden y Resistencia A La P
Cargado por
Maria Almeida0 calificaciones0% encontró este documento útil (0 votos)
13 vistas26 páginasTítulo original
Factor V Leiden y resistencia a la p
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
13 vistas26 páginasFactor V Leiden y Resistencia A La P
Cargado por
Maria AlmeidaCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 26
Factor V Leiden y resistencia a la proteína
C activada
Autor:
Kenneth A Bauer, MD
Editor de sección:
Lawrence LK Leung, MD
Editor adjunto:
Jennifer S Tirnauer, MD
Divulgaciones del colaborador
Todos los temas se actualizan a medida que se dispone de nueva evidencia
y se completa nuestro proceso de revisión por pares .
Revisión de literatura vigente hasta: diciembre de 2020. | Última
actualización de este tema: 22 de noviembre de 2019.
INTRODUCCIÓN El factor V Leiden (FVL) resulta de una
mutación puntual en el gen F5 , que codifica la proteína del
factor V en la cascada de la coagulación. La FVL hace que el
factor V (tanto la forma activada como la inactiva) sea insensible
a las acciones de la proteína C activada (aPC), un anticoagulante
natural. Como resultado, las personas que portan la variante FVL
tienen un mayor riesgo de tromboembolismo venoso (TEV). Sin
embargo, la FVL es extremadamente común en la población y
muchas personas con la variante nunca tendrán una TEV. Por
estas razones, las ramificaciones de portar FVL pueden presentar
decisiones de manejo desafiantes (tanto con respecto a la
prevención primaria como a la prevención de TEV recurrente).
Esta revisión de tema analiza el diagnóstico de FVL y el
tratamiento de las personas que portan esta variante.
Las revisiones de temas separados discuten otras trombofilias y el
papel de la detección de trombofilia en varias poblaciones:
Otras trombofilias:
●Variante de protrombina G20210A - (Ver "Protrombina
G20210A" ).
●Deficiencia de proteína C - (Ver "Deficiencia de proteína C" ).
●Deficiencia de proteína S - (Ver "Deficiencia de proteína S" ).
●Deficiencia de AT - (Ver "Deficiencia de antitrombina" ).
●APS : (consulte "Diagnóstico del síndrome antifosfolípido" ).
●HPN - (Ver "Manifestaciones clínicas y diagnóstico de
hemoglobinuria paroxística nocturna" ).
●MPN : (consulte "Descripción general de las neoplasias
mieloproliferativas" ).
Papel del cribado:
●Niños : (consulte "Pruebas de trombofilia en niños y
adolescentes" ).
●Personas asintomáticas : (consulte "Detección de trombofilia
hereditaria en adultos asintomáticos" ).
●Embarazo : (consulte "Trombofilias hereditarias en el
embarazo", sección sobre "Selección de pacientes para el
cribado" ).
●Individuos con TEV - (consulte "Evaluación de pacientes
adultos con tromboembolismo venoso establecido para
factores de riesgo adquiridos y heredados" ).
●Accidente cerebrovascular isquémico : (consulte "Accidente
cerebrovascular isquémico en niños: presentación clínica,
evaluación y diagnóstico", sección sobre "Evaluación
hipercoagulable" y "Descripción general de la evaluación del
accidente cerebrovascular", sección sobre "Análisis de
sangre" ).
FISIOLOGÍA
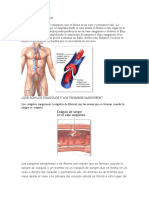
Biología del factor V y la proteína C : el factor V, codificado por
el gen F5 , es un factor de coagulación procoagulante que
amplifica la producción de trombina, la enzima central que
convierte el fibrinógeno en fibrina, lo que conduce a la formación
de coágulos (Figura 1 y Figura 2). El factor V se sintetiza como
un factor inactivo que circula en el plasma. Una pequeña cantidad
de trombina en el sitio de una herida activa el factor V mediante
proteólisis limitada. Este factor V activado (factor Va) luego sirve
como cofactor en el complejo de protrombinasa, que escinde la
protrombina para generar más trombina, en un circuito de
retroalimentación positiva. (Consulte "Descripción general de la
hemostasia", sección sobre "Complejos multicomponente" ).
La trombina (unida a la trombomodulina en la superficie de las
células endoteliales) también ralentiza su propia producción al
crear un circuito de retroalimentación negativa separado. Para
ello, convierte la proteína C en proteína C activada (aPC), una
proteasa que actúa como un potente anticoagulante natural. La
aPC degrada el factor Va activado (y el factor VIIIa activado,
corriente arriba en la cascada de coagulación), reduciendo
finalmente la producción de trombina. aPC utiliza la proteína S
como cofactor en todas sus reacciones de
escisión. (Consulte "Descripción general de la hemostasia",
sección sobre "Proteína C activada y proteína S" ).
El factor V Leiden ( FVL ) resulta de una mutación puntual única
en el gen del factor V (guanina a adenina en el nucleótido 1691),
que conduce a un solo cambio de aminoácido (reemplazo de
arginina por glutamina en el aminoácido 506); de ahí los nombres
factor V R506Q y factor V Arg506Gln. Esto suprime el sitio de
escisión de Arg506 para aPC en factor V y factor Va. Este defecto
se denominó inicialmente "resistencia a aPC" porque la actividad
anticoagulante de aPC se redujo en un ensayo de tiempo de
tromboplastina parcial activado modificado (aPTT).
La escisión del factor V y el factor Va mediada por aPC tiene
diferentes consecuencias para la función de las proteínas. La
escisión por aPC del factor Va procoagulante provoca la
degradación del factor Va, mientras que la escisión por aPC del
factor V anticoagulante mejora la función del factor V. FVL es
insensible a estas dos escisiones porque carece del sitio de
escisión Arg506. Por lo tanto, la mutación FVL aumenta
simultáneamente la coagulación al crear dos cambios distintos en
la cascada de la coagulación:
●Función procoagulante mejorada del factor Va : aPC destruye
el factor Va en una serie de escisiones secuenciales. La
primera escisión en Arg506 expone sitios de escisión
adicionales en Arg306 y Arg679. Dado
que las FVL activadas no se pueden escindir en Arg506,
estos otros sitios permanecen enterrados en la proteína, lo que
resulta en una degradación 20 veces más lenta de las FVL
activadas. La presencia prolongada de FVL activada da como
resultado una generación continua de trombina.
●La reducción del papel anticoagulante del factor V - la
escisión de aPC del factor V inactivado en la posición 506
aumenta su capacidad para actuar como cofactor en la
degradación de los factores Va y VIIIa. Dado que
la FVL inactivada no puede escindirse en Arg506, es menos
eficaz como cofactor de aPC, lo que resulta en una
degradación reducida de los factores Va y VIIIa [ 1-3 ].
La escisión reducida de FVL activada por aPC y la escisión
deficiente de FVL inactivada por aPC parecen contribuir
igualmente al fenómeno de resistencia a la aPC asociada a FVL y
al consiguiente estado de hipercoagulabilidad [ 2,4 ]. La variante
FVL representa más que la gran mayoría de los casos de
resistencia hereditaria a PCa, y el resto de los casos de
resistencia a PCa se deben a otros factores heredados y
adquiridos. (Consulte 'Otras causas de resistencia a PCa'
a continuación).
La función dual del factor V también ayuda a explicar por qué el
riesgo de trombosis es mayor en pacientes homocigotos o
pseudohomocigotos para FVL (es decir, heterocigotos compuestos
para FVL y deficiencia de factor V) [ 2,5 ]. Por el contrario, el
plasma de heterocigotos de FVL contiene FVL y factor V normal.
El factor V normal tiene una actividad de cofactor de PC para la
inactivación del factor VIIIa, lo que proporciona cierta protección
contra la trombosis. (Consulte 'Genotipos de FVL'
a continuación).
Genotipos de FVL : el FVL es una enfermedad autosómica
dominante y el 99 por ciento de los individuos con FVL son
heterocigotos para la variante. El otro 1 por ciento son
homocigotos o los casos extremadamente raros con
pseudohomocigosis para FVL debido a FVL heterocigoto más una
variante en el otro alelo F5 que causa deficiencia de factor V, lo
que resulta en FVL como la única forma disponible de factor V en
su circulación [ 6-9 ]. Estos pacientes parecen ser más
propensos a la trombosis que los parientes heterocigotos con FVL
solo, con un fenotipo clínico similar o más grave que el de los
homocigotos de FVL [ 5,10,11]. El plasma de estos individuos
manifiesta una resistencia severa a PCa en los ensayos de
aPTT. Los individuos homocigotos o pseudohomocigotos de FVL
están representados clínicamente de manera desproporcionada
debido a un mayor riesgo trombótico. (Consulte 'Manifestaciones
clínicas' a continuación).
Otras variantes genéticas : solo aproximadamente el 5 por
ciento de los heterocigotos de FVL experimentarán
tromboembolismo venoso (TEV) durante su vida. Las razones del
fenotipo altamente variable no se comprenden
completamente; puede explicarse en parte por la coexistencia de
otras trombofilias hereditarias u otros modificadores genéticos
aún no aclarados que pueden aumentar el riesgo de trombosis.
●Otras trombofilias hereditarias : la presencia de una segunda
variante trombofílica puede aumentar el riesgo de TEV
asociado con FVL.
Ha habido informes de presentaciones tempranas de trombosis
en pacientes con deficiencia de antitrombina (AT) y FVL
[ 12 ]. Como los genes de AT y factor V se encuentran ambos
en el brazo largo del cromosoma 1, los defectos en familias en
las que ambas variantes están en el mismo cromosoma casi
siempre ocurrirán juntos.
Existe evidencia de una mayor prevalencia de deficiencias de
proteína S y proteína C en individuos con FVL que han tenido
un TEV en comparación con individuos con FVL que no han
tenido un TEV. Como ejemplo, en una serie de 18 familias
trombofílicas con deficiencia de proteína S, la FVL
concomitante estaba presente en el 39% de los individuos
afectados [ 13 ].
No es raro que un individuo tenga tanto la variante de
protrombina G20210A como FVL. Si bien los datos más
antiguos indicaron que la combinación aumenta aún más el
riesgo de TEV, sorprendentemente un gran metanálisis no
encontró que este fuera el caso [ 14 ]. (Consulte 'Riesgo de
TEV inicial' a continuación).
●Variantes de genes distintos de los factores de coagulación :
es posible que otras variantes de genes no aumenten
apreciablemente el riesgo de trombofilia por sí solas, pero
pueden aumentar el riesgo en el contexto de FVL.
•Los grupos sanguíneos no O (p. Ej., A, B o AB) se asocian
con niveles más altos del factor VIII procoagulante que el
grupo sanguíneo O [ 15-17 ]. Los grupos sanguíneos no O
parecen incrementar el riesgo de TEV en heterocigotos y
homocigotos para FVL de dos a cuatro veces
[ 15,18,19 ]. (Consulte "Biología y función normal del
factor von Willebrand", sección sobre "Biología del FvW" ).
•La proteína Z es una proteína dependiente de la vitamina K
que puede servir como cofactor para los factores activados
X y XI en la cascada de la coagulación. Las variantes en el
gen de la proteína Z pueden aumentar el riesgo de TEV en
personas con FVL. Sin embargo, no se detectó una
relación entre el nivel de proteína Z o su inhibidor (inhibidor
de proteasa dependiente de proteína Z) y la trombosis
venosa entre los individuos que participaron en el Estudio
de Trombofilia de Leiden [ 20 ]. (Consulte "La vitamina K
y la síntesis y función del ácido gamma-carboxiglutámico",
sección sobre 'Proteína Z' ).
●Haplotipos del factor V: los haplotipos del factor V, como el
haplotipo HR2, se encuentran con mayor frecuencia en
heterocigotos para FVL que tienen las proporciones más bajas
de resistencia a PCa [ 21-23 ]. La mayoría de los estudios, sin
embargo, no han encontrado ningún aumento o solo un
modesto aumento del riesgo tromboembólico asociado con el
haplotipo HR2 en ausencia de FVL [ 2,23-29 ].
Como se analiza a continuación, generalmente basamos las
decisiones de manejo en el fenotipo clínico del paciente y la
familia y generalmente no buscamos modificadores genéticos
o biológicos adicionales (p. Ej., Haplotipos del factor V, otras
variantes genéticas que causan resistencia a PCa, niveles de
actividad del factor VIII, proteína Z, o inhibidor de proteasa
dependiente de la proteína Z), aunque algunos expertos
prueban variantes trombofílicas adicionales en algunos
entornos. (Consulte 'Gestión' a continuación).
Recomendamos no obtener niveles de homocisteína ni pruebas
genéticas para variantes de MTHFR (C677T o
A1298C). (Consulte "Descripción general de la homocisteína" ).
Otras causas de resistencia a PCa : en casos raros, las
variantes del factor V distintas de FVL producen el fenotipo de
resistencia a PCa. Ejemplos incluyen:
●Factor V Cambridge (reemplazo de Arg306 con treonina)
[ 30 ]
●Factor V Nara (reemplazo de Trp1920 con arginina) [ 31 ]
●Factor V Liverpool (reemplazo de Ile359 con treonina)
[ 32,33 ]
●Factor V Bonn (sustitución de Ala512 por valina) [ 34 ]
El reemplazo de Arg306 por glicina (en chino de Hong Kong) tiene
un significado clínico incierto, ya que la variante está presente
con la misma frecuencia en donantes de sangre chinos sanos que
en pacientes con trombosis (algo menos del 5% en ambos grupos)
[ 35,36 ] .
La resistencia a PCa se define mediante un ensayo de coagulación
funcional, y la definición de resistencia a PCa depende del ensayo
utilizado (consulte 'Ensayos de resistencia funcional a PC'
a continuación). Además de la variante FVL, se han identificado
una serie de condiciones que perjudican la actividad de aPC in
vitro usando ensayos de primera generación.
●Deficiencia de proteína S : la deficiencia del cofactor de
proteína C, proteína S, puede causar la aparición de
resistencia a PCa en algunos ensayos funcionales de
resistencia a PCa; no debe considerarse una causa
independiente de resistencia a PC. (Consulte "Deficiencia de
proteína S", sección sobre "Causas de la proteína S
reducida" ).
●Se ha descrito un aumento de la resistencia al factor VIII -
aPC en pacientes con niveles elevados de factor VIII de
coagulación (Figura 1). Los niveles circulantes de factor VIII
pueden aumentar en los trastornos inflamatorios y el
embarazo. (Consulte "Descripción general de las causas de la
trombosis venosa", sección sobre 'Factor VIII' ).
●Estrógenos : el aumento de los niveles de estrógeno puede
causar resistencia al efecto anticoagulante del aPC a través
de múltiples efectos sobre los factores de coagulación,
incluidos la reducción de la proteína S, el aumento de la
protrombina, el aumento de los factores VIII, IX y X, y otros
[ 37 ].
•Anticonceptivos orales : el uso de anticonceptivos orales
(AO) que contienen estrógenos, especialmente los de
tercera generación, se ha asociado con una resistencia
adquirida a la PCa, así como con un mayor riesgo
trombótico. El riesgo de trombosis en heterocigotos de
FVL que toman anticonceptivos orales es de 1 en 345,
significativamente mayor que el de las personas con FVL u
OC solo (tabla 1). (Consulte "Anticoncepción combinada
de estrógeno y progestina: efectos secundarios y
problemas de salud", sección sobre "Tromboembolia
venosa" ).
•Terapia hormonal sustitutiva: la terapia hormonal
sustitutiva se ha asociado con resistencia adquirida a PCa
[ 38 ]. La razón de riesgo es aproximadamente 2.
(Ver "Terapia hormonal menopáusica y riesgo
cardiovascular", sección sobre "Tromboembolismo
venoso" y "Descripción general de las causas de la
trombosis venosa", sección sobre "Anticonceptivos orales
y transdérmicos" ).
•Embarazo : el embarazo está asociado con un estado
protrombótico por muchas razones, algunas de las cuales
están asociadas con la resistencia al
PCa. (Consulte "Trombosis venosa profunda en el
embarazo: epidemiología, patogenia y diagnóstico",
sección sobre 'Factores de riesgo' ).
●Anticuerpos antifosfolípidos: los anticuerpos antifosfolípidos
causan un estado de hipercoagulabilidad a través de varios
mecanismos que incluyen la resistencia a aPC.
●Cáncer : una variedad de tumores sólidos y neoplasias
malignas hematológicas producen variaciones en los niveles
de factores de coagulación que pueden conferir resistencia a
PCa [ 37 ]. La etiología del estado de hipercoagulabilidad en
el cáncer se analiza por separado. (Consulte "Patogenia del
estado de hipercoagulabilidad asociado con la
malignidad" y "Descripción general de las causas de la
trombosis venosa", sección sobre "Malignidad" ).
●Otros : los factores adicionales asociados con la resistencia
a PCa incluyen una variedad de fenómenos como proteinuria,
índice de masa corporal elevado y tabaquismo [ 39-41 ]. Los
mecanismos son multifactoriales a través de efectos sobre
varios factores de coagulación. Se han descrito pacientes
adicionales con resistencia a PCa de causa desconocida
[ 42,43 ].
EPIDEMIOLOGÍA La heterocigosidad para FVL es la
trombofilia hereditaria más común en individuos caucásicos con
tromboembolismo venoso (TEV) (Tabla 2):
●En 121 hombres con TEV en el Physicians 'Health Study,
aproximadamente el 12% eran heterocigotos para FVL
[ 44 ]. En 31 hombres mayores de 60 años con TEV, la FVL
estuvo presente en 8 (26 por ciento).
●En 301 individuos con TEV en el estudio de trombofilia de
Leiden, se encontró resistencia a PCa (un sustituto de FVL) en
64 (21 por ciento) [ 45 ]. En una serie posterior del mismo
grupo que incluyó a 471 individuos con TEV, 85 (18%) eran
heterocigotos para FVL y 7 (aproximadamente el 1%) eran
homocigotos para FVL [ 46 ].
En la población general sin antecedentes personales de TEV, un
estudio en el que participaron 1690 personas no relacionadas de
Europa encontró una prevalencia de FVL de aproximadamente el
4% y un estudio en el que participaron 356 personas de Canadá
encontró una incidencia de aproximadamente el 5% [ 47,48 ]. En
una serie de 4047 hombres y mujeres que participaron en el
Physicians 'Health Study y el Women's Health Study (ambos en los
Estados Unidos), se encontraron las siguientes frecuencias de
heterocigosidad de FVL [ 49 ]:
●Caucásicos - 5.3 por ciento
●Hispanoamericanos: 2,2 por ciento
●Nativos americanos - 1.2 por ciento
●Afroamericanos: 1,2 por ciento
●Americanos de origen asiático: 0,45 por ciento
Se ha informado de una mayor prevalencia de FVL (12 a 14 por
ciento) en poblaciones de partes de Grecia, Suecia y Líbano [ 50-
52 ].
No se ha informado FVL en ciertas poblaciones de negros
africanos, chinos o japoneses. Sin embargo, en muchas regiones
del mundo puede que no sea posible inferir la ascendencia del
color de piel o del país de origen.
Como se indica a continuación, a pesar de que FVL es la
trombofilia más común en individuos con TEV, el riesgo de TEV
conferido por FVL es menor que el asociado con una deficiencia
hereditaria de proteína C, proteína S o antitrombina
(AT). (Consulte 'Riesgo de TEV inicial' a continuación).
MANIFESTACIONES CLÍNICAS
Descripción general : la principal manifestación clínica de
heterocigosidad para FVL es el tromboembolismo venoso
(TEV). Sin embargo, solo un pequeño porcentaje de personas con
FVL desarrollará TEV durante su vida (riesgo aproximado, 5% para
heterocigotos de FVL en la población general y hasta 20% en
familias trombofílicas). Por lo tanto, el hallazgo más común en
individuos con heterocigosidad para FVL es una anomalía de
laboratorio solamente. (Ver 'Tromboembolia venosa'
a continuación).
Las FVL pueden estar implicadas en la tromboembolia arterial,
aunque los datos son mixtos y es probable que el efecto, si está
presente, sea pequeño en comparación con otros factores de
riesgo. (Consulte "Tromboembolismo arterial" a continuación
y "Infarto de miocardio sin aterosclerosis coronaria obstructiva",
sección sobre "Causas" y "Accidente cerebrovascular isquémico
en niños y adultos jóvenes: epidemiología, etiología y factores de
riesgo", sección sobre "Etiologías y factores de riesgo". .)
Algunos datos sugieren que FVL puede desempeñar un papel en
algunos casos de pérdida tardía del embarazo recurrente
inexplicable, presumiblemente debido a la trombosis de los vasos
placentarios [ 53-56 ]. (Consulte "Pérdida fetal y complicaciones
obstétricas" a continuación y "Trombofilias hereditarias en el
embarazo" ).
A pesar del aumento del riesgo de TEV, no hay pruebas de que la
heterocigosidad de la FVL aumente la mortalidad global [ 57,58 ].
Tromboembolismo venoso - El tromboembolismo venoso (TEV)
es la principal manifestación clínica de FVL. Sin embargo, es
importante tener en cuenta que solo aproximadamente el 5 por
ciento de los heterocigotos FVL experimentarán TEV durante su
vida.
Riesgo de TEV inicial : varios estudios han demostrado un
mayor riesgo de TEV en personas con FVL (Tabla 2) [ 44-46,59-
62 ]. Como se señaló anteriormente, el riesgo de TEV puede
aumentar aún más con la edad avanzada, la homocigosidad de
FVL, la herencia conjunta de otra trombofilia con FVL o factores
adquiridos como el embarazo o los anticonceptivos que contienen
estrógenos. (Consulte 'Fisiología' más arriba).
La magnitud del riesgo se ilustra con los siguientes estudios:
●Un metanálisis de 2013 que incluyó 11.239 casos de TEV con
21.521 controles encontró que el riesgo de TEV aumentaba con
heterocigosidad y homocigosidad para FVL (odds ratios [OR]
4,2; IC del 95%: 3,4-5,32 y 11,5; IC del 95%: 6,8-19,3,
respectivamente ) [ 14 ]. Cabe señalar que la OR de 11,5 es
considerablemente más baja para las personas con FVL
homocigótica que las estimaciones anteriores, como una OR
de 79,4 (IC del 95%: 22-289) derivada de un pequeño número de
casos en el Estudio de trombofilia de Leiden [ 46 ] .
●Un metaanálisis de 2012 en el que participaron más de 11.000
personas encontró que los pacientes con FVL tenían más
probabilidades de presentar trombosis venosa profunda (TVP)
que embolia pulmonar (EP), con TVP en el 19% frente a EP en
el 9% [ 63 ].
●El estudio de trombofilia de Leiden comparó la magnitud del
riesgo con FVL heterocigóticas y homocigotas, con y sin
anticonceptivos que contienen estrógenos, y encontró un alto
grado de sinergia, donde la homocigosidad para FVL confiere
el mayor riesgo, seguida de heterocigosidad para FVL más el
uso de anticonceptivos hormonales orales (tabla 1) [ 46,64 ].
●En un estudio en el que participaron 308 personas de 50
familias suecas con FVL, se observó TEV en el 40% de los
homocigotos de FVL, el 20% de los heterocigotos y el 8% de
los individuos que no heredaron la variante [ 42 ].
No es raro que un individuo tenga tanto protrombina G20210A
como FVL (es decir, doble heterocigosidad). En el metanálisis de
2013 mencionado anteriormente, el riesgo de TEV en
heterocigotos para la protrombina G20210A sola (sin FVL) fue 2,79
(IC del 95%: 2,25-3,46) [ 46 ]. Varios estudios indicaron que la
combinación de FVL más protrombina G20210A aumenta aún más
el riesgo de TEV. En un análisis combinado de ocho estudios de
casos y controles en los que participaron 2310 individuos con TEV
y 3204 controles, 51 de los casos (2%) fueron doblemente
heterocigotos tanto para FVL como para protrombina G20210A
(ninguno de los controles fue doblemente heterocigoto)
[ 65 ]. Los quirófanos para TEV fueron los siguientes:
•Protrombina G20210A - 3.8 (95% CI 3.0-4.9)
•FVL - 4,9 (IC del 95%: 4,1-5,9)
•Ambas variantes: 20,0 (IC del 95%: 11,1-36,1)
Otros estudios también han documentado un aumento de la
incidencia de la combinación de protrombina G20201A y FVL, y de
un mayor riesgo trombótico asociado con la combinación
[ 66,67 ].
Sin embargo, un metaanálisis publicado en 2013 encontró que la
OR para individuos con heterocigosidad compuesta para FVL y
protrombina G20210A fue 3,42 (IC del 95%: 1,64-7,13), que es
considerablemente más baja de lo que se pensaba anteriormente
[ 14 ]. Este resultado es sorprendente y la razón de esta
diferencia no está clara; Cabe señalar que el IC es mayor que para
los defectos genéticos individuales.
Riesgo de TEV recurrente - Numerosos estudios y revisiones
sistemáticas han evaluado el riesgo de recurrencia de TEV en
personas con FVL y un episodio de TEV previo [ 62,66,68-78 ]. En
una revisión sistemática de 2006 que evaluó el riesgo de
recurrencia de TEV en individuos con FVL en comparación con
aquellos que carecen de la variante, solo hubo un aumento
modesto en el riesgo de recurrencia debido a FVL (OR 1.4; IC 95%
1.1-1.8) [ 68 ] . Por lo tanto, se acepta generalmente que la
heterocigosidad para FVL no confiere un mayor riesgo de TEV
recurrente entre los pacientes con una primera TEV no provocada,
y la presencia de FVL generalmente no altera la toma de
decisiones con respecto a la duración de la
anticoagulación. (Consulte 'Pacientes con TEV' a continuación
y"Descripción general del tratamiento de la trombosis venosa
profunda de las extremidades inferiores (TVP)" .)
En un estudio en el que participaron 62 pacientes con FVL y TEV a
los que se les suspendió el anticoagulante, la mediana del tiempo
hasta la recurrencia fue de nueve años [ 79 ]. El intervalo antes
de la recurrencia fue de 3,5 años entre los que tenían un TEV no
provocado. Un modelo de análisis de decisiones sobre el valor de
la anticoagulación prolongada con un antagonista de la vitamina K
en pacientes con FVL que tuvieron una primera TVP concluyó que
el número de hemorragias inducidas mayores excedería el número
de embolias pulmonares clínicas que se podrían prevenir, y que la
extensión de la anticoagulación más allá de un año no produciría
un beneficio clínico [ 80 ].
Lechos vasculares afectados : el sitio más común de TEV en
personas con FVL es TVP y EP. Algunos individuos presentan EP
aislada (sin evidencia de TVP). Los individuos con FVL también
pueden desarrollar trombosis en las venas cerebrales,
mesentéricas o porta [ 81-83 ].
Los datos sobre algunos de estos otros sitios de tromboembolismo
incluyen los siguientes:
●Superficial trombosis venosa - Trombosis que implica las
venas superficiales de las extremidades inferiores (SVT) puede
ocurrir en individuos con FVL, incluso en ausencia de otros
factores de riesgo para SVT tales como varices, malignidad, o
enfermedad autoinmune [ 84-86 ]. (Ver "Flebitis y trombosis
de las venas superficiales de las extremidades inferiores" ).
●EP aislada: la EP aislada (es decir, sin evidencia de TVP)
puede ocurrir en personas con FVL, pero esta es una
presentación menos común de TEV en personas con FVL en
comparación con la población general, un fenómeno que se ha
denominado "FVL paradoja "[ 87-92 ]. Se desconoce la
explicación de esta observación, pero puede reflejar una
frecuencia más baja de TVP que es probable que se embolice,
como las que afectan los grandes vasos ileofemorales
proximales. En una serie de 20 individuos homocigóticos para
FVL, la prevalencia de disnea grave fue del 32%, en
comparación con el 6% en los controles, lo que sugiere un
posible aumento de la frecuencia de EP no diagnosticada en
estos individuos [ 93 ]. (Consulte "Introducción a la embolia
pulmonar aguda en adultos" ).
●Trombosis de la vena cerebral: la trombosis de la vena
cerebral (TVC, incluida la trombosis del seno cerebral) puede
ocurrir en personas con FVL, especialmente en personas que
toman un anticonceptivo oral (AO) que contiene
estrógenos. En una serie que evaluó la presencia de
trombofilia hereditaria en 40 mujeres con TVC y 2248
controles, la probabilidad de TVC aumentó de tres a cuatro
veces en presencia de una trombofilia heredada, y de 30 veces
en aquellas con trombofilia más el uso de anticonceptivos
orales [ 94 ]. Otros estudios han hecho observaciones
similares, con FVL visto en aproximadamente el 10 al 20 por
ciento de las personas con TVC [ 95-
97 ]. (Consulte "Trombosis venosa cerebral: etiología,
características clínicas y diagnóstico" ).
●Trombosis de la vena porta o hepática : un metanálisis de
2014 de estudios que incluyeron a 516 pacientes con síndrome
de Budd-Chiari y 1342 controles encontró que la FVL se asoció
con un mayor riesgo de síndrome de Budd-Chiari (OR 6,3; IC del
95%: 4,2 a 9,4) [ 98 ].
Tromboembolismo arterial : una asociación entre FVL y
tromboembolismo arterial sigue siendo controvertida y es probable
que sea relativamente pequeña si está presente.
●Infarto de miocardio : en el Physicians 'Health Study, en el
que participaron casi 15.000 hombres aparentemente sanos, la
FVL fue igualmente prevalente en aquellos con infarto de
miocardio (IM) o accidente cerebrovascular como controles
[ 44 ]. Otros estudios pequeños (<1000 pacientes) tampoco
han encontrado una asociación [ 99-104 ]. Sin embargo, un
metanálisis de 2006 encontró un aumento modesto en el riesgo
de enfermedad de las arterias coronarias con FVL (riesgo
relativo [RR] 1,17; IC del 95%: 1,08-1,28) [ 105 ]. Otro
metanálisis que incluyó más de 66.000 casos de IM en
pacientes menores de 45 años y más de 91.000 controles
también encontró un mayor riesgo de IM con FVL (OR 1,66; IC
del 95%: 1,15-2,38) [ 106 ]. (Ver "Enfermedad coronaria e
infarto de miocardio en hombres y mujeres jóvenes" ).
●Accidente cerebrovascular : en series pequeñas de pacientes
con accidente cerebrovascular o ataque isquémico transitorio,
la FVL se ha asociado con un mayor riesgo, especialmente en
individuos más jóvenes, mujeres y fumadores [ 104,107-
109 ]. (Ver "Accidente cerebrovascular isquémico en niños y
adultos jóvenes: epidemiología, etiología y factores de
riesgo" ).
Pérdida fetal y complicaciones obstétricas : la pérdida fetal
recurrente puede ocurrir en pacientes con FVL, aunque es
probable que la contribución de FVL a este riesgo sea modesta en
comparación con otros factores de riesgo. Este tema se discute
por separado. (Consulte "Trombofilias hereditarias en el
embarazo", sección sobre "Riesgo de resultados adversos del
embarazo" ).
DIAGNÓSTICO
Indicaciones para las pruebas : se puede sospechar FVL en un
miembro de una familia trombofílica o en un individuo con
tromboembolismo venoso (TEV), especialmente TEV a una edad
temprana (p. Ej., <50 años), TEV en una ubicación inusual (p. Ej.,
Vena porta , vena cerebral) o TEV recurrente.
Por el contrario, generalmente no realizamos pruebas en personas
con un primer episodio provocado de TEV (p. Ej., Debido a una
inmovilidad prolongada) o una primera TEV en un individuo ≥ 50
años de edad en ausencia de antecedentes familiares de
TEV. Tampoco realizamos pruebas de FVL en personas con
afecciones no relacionadas con TEV para las que se ha propuesto
una asociación con FVL, como aquellas con osteonecrosis o
enfermedad de Legg-Calvé-Perthes, a menos que también tengan
antecedentes personales o familiares importantes de TEV. Esto
se debe a que el hallazgo de que el individuo porta la variante FVL
no alteraría el manejo, que se basaría en el historial de TEV.
Las indicaciones para la prueba de FVL (y otras trombofilias
hereditarias) en mujeres embarazadas se discuten por
separado. (Consulte "Trombofilias hereditarias en el embarazo",
sección sobre "Selección de pacientes para el cribado" ).
Con el uso cada vez mayor de pruebas de secuenciación genómica
(incluidas las pruebas directas al consumidor), es posible que se
identifique un número cada vez mayor de heterocigotos de FVL sin
antecedentes familiares ni antecedentes personales de TEV. No
está claro si los individuos diagnosticados con FVL por cribado
poblacional aleatorio o secuenciación genómica de individuos
sanos sin sospecha clínica de trombofilia deben tratarse de
manera diferente a la población general. (Consulte 'Personas
asintomáticas' a continuación).
Pruebas de diagnóstico
Elección entre prueba genética o ensayo funcional : la FVL
puede detectarse mediante una prueba genética (prueba de ADN)
o una prueba de coagulación funcional para determinar la
resistencia a PCa utilizando un ensayo de resistencia a PC de
"segunda generación". Cualquiera de estos enfoques
generalmente proporcionará un diagnóstico preciso de FVL, y la
elección de la prueba de diagnóstico puede basarse en el costo y
la disponibilidad institucional.
●Para las personas con antecedentes familiares de FVL que
requieren pruebas, las pruebas genéticas son preferibles
porque brindan evidencia definitiva de la variante.
●Para las personas con síndrome antifosfolípido o aquellas que
requieren pruebas mientras reciben un anticoagulante que
podría interferir con los resultados (p. Ej., Inhibidor directo de
la trombina, inhibidor directo del factor Xa), las pruebas
genéticas evitarán estas posibles fuentes de interferencia en
las pruebas.
●Para las personas con antecedentes familiares de trombofilia
para quienes aún no se ha identificado un defecto genético, es
apropiado hacer pruebas a los miembros clínicamente
afectados en primer lugar, para identificar el defecto o
defectos familiares, seguido de pruebas de los miembros de la
familia no afectados (si clínicamente indicado) para el defecto
familiar específico.
●Para las personas que tienen un ensayo funcional positivo
para la resistencia a PCa, se deben realizar pruebas genéticas
para confirmar el diagnóstico, permitir el cribado familiar si es
apropiado y determinar si el paciente es homocigoto o
heterocigoto.
Un resultado negativo de las pruebas genéticas o de un ensayo
funcional de segunda o tercera generación es una buena evidencia
de que el individuo no tiene FVL [ 110 ]. Sin embargo, pueden
ocurrir errores de prueba con cualquier tipo de prueba, y puede
haber casos en los que sea apropiado repetir la prueba usando la
otra plataforma, como individuos con antecedentes personales o
familiares de trombosis muy positivos.
Pruebas genéticas : las FVL se pueden detectar directamente
analizando el ADN genómico de las células nucleadas (p. Ej., De
sangre periférica). Dado que solo está involucrada una variante
genética, esta prueba es sencilla y relativamente económica de
realizar.
Los métodos de reacción en cadena de la polimerasa (PCR) para
detectar la variante de FVL se han implementado en la mayoría de
los laboratorios y han reemplazado a los ensayos anteriores que
aprovecharon la secuencia de FVL que eliminó un sitio de enzima
de restricción. En estos ensayos anteriores, el ADN de los
individuos sin la variante se cortaba con una enzima de
restricción, mientras que el ADN con la variante de FVL no se
cortaba, lo que generaba un patrón de bandas diferente en un gel
de ADN [ 111 ].
Las pruebas genéticas no se ven afectadas por los
anticoagulantes y otros fármacos porque detectan directamente la
variante FVL. Sin embargo, las pruebas genéticas para FVL no
detectarán otras causas hereditarias de resistencia a PCa, que
son raras, o causas adquiridas de resistencia a
PCa. (Consulte 'Otras causas de resistencia a PCa' más arriba).
Ensayos funcionales resistencia a la PCA - El activado de
tiempo inicial de tromboplastina parcial (APTT) Los ensayos
usados para detectar resistencia a la PCA utilizado inalterado
( "limpio") de plasma ( "ensayos de primera generación"); algunas
versiones del ensayo no eran sensibles ni específicas para
FVL. Las modificaciones en las que el plasma diluido del paciente
se mezcla con plasma deficiente en factor V han dado lugar a
ensayos funcionales de "segunda generación" que se
correlacionan extremadamente bien con la presencia de FVL
[ 112,113 ]. Si se utiliza un ensayo funcional para analizar FVL,
casi siempre se trata de un ensayo de "segunda
generación". Estas pruebas generalmente cuestan menos que las
pruebas genéticas, aunque el costo de las pruebas genéticas
continúa disminuyendo.
En casos raros, los ensayos funcionales para la resistencia a PCa
pueden dar resultados engañosos. Por ejemplo, la presencia de un
anticoagulante lúpico puede provocar resultados falsamente
anormales en algunos ensayos, y la terapia con un inhibidor
directo de la trombina ( argatroban , dabigatrán ) o un inhibidor
oral del factor Xa (p. Ej., Apixabán , edoxabán , rivaroxabán )
puede producir resultados falsamente normales. [ 114 ].
DIAGNÓSTICO DIFERENCIAL Los diagnósticos
diferenciales de los factores de riesgo de tromboembolismo
venoso y las causas de la pérdida del embarazo se presentan por
separado. (Consulte "Evaluación de pacientes adultos con
tromboembolismo venoso establecido para factores de riesgo
adquiridos y hereditarios" y "Trombofilias hereditarias durante el
embarazo" ).
PRUEBAS POST-DIAGNÓSTICO Y PRUEBAS DE
FAMILIARES DE PRIMER GRADO Por lo general, no
realizamos pruebas adicionales de rutina en pacientes con FVL
que no han tenido un evento tromboembólico.
Para las personas con FVL que justifican la prueba de trombofilia
según su historial y presentación clínica con tromboembolismo
venoso (TEV), generalmente evaluamos las cinco trombofilias
hereditarias.
●FVL
●Protrombina G20210A
●Deficiencia de proteína C (PC)
●Deficiencia de proteína S (PS)
●Deficiencia de antitrombina (AT)
Los resultados para la deficiencia de PC, PS y AT pueden ser
inexactos en el contexto de la TEV aguda o el tratamiento
con warfarina y pueden posponerse hasta que el episodio agudo
se haya resuelto y el paciente ya no esté tomando warfarina
(Tabla 3).
Las pruebas de rutina de los familiares de primer grado de un
individuo con FVL son controvertidas y pueden no estar indicadas,
especialmente en casos en los que la información no alterará el
manejo. Antes de evaluar a los individuos para FVL, se deben
discutir con el paciente los problemas relacionados con las
pruebas, incluida una mayor probabilidad de que la variante esté
presente en familiares de primer grado en caso de una prueba
positiva. Las situaciones en las que las pruebas de familiares
pueden ser apropiadas incluyen:
●Familiares de primer grado de individuos afectados en
familias con FVL y un fuerte historial de trombofilia
incluyendo TEV en individuos <50 años de edad; personas con
TEV en una ubicación inusual, o personas con TEV grave que
pone en peligro la vida. (Consulte "Detección de trombofilia
hereditaria en adultos asintomáticos" ).
●Parientes femeninas de primer grado de personas con FVL que
están considerando el uso de un anticonceptivo que contiene
estrógenos. (Consulte "Anticoncepción: asesoramiento para
mujeres con trombofilias hereditarias" ).
●Hermanos de individuos que son homocigotos para FVL o
heterocigotos dobles para FVL y otra trombofilia
hereditaria. En estos casos, los padres y los hijos pueden
heredar solo un defecto genético, mientras que los hermanos
corren el riesgo de heredar dos variantes (una de cada padre).
ADMINISTRACIÓN
Pacientes con TEV : el tratamiento inicial de la tromboembolia
venosa (TEV) en individuos con FVL es el mismo que el de la
población general, con anticoagulación a menos que exista una
contraindicación (algoritmo 1).
La presencia de FVL no influye en la decisión de
utilizar warfarina o un anticoagulante oral directo (DOAC). Esta
elección se basa en una serie de factores que incluyen la
gravedad de la trombosis, la preferencia del paciente, la
adherencia al tratamiento y las posibles interacciones
farmacológicas y dietéticas. Es más probable que usemos un
DOAC para individuos con presentaciones típicas de TEV, y es más
probable que usemos warfarina para individuos con inquietudes
sobre la adherencia o aquellos que se beneficiarían de mantener
un índice internacional normalizado (INR) en el extremo superior
de la terapia. rango (p. ej., embolia pulmonar [EP] submasiva o
masiva con presentaciones clínicas graves como hipoxemia /
shock o trombosis venosa profunda [TVP] con carga de coágulo
proximal). (Ver"Anticoagulantes orales directos (ACOD) y
anticoagulantes de acción directa parenterales: dosificación y
efectos adversos", sección sobre 'Comparación con heparina y
warfarina' ).
La duración de la anticoagulación depende del riesgo de TEV
recurrente, que es similar en heterocigotos FVL al riesgo de
recurrencia de TEV en la población general (ver 'Riesgo de TEV
recurrente'encima). Al igual que en la población general, la
duración de la anticoagulación en estos individuos es una decisión
individualizada. Al igual que en la población general, es más
probable que aconsejemos la anticoagulación indefinida en
aquellos cuya TEV no es provocada, pone en peligro la vida, en un
sitio inusual como la vena mesentérica o porta, o en más de un
episodio de TEV. Para las personas con FVL heterocigoto y una
sola TEV provocada, generalmente no se requiere anticoagulación
indefinida después de un tratamiento inicial de tres a seis
meses. Los factores que se deben incorporar en la decisión sobre
la duración de la anticoagulación se analizan con más detalle por
separado. (Ver "Justificación e indicaciones de la
anticoagulación indefinida en pacientes con tromboembolismo
venoso" ).
La información adicional sobre los anticoagulantes y su
dosificación y seguimiento se presenta por
separado. (Ver "Tromboembolismo venoso: inicio de la
anticoagulación (primeros 10 días)" y "Tromboembolismo venoso:
anticoagulación después del tratamiento inicial" y "Heparina y
heparina de BPM: dosis y efectos adversos" .)
Las recomendaciones específicas para el sitio de la
tromboembolia también se presentan en revisiones de temas
separadas:
●Embolia pulmonar (EP) - (Ver "Tromboembolia venosa: Inicio
de la anticoagulación (primeros 10 días)" .)
●Trombosis venosa profunda (TVP) : (consulte "Descripción
general del tratamiento de la trombosis venosa profunda (TVP)
de las extremidades inferiores" ).
●Trombosis de la vena porta (TVP) : (consulte "Trombosis
aguda de la vena porta en adultos: manifestaciones clínicas,
diagnóstico y tratamiento" y "Trombosis crónica de la vena
porta en adultos: manifestaciones clínicas, diagnóstico y
tratamiento" ).
●Trombosis de la vena cerebral (TVC) : (consulte " Trombosis
de la vena cerebral: tratamiento y pronóstico" y " Trombosis
de la vena cerebral : etiología, características clínicas y
diagnóstico" ).
Individuos asintomáticos
Heterocigotos de FVL : es poco probable que la mayoría de las
personas que son heterocigotas para FVL y que no tienen
antecedentes personales de trombosis sepan que tienen un
defecto genético. Sin embargo, algunas personas pueden
someterse a pruebas sin darse cuenta o darse cuenta de su estado
de FVL a partir de la secuenciación del genoma o las pruebas
directas al consumidor.
Estos individuos suelen recibir un trato similar al de la población
general. No administramos anticoagulantes profilácticos ni
agentes antiplaquetarios a menos que exista una indicación
clínica, como una enfermedad médica aguda o una cirugía para la
que esté indicada la tromboprofilaxis de rutina. Sin embargo, a
diferencia de la población general, es más probable que usemos
anticoagulantes para ciertas cirugías (consulte "Cirugía"
a continuación); cuando la anticoncepción es apropiada,
recomendamos los métodos que no contienen estrógenos cuando
sea posible (por ejemplo, cuando estos métodos están disponibles)
(ver "Anticoncepción: asesoramiento para mujeres con
trombofilias hereditarias" ); y es más probable que
anticoagulemos durante el embarazo y el posparto si existen otros
factores de riesgo. (Consulte 'Problemas obstétricos'
a continuación).
Una pregunta común que surge es la prevención de TEV durante
los viajes en avión u otras situaciones con estar sentado durante
mucho tiempo. Generalmente sugerimos caminar y realizar
ejercicios para las piernas mientras está sentado. Las medias de
compresión pueden ser apropiadas para personas con edema de
piernas. No hay datos de alta calidad de que la aspirina o un
anticoagulante reduzcan el riesgo de TEV; sin embargo, no nos
oponemos a la administración de aspirina en dosis bajas siempre
que el individuo sepa que no está respaldada por pruebas de alta
calidad. (Ver "Prevención de la tromboembolia venosa en viajeros
adultos" ).
Tampoco realizamos pruebas de detección de otras trombofilias
hereditarias en estos individuos asintomáticos como una forma de
estimar su riesgo de TEV, porque no hay datos que respalden esta
práctica. (Ver "Detección de trombofilia hereditaria en adultos
asintomáticos", sección sobre "Argumentos en contra de la
detección" y "Detección de trombofilia hereditaria en adultos
asintomáticos", sección sobre "Argumentos a favor de la
detección" ).
En las siguientes secciones se describen los posibles entornos en
los que la anticoagulación puede ser
apropiada. (Consulte 'Homocigotos FVL' a continuación
y 'Cirugía' a continuación y 'Problemas obstétricos'
a continuación).
Además, las personas asintomáticas que son heterocigotas para
FVL pueden beneficiarse del asesoramiento sobre los siguientes
problemas:
●Conciencia de los signos y síntomas de TEV que requieren
atención médica inmediata. (Ver "Introducción a la embolia
pulmonar aguda en adultos", sección sobre "Presentación
clínica, evaluación y diagnóstico" ).
●Obtener un historial familiar completo de TEV, tanto para
aclarar el riesgo individual como para asesorar sobre la prueba
o no a los miembros de la familia. Se considera que las
personas con FVL y antecedentes familiares positivos de TEV
tienen un mayor riesgo personal de TEV que las identificadas
por el cribado de la población general. Para estas personas,
nos sentimos más decididos a evitar los anticonceptivos que
contienen estrógenos y limitar otras exposiciones que podrían
provocar TEV. (Consulte "Detección de trombofilia hereditaria
en adultos asintomáticos", sección sobre "Problemas
generales de detección" ).
Homocigotos de FVL : como se señaló anteriormente, los
individuos que son homocigotos o pseudohomocigotos para FVL,
así como aquellos que son heterocigotos para FVL y otra variante
trombofílica, tienen mayor riesgo de TEV que los heterocigotos de
FVL. No hay datos que demuestren un beneficio de la
anticoagulación a largo plazo en estos pacientes y, por lo general,
no los anticoagulamos en ausencia de TEV. Sin embargo, la
anticoagulación podría ser apropiada para un individuo
asintomático que valora especialmente la prevención de la
trombosis (p. Ej., Debido a una embolia pulmonar masiva no
provocada en un miembro de la familia).
Cirugía : las personas con FVL que se someten a cirugía
generalmente deben tratarse como un grupo de alto riesgo y
recibir anticoagulación profiláctica para reducir el riesgo de TEV
(p. Ej., Con heparina de bajo peso
molecular, fondaparinux o heparina no fraccionada ); esto es
especialmente cierto para pacientes con antecedentes personales
de TEV (algoritmo 1). Los homocigotos FVL sometidos a cirugía
deben tratarse como un grupo de mayor riesgo en el contexto
perioperatorio, incluso en ausencia de antecedentes personales
de trombosis. (Consulte "Prevención de la enfermedad
tromboembólica venosa en pacientes adultos con cirugía
no ortopédica ", sección "Evaluación del riesgo de
trombosis" y "Prevención de la tromboembolia venosa en
pacientes adultos con cirugía ortopédica", sección "Riesgo de
trombosis y hemorragia" y "Heparina y BPM heparina: posología y
efectos adversos " .)
Problemas obstétricos : los dos problemas principales que
surgen relacionados con el embarazo en una persona con FVL son
si se debe intervenir para reducir el riesgo de complicaciones del
embarazo (aborto espontáneo, preeclampsia) y si se debe
intervenir para reducir el riesgo de TEV. A pesar de la frecuencia
relativamente alta de FVL en la población general, no existen
ensayos aleatorizados u otra evidencia de alta calidad para guiar
el manejo de las mujeres con FVL antes, durante y después del
embarazo.
●Complicaciones del embarazo : la FVL no se asocia con un
mayor riesgo de fertilización in vitro (FIV) fallida. La
información sobre la pérdida temprana del embarazo es mixta,
pero si existe una asociación, es probable que sea modesta en
el mejor de los casos. Los enfoques para el tratamiento de las
personas con FVL que están preocupadas por posibles
complicaciones del embarazo o que han experimentado estas
complicaciones se presentan por
separado. (Ver "Trombofilias hereditarias en el embarazo",
sección sobre "Riesgo de resultado adverso del
embarazo" y "Pérdida recurrente del embarazo: evaluación",
sección sobre "Estado de hipercoagulabilidad" y "Pérdida
recurrente del embarazo: tratamiento", sección "Trombofilia" )
●Profilaxis de TEV : para la profilaxis de TEV, la
anticoagulación durante el embarazo y / o el posparto puede
ser apropiada, según los antecedentes personales y familiares
de TEV de la mujer, el método de parto y otros factores de
riesgo de TEV (tabla 4). (Ver "Trombofilias hereditarias en el
embarazo", sección sobre "Prevención de TEV" ).
La elección del anticoagulante, la dosis, el momento y los
problemas relacionados con el parto y la lactancia en mujeres que
reciben un anticoagulante se analizan por
separado. (Consulte "Uso de anticoagulantes durante el
embarazo y el posparto" ).
ENLACES DE LAS DIRECTRICES DE LA
SOCIEDAD Los enlaces a las directrices patrocinadas por
la sociedad y el gobierno de países y regiones seleccionados de
todo el mundo se proporcionan por separado. (Consulte "Enlaces
de pautas de la sociedad: Anticoagulación" ).
INFORMACION PARA PACIENTES UpToDate ofrece dos
tipos de materiales educativos para pacientes, "Conceptos
básicos" y "Más allá de los conceptos básicos". Las piezas de la
educación del paciente Basics están escritos en un lenguaje
sencillo, en el 5 ° a 6 ° grado nivel de lectura, y que responden a
las cuatro o cinco preguntas clave que un paciente pueda tener
sobre una condición dada. Estos artículos son los mejores para
pacientes que desean una descripción general y que prefieren
materiales breves y fáciles de leer. Más allá de lo básico, los
artículos educativos para el paciente son más largos, más
sofisticados y más detallados. Estos artículos están escritos en el
10 º a 12 º grado de lectura y son los mejores para los pacientes
que quieren información en profundidad y se sienten cómodos con
la jerga médica.
Aquí están los artículos de educación para pacientes que son
relevantes para este tema. Le recomendamos que imprima o
envíe por correo electrónico estos temas a sus
pacientes. (También puede encontrar artículos de educación para
pacientes sobre una variedad de temas si busca "información del
paciente" y las palabras clave de interés).
●Tema básico (consulte "Educación del paciente: Factor V
Leiden (Conceptos básicos)" )
RESUMEN Y RECOMENDACIONES
●El factor V Leiden (FVL) es una mutación puntual que elimina
un sitio de escisión crítico en el factor V y el factor Va, lo que
hace que el FVL inactivado sea menos efectivo como cofactor
para la escisión de la proteína C activada (aPC) de FVa y
FVIIIa, mientras que el FVL activado es relativamente
resistente a la inactivación por aPC. Ambos mecanismos
contribuyen al aumento del riesgo de trombosis en
heterocigotos FVL. Este riesgo puede aumentar aún más por
homocigosidad o pseudohomocigosidad para FVL, o por otras
trombofilias heredadas o adquiridas. (Consulte 'Fisiología'
más arriba).
●La heterocigosidad para FVL es la trombofilia hereditaria más
común en poblaciones caucásicas no seleccionadas
(prevalencia, aproximadamente del 1 al 5 por ciento) y la
trombofilia hereditaria más común en personas con
tromboembolismo venoso (TEV; prevalencia, aproximadamente
del 10 al 20 por ciento) (Tabla 2). (Ver 'Epidemiología' arriba).
●La principal manifestación clínica de heterocigosidad de FVL
es la TEV. Sin embargo, solo un pequeño porcentaje de
personas con FVL desarrollará TEV en su vida (riesgo
aproximado, 4 a 5 por ciento para heterocigotos de FVL en la
población general y hasta 20 por ciento en familias
trombofílicas). El riesgo es mayor en el contexto de
homocigosidad para FVL o heterocigosidad compuesta para
FVL y otra trombofilia hereditaria. El sitio más común de TEV
es la trombosis venosa profunda y la embolia pulmonar, pero
también se observan otros sitios, como las venas superficiales
de la pierna y las venas cerebrales, portales y
hepáticas. (Ver 'Tromboembolia venosa' más arriba).
●En algunos casos, la FVL puede contribuir al
tromboembolismo arterial (infarto de miocardio, accidente
cerebrovascular) o complicaciones del embarazo, como la
pérdida fetal tardía, pero es probable que la magnitud del
efecto sea pequeña en relación con otros factores de
riesgo. (Ver 'Tromboembolismo arterial' arriba y 'Pérdida
fetal y complicaciones obstétricas' arriba).
●Puede sospecharse FVL en un miembro de una familia
trombofílica o en un individuo con TEV, especialmente TEV a
una edad temprana (p. Ej., <50 años), TEV en una ubicación
inusual (p. Ej., Vena porta, vena cerebral) o TEV recurrente . El
diagnóstico se puede realizar mediante pruebas genéticas o
una prueba funcional (ensayo de resistencia a PCa de
"segunda generación"). Los entornos en los que pueden ser
preferibles las pruebas genéticas se describen
anteriormente. (Consulte 'Diagnóstico' más arriba).
●Los diagnósticos diferenciales de los factores de riesgo de
tromboembolismo venoso y las causas de la pérdida del
embarazo se presentan por separado. (Consulte "Evaluación
de pacientes adultos con tromboembolismo venoso
establecido para factores de riesgo adquiridos y
hereditarios" y "Trombofilias hereditarias durante el
embarazo" ).
●Por lo general, no realizamos pruebas adicionales (p. Ej., Para
otras trombofilias) en personas con FVL que no han tenido un
evento tromboembólico. Puede ser apropiado realizar pruebas
a familiares de primer grado en algunos entornos (p. Ej.,
Antecedentes familiares sólidos de TEV, asesoramiento
anticonceptivo para parientes de primer grado femeninas,
hermanos de homocigotos). (Consulte 'Pruebas posteriores al
diagnóstico y pruebas de familiares de primer grado'
más arriba).
●Para los heterocigotos FVL con TEV aguda, el tratamiento
inicial es el mismo que para la población general, con
anticoagulación a menos que exista una contraindicación
(algoritmo 1). Sugerimos que la duración de la anticoagulación
se individualice de acuerdo con características tales como si
la TEV fue provocada, potencialmente mortal o en un sitio
inusual, como se hace para la población general, en lugar de
un enfoque más agresivo ( Grado 2C ). (Consulte "Pacientes
con TEV" más arriba y "Justificación e indicaciones de la
anticoagulación indefinida en pacientes con tromboembolismo
venoso" ).
●Para las personas asintomáticas que son heterocigotas para
FVL, sugerimos no tratar de forma rutinaria con
anticoagulación ( Grado 2B ), con la excepción de ciertas
situaciones de alto riesgo como cirugía, embarazo o la
presencia de variantes trombofílicas adicionales. Temas
adicionales como la posible evitación de anticonceptivos que
contienen estrógenos o el asesoramiento sobre el riesgo de
TEV se analizan anteriormente. (Consulte "Personas
asintomáticas" más arriba y "Problemas
obstétricos" y "Anticoncepción: asesoramiento para mujeres
con trombofilias hereditarias" ).
●La detección de FVL en individuos asintomáticos y en
individuos con hallazgos clínicos específicos se discute en
revisiones de temas separadas. (Ver "Pruebas de trombofilia
en niños y adolescentes" y "Detección de trombofilia
hereditaria en adultos asintomáticos" y "Evaluación de
pacientes adultos con tromboembolismo venoso establecido
para factores de riesgo adquiridos y heredados" y "Accidente
cerebrovascular isquémico en niños: presentación clínica,
evaluación y diagnóstico " y " Descripción general de la
evaluación del accidente cerebrovascular " y " Trombofilias
hereditarias en el embarazo ", sección sobre" Selección de
pacientes para el cribado " ).
El uso de UpToDate está sujeto al Acuerdo de suscripción y
licencia .
También podría gustarte
- Sindrome SafDocumento76 páginasSindrome SafZarinaVillantoyBendezúAún no hay calificaciones
- Enfermedad de Von Willebrand PDFDocumento6 páginasEnfermedad de Von Willebrand PDFeliza garavitoAún no hay calificaciones
- PRESENTACION eNFERMEDAD vON wILLEBRANDDocumento13 páginasPRESENTACION eNFERMEDAD vON wILLEBRANDYhovana Mendoza MamaniAún no hay calificaciones
- Anticoagulantes FisiológicosDocumento4 páginasAnticoagulantes FisiológicosValeria VillaAún no hay calificaciones
- Enfermedaddevonwillebrand 201024003058Documento54 páginasEnfermedaddevonwillebrand 201024003058Angel Slee TorresAún no hay calificaciones
- Enf VWDocumento5 páginasEnf VWLaura Daniela MurilloAún no hay calificaciones
- 10 Factor V LeidenDocumento34 páginas10 Factor V Leideneddy_rousAún no hay calificaciones
- 1c. Diatesis HemorrágicaDocumento7 páginas1c. Diatesis HemorrágicaBastián Barrueto CancinoAún no hay calificaciones
- Enfermedad de Von WillebrandDocumento4 páginasEnfermedad de Von Willebrandavefenix666Aún no hay calificaciones
- 2 - Enfermedad de Von Willebrand1677704718022Documento15 páginas2 - Enfermedad de Von Willebrand1677704718022Keicy Tehany Macias TorresAún no hay calificaciones
- Cromosoma FiladelfiaDocumento2 páginasCromosoma FiladelfiaPaloma AroliAún no hay calificaciones
- Enfermedad de Von WillebrandDocumento20 páginasEnfermedad de Von Willebrandmaria isabel100% (1)
- Enfermedad de Von Willebrand 2021 ValentinaDocumento21 páginasEnfermedad de Von Willebrand 2021 ValentinaNicole HuechanteAún no hay calificaciones
- Enfermedad de WillebrandDocumento11 páginasEnfermedad de WillebrandrwkvhfdjqcAún no hay calificaciones
- Enfermedad de Von Willebrand - Hematología y Oncología - Manual MSD Versión para ProfesionalesDocumento4 páginasEnfermedad de Von Willebrand - Hematología y Oncología - Manual MSD Versión para ProfesionalesRamón Exequiel Vargas CortezAún no hay calificaciones
- EvW: Etiología, fisiopatología y epidemiologíaDocumento2 páginasEvW: Etiología, fisiopatología y epidemiologíaLUCIA GUADALUPEAún no hay calificaciones
- Estados de HipercoagubilidadDocumento41 páginasEstados de HipercoagubilidadJarol Justo MamaniAún no hay calificaciones
- Hernandez Fuente Gabriel CoagulaciónDocumento8 páginasHernandez Fuente Gabriel CoagulaciónGabriel HernándezAún no hay calificaciones
- TrombofiliaDocumento8 páginasTrombofiliaMarbeaAún no hay calificaciones
- 40 B. SafDocumento41 páginas40 B. Safgapupa19Aún no hay calificaciones
- Alteraciones de La Hemostasia SecundariaDocumento8 páginasAlteraciones de La Hemostasia SecundariaMatias Chavez SaezAún no hay calificaciones
- Enfermedad de Von WillebrandDocumento5 páginasEnfermedad de Von WillebrandChristina Trejo ChávezAún no hay calificaciones
- Trombofilia y EmbarazoDocumento6 páginasTrombofilia y EmbarazoMaria Paula Cano RomeroAún no hay calificaciones
- Trombofilia CongénitaDocumento8 páginasTrombofilia CongénitaISRAELAún no hay calificaciones
- Capítulo 5Documento123 páginasCapítulo 5SAMUEL ESCARESAún no hay calificaciones
- Protocolo diagnóstico de trombofilia (PDTDocumento5 páginasProtocolo diagnóstico de trombofilia (PDTMayra Alejandra Prada SerranoAún no hay calificaciones
- Factor V Leiden y Mutación de La Protrombina G20210A en Pacientes Con Trombosis Venosa y Arterial AMRDocumento27 páginasFactor V Leiden y Mutación de La Protrombina G20210A en Pacientes Con Trombosis Venosa y Arterial AMRAlejandra MongeAún no hay calificaciones
- Enfermedad de Von WillembrandDocumento2 páginasEnfermedad de Von WillembrandIsabela Rosero CastroAún no hay calificaciones
- Copia de Trabajo AA HematoDocumento6 páginasCopia de Trabajo AA Hematocarlaguzmangutierrez3Aún no hay calificaciones
- Qué Es Un TromboDocumento4 páginasQué Es Un TromboMagu LezaAún no hay calificaciones
- Tarea 9Documento4 páginasTarea 9Sergio Correa TroncosoAún no hay calificaciones
- Trastornos Hematopoyeticos - Trastornos de La CoagulacionDocumento32 páginasTrastornos Hematopoyeticos - Trastornos de La Coagulacionjorge456z100% (1)
- Seimc Procedimientomicrobiologia23Documento24 páginasSeimc Procedimientomicrobiologia23Alfredo Oyarzun100% (2)
- Trombofilias AdquiridasDocumento30 páginasTrombofilias Adquiridasluismi33Aún no hay calificaciones
- Cascada de Coagulación y Factores de CoagulaciónDocumento22 páginasCascada de Coagulación y Factores de Coagulaciónchio_hernandez100% (1)
- SxantifosfoDocumento33 páginasSxantifosfoIngrid MartínezAún no hay calificaciones
- Trombofilia HereditariaDocumento6 páginasTrombofilia HereditariaAzrael Ángel VengadorAún no hay calificaciones
- Enfermedad de Von Willebrand Síndrome de Bernard Soulier Grupo #6Documento32 páginasEnfermedad de Von Willebrand Síndrome de Bernard Soulier Grupo #6Kenneddy D. YaugerAún no hay calificaciones
- Hemorragias y hemofilia ADocumento17 páginasHemorragias y hemofilia AAlejandra PalaciosAún no hay calificaciones
- Apuntes Coagulopatías y EmbarazoDocumento2 páginasApuntes Coagulopatías y EmbarazoJazmine Vidal LaraAún no hay calificaciones
- Manifestaciones clínicas y diagnóstico de las talasemiasDocumento21 páginasManifestaciones clínicas y diagnóstico de las talasemiasPaula GonzalezAún no hay calificaciones
- Trombofilia y SAF DR Rosa Nov 2022Documento74 páginasTrombofilia y SAF DR Rosa Nov 2022yandros666Aún no hay calificaciones
- Cromosoma FiladelfiaDocumento3 páginasCromosoma FiladelfiaKevin MarTínezAún no hay calificaciones
- Articulo de FisologiaDocumento6 páginasArticulo de FisologiaTatiana Mishell Huertas B.Aún no hay calificaciones
- Guia de LecturaDocumento2 páginasGuia de LecturaSergio JavierAún no hay calificaciones
- Art 11Documento3 páginasArt 11amoyamsAún no hay calificaciones
- COAGULACIÓN CONGENITADocumento22 páginasCOAGULACIÓN CONGENITADAVID CORALAún no hay calificaciones
- POLICITEMIASDocumento16 páginasPOLICITEMIASAlexis Jared Perez AranaAún no hay calificaciones
- Alteraciones de La CoagulaciónDocumento13 páginasAlteraciones de La CoagulaciónNancy Pamela Bravo ChirreAún no hay calificaciones
- FisiologiaDocumento7 páginasFisiologiaValiixx SAún no hay calificaciones
- Caso Clínico - Grupo 3B (3) (Reparado)Documento8 páginasCaso Clínico - Grupo 3B (3) (Reparado)ro_mao21573Aún no hay calificaciones
- Hipercoagulabilidad 160105181330Documento68 páginasHipercoagulabilidad 160105181330ancomarcio0% (1)
- HemofiliaDocumento15 páginasHemofiliaSARA ALEJANDRA SANCHEZ ESPINOZAAún no hay calificaciones
- Anomalías Cromosómicas y Tumores SólidosDocumento3 páginasAnomalías Cromosómicas y Tumores SólidosRuth Callo Castillo100% (2)
- Correcciones y diluciones del plasma: análisis de factores de coagulaciónDocumento4 páginasCorrecciones y diluciones del plasma: análisis de factores de coagulaciónRafael Huerta LopezAún no hay calificaciones
- Von WillebrandDocumento21 páginasVon WillebrandMaríaFernandaLeal100% (2)
- Enfermedad de Von WillebrandDocumento11 páginasEnfermedad de Von WillebrandNancy OlivaresAún no hay calificaciones
- Cromosoma Filadelfia - Doc3Documento4 páginasCromosoma Filadelfia - Doc3princess123456789Aún no hay calificaciones
- Sindrome antifosfolipídico Farreras - ClaseDocumento10 páginasSindrome antifosfolipídico Farreras - ClaseLautaro Gabriel IbañezAún no hay calificaciones
- Absorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleDe EverandAbsorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleAún no hay calificaciones
- TromboprofilaxisDocumento12 páginasTromboprofilaxisJonathan MartinezAún no hay calificaciones
- Estados de Hipercoagulabilidad - PUC PDFDocumento10 páginasEstados de Hipercoagulabilidad - PUC PDFGerardoAún no hay calificaciones
- Sindrome AntifosfolipidoDocumento104 páginasSindrome Antifosfolipidoluyoha8Aún no hay calificaciones
- TROMBOFILIASDocumento50 páginasTROMBOFILIASMaru CMAún no hay calificaciones
- 02 Fisiopatología de La Trombosis VenosaDocumento18 páginas02 Fisiopatología de La Trombosis VenosaRoberto R. RitteAún no hay calificaciones
- 5044f3299865d Catlogo Bioarray Clinica 2012Documento56 páginas5044f3299865d Catlogo Bioarray Clinica 2012AidaLimaAún no hay calificaciones
- TrombofiliaDocumento33 páginasTrombofiliaConstantino AquilesAún no hay calificaciones
- Triada de VirchowDocumento12 páginasTriada de Virchowbelle15060% (2)
- Solucionario - EUNACOM 2018 (Dic)Documento10 páginasSolucionario - EUNACOM 2018 (Dic)Pablo TorrejónAún no hay calificaciones
- Vasculopatias VenosasDocumento33 páginasVasculopatias VenosasNancy DoradorAún no hay calificaciones
- Trombofilias 6PM6Documento26 páginasTrombofilias 6PM6Giordano OvandoAún no hay calificaciones
- Tromboembolismo PulmonarDocumento163 páginasTromboembolismo Pulmonarnitzer_ebbAún no hay calificaciones
- Guías anticoagulación 2012Documento22 páginasGuías anticoagulación 2012Carlos Gonzalez Andrade100% (1)
- Prevención Del Tromboembolismo Venoso Durante El Embarazo y El Puerperio en Atención Primaria y EspecializadaDocumento7 páginasPrevención Del Tromboembolismo Venoso Durante El Embarazo y El Puerperio en Atención Primaria y EspecializadaMony H. LoayzaAún no hay calificaciones
- Trombofilias Hereditarias.. El Perfil de PruebasDocumento7 páginasTrombofilias Hereditarias.. El Perfil de PruebasAngela MontañoAún no hay calificaciones
- Anticoagulante LupicoDocumento9 páginasAnticoagulante LupicoKrlos Elias Ruiz100% (1)
- Interpretacion de Las Pruebas de CoagulaciónDocumento70 páginasInterpretacion de Las Pruebas de CoagulaciónJosué García Flores100% (1)
- Hematología III: TrombofiliaDocumento78 páginasHematología III: TrombofiliaLyz Honorato SoledadAún no hay calificaciones
- GUIA UCI ANTICOAGULACIONDocumento8 páginasGUIA UCI ANTICOAGULACIONjeniferAún no hay calificaciones
- Tratamiento de la TEPDocumento240 páginasTratamiento de la TEPreinaldo valdes iznaga100% (1)
- Trombosis Venosa CerebralDocumento67 páginasTrombosis Venosa Cerebralrepre64Aún no hay calificaciones
- El Cofactor II de La HeparinaDocumento5 páginasEl Cofactor II de La HeparinaRuth Aydeé SoláAún no hay calificaciones
- HipercoagulabilidadDocumento41 páginasHipercoagulabilidadRenato Alvarez LoureiroAún no hay calificaciones
- Trombosis Implicancia ClinicaDocumento21 páginasTrombosis Implicancia ClinicamateoAún no hay calificaciones
- Clase 7 M2 Hemostasia (07.11)Documento9 páginasClase 7 M2 Hemostasia (07.11)Fabián Rivas MirandaAún no hay calificaciones
- Anticoagulantes en El EmbarazoDocumento35 páginasAnticoagulantes en El EmbarazocarlangaslaraAún no hay calificaciones
- Anticoagulacion Gestante 1Documento55 páginasAnticoagulacion Gestante 1Alex VillanuevaAún no hay calificaciones
- Tromboembolismo Pulmonar 2020Documento28 páginasTromboembolismo Pulmonar 2020Laura Daniela Castillo Bedoya100% (1)
- Plaquetas PegajosasDocumento16 páginasPlaquetas PegajosaserikaAún no hay calificaciones
- Anticoagulante Lúpico PDFDocumento9 páginasAnticoagulante Lúpico PDFAna Maria Zapata OrozcoAún no hay calificaciones