Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tabla Orgánica 23 24
Cargado por
garciagarcia.ack0 calificaciones0% encontró este documento útil (0 votos)
9 vistas3 páginas1) El documento resume las principales reacciones orgánicas de alcanos, alquenos, alquinos, dienos conjugados, compuestos aromáticos y aminas.
2) Describe los reactivos, productos y características clave de reacciones como la pirólisis, adición de haluros, hidrogenación catalítica y oxidación para cada tipo de compuesto.
3) También resume efectos electrónicos de sustituyentes en anillos aromáticos y cómo afectan a la posición de sustitución, así como conversiones entre amin
Descripción original:
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documento1) El documento resume las principales reacciones orgánicas de alcanos, alquenos, alquinos, dienos conjugados, compuestos aromáticos y aminas.
2) Describe los reactivos, productos y características clave de reacciones como la pirólisis, adición de haluros, hidrogenación catalítica y oxidación para cada tipo de compuesto.
3) También resume efectos electrónicos de sustituyentes en anillos aromáticos y cómo afectan a la posición de sustitución, así como conversiones entre amin
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
9 vistas3 páginasTabla Orgánica 23 24
Cargado por
garciagarcia.ack1) El documento resume las principales reacciones orgánicas de alcanos, alquenos, alquinos, dienos conjugados, compuestos aromáticos y aminas.
2) Describe los reactivos, productos y características clave de reacciones como la pirólisis, adición de haluros, hidrogenación catalítica y oxidación para cada tipo de compuesto.
3) También resume efectos electrónicos de sustituyentes en anillos aromáticos y cómo afectan a la posición de sustitución, así como conversiones entre amin
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
Resumen reacciones orgánicas
TIPO DE REACCIÓN REACTIVO/ QUÉ PRODUCE CARACTERÍSTICA
DISOLVENTE
ALCANOS
Pirólisis Calefacción / Pt o Pd Alqueno //
ALQUENOS
HCl ó HBr Derivado halogenado Markovnikov / vía C+ / no
Adición de haluros estereoquímica
Br2 ó Cl2 Derivado halogenado Markovnikov / vía C+ /
ANTI
H2SO4/H2O/Δ Alcohol Markovnikov / vía C+
Adición electrófila H3O+/H2O Alcohol Markovnikov / vía C+
HCl/[O] (peróxidos) ó hv Derivado halogenado Antimarkovnikov / vía
radicálica
Hidroboración/oxidación BH3 (THF)/H2O2/OH- Alcohol Antimarkovnikov / SIN
Epoxidación (oxidación) CH3COOH ó AmCPB Epóxido (éter cíclico) SIN o ANTI
Formación de dioles OsO4/NaHSO3 ó KMnO4 Diol (dos SIN
(oxidación) (dil) / frío alcoholesvecinales)
Ozonólisis O3/Zn/CH3COOH Aldheídos y cetonas El compuesto se parte
O3/H2O2 Ácido carboxílico
Bromación (halogenación NBS Añadir Br a un alquilo //
alílica)
Hidrogenación catalítica H2/Pd Alcano //
ALQUINOS
Hidrogenación catalítica H2/Pd (c)/BaSO4 Alcano Lindar SIN
(reducciones)
NaNH3 Alcano Birch ANTI (enlaces
centrales)
Sustitución (H ácidos) NaNH2/R-X (R= haluro Alargar la cadena + //
1º) /H3O+ alcohol
Adición de X2 (electrófila) Br2 / CCl4 (disolv) ó CBr Tetrahalogenación Markovnikov / ANTI
HCl Derivado halogenado Markovnikov /vía C+
Adición HX HCl Derivado halogenado Antimarkovnikov / vía
radicálica
Adición electrófila de Hg+/H2O Tautomería ceto-enólica Vía C+ más estable
H2O
ALILOS
HX / [O] (peróxido) Derivado halogenado Antimarkovnikov / cuando
(alcano) hay H disponibles
Halogenación alílica Br2/hv Derivado halogenado Vía intermedio más
(alqueno) estable / cuando no hay H
disponibles
DIENOS CONJUGADOS
Diels-Alder Dieno conjugado + Ciclohexenos en orto (1,2)
dienófilo o para (1,4)
Adición 1,2 haluros de Dieno conjugado + XH / Derivado halogenado + C. cinético (intermedio
ácido baja Tº alqueno más estable)
Adición 1,4 haluros de Dieno conjugado + XH / Derivado halogenado + C. termodinámico (doble
ácido Tº alta alqueno enlace final más
sustituido)
COMPUESTOS AROMÁTICOS
Reacciones fuera del anillo
Halogenación radicálica NBS ó NCS ó hv ó Br2 Derivado halogenado No tiene que haber H en el
(fuera del anillo) medio
Oxidación de la cadena KMnO4/ OH-/ Δ Ácido carboxílico //
lateral (carbonatada)
Adición electrófila de HBr Derivado halogenado Markovnikov
alquilbencenos
Reacciones dentro del anillo
Resumen reacciones orgánicas
Nitración HNO3/H2SO4 Nitrobenceno //
Reducción de Zn (Hg)/HCl ó Sn/HCl ó Del NO2 a NH2. Condiciones ácidas
Clemmensen Fe/HCl Reducción de aldheídos y
cetonas hasta el compuesto
saturado
Oxidación (caso CF3-COOH/OX Pasamos del NH2 a NO2 No es muy común
clemmensen)
K2Cr2O7 o K2MnO4 / La cadena alquílica
H2SO4 y calefacción con al menos un
Oxidación (normal) hidrógeno en posición
bencílica del benceno
se oxida para dar lugar
un grupo carboxilo
Sulfonación SO3/H2SO4 Anillo + SO3H (sulfona) Grupo protector
H2O/H+ Anillo Para quitar la sulfona
Halogenación X2/FeBr3 ó X2/AlX3 Derivado halogenado //
Alquilación de Friedel- R-X/AlCl3 Benceno+R y HX Vía C(+). Ojo a las
Crafts Cetona aromática limitaciones
Acilación de Friedel- R-C=O /AlCl3 Cetona aromática //
Crafts
Reducción de Birch Na ó Li/NH3 1,4-ciclohexadienos //
Hidrogenación catalítica H2/Pt o Pd. Altas Cicloalcanos //
presiones y T
NH2-NH2 /KOH Reducción de //
Reducción de Wolff- aldehídos y cetonas
Kishner aromáticas hasta el
compuesto saturado.
NaNO2 / HCl, H2O Consigues la //
respectiva sal de
diazonio
H3PO2 Eliminas la sal de diazonio //
Síntesis sales de diazonio CuBr, CuCl, H2O / Preparar derivados a partir //
calefacción, HBF4, de la sal
calefacción (reacción de
Schiemann)
Acilación de fenoles Anhídridos acético / pyr Ésteres //
Carboxilación de fenoles
(Reacción de Kolbe – 1. NaOH/CO2 Ácido salicílico a partir de //
Schmitt) 2. H3O+ fenol
Efectos electrónicos de otros grupos sobre el anillo
X = +K OH, OR, NH2 Muy activantes Orto y Para
X = -K COOH, CO, CN, SO3H Muy desactivantes Meta
X= +I Alquilos (metilos, Activan un poco Orto y Para (p>>>o)
etilos…)
X = -I CF3 Desactivan un poco Meta
Prioridad Activante > Desactivante // K>>>I
Prioridad en halógenos I > K
AMINAS
Alquilación H3O+ Consigues sal de //
amonio a partir de una
amina
OH- Consigues una amina //
primaria a partir de una
sal de amonio
Conversión a amida R-COCl Consigues una amida //
N-sustituida a partir de
Resumen reacciones orgánicas
una amina (N, N
disustituida si la amina
es secundaria etc…)
Conversión a sulfonamida ArSO2Cl Consigues //
sulfonamida N-
sustituida a partir de
una amina (N, N
disustituida si la amina
es secundaria etc…)
Reacciones con ácido HNO2/0Cº Consigues sales de //
nitroso diazonio que
posteriormente pueden
transformarse en
mezclas de alcoholes y
alquenos a partir de
una amina alifática
primaria
Eliminación de Hoffman 1. R-X (CH3I) exc Consigues el alqueno Muy importantes
2. Ag2O/H2O/ Δ menos sustituido y la
ó amina terciaria primero
1. RX (exceso) consiguiendo la sal de
2. OH- / Δ amonio cuaternario (es
la que sufre la
eliminación) gracias al
RX en exceso
Nitrosación NaNO2/H+ Sal de diazonio Sobretodo se da con
aminas 1º, las 2º son
menos comunes y las 3º
no se dan por el tamaño
También podría gustarte
- 12-Ojuani ObaraDocumento8 páginas12-Ojuani ObaraSilvano Ramírez González100% (1)
- Resumen Reacciones Orgánica 2º BachillerDocumento4 páginasResumen Reacciones Orgánica 2º BachillerSaraGFAún no hay calificaciones
- Acupuntura para Dejar de BeberDocumento3 páginasAcupuntura para Dejar de BeberGlo AlemanAún no hay calificaciones
- Metodos de Obtencion de Los Alcanos, Alquenos y AlquinosDocumento6 páginasMetodos de Obtencion de Los Alcanos, Alquenos y AlquinosAreli Hernández40% (5)
- Análisis Retrosintético IDocumento28 páginasAnálisis Retrosintético IEsther IsabelAún no hay calificaciones
- AlquinosDocumento46 páginasAlquinosUnknowAún no hay calificaciones
- ALQUINOSDocumento55 páginasALQUINOSALAN TORRES100% (1)
- Proyectos CerdosDocumento94 páginasProyectos CerdosTOPROYECCIONAún no hay calificaciones
- Reacciones de AlquenosDocumento11 páginasReacciones de AlquenosmarlyAún no hay calificaciones
- Diseño Conceptual Aerodinámico de Un Cohete SondaDocumento179 páginasDiseño Conceptual Aerodinámico de Un Cohete SondaDanielLaraFavela0% (1)
- Prueba GrafolexicaDocumento26 páginasPrueba Grafolexicashura100% (1)
- Actividad de Puntos Evaluables Escenario 2 Calculo 2Documento5 páginasActividad de Puntos Evaluables Escenario 2 Calculo 2BRISMAN EDUARDO BERMUDEZ ORTEGAAún no hay calificaciones
- Reacciones de Alquenos-TablaDocumento13 páginasReacciones de Alquenos-TablaCeci CuellarAún no hay calificaciones
- AromÁticosDocumento16 páginasAromÁticosIgnacio Rodriguez RoblesAún no hay calificaciones
- CLASE 11 Sustitución en Derivados Halogenados 2021Documento36 páginasCLASE 11 Sustitución en Derivados Halogenados 2021Nicolas GRECOAún no hay calificaciones
- Reacciones de AlquenosDocumento102 páginasReacciones de AlquenosAndrea PachecoAún no hay calificaciones
- Presentación Aromáticos ArenosDocumento31 páginasPresentación Aromáticos ArenosCharlieAún no hay calificaciones
- Organic CDocumento43 páginasOrganic Cpocho dlpAún no hay calificaciones
- Alquenos 2021Documento108 páginasAlquenos 2021Dany MirelyAún no hay calificaciones
- Hidrocarburos Caracteristicas y ReaccionesDocumento12 páginasHidrocarburos Caracteristicas y Reaccionesjaja1100% (4)
- Laboratorio #4: Hidrocarburos: 1. ObjetivoDocumento10 páginasLaboratorio #4: Hidrocarburos: 1. ObjetivoRodolfo CárdenasAún no hay calificaciones
- Resumen Alquenos 2Documento6 páginasResumen Alquenos 2Heimmy Lilian PicartAún no hay calificaciones
- QOI CT 12 AlquenosDocumento55 páginasQOI CT 12 Alquenosrosariolema55Aún no hay calificaciones
- Compuestos Halogenados-1Documento20 páginasCompuestos Halogenados-1Ruvina Reque TorricoAún no hay calificaciones
- UNIDAD IV. Halogenuros de AlquiloDocumento19 páginasUNIDAD IV. Halogenuros de AlquiloValeriaAún no hay calificaciones
- Adicinelectroflicaaalquenosyalquinos 120528105337 Phpapp02Documento19 páginasAdicinelectroflicaaalquenosyalquinos 120528105337 Phpapp02Nura TamakiAún no hay calificaciones
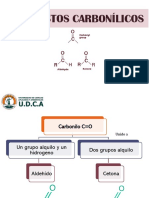
- Clase Aldehidos y Cetonas-2021-I-RthDocumento37 páginasClase Aldehidos y Cetonas-2021-I-RthTeodoro Enrique Linares MonjaAún no hay calificaciones
- AlquenosDocumento49 páginasAlquenosMaría Armijo Delgado0% (1)
- Sustitución: R R R 1 Y2 (S 2), Atacante PBR, Socl Ó PCL 3 (S 1) HCL: (CH) - C-+ H (CH) - C - +Documento1 páginaSustitución: R R R 1 Y2 (S 2), Atacante PBR, Socl Ó PCL 3 (S 1) HCL: (CH) - C-+ H (CH) - C - +DudududuAún no hay calificaciones
- Obtencion de AlquenosDocumento18 páginasObtencion de Alquenosgrcaceres70Aún no hay calificaciones
- Reacciones de Alquenos y Alquinos v1.1 PDFDocumento3 páginasReacciones de Alquenos y Alquinos v1.1 PDFCelene Valdez PichardoAún no hay calificaciones
- Resumen Parcial 1 QuimicaDocumento2 páginasResumen Parcial 1 QuimicaAlejandraAún no hay calificaciones
- Reacciones de AlquinosDocumento5 páginasReacciones de AlquinosCeci CuellarAún no hay calificaciones
- Repaso Aldehidos y CetonasDocumento50 páginasRepaso Aldehidos y CetonasJonathan Herrera PerezAún no hay calificaciones
- Compuestos HalogenadosDocumento21 páginasCompuestos HalogenadosAna EstradaAún no hay calificaciones
- Alcoholes IQ SDocumento30 páginasAlcoholes IQ SPERLAAún no hay calificaciones
- Tema 10. Alcoholes PDFDocumento41 páginasTema 10. Alcoholes PDFRaquel Aparicio SanchezAún no hay calificaciones
- Repaso QuímicaDocumento4 páginasRepaso QuímicaJaime PeñaAún no hay calificaciones
- Resumen Dienos y AlquinosDocumento9 páginasResumen Dienos y AlquinosHeimmy Lilian PicartAún no hay calificaciones
- ALQUINOSDocumento39 páginasALQUINOSjuancarlosbazziAún no hay calificaciones
- Apunte 1 quimica-IIIDocumento24 páginasApunte 1 quimica-IIILeire León LeónAún no hay calificaciones
- Reacciones Orgánicas CURSODocumento169 páginasReacciones Orgánicas CURSOErajh HertezAún no hay calificaciones
- Alquenos 2Documento74 páginasAlquenos 2Adrian AngelAún no hay calificaciones
- 4 - Reacciones RedoxDocumento28 páginas4 - Reacciones RedoxVictor Martin HerasAún no hay calificaciones
- Aldehídos y CetonasDocumento40 páginasAldehídos y CetonasLAURA VALENTINA MALDONADO VELASCOAún no hay calificaciones
- Acidos AromáticosDocumento48 páginasAcidos AromáticosarielAún no hay calificaciones
- Clase Unidad #7 Aldehidos, Cetonas, Acidos Carboxilicos y EsteresDocumento55 páginasClase Unidad #7 Aldehidos, Cetonas, Acidos Carboxilicos y EsteresNoelia Lopez0% (1)
- ALDEHIDOS Y CETONAS Clase 2020Documento137 páginasALDEHIDOS Y CETONAS Clase 2020Geraldine Gonzalez PatinoAún no hay calificaciones
- OBJ. N 12 Obtencion de Alcanos Alquenos y AlquinosDocumento11 páginasOBJ. N 12 Obtencion de Alcanos Alquenos y AlquinosJhon AvendañoAún no hay calificaciones
- Compuestos HidrogenadosDocumento2 páginasCompuestos HidrogenadosJulioCesarLunaIbañezAún no hay calificaciones
- Ejercicios de Quimica Organica AromaticosDocumento32 páginasEjercicios de Quimica Organica AromaticosRafael Alejandro S C50% (2)
- 05 Halogenuros de AlquiloDocumento32 páginas05 Halogenuros de AlquiloCarlos N. Valverde67% (3)
- Semana 10 - Prop Químicas de Ald y Cet-Ácidos Carboxilicos. Química OrgánicaDocumento52 páginasSemana 10 - Prop Químicas de Ald y Cet-Ácidos Carboxilicos. Química OrgánicaD GamingAún no hay calificaciones
- Aldehidos y Cetonas 09Documento36 páginasAldehidos y Cetonas 09Alison RoaAún no hay calificaciones
- Tema 1.11 Reacciones Radicalicas PDFDocumento20 páginasTema 1.11 Reacciones Radicalicas PDFLizbeth GarcíaAún no hay calificaciones
- Tema 5 2018 PDFDocumento72 páginasTema 5 2018 PDFLeandro PelletànAún no hay calificaciones
- Diapositivas AlquinosDocumento14 páginasDiapositivas AlquinosEFRAIN MIGUEL TINTAYA QUISPEAún no hay calificaciones
- Clase AlquinosDocumento48 páginasClase AlquinosRaul CabreraAún no hay calificaciones
- II-3 Reactividad de Los Alcoholes 202310Documento30 páginasII-3 Reactividad de Los Alcoholes 202310Andrés Solís GonzálezAún no hay calificaciones
- Aldehidos y CetonasDocumento25 páginasAldehidos y CetonasAbigail AyateAún no hay calificaciones
- Laboratorio de Aldehídos y CetonasDocumento14 páginasLaboratorio de Aldehídos y CetonasJhudit RamirezAún no hay calificaciones
- Taller de Quimica Punto 4Documento9 páginasTaller de Quimica Punto 4luz stella IBAÑEZ ARIASAún no hay calificaciones
- Quimica Semana 13 - 2021 IIIDocumento4 páginasQuimica Semana 13 - 2021 IIIAttene Rojas PomaAún no hay calificaciones
- Reacciones Químicas Orgánicas IIDocumento5 páginasReacciones Químicas Orgánicas IIVALERY NICOLLE MATOS RIOSAún no hay calificaciones
- Tipos de Catalizadores Según Las Reaccione QuimicasDocumento3 páginasTipos de Catalizadores Según Las Reaccione QuimicasVinicioBenalcazarAún no hay calificaciones
- Trabajo Grupal EstadisticaDocumento16 páginasTrabajo Grupal EstadisticaYordi Aguilar0% (1)
- ChampagneDocumento17 páginasChampagneClariza Cercedo EncarnacionAún no hay calificaciones
- El Orden Del CultoDocumento14 páginasEl Orden Del CultoArcangel LopezAún no hay calificaciones
- SIMULACRO R3 - Area ADocumento18 páginasSIMULACRO R3 - Area AJesús Curasma de la CruzAún no hay calificaciones
- Ecuaciones Diferenciales 11Documento22 páginasEcuaciones Diferenciales 11JahirVernazaAún no hay calificaciones
- 05 - VeracidadDocumento20 páginas05 - VeracidadIlseGallardoAún no hay calificaciones
- Caso 1 y 2Documento3 páginasCaso 1 y 2Alejandro AvilésAún no hay calificaciones
- El suelo es la parte externa de la corteza terrestre que, sometida a las influencias meteorológicas y biológicas, se ha descompuesto hasta tal punto que permite el establecimiento en ella de las plantas superiores.Documento9 páginasEl suelo es la parte externa de la corteza terrestre que, sometida a las influencias meteorológicas y biológicas, se ha descompuesto hasta tal punto que permite el establecimiento en ella de las plantas superiores.Rous Aviles TrujilloAún no hay calificaciones
- Ejercicio MetodologiaDocumento5 páginasEjercicio Metodologiacamila caceresAún no hay calificaciones
- La MojubaDocumento6 páginasLa MojubaNuytter Alexander RamirezAún no hay calificaciones
- Comprobacion de Los Inyectores GasolinaDocumento6 páginasComprobacion de Los Inyectores GasolinaJose HerreraAún no hay calificaciones
- Normas de Sistemas de AlcantarrilladoDocumento5 páginasNormas de Sistemas de AlcantarrilladomotamoyAún no hay calificaciones
- Glosario de Términos GeográficosDocumento9 páginasGlosario de Términos Geográficosmanuel sanchez hidalgoAún no hay calificaciones
- Etica para La VidaDocumento9 páginasEtica para La VidaEdgar CamargosAún no hay calificaciones
- Fenómenos Ondulatorios 2: Programa de Transición IntermedioDocumento20 páginasFenómenos Ondulatorios 2: Programa de Transición IntermedioMaríaAún no hay calificaciones
- Bono GASDocumento4 páginasBono GASarianaAún no hay calificaciones
- 09 Manual Papa Criolla 2020 EBOOKDocumento137 páginas09 Manual Papa Criolla 2020 EBOOKRafael Gomez ArrietaAún no hay calificaciones
- AP 10 Motricidad Fina y GruesaDocumento12 páginasAP 10 Motricidad Fina y GruesaFanny ReyesAún no hay calificaciones
- El Sistema DigestivoDocumento3 páginasEl Sistema DigestivoMaina Grillo VargasAún no hay calificaciones
- CC HipertiroidismoDocumento13 páginasCC HipertiroidismoStephanie GarciaAún no hay calificaciones
- Informe 2Documento3 páginasInforme 2Sara JimenexAún no hay calificaciones
- Diferenciacion CelularDocumento8 páginasDiferenciacion Celularr.damian.estrada.xfsAún no hay calificaciones
- Punto 2 Waira Algebra PDFDocumento3 páginasPunto 2 Waira Algebra PDFNilo Daniel MielesAún no hay calificaciones
- Heces AcoliaDocumento14 páginasHeces AcoliaAndrea ManiguaryAún no hay calificaciones