Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Informe Practica 1 MOAR
Cargado por
Vanessa RincónTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Informe Practica 1 MOAR
Cargado por
Vanessa RincónCopyright:
Formatos disponibles
Introducción a la identificación y análisis
morfológico de tejidos animales y vegetales
Vanessa Rincón Gómez, Gabriela Natalia Caro Buitrago, Juan Andrés Prieto
Universidad Militar Nueva Granada
En la presente práctica se observaron tres muestras del tejido de un riñón de ratón. Para cada uno se
usaron técnicas diferentes. Se buscaba diferenciar cada una con el fin de determinar cuál tenía mejor
calidad de tinción. Una técnica sería más efectiva según el detalle morfológico que proporcionara. Con
estas observaciones se nos introdujo a los diferentes procedimientos usados para la observación
microscópica de tejido.
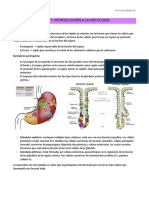
I. INTRODUCCIÓN para examinar muestras de: riñones, hígados, órganos
gastrointestinales y tumores, pulmones, médula ósea,
La observación es la base para la histología, por eso, entre otros (Caldas et al., 2018). El espesor, ancho y
su herramienta principal es el microscopio. Con él longitud de la muestra no deben ser mayores a 2 mm y
podemos caracterizar los detalles celulares, para así a 2x2 cm (Megías et al., 2019). La microscopía óptica
identificar particularidades en los tejidos. Además de tradicional supera estos estándares, teniendo mapyr
la observación, las muestras se tiñen con el fin de longitud y ancho..
diferenciar partes de la célula. Fijar y teñir tejidos para
ser examinados bajo un microscopio de luz es una La presente práctica pretende demostrar las diferencias
práctica estándar en los laboratorios de histología. La entre estas dos técnicas, para eso se usará tres tipos de
práctica que se realizará se centrará en la microscopía muestras del riñón de un ratón. Dos de estas muestras
óptica, sin embargo, se reconocen los diferentes tipos eran MOAR y una tradicional. El objetivo general de
de microscopía. Por ejemplo, la microscopía de la práctica es introducir de al análisis morfológico de
fluorescencia, que es utilizada para estudiar la tejidos, con lo que se logra específicamente conocer
distribución de las moléculas a nivel intracelular, o, las características de las distintas microscopias ópticas,
por otro lado. La microscopía electrónica, la cual, y distinguir las técnicas necesarias para cada tipo de
permite una resolución mucho mayor que la microscopía óptica.
microscopía óptica ya que no depende de la longitud
de onda de la luz, sino la de los electrones, que tienen En la presente práctica se tomaron tres muestras de
una longitud de onda mucho menor (Cooper et al, riñón de ratón, con tal de llevar a cabo los objetivos de
2014). la práctica. La calidad de una microscopía frente a la
otra se daría al comparar la observación de estructuras
Los microscopios funcionan a partir de la longitud de renales que se buscaban identificar, tales como
onda de la luz visible y el poder de la captación de los glomérulos, cápsulas de Bowman, túbulos y núcleos
de los lentes del microscopio. La resolución óptica celulares. Al final se realizó un cuadro comparativo
MOAR (Microscopía Óptica de Alta Resolución), entre ambas técnicas y se concluyó cuál era mejor a la
lleva al límite la capacidad de captación de luz en el otra.
microscopio. Esta técnica consiste en la capacidad
realizar cortes de tan solo 0,5- 2 (µ) micras, cuando el II. MÉTODOS Y MATERIAL
espesor de cada corte en general debe ser de 0.5µ-10µ
(Colombia, s.f.). Este método se utiliza generalmente Observación de láminas tradicional contra MOAR
En la presente práctica se pretendía introducir al
análisis morfológico de tejidos. Para esto la docente
proporcionó tres muestras del tejido de riñón de un
ratón. Se usaron dos muestras de MOAR y una
tradicional. Una MOAR tenía una tinción de azul
(MO1) de toluidina, la otra con tinción de
hematoxilina y eosina (MO2). La muestra tradicional
también estaba teñida con hematoxilina y eosina
Figura 1.3 y 1.4. Muestra de riñón de
(MT).
ratón en 40X. A la izquierda la tinción
Para ver las principales diferencias entre los tipos de tradicional y a la derecha MOAR con
microscopía óptica se compararon primero dos tinción de azul de toluidina.
muestras. La muestra MO1, la cual es MOAR y teñida
con toluidina, y la muestra MT, la cual es tradicional y
teñida con hematoxilina y eosina. Ambas muestras
fueron observadas en los aumentos, 10x, 40x, 100x,
seguido a ser observadas se fotografió cada muestra
bajo cada aumento con el fin de comparar la muestra
en cada resolución correspondiente. Al ser observadas
se compararán según el detalle morfológico que se
Figura 1.5 y 1.6. Muestra de riñón de
logre captar. Seguido a esto, se utilizó la muestra MO2
ratón de ratón en 100X. A la izquierda la
(Muestra MOAR, teñida con hematoxilina y eosina),
tinción tradicional y a la derecha MOAR
la cual se observó a 100x y se tomó evidencia. Al final
con tinción de azul de toluidina.
se comparó esta muestra con la MT (muestra
tradicional)
III. RESULTADOS
Teniendo en cuenta el objetivo de la
práctica, el cual es identificar la calidad
según el detalle morfológico de diferentes
tinciones; se observaron muestras de riñón
de ratón con tratamiento MOAR y Figura 1.7. Muestra de riñón de ratón en
tradicional. Finalmente, obtuvimos las 100X. MOAR con tinción de hematoxilina
siguientes fotografías. y eosina.
Figura 1.1 y 1.2. Muestra de riñón de
ratón en 10X. A la izquierda la tinción
tradicional y a la derecha MOAR con Figura 1.9. Corte longitudinal de riñón humano visto
tinción de azul de toluidina. en 60X, donde se pueden apreciar diferentes partes de
dicho órgano. RC hace referencia al corpúsculo renal pequeñas extensiones de la arteria renal, en su cercanía
(glomérulo y cápsula de Bowman), MR al rayo se pueden identificar otras extensiones de ella no
medular el cual contiene segmentos gruesos pertenecientes al corpúsculo (Color café, ver figura 1.3
proximales, segmentos huesos distales y túbulos y 1.4). Finalmente, esta parte es el primer paso para
colectores (Pawlina & Ross,2015). empezar a filtrar la orina.
Por otro lado, la presencia del orgánulo nuclear es
evidente debido a su forma circular u ovalada y tono
oscuro en la mayoría de las muestras. Se encuentran
señaladas con azul claro (Ver figura y en algunos
casos, se puede diferenciar la membrana celular (Color
rosa, ver figura 1.4, 1.5, 1.6 y 1.7).
Finalmente, en ambas muestras se pudieron apreciar
algunas células epiteliales y renales, marcadas con
color naranja en la figura 1.3, sin embargo, se dificulta
ver su interior.
IV. ANÁLISIS DE RESULTADOS
Figura 1.9. Sección transversal de riñón humano vista En las prácticas de laboratorio, es importante el uso
en 120X a través del microscopio. En esta imagen se del microscopio y con ello la manipulación de las
puede apreciar el rayo medular (MR) visto desde otra muestras que se vayan a analizar. Durante el
perspectiva. (Pawlina & Ross,2015). laboratorio se observaron dos tratamientos diferentes
sobre disecciones realizadas en el riñón de un ratón,
En cada imagen obtenida de las observaciones en el
esto con el objetivo de comparar la calidad de las
microscopio se señalaron las estructuras internas
imágenes obtenidas con el microscopio. La rúbrica
renales más características como referente para
para poder evaluar dicha cualidad son: Las
comparar los dos métodos usados en tejidos. Dichos
características entre ambos métodos (MOAR y
componentes tenidos en cuenta fueron: Túbulos (Ver
tradicional) junto con estructuras renales que se
figura 1.9), corpúsculo renal (Ver figura 1,8), el cual se
buscaban identificar, tales como glomérulos, cápsulas
compone de glomérulos junto con su respectiva
de Bowman, túbulos y núcleos celulares.
cápsula de Bowman y núcleos celulares. En algunos
casos, la resolución de la figura permitió identificar En las figuras 1.1 y 1.2 en color verde podemos
arterias y membranas celulares. observar a gran escala el tejido renal, sin embargo, en
la figura 1.2 es más fácil notar la cantidad de túbulos
De color rojo se ven referenciados los túbulos renales,
existentes y su interior vacío que ayuda a transportar la
los cuales adquieren una forma circular u ovalada,
orina, además. permitió identificar una arteria que
dependiendo de su cercanía a los glomérulos, son
posiblemente esté relacionada con la anterior
abundantes a lo largo del tejido renal. Su interior se
estructura, sin embargo, en la figura 1.1 fue más fácil
compone de células parietales y tienen un espacio
hallar el corpúsculo renal gracias a su tamaño, pero la
vacío en el centro, debido a que allí se filtra la sangre
cantidad de túbulos es menor, además que pueden
que llega a los riñones (Ver figura 1.3, 1.4, 1.5 ,1.6 y
llegar a confundirse con tejido epitelial.
1.7).
Continuando con las figuras 1.3 y 1.4, al tener un leve
Así mismo, el corpúsculo renal, compuesto por
acercamiento, podemos diferenciar en la figura 1.3 los
glomérulos y una membrana incolora que los rodea
túbulos de las células epiteliales comentadas
llamada cápsula de Bowman. Son estructuras que solo
anteriormente y arterias que se encuentran en su lateral
se encuentran en el aumento de 10 X (Figura 1.1 y
derecho, sin embargo se dificulta ver su interior. En el
1.2), se encuentran señaladas con color amarillo y
caso de la otra imagen (figura 1.4) se detalla más el
verde respectivamente. Al estar compuestas de
interior del túbulo, con ello sus células parietales y en términos de detalles morfológicos en el estudio de
núcleos de células que se encuentran a su alrededor. tejidos.
Por otro lado, en las figuras 1.5 , 1.6 y 1.7 se tiene el V. CONCLUSIONES:
mayor objetivo usado en la práctica, en todas las
imágenes se ven los túbulos a grandes rasgos y demás Finalmente, podemos concluir que la Microscopía
estructuras acompañantes. Sin embargo, en la muestra Óptica de Alta Resolución es la mejor herramienta
tradicional se ve distorsionado el túbulo en su interior para poder observar detalles morfológicos y
y se dificulta ver algo más en el margen que nos estructurales al interior de una muestra, logrando
otorgaba el microscopio, a diferencia de las otras dos caracterizar un tejido con la observación de un grupo
figuras, en donde es más claro identificar la estructura de células.
interna circular del túbulo y a sus alrededores REFERENCIAS
facilitaba ver las membranas celulares junto con sus
núcleos. ● Caldas, M. L., Ricaurte, O., Rodríguez, G., &
CARACTERÍ MOAR TRADICION Amaya, J. (2018, 03 25). Microscopia optica
STICA AL
de alta resolucion Moar. Ministerio de Salud
Tamaño de la Permite Maneja el
muestra obtener espesor general y Protección Social. Retrieved August 15,
muestras de 0,5 de 0.5µ-10µ
- 2 micras (Colombia, s.f) 2022, from
Observación Su calidad de Su resolución https://www.minsalud.gov.co/sites/rid/Lists/Bi
imagen permite solo permite
una mejor enfocar los bliotecaDigital/RIDE/IA/INS/Microscopia-opt
observación de elementos más
detalles en la grandes en la ica%20de%20alta%20resolucion%20Moar.pdf
muestra. imagen, sin
tener en cuenta ● Colombia, E. y. L. d. (s.f., s.f. s.f.). QUE ES
su interior.
UN CORTE HISTOLOGICO. Equipos y
Campo de Puede ser Sólo sería
acción utilizada en pertinente laboratorio de Colombia. Retrieved August
biopsias y usarla en
autopsias. En ocasiones 15, 2022, from
general en donde se
cualquier busquen https://www.equiposylaboratorio.com/portal/a
escenario estructuras de
donde importen gran tamaño o rticulo-ampliado/que-es-un-corte-histologico
las hacer estudios
características a gran escala. ● Megías, M., Molist, P., & Pombal, M. (2019).
específicas y el
detalle. Técnicas Histológicas. 1. Introducción. Atlas
Tabla 1. Comparación entre la Microscopía óptica de
de histología vegetal y animal. Retrieved
alta resolución y la microscopía tradicional.
August 15, 2022, from
Reuniendo el análisis realizado de las muestras y su
respectiva comparación con la literatura, se http://mmegias.webs.uvigo.es/6-tecnicas/1-intr
compilaron las mayores diferencias en la tabla 1, en
donde se buscó hacer una comparación entre ambas oduccion.php
microscopias con el fin de identificar cual es la mejor
● Diccionario de cáncer del NCI. (2011, febrero ● Pawlina, W., & Ross, M. (2015). Ross.
2). Instituto Nacional del Cáncer. Histologia: Texto y atlas (7a ed.). Lippincott
https://www.cancer.gov/espanol/publicaciones Williams & Wilkins.
/diccionarios/diccionario-cancer/def/tubulo-re .
nal
● Lippert, H. (2001). Anatomia 4b* Ed. -
Estructura y Morfologia del Cuerpo Humano.
Marban Libros
También podría gustarte
- Informe 5 Fraccionamiento CelularDocumento9 páginasInforme 5 Fraccionamiento CelularLuis Felipe Alarcon Lobos50% (2)
- Guía de Laboratorio N°1 DIVERSIDAD CELULARDocumento5 páginasGuía de Laboratorio N°1 DIVERSIDAD CELULARMARIA FERNANDA TANGARIFE0% (1)
- Informe de Fraccionamiento CelularDocumento7 páginasInforme de Fraccionamiento CelularNOLOSE100% (1)
- Informe Biologia CelularDocumento11 páginasInforme Biologia CelularDavid Cervantes OrozcoAún no hay calificaciones
- Informe 2 UltraestructuraDocumento5 páginasInforme 2 UltraestructuraAshley PinesAún no hay calificaciones
- 28016-Texto Del Artã Culo-43377-1-10-20191010Documento9 páginas28016-Texto Del Artã Culo-43377-1-10-20191010MARCO ANTONIO TAPIA MALDONADOAún no hay calificaciones
- Informe N°3 Frac. Cel.Documento5 páginasInforme N°3 Frac. Cel.NOLOSEAún no hay calificaciones
- La Microscopía Como Herramienta para La Observación y El Análisis de Células y TejidosDocumento3 páginasLa Microscopía Como Herramienta para La Observación y El Análisis de Células y TejidosKaren GonzalezAún no hay calificaciones
- HistologíaDocumento10 páginasHistologíaVARANI ALEXA MARTINEZ MUÑOZAún no hay calificaciones
- Técnicas de Estudio de La CélulaDocumento8 páginasTécnicas de Estudio de La CélulaKatya BuenrostroAún no hay calificaciones
- Citologia TerminadoDocumento128 páginasCitologia TerminadoAngela SuárezAún no hay calificaciones
- Httpsmiudla - Udla.cluploadscourse Attachmentattachment980211Clase 1 y 2 PDFDocumento41 páginasHttpsmiudla - Udla.cluploadscourse Attachmentattachment980211Clase 1 y 2 PDFKatherine Caceres UrrutiaAún no hay calificaciones
- Laboratorio 5, Microscopia. Morfologia Celular PDFDocumento11 páginasLaboratorio 5, Microscopia. Morfologia Celular PDFLuis MartinezAún no hay calificaciones
- Guia Practica Celula CoarDocumento11 páginasGuia Practica Celula CoarEDILSON ALCIDES VARGAS ARONEAún no hay calificaciones
- Practica 3.2Documento17 páginasPractica 3.2Teresa DíazAún no hay calificaciones
- Práctica de Microscopia Óptica Rúa W & Grisales SDocumento4 páginasPráctica de Microscopia Óptica Rúa W & Grisales SWilson andres Rua PeñaAún no hay calificaciones
- Informe Prácticas Biología Carlos RojasDocumento20 páginasInforme Prácticas Biología Carlos Rojascarlos rojasAún no hay calificaciones
- Análisis Cromosómico HumanoDocumento5 páginasAnálisis Cromosómico HumanoNiko CarreroAún no hay calificaciones
- Técnicas histológicas microscópicasDocumento4 páginasTécnicas histológicas microscópicasPedro Humberto Alvidrez BacaAún no hay calificaciones
- Ultraestructura Celular.docxDocumento6 páginasUltraestructura Celular.docxJUAN FERNANDO SEPULVEDA RODASAún no hay calificaciones
- Identificación de Muestras Histologicas de AnimalesDocumento4 páginasIdentificación de Muestras Histologicas de AnimalesElvis Muñoz RoaAún no hay calificaciones
- Unidad 1 IntroducciónDocumento10 páginasUnidad 1 IntroducciónAndrea DuránAún no hay calificaciones
- Histología 1Documento31 páginasHistología 1Rodríguez RoseAún no hay calificaciones
- Reporte de Practica InmunologiaDocumento9 páginasReporte de Practica InmunologiaAldo Enrique Castañeda CuevasAún no hay calificaciones
- 20 MesoteliomaDocumento6 páginas20 Mesoteliomaanon-101611100% (1)
- Tipos de células: Diferencias entre animales y vegetalesDocumento11 páginasTipos de células: Diferencias entre animales y vegetalesPedro SanchesAún no hay calificaciones
- Histo Resumen Cap 1,2 y 3Documento4 páginasHisto Resumen Cap 1,2 y 3Karen Simone Muñoz RodríguezAún no hay calificaciones
- Organelos celulares en plantas y animalesDocumento20 páginasOrganelos celulares en plantas y animalesMaria Cely05Aún no hay calificaciones
- Informe de Biología #2 - Paola Ardila Guzmán Juan Leguizamon ModeraDocumento7 páginasInforme de Biología #2 - Paola Ardila Guzmán Juan Leguizamon ModeraAngie Paola Ardila GuzmánAún no hay calificaciones
- Células procariotas y eucariotasDocumento11 páginasCélulas procariotas y eucariotasLucero PinedoAún no hay calificaciones
- Estructura y comparación célula eucariota vegetal y animalDocumento7 páginasEstructura y comparación célula eucariota vegetal y animalGiovannaAún no hay calificaciones
- Cromosomas de RatonDocumento2 páginasCromosomas de RatonMartin Galicia CortesAún no hay calificaciones
- Metodos de Estudio de La Biologia Celular y MolecularDocumento21 páginasMetodos de Estudio de La Biologia Celular y MolecularNohelia EspinozaAún no hay calificaciones
- Obtención de Metafase en Muestras de Sangre PeriféricaDocumento8 páginasObtención de Metafase en Muestras de Sangre PeriféricaMarjorie Lizeth Tineo DíazAún no hay calificaciones
- Laboratorio 2 - La CélulaDocumento10 páginasLaboratorio 2 - La CélulaJuan Carlos Portillo VillarruelAún no hay calificaciones
- Medición de Células Por Medio de MicrometríaDocumento8 páginasMedición de Células Por Medio de MicrometríaLauren Robinson100% (1)
- Diferenciación entre Histología, Histopatología y CitologíaDocumento6 páginasDiferenciación entre Histología, Histopatología y CitologíaSonia Huamani AranaAún no hay calificaciones
- Celula FinalDocumento19 páginasCelula FinalJuanCho Marquez0% (1)
- Lab Diversidad CelularDocumento17 páginasLab Diversidad CelularYesid Soto CobosAún no hay calificaciones
- Informe Bio - N°2Documento13 páginasInforme Bio - N°2Sofía Flores SantilliAún no hay calificaciones
- Métodos para el estudio de la célula a nivel microscópicoDocumento80 páginasMétodos para el estudio de la célula a nivel microscópicoCarmen BazanAún no hay calificaciones
- Práctica de Laboratorio - Meiosis y MitosisDocumento5 páginasPráctica de Laboratorio - Meiosis y MitosisFlores Camacho Irlanda ValeriaAún no hay calificaciones
- Laboratorio #2 Celula VegetalDocumento16 páginasLaboratorio #2 Celula VegetalJacob Edwin Valera AspettyAún no hay calificaciones
- Métodos de Estudio de Las Células. Las Células Procariotas y Eucariotas. La Célula Animal y Vegetal y Las Formas AcelularesDocumento5 páginasMétodos de Estudio de Las Células. Las Células Procariotas y Eucariotas. La Célula Animal y Vegetal y Las Formas Acelularesjose montezaAún no hay calificaciones
- Biologia Celular UVM - 1er Practica LaboratorioDocumento14 páginasBiologia Celular UVM - 1er Practica LaboratorioEdgarAún no hay calificaciones
- Informe Cansat Picassat Icman-CsicDocumento3 páginasInforme Cansat Picassat Icman-CsicJuan Vecina SilvaAún no hay calificaciones
- Informe 1 - Variaciones de La CromatinaDocumento13 páginasInforme 1 - Variaciones de La Cromatinaarlet katherine contreras riquelmeAún no hay calificaciones
- Biolog IsDocumento8 páginasBiolog IsStephanie Antonio AguilarAún no hay calificaciones
- Elaboracion de Micropreparados para La Visualizacion de Tejidos y Estructuras CelularesDocumento6 páginasElaboracion de Micropreparados para La Visualizacion de Tejidos y Estructuras CelularesSandra Viviana Santiago SabogalAún no hay calificaciones
- Proyecto-Biología CelularDocumento3 páginasProyecto-Biología CelularlmoralessaAún no hay calificaciones
- Practica 5 Equipo 5Documento8 páginasPractica 5 Equipo 5LUIS JAIME OLIVARES ONTIVEROSAún no hay calificaciones
- Cap 6Documento30 páginasCap 6usuario desconocidoAún no hay calificaciones
- Clase 1 - Introduccion A La HistologíaDocumento42 páginasClase 1 - Introduccion A La HistologíaGAJARDO MUNOZ FLORENCIA ANTONAún no hay calificaciones
- Informe de Fisiologia VegetalDocumento7 páginasInforme de Fisiologia Vegetalbicho1243Aún no hay calificaciones
- Observación de Núcleos de Paramecium, Amebas, Vorticela, DiatomeasDocumento8 páginasObservación de Núcleos de Paramecium, Amebas, Vorticela, DiatomeasNicole valeroAún no hay calificaciones
- GPE Primer Parcial HistoDocumento35 páginasGPE Primer Parcial HistoJesus Beltran Romero ParedesAún no hay calificaciones
- Informe 05 de Biología - FragmentaciónDocumento11 páginasInforme 05 de Biología - FragmentaciónGenny Isabel Geldres PintoAún no hay calificaciones
- Diversidad Celular Informe 2Documento7 páginasDiversidad Celular Informe 2MARIA JOSE CARDONA MENDOZAAún no hay calificaciones
- Informe CebollaDocumento9 páginasInforme CebollaPame BolañosAún no hay calificaciones
- Aplicación de Matemáticas en La MecánicaDocumento3 páginasAplicación de Matemáticas en La MecánicaPEPE PEPEAún no hay calificaciones
- Plantilla Protocolo Individual Sist Digitales Un1Documento7 páginasPlantilla Protocolo Individual Sist Digitales Un1marcotulio9272Aún no hay calificaciones
- Variables2 PDFDocumento19 páginasVariables2 PDFFernando JuarezAún no hay calificaciones
- GUIA DE EJERCICIOS - DISTRIBUCION DE FRECUENCIAS-ejercicio 4Documento3 páginasGUIA DE EJERCICIOS - DISTRIBUCION DE FRECUENCIAS-ejercicio 4CarlosUchihaAún no hay calificaciones
- Instalaciones Mecánicas Especificaciones TécnicasDocumento102 páginasInstalaciones Mecánicas Especificaciones TécnicasIvan Urrutia RomeroAún no hay calificaciones
- Sistema RAFADocumento54 páginasSistema RAFAAngie Fer.Aún no hay calificaciones
- Manual de Instacion Epson L395Documento4 páginasManual de Instacion Epson L395Maximiliano Gaston AmeriAún no hay calificaciones
- AlgoritmosDocumento4 páginasAlgoritmosJorge YpAún no hay calificaciones
- 01 Ejercicios BasicosDocumento2 páginas01 Ejercicios BasicoscocolizoAún no hay calificaciones
- 0601-488 - Ficha Técnica 0601-488Documento2 páginas0601-488 - Ficha Técnica 0601-488fragmentosAún no hay calificaciones
- Trabajo Laura AcevedoDocumento20 páginasTrabajo Laura AcevedoLAURA ISABELLA ACEVEDO QUINTEROAún no hay calificaciones
- HV Roberto VillegasDocumento35 páginasHV Roberto VillegasAndreaKaroVasqueleMartinAún no hay calificaciones
- La Importancia y Aplicaciones Del Diseño de EjesDocumento4 páginasLa Importancia y Aplicaciones Del Diseño de EjesMiguel Amaro100% (1)
- Defectos de Los Embutidos NDocumento3 páginasDefectos de Los Embutidos Nbetto veenAún no hay calificaciones
- Tratamiento Termico Post Soldadura.Documento28 páginasTratamiento Termico Post Soldadura.Leo GastonAún no hay calificaciones
- G3 Ejercicios Cap2Documento30 páginasG3 Ejercicios Cap2Darío Sinchi Torres0% (1)
- Unidad 1 - Fase 2Documento9 páginasUnidad 1 - Fase 2Eliana RodríguezAún no hay calificaciones
- Prueba de Diagnóstico Física 2° MedioDocumento3 páginasPrueba de Diagnóstico Física 2° MedioMarcela Vega Muñoz67% (3)
- Qué Es El Interés CompuestoDocumento15 páginasQué Es El Interés CompuestoLuz ContrerasAún no hay calificaciones
- Cuestionario Gestion de La ProduccionDocumento4 páginasCuestionario Gestion de La ProduccionAnonymous 0Qs8nkeZokAún no hay calificaciones
- Módulo 05. Instalación y Mantenimiento de Motores Eléctricos Monofásicos (INTECAP 2002 Guatemala)Documento151 páginasMódulo 05. Instalación y Mantenimiento de Motores Eléctricos Monofásicos (INTECAP 2002 Guatemala)Krynio PerezAún no hay calificaciones
- Laboratorio de Fisica 7Documento13 páginasLaboratorio de Fisica 7Anderson FuentesAún no hay calificaciones
- Guia 4 Ciencias 3°aDocumento4 páginasGuia 4 Ciencias 3°aYulieth HeToAún no hay calificaciones
- Notación CientíficaDocumento1 páginaNotación CientíficaNuriaSantiagoAún no hay calificaciones
- Ejercicio Uso de Struct y FuncionesDocumento16 páginasEjercicio Uso de Struct y FuncionesNeyib fadulAún no hay calificaciones
- Tecnología CuánticaDocumento13 páginasTecnología CuánticaWilliam H. BoneyAún no hay calificaciones
- Automatización en El Sector AutomotrizDocumento3 páginasAutomatización en El Sector AutomotrizMumulAún no hay calificaciones
- 2 - Espesamiento de Concentrado de Cobre y Molibdeno Rev. 0Documento102 páginas2 - Espesamiento de Concentrado de Cobre y Molibdeno Rev. 0Sebastian Vera100% (1)
- Determinacion Cuantitativa de Pigmentos Fotosinteticos Utilizando Cromatografia en Capa FinaDocumento4 páginasDeterminacion Cuantitativa de Pigmentos Fotosinteticos Utilizando Cromatografia en Capa FinaJUAN CARLOS DROSOS RAMIREZAún no hay calificaciones
- Nodos y PunterosDocumento7 páginasNodos y PunterosAdrian ManjarresAún no hay calificaciones