Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Analisis Quimico Instrumental QMC208: Análisis Químico Instrumental - QMC 208 Primer Examen Parcial - G/01/2023
Cargado por
Fernanda JaldinTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Analisis Quimico Instrumental QMC208: Análisis Químico Instrumental - QMC 208 Primer Examen Parcial - G/01/2023
Cargado por
Fernanda JaldinCopyright:
Formatos disponibles
ANALISIS QUIMICO INSTRUMENTAL
QMC208
Análisis químico instrumental - QMC 208
Primer examen parcial – G/01/2023
martes, 18 de abril de 2023
Resolver los ejercicios planteados considerando siempre la exactitud y precisión,
además no olvidar el número de cifras significantes al reportar los resultados.
1) En un laboratorio se analizaron una serie de disoluciones estándar de plata
por espectrometría de absorción atómica de llama, obteniendo los
resultados que aparecen en el cuadro siguiente:
[Ag] ng/mL 0 5 10 15 20 25 30
A 0,003 0,127 0,251 0,390 0,498 0,625 0,763
a) Determinar la pendiente, la ordenada en el origen y el coeficiente de
determinación de la gráfica de calibración.
Primer parcial QMC 208 Página 1 de 12
ANALISIS QUIMICO INSTRUMENTAL
QMC208
𝑚 = 0,0252
𝑏 = 0,0021
𝑟 2 = 0,9994
Otra forma:
N° [Ag] ng/mL S
X2 Y2 XY
n X Y
1 0 0,003 0 0,000009 0,000
2 5 0,127 25 0,016129 0,635
3 10 0,251 100 0,063001 2,510
4 15 0,390 225 0,152100 5,850
5 20 0,498 400 0,248004 9,960
6 25 0,625 625 0,390625 15,625
7 30 0,763 900 0,582169 22,890
∑X 105 2,657 2275 1,452037 57,470
(𝑛•∑(𝑋•𝑌))−(∑ 𝑋•∑ 𝑌)
m= 2
𝑛•∑ 𝑋 2 −(∑ 𝑋)
(∑ 𝑌•∑ 𝑋 2 )−(∑ 𝑋•∑ 𝑋•𝑌)
b= 2 2
(𝑛•∑ 𝑋 −(∑ 𝑋)
2
(𝑛•∑(𝑋•𝑌)−(∑ 𝑋•∑ 𝑌))
𝑟2 = 2 2 2
(𝑛•∑ 𝑋 2 −(∑ 𝑋) )•(𝑛•(∑ 𝑌 )−(∑ 𝑌) )
Remplazando valores en las fórmulas se obtiene:
m = 0,02516429 → 0,0252
Primer parcial QMC 208 Página 2 de 12
ANALISIS QUIMICO INSTRUMENTAL
QMC208
b = 0,00210714 → 0,0021
r2 = 0,99944349 → 0,9994
b) Se realizó, por triplicado, un análisis de una disolución de plata en las
mismas condiciones que el calibrado anterior, obteniendo
absorbancias de 0,308, 0,314 y 0,312. Calcular la concentración de
la citada disolución.
DATOS
Absorbancia de la muestra: (Respuesta del instrumento “S” a tres alícuotas de la misma
muestra)
0,308 + 0,314 + 0,312
SM = = 0,311333
3
Curva de calibración:
S = mCx + b
Remplazando valores:
0,311333 = 0,025164Cx + 0,00211
0,311333−0,002107
Cx = = 12,288 ng/mL
0,025164
c) Calcular el LOD con los datos experimentales siguientes:
yB = a; sB (= sx/y ) = 0,007, para un ajuste lineal tipo y = a + bx; Luego;
DATOS:
YB = 0,0021 (Señal promedio del blanco)
SB = 𝑆𝑥/𝑦 = 0,007 (Desviación estándar del blanco)
Límite de detección:
Sm = 𝑺bl + k Ss = 0,0021 + 3 * 0,007 = 0,02311
Primer parcial QMC 208 Página 3 de 12
ANALISIS QUIMICO INSTRUMENTAL
QMC208
EL LIMITE DE DETECCION esta dado por:
𝑺𝒎 − 𝑺𝒃𝒍 0,02311−0,00211 𝑛𝑔
𝑪𝒎 = = = 0,835 𝑚𝐿
𝒎 0,02516
Primer parcial QMC 208 Página 4 de 12
ANALISIS QUIMICO INSTRUMENTAL
QMC208
2) S e quiere determinar la concentración de potasio en una partida de
plátanos. Par a él lo s e disuelven 150 g de muestra en 500 m L de
disolución ácida y se calcula la concentración del potasio e n la
disolución mediante la técnica de adiciones estándar tomando cinco
alícuotas de 10 mL de esta disolución a las que se le añaden 0; 5; 10; 15
y 20 mL de una disolución estándar de K1+ de 1,62 𝛍𝐠/𝐦𝐋 llevando
finalmente a un volumen de 100 mL. Las intensidades de emisión
obtenidas se reportan en la tabla.
Volumen del estándar Vs: (en mL) 0 5 10 15 20
Intensidad de emisión: 309 452 600 765 906
Calcule la concentración de K en la muestra problema en 𝜇𝑔/𝑔. Si la
concentración de K+ en el estándar es de 1,62 𝜇𝑔/𝑚𝐿 (Solución: 5,43
𝜇𝑔/𝑔)
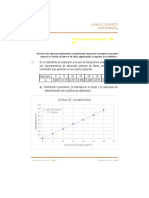
La grafica de los datos se ilustra en la figura siguiente, y en ella se
demuestra que hay una relación lineal entre la señal medida S del
instrumento y volumen añadido del estándar Vs.
Gráficamente:
Primer parcial QMC 208 Página 5 de 12
ANALISIS QUIMICO INSTRUMENTAL
QMC208
m = 30,14
b = 305,00
r2 = 0,9994
Curva de calibración:
S = 30,14Vs + 305,00
r2 = 0,9994
150 g de muestra
+
Solvente
V0 = 500 mL (Solución ácida)
En este problema, Cs = 1,62𝜇𝑔/𝑚𝐿, Vx = 10 mL, y Vt = 100 mL. Cx, puede
calcularse: El valor extrapolado, el volumen de reactivo que corresponde
a la respuesta cero del instrumento, en este caso es de -10,12 mL.
S = 30,14 Vs + 305,00
Si: S = 0 ⇒ 0 = 30,14 (Vs)0 + 305,00
𝟑𝟎𝟓,𝟎𝟎
(Vs)0 = - = - 10,12 mL
𝟑𝟎,𝟏𝟒
(𝑽𝒔 )𝒐• 𝑪𝒔 (𝐕𝐬)𝐨 ∗ 𝐂𝐬 −10,12 𝑚𝐿 ∗1,62𝜇𝑔/𝑚𝐿 𝜇𝑔
𝑪𝒙 = - =- =- = 0,1639
𝑽𝒙 𝐕𝐱 100 𝑚𝐿 𝑚𝐿
𝜇𝑔
= 0,1639 , 𝑽𝒙 = 100 mL
𝑚𝐿
Cx ∗ Vx = Cm Vm
μg
Cx Vx 0,1639 ∗100 mL 𝜇𝑔 1000𝑚𝐿 𝜇𝑔
mL
Cm = = = 1,639 ∗ = 1639
Vm 10mL 𝑚𝐿 𝐿 𝐿
Primer parcial QMC 208 Página 6 de 12
ANALISIS QUIMICO INSTRUMENTAL
QMC208
Masa de K+ en la muestra:
μg
m = 1639 ∗ 0,5L = 819,5 μg
L
𝜇𝑔
5,463
𝑔
Otra forma:
Señal del Instrumento
𝑉𝑠
“S ”
N° X*Y 𝑋2 𝑋2
(𝑒𝑛 𝑚𝐿)
1 0 309 0 0 95481
2 5 452 2260 25 204304
3 10 600 6000 100 360000
4 15 765 11475 225 585225
5 20 906 18120 400 820836
Σ𝑋𝑖 50 3032 37855 750 2065846
Aplicando formulas se obtiene:
(𝑛•∑(𝑋•𝑌))−(∑ 𝑋•∑ 𝑌)
m= 2
𝑛•∑ 𝑋 2 −(∑ 𝑋)
(∑ 𝑌•∑ 𝑋 2 )−(∑ 𝑋•∑ 𝑋•𝑌)
b= 2 2
(𝑛•∑ 𝑋 −(∑ 𝑋)
2
(𝑛•∑(𝑋•𝑌)−(∑ 𝑋•∑ 𝑌))
𝑟2 = 2 2 2
(𝑛•∑ 𝑋 2 −(∑ 𝑋) )•(𝑛•(∑ 𝑌 )−(∑ 𝑌) )
Primer parcial QMC 208 Página 7 de 12
ANALISIS QUIMICO INSTRUMENTAL
QMC208
Se tiene:
m = 30,14
b = 305,00
r2 = 0,9994
Primer parcial QMC 208 Página 8 de 12
ANALISIS QUIMICO INSTRUMENTAL
QMC208
3) 0.4853 g de una muestra problema en la que queremos determinar un
compuesto X, los disolvemos y los llevamos a un matraz de 250 mL
(Disolución A). De esta disolución tomamos 5 mL y los llevamos a un
matraz aforado de 25 mL, enrasando con agua (Disolución B). Tomamos
8 mL de esta disolución y los ponemos en una cubeta cilíndrica, medimos
su concentración por un método instrumental y resulta ser de 5.00 ppm en
la disolución de la cubeta. Calcular la concentración del compuesto X en
el matraz A y el porcentaje de X en la muestra original.
Solución:
m = 0,4853 g. X
V(A) = { + } = 250 mL
Solvente
V(A) = 5 𝑚𝐿
V(B) = { + } = 25 mL
𝑆𝑜𝑙𝑣𝑒𝑛𝑡𝑒
V(B) = 8 𝑚𝐿
V(B) = { + } = 5,00 ppm
𝑀𝑒𝑑𝑖𝑑𝑎 𝐼𝑛𝑠𝑡𝑟𝑢𝑚𝑒𝑛𝑡𝑜
Concentración del compuesto X en un Volumen de VA = 250 mL
C(A) * V(A) = C(B) * V(B)
5,00 ppm ∗ 25 mL
CA = = 25,00 𝑝𝑝𝑚
5 mL
Masa de X.-
𝒎𝒈 𝑿
25,00 𝑳 * 0, 250 L = 6,25 mg X = 0,00625 g X
𝟎,𝟎𝟎𝟔𝟐𝟓
%X= * 100 = 1,29
𝟎,𝟒𝟖𝟓𝟑
Primer parcial QMC 208 Página 9 de 12
ANALISIS QUIMICO INSTRUMENTAL
QMC208
4) Para la determinación de Cu en una aleación se pesa 1,843 g de muestra,
se disuelve y se afora a 500 mL. Se miden 25 mL de esta solución y se
diluye hasta un volumen final de 250 mL. De esta última solución se miden
10 mL y se afora hasta 100 mL, la cual presenta una absorbancia de 0,045.
Por otra parte, se mezclan 10 mL de la última solución diluida, con 20 mL
de una solución patrón que contiene 0,5 ppm de Cu y se diluye a 100 mL.
Esta solución presenta una absorbancia de 0,098. Determine el % de Cu
en la muestra. R: 0,16 %
m = 1,843 g (masa aleación)
+
Solvente
V1 = 500 mL; C1 = ?
V1 = 25 mL 𝐶1 =?
+
Solvente
V2 = 250 mL;
V2 = 10 mL 𝐶2 =?
+
Solvente
V3 = 100 mL; 𝑨𝑽𝟑 = 𝟎, 𝟎𝟒𝟓
𝒎𝒈
𝑪𝟑 = 𝟎, 𝟎𝟒𝟖 𝑳 valor calculado
Aplicando la Ley de Beer – Lamberth
𝑨𝑽𝟑 = 𝜖𝑏𝐶3 Ec. 01
Primer parcial QMC 208 Página 10 de 12
ANALISIS QUIMICO INSTRUMENTAL
QMC208
Por otra parte, se mezclan 10 mL de la última solución diluida, con 20
mL de una solución patrón que contiene 0,5 ppm de Cu y se diluye a
100 mL. Esta solución presenta una absorbancia de 0,098.
V3 = 10 mL; C3 = ?
+
Vs = 20 mL; Cs = 0,5 ppm = 0,5 mg/L (Solución Estándar Cu)
𝑉4 = 100𝑚𝐿
0,5 𝑚𝑔
∗20𝑚𝐿 𝑚𝑔
𝐿
𝐶4 = 𝐶𝑆 + 𝐶3 ⇒ 𝐶𝑠 → 𝑉4 = = 0,1
100 𝑚𝐿 𝐿
𝐶3 ∗10𝑚𝐿
𝐶3 → 𝑉4 = = 0,10𝐶3
100 𝑚𝐿
𝐦𝐠
𝐂𝟒 = 𝟎, 𝟏𝟎𝐂𝟑 + 𝟎, 𝟏 ⇒ 𝑨𝑽𝟒 = 𝟎, 𝟎𝟗𝟖
𝐋
Aplicando la Ley de Beer – Lamberth
𝑨𝑽𝟒 = 𝜖𝑏𝐶4 Ec. 02
Dividiendo la Ec. 01 y 02 miembro a miembro, se tiene:
AV3 εbC3
=
AV4 εbC4
0,045 C3
=
0,098 0,10C3 + 0,1 mg
L
mg
0,0045C3 + 0,0045 = 0,098C3
L
mg
0,0045 = 0,098C3 − 0,0045C3
L
Primer parcial QMC 208 Página 11 de 12
ANALISIS QUIMICO INSTRUMENTAL
QMC208
mg
C3 = 0,04813
L
𝑚𝑔
Con el valor de 𝐶3 = 0,04813 𝑚𝐿 , se tiene:
V2 = 10 mL → V3 = 100 mL
𝑚𝑔
𝐶3 = 0,04813 𝐿
𝑚𝑔
C3 ∗ V3 100𝑚𝐿 ∗ 0,04813 𝐿
C2 ∗ V2 = C3 ∗ V3 ⇒ C2 = =
V2 10𝑚𝐿
𝑚𝑔
= 0,4813 𝐿
V1 = 25 mL → V2 = 250 mL
mg
C2 = 0,4813
L
𝑚𝑔
C2 ∗ V2 250𝑚𝐿 ∗ 0,481 𝐿
C1 ∗ V1 = C2 ∗ V2 ⇒ C1 = =
V3 25𝑚𝐿
𝑚𝑔
𝐶1 = 4,813 𝐿
% de Cu en la muestra.
500 mL 𝑔 4,813 mg
∗ ∗ ∗ 100 = 0,16 %
1,483 𝑔 1000 mg 1000 mL
Primer parcial QMC 208 Página 12 de 12
También podría gustarte
- Formulario Oficial 1er Parcial Fisicoquimica AtkinsDocumento24 páginasFormulario Oficial 1er Parcial Fisicoquimica AtkinsYozzalet LGAún no hay calificaciones
- Informe Nº1Documento10 páginasInforme Nº1Jhonny IbañezAún no hay calificaciones
- Flujograma 9 David Gutierrez CondoriDocumento4 páginasFlujograma 9 David Gutierrez CondoriDavid GutierrezAún no hay calificaciones
- Balance de Materia y EnergíaDocumento3 páginasBalance de Materia y EnergíaCorrecaminos ZuñigaAún no hay calificaciones
- Valvula de Agua BELIMODocumento4 páginasValvula de Agua BELIMOJesús MarquinaAún no hay calificaciones
- Métodos Eléctricos Aplicados A La Exploración de Agua SubterráneaDocumento20 páginasMétodos Eléctricos Aplicados A La Exploración de Agua SubterránearubenAún no hay calificaciones
- Informe 7 Del Laboratorio de Química InorgánicaDocumento18 páginasInforme 7 Del Laboratorio de Química InorgánicaisaacAún no hay calificaciones
- Practica N°5Documento9 páginasPractica N°5mijaheel ferrufinoAún no hay calificaciones
- Informe LaboratorioDocumento19 páginasInforme Laboratorioluis alejandroAún no hay calificaciones
- Practica 1Documento8 páginasPractica 1mayra dayana mamani gonzalesAún no hay calificaciones
- Informe de Organica 2Documento8 páginasInforme de Organica 2Nelson DiazAún no hay calificaciones
- Práctica # 3 Cuestionario Reconocimiento de Cationes Del Grupo I y IIDocumento4 páginasPráctica # 3 Cuestionario Reconocimiento de Cationes Del Grupo I y IIDaniela Maturano100% (1)
- Wa0000Documento8 páginasWa0000Moises Mimo RomeroAún no hay calificaciones
- Fisico Calor 1 Presencacion CADocumento9 páginasFisico Calor 1 Presencacion CAJhonny Yasmani Martinez MejiaAún no hay calificaciones
- Laboratorio FIS 102Documento11 páginasLaboratorio FIS 10215854374Aún no hay calificaciones
- Quimica 104 Práctica 3Documento10 páginasQuimica 104 Práctica 3ShirleyAún no hay calificaciones
- Informe N2 CorregidoDocumento7 páginasInforme N2 CorregidoJhonny IbañezAún no hay calificaciones
- Practica N°4 Principio de ArquimidesDocumento7 páginasPractica N°4 Principio de ArquimidesGilberto Avendaño CanoAún no hay calificaciones
- Informe de Laboratorio N3Documento13 páginasInforme de Laboratorio N3pepeAún no hay calificaciones
- Practica Nº5Documento17 páginasPractica Nº5Michelle BallesterosAún no hay calificaciones
- Practica N 4 (Reparado)Documento9 páginasPractica N 4 (Reparado)Jesus DelgadilloAún no hay calificaciones
- Teoría Del Error InformeDocumento7 páginasTeoría Del Error InformeHenry W. EspíndolaAún no hay calificaciones
- Practica 7Documento3 páginasPractica 7Maria Rojas100% (1)
- Ajuste de CurvasDocumento7 páginasAjuste de Curvas15854374Aún no hay calificaciones
- Practica No 4 Pendulo Fisico 2 2017Documento9 páginasPractica No 4 Pendulo Fisico 2 2017Kevin Abad liquitaya lopezAún no hay calificaciones
- Labo de QMC-104 (Cinetica Quimica)Documento20 páginasLabo de QMC-104 (Cinetica Quimica)Luvinca Daniela Plata AlconAún no hay calificaciones
- Informe 3 ElectroquimicaDocumento9 páginasInforme 3 ElectroquimicaNelson DiazAún no hay calificaciones
- Practica de LB de Electroquimica Tema 2Documento9 páginasPractica de LB de Electroquimica Tema 2Saúl RodríguezAún no hay calificaciones
- Informe 4 Lab Fisicoquimica Presiones KarenDocumento10 páginasInforme 4 Lab Fisicoquimica Presiones KarenJuan Carlos FloresAún no hay calificaciones
- PRACTICA N°5 Determinción de Aldehidos y Cetonas Copacalle RamosDocumento11 páginasPRACTICA N°5 Determinción de Aldehidos y Cetonas Copacalle RamosNahum Agustin Copacalle Ramos ing alimentos100% (1)
- Informe Practica 6Documento3 páginasInforme Practica 6Ana MariaAún no hay calificaciones
- Informe 6Documento19 páginasInforme 6Carol Alicia Gonzales SiñaniAún no hay calificaciones
- En Que Se Basa La Reacción de Zeisel y Cuál Es Su UtilidadDocumento1 páginaEn Que Se Basa La Reacción de Zeisel y Cuál Es Su UtilidadEstrada Mamani MariaAún no hay calificaciones
- TablasDocumento3 páginasTablasjoseAún no hay calificaciones
- Informe Nº4 (Reconocimento de Cationes Del Grupo I y Ii)Documento9 páginasInforme Nº4 (Reconocimento de Cationes Del Grupo I y Ii)Ronal CAún no hay calificaciones
- PracticaDocumento2 páginasPracticaEun Suk KimAún no hay calificaciones
- Informe 5 Lab QMC 200 Destilacion A Presion ReducidaDocumento7 páginasInforme 5 Lab QMC 200 Destilacion A Presion ReducidaAlecita Mendoza100% (1)
- Análisis Químico - Practica #01Documento4 páginasAnálisis Químico - Practica #01FRONDAún no hay calificaciones
- Calculadora de Números de OxidacionDocumento2 páginasCalculadora de Números de OxidacionRobert José Lobatón AlvarezAún no hay calificaciones
- Tarea 3 EstequiometriaDocumento1 páginaTarea 3 EstequiometriaJhonny Ibañez0% (1)
- Destilación FraccionadaDocumento4 páginasDestilación FraccionadaFernanda Zamorano AriasAún no hay calificaciones
- Práctica Nro3 ElectroquimicaDocumento6 páginasPráctica Nro3 ElectroquimicaWilliams Torreón corralAún no hay calificaciones
- Primer CuestionarioDocumento4 páginasPrimer CuestionarioJhonny IbañezAún no hay calificaciones
- 1er Informe Lab Fis 102Documento8 páginas1er Informe Lab Fis 102Eddy Andres Carvajal PadillaAún no hay calificaciones
- Barrio BelenDocumento6 páginasBarrio BelenGemaAún no hay calificaciones
- Reconomientos de CationesDocumento8 páginasReconomientos de CationesJhonny IbañezAún no hay calificaciones
- Ecuacion de BernoulliDocumento10 páginasEcuacion de BernoulliMiguel Angel Arando EstradaAún no hay calificaciones
- Determinación de La Formula de Un HidratDocumento4 páginasDeterminación de La Formula de Un HidratFranny CasasolaAún no hay calificaciones
- Universidad Autónoma Tomás Frías Facultad de Ciencias Puras Carrera de QuimicaDocumento13 páginasUniversidad Autónoma Tomás Frías Facultad de Ciencias Puras Carrera de QuimicaCM DianaAún no hay calificaciones
- Informe Nº5 - 1Documento6 páginasInforme Nº5 - 1Jhonny Ibañez0% (1)
- Resumen EstaticaDocumento2 páginasResumen EstaticaDerek Briones100% (1)
- 1er Informe QMC 100LDocumento7 páginas1er Informe QMC 100LJhoel ChoqueAún no hay calificaciones
- Reporte de Practica 3 Quimica Del CobreDocumento9 páginasReporte de Practica 3 Quimica Del CobreBrandon Etian Barrera ArredondoAún no hay calificaciones
- Destilación Por Arrastre de VaporDocumento11 páginasDestilación Por Arrastre de VaporDavid Montaño PozoAún no hay calificaciones
- Informe Fisica II - UNAC - FIEEDocumento8 páginasInforme Fisica II - UNAC - FIEEBrandon Payano De La CruzAún no hay calificaciones
- Práctica Celda de DaniellDocumento8 páginasPráctica Celda de DanielllasisolAún no hay calificaciones
- Práctica 9 - Campos Magnéticos EstacionariosDocumento17 páginasPráctica 9 - Campos Magnéticos EstacionariosVilla García Alejandra GpeAún no hay calificaciones
- Cuestionario 4 Lab200Documento2 páginasCuestionario 4 Lab200Roberto Caceres DuranAún no hay calificaciones
- Practica #1Documento7 páginasPractica #1Miguel Angel Sejas VillarroelAún no hay calificaciones
- Práctica 3Documento2 páginasPráctica 3Lizbeth CaizaAún no hay calificaciones
- Laboratorio QMC 206 Practica Nº4Documento12 páginasLaboratorio QMC 206 Practica Nº4Jorge Francisco Garabito Erquicia100% (1)
- TAREA Unidad Tematica HidrodinamicaDocumento1 páginaTAREA Unidad Tematica HidrodinamicaEstrada Mamani MariaAún no hay calificaciones
- Analisis Quimico Instrumental QMC208: Análisis Químico Instrumental - QMC 208 Primer Examen Parcial - G/01/2023Documento14 páginasAnalisis Quimico Instrumental QMC208: Análisis Químico Instrumental - QMC 208 Primer Examen Parcial - G/01/2023Fernanda JaldinAún no hay calificaciones
- Cálculo FDocumento3 páginasCálculo FFernanda JaldinAún no hay calificaciones
- 3.celula Procariota1Documento62 páginas3.celula Procariota1marielaAún no hay calificaciones
- 4 Resumen Del PresupuestoDocumento1 página4 Resumen Del PresupuestoFernanda JaldinAún no hay calificaciones
- MDRPIBQ2012002Documento97 páginasMDRPIBQ2012002Fernanda JaldinAún no hay calificaciones
- 2.microscopia y MuestrasDocumento57 páginas2.microscopia y MuestrasJorge Zapana GonzálezAún no hay calificaciones
- Torres de Enfriamiento de Agua Parte 2Documento12 páginasTorres de Enfriamiento de Agua Parte 2Fernanda JaldinAún no hay calificaciones
- Xdoc - MX Introduccion A Las Operaciones de Separacion PDFDocumento3 páginasXdoc - MX Introduccion A Las Operaciones de Separacion PDFWalter VillavicenciaAún no hay calificaciones
- Practica 4 de SimulacionDocumento15 páginasPractica 4 de SimulacionFernanda JaldinAún no hay calificaciones
- 7 Delimitación Del ProyectoDocumento2 páginas7 Delimitación Del ProyectoFernanda JaldinAún no hay calificaciones
- 4 Resumen Del PresupuestoDocumento1 página4 Resumen Del PresupuestoFernanda JaldinAún no hay calificaciones
- FILTRACION Y CENTRIFUGACIOnDocumento14 páginasFILTRACION Y CENTRIFUGACIOnFernanda JaldinAún no hay calificaciones
- Unidad 4 ConductividadDocumento35 páginasUnidad 4 Conductividadfamilia ApazaAún no hay calificaciones
- TJMF R31 01Documento5 páginasTJMF R31 01Fernanda JaldinAún no hay calificaciones
- Ecuación de EstadoDocumento3 páginasEcuación de EstadoFernanda JaldinAún no hay calificaciones
- TJMF R51 01Documento6 páginasTJMF R51 01Fernanda JaldinAún no hay calificaciones
- 1er Trabajo Practico 2-2022Documento2 páginas1er Trabajo Practico 2-2022Fernanda JaldinAún no hay calificaciones
- TJMF R61 01Documento5 páginasTJMF R61 01Fernanda JaldinAún no hay calificaciones
- AletasDocumento4 páginasAletasLeo RojasAún no hay calificaciones
- TJMF R51 01Documento6 páginasTJMF R51 01Fernanda JaldinAún no hay calificaciones
- Equilibrio QuímicoDocumento34 páginasEquilibrio QuímicoRobert100% (5)
- TJMF R61 01Documento5 páginasTJMF R61 01Fernanda JaldinAún no hay calificaciones
- Cap - 5 - Equilibrio Químico - PpsDocumento28 páginasCap - 5 - Equilibrio Químico - PpsJavier TeránAún no hay calificaciones
- Rol Exam - Finales-2°instancia Qil 2.2022Documento2 páginasRol Exam - Finales-2°instancia Qil 2.2022Fernanda JaldinAún no hay calificaciones
- 4.celula EucariotaDocumento69 páginas4.celula EucariotamarielaAún no hay calificaciones
- Fluidos IdealesDocumento11 páginasFluidos IdealesManuel Mendoza100% (1)
- Sucre - Bolivia 2022Documento3 páginasSucre - Bolivia 2022Fernanda JaldinAún no hay calificaciones
- Guía de La Práctica #1Documento3 páginasGuía de La Práctica #1Fernanda JaldinAún no hay calificaciones
- Datos 202302-P1Documento2 páginasDatos 202302-P1Fernanda JaldinAún no hay calificaciones
- P4 Labprq350 1.2023 G3Documento21 páginasP4 Labprq350 1.2023 G3Fernanda JaldinAún no hay calificaciones
- Cápsulas de Gelatina Dura y SuaveDocumento2 páginasCápsulas de Gelatina Dura y SuaveMarelyn GarcíaAún no hay calificaciones
- Especies LepidopterosDocumento50 páginasEspecies LepidopterosYunior Mendoza YlchaAún no hay calificaciones
- Polimerización Vía EmulsiónDocumento4 páginasPolimerización Vía EmulsiónJohn SchilleciAún no hay calificaciones
- NMX C 160 Onncce 2008Documento11 páginasNMX C 160 Onncce 2008Gismo CamachoAún no hay calificaciones
- Asfaltos NaturalesDocumento105 páginasAsfaltos NaturalesPajuelo Carlos100% (1)
- IsómerosDocumento5 páginasIsómerosYoraxis RodriguezAún no hay calificaciones
- Captación de Energía en Las FototrofasDocumento4 páginasCaptación de Energía en Las FototrofasHildebrandt AlfonsoAún no hay calificaciones
- Informe #7Documento5 páginasInforme #7camila lopera peraltaAún no hay calificaciones
- Tecnicas de PrecipitacionDocumento3 páginasTecnicas de PrecipitacionDaniel Del Valle100% (1)
- Ensayo de ChispasDocumento3 páginasEnsayo de ChispasCarlos Chacon DiazAún no hay calificaciones
- Cuenca Tampico - MisantlaDocumento46 páginasCuenca Tampico - MisantlamvergelAún no hay calificaciones
- PropilenoDocumento11 páginasPropilenoGael HammidAún no hay calificaciones
- Comportamiento Del Campo Electrico Dentro de Materiales DielectricosDocumento8 páginasComportamiento Del Campo Electrico Dentro de Materiales DielectricosLatiegAún no hay calificaciones
- t6 Reproduccion de La Celula Al Organismo PDFDocumento56 páginast6 Reproduccion de La Celula Al Organismo PDFmarajAún no hay calificaciones
- Trabajo D QuimicaDocumento5 páginasTrabajo D QuimicaLILIANA RUBIO ROMEROAún no hay calificaciones
- 1.1.4 (1) - Formulación y Nomenclatura InorgánicaDocumento40 páginas1.1.4 (1) - Formulación y Nomenclatura InorgánicaMitsuki LiAún no hay calificaciones
- Composicion Quimica Del Mucilago Del CafeDocumento18 páginasComposicion Quimica Del Mucilago Del CafeJuan Carlos GarzonAún no hay calificaciones
- Calentamiento OhmicoDocumento19 páginasCalentamiento OhmicoJorge Kure100% (1)
- BoletÍ N 2018 - 8 Instalaciones de GasDocumento6 páginasBoletÍ N 2018 - 8 Instalaciones de GasDonald FelipezAún no hay calificaciones
- Analgesic OsDocumento71 páginasAnalgesic OsArual Kilegna Azem SogrubAún no hay calificaciones
- Tesis ExperimentalDocumento63 páginasTesis ExperimentalChristian SanchezAún no hay calificaciones
- Reporte 2 SofiDocumento20 páginasReporte 2 SofiMiguel BedoyaAún no hay calificaciones
- Aldehà Dos y Cetonas DiapositivasDocumento92 páginasAldehà Dos y Cetonas DiapositivasJhonatan Stiven Ortega RamirezAún no hay calificaciones
- Catalogo Polymec SLDocumento32 páginasCatalogo Polymec SLjlct2009Aún no hay calificaciones
- Taller 3 Laci Gabriel Williams AlexDocumento7 páginasTaller 3 Laci Gabriel Williams Alexfmk342112Aún no hay calificaciones
- Fisiología de La Secreción de Insulina y GlucagónDocumento2 páginasFisiología de La Secreción de Insulina y GlucagónJahir Ortega RuizAún no hay calificaciones
- Manual Uso y Cuidado 233d1597p006Documento46 páginasManual Uso y Cuidado 233d1597p006eduasoft senseiAún no hay calificaciones
- Cristalizacion Del Sulfato de CobreDocumento8 páginasCristalizacion Del Sulfato de CobreDaniela GomezAún no hay calificaciones