Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Química Unidad 2
Cargado por
Martina VegaDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Química Unidad 2
Cargado por
Martina VegaCopyright:
Formatos disponibles
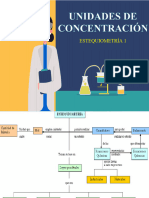
Química Unidad 2:
Las cantidades de materia se expresan en unidades de medida:
Masa Kg, gr, ug, mg
Volumen L, mL, cm3, m3.
Densidad Kg, L, mL
Concentración %m/m %v/v %p/v M
La hipótesis de Avogadro establece que el mismo volumen de gases, en
igualdad de condiciones de temperatura y presión, tiene el mismo número de
partículas.
La constante o número de Avogadro corresponde a 6,023 exp 23. Este se
determinó gracias a la coulombimetría, que relaciona la carga de un mol de
electrones con la carga individual de un electrón.
Un mol es la cantidad de sustancia que contiene el número de Avogadro de
esa especie (partícula, moléculas, átomos)
1 mol de una especie química = 6,023 x 1023 unidades de esa especie =
masa molar en g de esa especie
Un mol = masa molar (g)
Masa molar = N° de Avogadro
Un mol es la cantidad de materia que contiene el número de Avogadro.
Soluciones químicas:
Una solución o disolución corresponde a una mezcla homogénea de dos o más
componentes, los cuales se encuentran diluidos.
Disolución soluto + solvente.
Soluto: sustancia que se encuentra en menor cantidad, es disuelto.
Solvente: se encuentra en mayor cantidad, por lo tanto, disuelve.
El agua es un disolvente universal, pues es el que diluye más sustancias, pero
solo aquellas que sean polares; sustancias apolares se disuelven con solventes
apolares.
Concentración: expresa la cantidad de soluto en una disolución. Se mide en:
Molaridad, %m/m %m/v
% m/m = masa del soluto/masa de solución x 100
% m/m = masa del soluto/100 g de solución
% m/v = masa del soluto/volumen de solución x 100
% m/v = masa del soluto/100 mL de solución
M = Molaridad = Moles de soluto/Litros de solución
Diluciones:
Al diluir un soluto en un solvente, cambia la concentración, es decir, la cantidad
de soluto en relación al solvente, pero no la cantidad de soluto.
La dilución de una concentración es la solución de concentración menor a
partir de una de concentración mayor.
Preparar disolución a partir de un soluto sólido:
Encender balanza
Colocar navecilla en la balanza.
Tarar la balanza.
Masar el soluto en la balanza.
Traspasar el soluto a un vaso precipitado.
Disolver con pequeña cantidad de agua destilada.
Trasvasijar a matraz aforado.
Agregar solvente hasta el aforo.
Tapar matraz y homogenizar.
Extra:
En %m/m no se llega hasta el aforo del matraz, pues trabajamos con las
medidas indicadas.
En %m/v sí llegamos hasta el aforo.
Lo concentrado se trabaja con dispensador y lo diluido con pipeta.
El diluir 10 veces significa multiplicar el volumen inicial por 10.
Cuando un problema dice que lleva una solución “a 50 mL”, quiere decir
que llega al aforo (en caso de ser %m/v)
En una disolución, el Mi es mayor que el Mf y el Vi es menor que el Vf.
También podría gustarte
- Molaridad y MolalidadDocumento9 páginasMolaridad y Molalidad.:("*"BLacK BuLLeT"*"):.88% (16)
- Soluciones MCC11Documento7 páginasSoluciones MCC11Kevin ToledoAún no hay calificaciones
- Cálculo de Preparación de Disoluciones CLASE 05Documento41 páginasCálculo de Preparación de Disoluciones CLASE 05William Lopez PerezAún no hay calificaciones
- SolucionesDocumento37 páginasSolucionesGerald Paul Chumpitaz HuanquiAún no hay calificaciones
- Concentraciones de SolucionesDocumento11 páginasConcentraciones de SolucionesMIGUELAún no hay calificaciones
- 7 HojasDocumento18 páginas7 HojasGilbert GómezAún no hay calificaciones
- Poesia 26 de Mayo MajitoDocumento38 páginasPoesia 26 de Mayo MajitoVanessa Guizelly Olvea ZapanaAún no hay calificaciones
- Disoluciones Y CONCENTRACIÓNDocumento43 páginasDisoluciones Y CONCENTRACIÓNzumitos.jugoAún no hay calificaciones
- Laboratorio 1 de Bioquimica - Disoluciones y Su Importancia en Celulas SanguineasDocumento6 páginasLaboratorio 1 de Bioquimica - Disoluciones y Su Importancia en Celulas Sanguineaslaurien vegaAún no hay calificaciones
- Practica 1 Laboratorio de SolucionesDocumento6 páginasPractica 1 Laboratorio de SolucionesMANUEL ANDRES VILLANUEVA LEONAún no hay calificaciones
- So Luci OnesDocumento32 páginasSo Luci OnesEliezer ChulinAún no hay calificaciones
- Soluciones 2023Documento27 páginasSoluciones 2023Elizabeth AngelesAún no hay calificaciones
- Modulo Iii - Sesion 4 - QuimicaDocumento16 páginasModulo Iii - Sesion 4 - QuimicaYESSICAAún no hay calificaciones
- Expresiones de La ConcentracionNDocumento22 páginasExpresiones de La ConcentracionN.:("*"BLacK BuLLeT"*"):.100% (5)
- Semana 5 SolucionesDocumento22 páginasSemana 5 SolucionesJosh OyolaAún no hay calificaciones
- DILUCIONESDocumento50 páginasDILUCIONESMARIA CAMILA MARIN NIETOAún no hay calificaciones
- Tema 9. Disoluciones, Diluciones y Densidad.Documento4 páginasTema 9. Disoluciones, Diluciones y Densidad.AndreaAún no hay calificaciones
- Disoluciones 2 MedioDocumento31 páginasDisoluciones 2 MedioChristian Navarro TriviñosAún no hay calificaciones
- Unidad 2 AgroquimicaDocumento21 páginasUnidad 2 AgroquimicagerardoAún no hay calificaciones
- Unidades de ConcentracionDocumento24 páginasUnidades de ConcentracionNielsBohr RamirezAún no hay calificaciones
- Lab-N 3-DisolucionesDocumento5 páginasLab-N 3-Disoluciones9s5mbk8dn9Aún no hay calificaciones
- Guía Concentración de Las DisolucionesDocumento5 páginasGuía Concentración de Las Disolucioneswilson rodriguezAún no hay calificaciones
- Q.A. 1.4 Soluciones-ConcentracionDocumento46 páginasQ.A. 1.4 Soluciones-ConcentracionclarisbethAún no hay calificaciones
- L Uuuuuuu Uuuu UuuuuuuDocumento12 páginasL Uuuuuuu Uuuu UuuuuuuRenan Angel Sanchez CernaAún no hay calificaciones
- QUIMICA-Clase 07-Soluciones - Unidades de ConcentraciónDocumento44 páginasQUIMICA-Clase 07-Soluciones - Unidades de ConcentraciónDavid VasquezAún no hay calificaciones
- SolucionesDocumento9 páginasSolucionesJim AvilaAún no hay calificaciones
- Septimo Informe de Laboratorio de QUIMICA GENERALDocumento13 páginasSeptimo Informe de Laboratorio de QUIMICA GENERALferfarg12Aún no hay calificaciones
- Disoluciones 2 MedioDocumento28 páginasDisoluciones 2 MedioGlealmary SilvaAún no hay calificaciones
- Quimica Informe N 8Documento16 páginasQuimica Informe N 8Lizeth Miranda BerrocalAún no hay calificaciones
- Propiedades Generales de La SolucionesDocumento10 páginasPropiedades Generales de La SolucionesAlvaro PizarroAún no hay calificaciones
- Unidad 1 SolucionesDocumento41 páginasUnidad 1 SolucionesKaren Martín Rozas SanAún no hay calificaciones
- Grupo4 QuimicaDocumento27 páginasGrupo4 QuimicaAngie CrucesAún no hay calificaciones
- Material CienciasDocumento5 páginasMaterial CienciasIgnacio Antonio Huircán SotoAún no hay calificaciones
- SolucionesDocumento35 páginasSolucionesRebeca Abreu CuadraAún no hay calificaciones
- Guia Disoluciones (Tema 3)Documento12 páginasGuia Disoluciones (Tema 3)Gabriela ContrerasAún no hay calificaciones
- Informe de Practica3Documento20 páginasInforme de Practica3Leria CordeliaAún no hay calificaciones
- Soluciones, Molaridad y NormalidadDocumento9 páginasSoluciones, Molaridad y NormalidadAlexandraAún no hay calificaciones
- Soluciones, Molaridad y NormalidadDocumento9 páginasSoluciones, Molaridad y NormalidadAlexandraAún no hay calificaciones
- Qui MicaDocumento31 páginasQui MicaKathe AlvarezAún no hay calificaciones
- Unidad - 4.disoluciones y Propiedades ColigativasDocumento54 páginasUnidad - 4.disoluciones y Propiedades ColigativasConsueloAndreaRiquelmeCarrascoAún no hay calificaciones
- 2° Medio - Disoluciones QuímicasDocumento21 páginas2° Medio - Disoluciones QuímicasacyutaAún no hay calificaciones
- Soluciones QuímicasDocumento35 páginasSoluciones QuímicasDiego WalAún no hay calificaciones
- Informe 5 Grupo 1 Labq Ing MinasDocumento16 páginasInforme 5 Grupo 1 Labq Ing MinasSebastian ZevallosAún no hay calificaciones
- Power de SolucionesDocumento13 páginasPower de SolucionesPool Ankori QuilcaAún no hay calificaciones
- Unidades de Concentracion y Soluciones 3aDocumento47 páginasUnidades de Concentracion y Soluciones 3atakit osAún no hay calificaciones
- Electivo Química Disoluciones GUIA. Unidades de Concentración FisicasDocumento4 páginasElectivo Química Disoluciones GUIA. Unidades de Concentración FisicasJohana TipanAún no hay calificaciones
- Practica 5 Preparacion de SolucionesDocumento9 páginasPractica 5 Preparacion de SolucionesDaniela Elizabeth Pérez ReséndizAún no hay calificaciones
- Preparacion y Valoracion de SolucionesDocumento4 páginasPreparacion y Valoracion de SolucionesLeonel100% (1)
- 2 Informe LabQuimicaGeneralDocumento6 páginas2 Informe LabQuimicaGeneralvalentina valentinarr2000hotmail.comAún no hay calificaciones
- DisolucionesDocumento19 páginasDisolucionesCieloAún no hay calificaciones
- Curso+Lab+Teoria Sesión+3 SolucionesDocumento49 páginasCurso+Lab+Teoria Sesión+3 SolucionesAlma UrrutiaAún no hay calificaciones
- SOLUCIONES PREPERACION Y TITULACION NuevoDocumento15 páginasSOLUCIONES PREPERACION Y TITULACION NuevoZayrha AcostaAún no hay calificaciones
- La Concentración Es La Magnitud FisicoDocumento9 páginasLa Concentración Es La Magnitud FisicoLeonidas MianoAún no hay calificaciones
- MolaridadDocumento5 páginasMolaridadMauricio Catalan RojasAún no hay calificaciones
- Unidades Físicas de Concentración de Las SolucionesDocumento11 páginasUnidades Físicas de Concentración de Las SolucionesNAHOMY ALEXANDRA MEZA ALFAROAún no hay calificaciones
- PREPARACION DE SOLUCIONES TeoriaDocumento3 páginasPREPARACION DE SOLUCIONES TeoriaClaudio Sayago100% (1)
- Guía Concentraciones y Propiedades ColigativasDocumento13 páginasGuía Concentraciones y Propiedades ColigativasTinxsAún no hay calificaciones
- Solucionesquimicas 120602171917 Phpapp01Documento20 páginasSolucionesquimicas 120602171917 Phpapp01Cecilia Parraga AlavaAún no hay calificaciones
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDe EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadAún no hay calificaciones
- Constante de Ionización (Química)Documento1 páginaConstante de Ionización (Química)Martin AvilesAún no hay calificaciones
- Informe de Laboratorio 6Documento2 páginasInforme de Laboratorio 6Mateo Castrillon vegaAún no hay calificaciones
- PH, Simulador para Cálculos de Acides.Documento3 páginasPH, Simulador para Cálculos de Acides.Profesor de químicaAún no hay calificaciones
- Guía Práctica 4 - Virtual - Soluciones - Diluciones y PHDocumento8 páginasGuía Práctica 4 - Virtual - Soluciones - Diluciones y PHJames BenavidesAún no hay calificaciones
- Imperfecciones en La Estructura CristalinasDocumento21 páginasImperfecciones en La Estructura CristalinasMario ManciaAún no hay calificaciones
- Interpretación de Cromatogramas de HPLCDocumento9 páginasInterpretación de Cromatogramas de HPLCcatherine suazo candiaAún no hay calificaciones
- PH y Acides de Los AlimentosDocumento7 páginasPH y Acides de Los Alimentoshalo1sAún no hay calificaciones
- Pre-Informe Trabajo Final G01Documento6 páginasPre-Informe Trabajo Final G01Jorge Luis CastilloAún no hay calificaciones
- QUIMICA ANALITICA - SolucionesDocumento6 páginasQUIMICA ANALITICA - SolucionesManu Almeyda CubaAún no hay calificaciones
- Volumetria Por RetrocesoDocumento11 páginasVolumetria Por RetrocesoJoseph Alexander Vega JuradoAún no hay calificaciones
- Informe QUIMICA n6 Daymer1 XDDocumento8 páginasInforme QUIMICA n6 Daymer1 XDRoyer Quispe BejarAún no hay calificaciones
- 5.0 GravimetríaDocumento29 páginas5.0 GravimetríaAntony TabaresAún no hay calificaciones
- Syllabus de Curso Química Analítica e InstrumentalDocumento12 páginasSyllabus de Curso Química Analítica e Instrumentalfelipe salamancaAún no hay calificaciones
- Metodo DSC en Excel (Davies Swann y Campey)Documento6 páginasMetodo DSC en Excel (Davies Swann y Campey)ALeDuckBoanergesAún no hay calificaciones
- Pre 4 Termo LL Marcela AndradeDocumento6 páginasPre 4 Termo LL Marcela AndradeMarcela AndradeAún no hay calificaciones
- Examen PHDocumento2 páginasExamen PHBeatriz Sanchéz LopesAún no hay calificaciones
- Practica de Laboratorio Semana 13 - Grupo 3Documento18 páginasPractica de Laboratorio Semana 13 - Grupo 3Liga Distrital DE Los Baños DEL IncaAún no hay calificaciones
- Guia de Actividades y Rúbrica de Evaluación - Unidad 1 - Tarea 2 - Principios Cromatográficos-2Documento16 páginasGuia de Actividades y Rúbrica de Evaluación - Unidad 1 - Tarea 2 - Principios Cromatográficos-2Diana MejíaAún no hay calificaciones
- PREPARACIÓN Y ESTANDARIZACIÓN DE SOLUCIÓN DE HCL FINALDocumento13 páginasPREPARACIÓN Y ESTANDARIZACIÓN DE SOLUCIÓN DE HCL FINALCarlos RodriguezAún no hay calificaciones
- Insumos Fiscalizados (Informe Técnico)Documento25 páginasInsumos Fiscalizados (Informe Técnico)Armando Rivas92% (13)
- LibroReacAcBasEsqMonp UNAMDocumento79 páginasLibroReacAcBasEsqMonp UNAMMartha Lilia Leon NorisAún no hay calificaciones
- Determinación de PH y Acidez Titulable TotalDocumento5 páginasDeterminación de PH y Acidez Titulable TotalEvelyn MalcaAún no hay calificaciones
- Equilibrio Químico. KC y KP: 1.-La Constante de Equilibrio KDocumento2 páginasEquilibrio Químico. KC y KP: 1.-La Constante de Equilibrio KLuis Mario 607 Vasquez RomeroAún no hay calificaciones
- Analisis CualitativoDocumento40 páginasAnalisis CualitativoEnith QuispeAún no hay calificaciones
- Sacha Labot N°5Documento29 páginasSacha Labot N°5Elizabeth VelasquezAún no hay calificaciones
- Silabus Quimica Medicinal IIDocumento14 páginasSilabus Quimica Medicinal IILuz Novoa OrdoñezAún no hay calificaciones
- Práctica Ácidos BasesDocumento4 páginasPráctica Ácidos Basesmarnah79Aún no hay calificaciones
- Equilibrio Químico y PHDocumento20 páginasEquilibrio Químico y PHamanda grimaldoAún no hay calificaciones
- Capítulo 2 - Equilibrio QuímicoDocumento41 páginasCapítulo 2 - Equilibrio QuímicoandreaAún no hay calificaciones
- Arcata, Informe Pruebas de Sedimentacion Mineral MacarenaRelaves, 06-12-12 - Final-Usuario - PDFDocumento12 páginasArcata, Informe Pruebas de Sedimentacion Mineral MacarenaRelaves, 06-12-12 - Final-Usuario - PDFMary Elyzabeth Loayza MedinaAún no hay calificaciones