BIOMOLECULAS
PROTEÍNAS
• Las proteínas son las biomoléculas
orgánicas más abundantes en las
células. Todas las proteínas
contienen carbono, oxígeno,
hidrógeno y nitrógeno; además, la
mayoría contiene azufre y, algunas,
fosforo, hierro, cinc y cobre.
• Composición: Las proteínas son
grandes moléculas formadas por la
unión de subunidades más
pequeñas llamadas aminoácidos.
• Existen 20 aminoácidos diferentes y El enlace se produce entre el grupo carboxilo
todos tienen una estructura básica de un aminoácido y el amino del siguiente;
idéntica: un grupo amino, un grupo esta unión libera una molécula de agua. Este
carboxilo y un carbono central enlace es covalente y se denomina enlace
unido a un radical que varia de un
aminoácido a otro. peptídico.
Debido a ello, a las moléculas formadas las
podemos denominar también polipéptidos.
�� Características de las proteínas
• Las proteínas forman
soluciones coloidales que
pueden precipitar en
coágulos, al añadir
sustancias ácidas o básicas,
o cuando se calientan; así
sucede con la albúmina del
huevo. Algunas pueden
cristalizar, como el
citocromo, que transporta
electrones en las reacciones
que se producen durante la
respiración celular.
� Clasificación de las proteínas
Las proteínas se pueden clasificar en dos grandes grupos:
proteínas simples y proteínas conjugadas.
• Las proteínas simples u holoproteínas están formadas
exclusivamente por cadenas de polipéptidos; por tanto, su
hidrolisis produce únicamente aminoácidos. Entre las
holoproteínas más conocidas están las del grupo de las
albuminas.
• Las proteínas conjugadas o heteroproteínas están formadas
por cadenas de péptidos unidas a otro tipo de compuestos
que reciben el nombre de grupo prostético. Si el grupo
prostético es un glúcido; la heteroproteína la denominamos
glucoproteína; si es una sustancia lipídica recibe el nombre de
lipoproteína. En la organización en el espacio de una proteína,
podemos distinguir cuatro niveles o estructuras que son
sucesivamente mas complejos. Estas estructuras son:
�� ORGANIZACIÓN PRIMARIA: estructura primaria
• Es la secuencia única de amino
ácidos que se mantienen juntos
por enlaces peptídicos en cada
proteína. Esta estructura
determina la estructura
tridimensional de la proteína
• Hay 20 amino ácidos y pueden
estar arreglados en cualquier
orden, este orden o secuencia en
la cual los amino ácidos son
arreglados está determinado por
la secuencia de bases en los
nucleótidos en el ADN.
• Cada organismo tiene sus propias
y únicas proteínas.
� Organización secundaria: estructura
secundaria
• Se da cuando la cadena de
aminoácidos se pliega sobre si
misma, se establecen puentes
de hidrogeno en diferentes
partes de la molécula y esta
adquiere una estructura
Tridimensional
• Esta es creada por la formación
de enlaces de hidrógeno entre el
O del grupo carboxilo de una
aminoácido y el H del grupo
amino del otro aminoácido.
• Las dos configuraciones más
comunes de la estructura
secundaria son la hélice α
(cabello, uñas y plumas) y la hoja
plegada β (seda).
� Organización terciaria: estructura
terciaria
Se da en aquellas proteínas en que
la estructura secundaria se pliega
sobre si misma. Los enlaces mas
importantes que
mantienen la estructura terciaria
son los puentes de hidrogeno entre
cadenas laterales y los puentes
disulfuro entre aquellas zonas de la
proteína en las que existen átomos
de azufre. Un ejemplo es la
mioglobina en los músculos de los
vertebrados.
� Organización cuaternaria:
estructura cuaternaria
• Es la única que incluye múltiples
cadenas de polipéptidos las cuales se
unen por enlaces covalentes para
formar una sola estructura.
• Las proteínas de estructura
cuaternaria incluyen grupos
prostéticos o no polipéptidicos.
• Estas proteínas son llamadas
conjugadas.
• La hemoglobina es una proteína
conjugada, contiene 4 cadenas
polipéptidicas, cada una de las cuales
contienen grupos prostéticos
llamados hemos, los cuales contienen
átomos de hierro par unirse al
oxígeno.
• Todos los enlaces mencionados en las
otras 3 estructuras se encuentran en
este nivel.
� Desnaturalización de las proteínas
• Cuando las proteínas son
sometidas a la acción del calor o a
valores de pH extremos, pierden
su configuración tridimensional y,
por tanto, sus propiedades físicas
y su funciones biológicas.
• A este proceso lo conocemos con
el nombre de desnaturalización
de la proteína.
• Las posibilidades de combinación
en cuanto al numero y tipo de
aminoácidos que se unen en las
cadenas son muy numerosas.
• De ahí la gran variedad de
funciones que desempeñan las
proteínas.
�� PROTEÍNAS: EJEMPLOS
Estructura y función
�Proteínas
�• Cada proteína tiene una secuencia de
aminoácidos concreta.
• De ella depende que la molécula se
pliegue correctamente, es decir, que
adquiera su correcta conformación.
• Cualquier error en la posición de los
aminoácidos puede provocar que la
proteína no se pliegue correctamente y,
por tanto, que no tenga la estructura
tridimensional que le permite realizar su
función. Esto puede alterar el
funcionamiento de todo el organismo. Por
este motivo, el análisis de la secuencia de
aminoácidos puede ayudar en el desarrollo
de pruebas diagnosticas y terapias
eficaces. Por ejemplo, el cambio de un
aminoácido por otro en la molécula de
hemoglobina provoca la anemia
falciforme.
• En la anemia falciforme los glóbulos rojos
están deformados porque el aminoácido
cambiado respecto a la hemoglobina
normal hace que la molécula se pliegue de
manera incorrecta.
• Los glóbulos rojos son mas frágiles y se
rompen con facilidad, lo que provoca la
anemia.
�Aminoácidos
���Ejemplos de enzimas y cómo funciona
una enzima
�� Mecanismo de acción
El conjunto de procesos por medio de los cuales los enzimas
catalizan las reacciones, recibe el nombre de mecanismo de
acción y depende de la composición, de la estructura de los
enzimas, y también de la especificidad que tienen por el
sustrato.
En este dibujo vemos representado el mecanismo de acción de
un enzima.
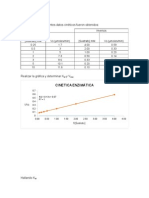
�� Cinética enzimática
• Para conocer más detalladamente el
mecanismo de acción de los enzimas,
estudiamos la velocidad de las reacciones
que catalizan y los factores que modifican
esta velocidad. A este estudio lo
denominamos cinética enzimática.
La velocidad máxima que alcanza una
reacción depende de la concentración de
enzima y la de sustrato. Mientras la
concentración de enzima se mantiene
constante, la de sustrato cambia a medida
que se transforma en producto.
Por este motivo, la concentración de sustrato
es un factor que modifica la velocidad a lo
largo de la reacción. Otros factores
importantes son la temperatura, el pH y la
presencia de inhibidores.
� La concentración de sustrato
En la mayoría de las reacciones catalizadas por
enzimas, la relación entre la velocidad y la
concentración de sustrato describe una curva,
en la que distinguimos tres etapas:
A. La velocidad aumenta linealmente con el
incremento de la concentración de sustrato.
B. El incremento de la concentración de
sustrato produce un aumento mucho menor
de la velocidad.
C. Si la concentración de sustrato es muy
elevada, el incremento de la velocidad es
despreciable y consideramos que la velocidad
tiene un valor constante. En esta etapa, la
velocidad alcanza el valor máximo.
Las diferencias de velocidad en cada una de
estas etapas se explican por el predominio de
una de las formas posibles del enzima: en
forma libre, sin combinar con el sustrato; o en
forma combinada, formando el complejo
enzima-sustrato.
�Aunque durante toda la reacción el enzima se encuentra en las dos formas, la
concentración de ambas es diferente según la etapa de la reacción.
� La temperatura
En el efecto de la temperatura sobre la velocidad
de la reacción se distinguen tres etapas:
A. La velocidad de la reacción aumenta con la
temperatura.
B. La velocidad alcanza su valor máximo, que
corresponde a la temperatura optima.
C. En la mayoría de los enzimas, la velocidad de la
reacción empieza a descender a partir de los 60 °C
aproximadamente.
El aumento de la temperatura produce un
incremento de la energía cinética de las
moléculas.
Esta favorece los choques entre las moléculas de
enzima y de sustrato, y la inestabilidad
de los enlaces. De este modo, se favorece la
actividad enzimática y aumenta la velocidad
de reacción hasta que llega al valor máximo.
� El pH
La valores de pH modifican la actividad de los
enzimas. Para la mayoría de enzimas, la
representación de la variación de la velocidad
de reacción respecto a la variación de pH da
una curva como la de la derecha.
Podemos observar que el pH optimo se sitúa
entre 7 y 7,5. En el caso de pH extremos, por
debajo de 4 y por encima de 10, los enzimas
se desnaturalizan.
Algunos enzimas desarrollan su actividad
máxima en valores extremos de pH, porque
es el valor del medio donde se localizan.
Es el caso de la pepsina, un enzima que
participa en la digestión y que tiene un pH
optimo en torno a 2. Los cambios de pH
modifican el estado de ionización de los
grupos funcionales, sobre todo los del
enzima. Por ello, pequeñas variaciones
de pH producen cambios de velocidad
notables.
� Los inhibidores
En las células hay unas
sustancias, en algunos casos
parecidas al sustrato, que se
caracterizan porque pueden
unirse al enzima de forma
reversible y producir una
disminución de la velocidad de
la reacción. Estas sustancias que
interfieren en la actividad de los
enzimas son los inhibidores.
Los inhibidores se clasifican en
competitivos y no competitivos: