Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Diagrama de Flujo Equilibrio Cinetico
Cargado por
Evelyn Lizbeth Rodriguez SalazarTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Diagrama de Flujo Equilibrio Cinetico
Cargado por
Evelyn Lizbeth Rodriguez SalazarCopyright:
Formatos disponibles
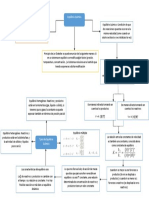
K >1 K<1
EQUILIBRIO QUÍMICO El equilibrio se El equilibrio se
desplazará hacia la desplazará a la
derecha y favorecerá izquierda y favorecerá
a los productos. a los reactivos.
Se define como FACTORES QUE
AFECTAN
Proceso dinámico donde las
velocidades de las reacciones directa La concentración de
o inversa se igualan, y las reactivos y productos, la
presión, el volumen, la Constante de equilibrio
concentraciones netas de los temperatura
reactivos y productos permanecen
constantes
PRINCIPIO DE LE CHÂTELIER
Estudia el comportamiento de las
El sistema desplaza su posición de
equilibrio de modo que se Las reacciones que no han alcanzado el equilibrio se
Reacciones contrarreste el efecto de la utiliza el cociente de reacción Qc. Para determinar el
perturbación, hasta alcanzar un sentido de la reacción basta comparar el valor de ambas
nuevo estado de equilibrio magnitudes Qc y Kc.
Pueden ser
Irreversibles Reversibles
Qc > Kc
AB (Reacción directa) A B (Reacción directa) Qc < Kc
Para alcanzar el equilibrio,
Las leyes de equilibrio AB (Reacción inversa) Donde a, b, c y d son coeficientes Para alcanzar el equilibrio, los los productos deben
estequiométricos de las especies reactivos deben transformarse transformarse en reactivos
químico no son
La cantidad de sustancias del reactivas A, B, C y D. en productos y la reacción neta y la reacción neta procede
aplicables en esta
reactivo y del producto son procede hacia la derecha hacia la izquierda.
reacción
constantes
Qc = Kc
Ley de acción de masas Las concentraciones
iniciales son
Evelyn Lizbeth Rodriguez Salazar
A una temperatura constante, una relación concentraciones de
determinada de concentraciones de reactivos y equilibrio; el sistema está
productos tiene un valor constante Kc llamado en equilibrio
constante de equilibrio
MANUEL ROJAS TIPULA
ANIE RODRIGUEZ VEGA
También podría gustarte
- Equilibrio QuimicoDocumento7 páginasEquilibrio QuimicoKAREN MONSERRAT FRANCO ACHARAún no hay calificaciones
- Equilibrio Quimico PDFDocumento19 páginasEquilibrio Quimico PDFANA MARIA DIAZ BONILLAAún no hay calificaciones
- Cuadro SinopticoDocumento4 páginasCuadro SinopticoAline liraAún no hay calificaciones
- Equilibrio QuimicoDocumento19 páginasEquilibrio QuimicoPatricia QuirogaAún no hay calificaciones
- Mapa Conceptual - Equilibrio Químico - DANIELA ESTRADA SEVERIANODocumento5 páginasMapa Conceptual - Equilibrio Químico - DANIELA ESTRADA SEVERIANODaniela Estrada Severiano100% (1)
- Marco Teórico - Práctica DirigidaDocumento4 páginasMarco Teórico - Práctica DirigidaJuan CastañedaAún no hay calificaciones
- Equilibrio Químico PDFDocumento19 páginasEquilibrio Químico PDFCarlosAún no hay calificaciones
- Tarea Quimica AnaliticaDocumento1 páginaTarea Quimica AnaliticaIsa UrbinaAún no hay calificaciones
- Análisis químico y equilibrioDocumento36 páginasAnálisis químico y equilibrioAngel David Mamani GuardiaAún no hay calificaciones
- Mapa Conceptual Equilibrio QuímicoDocumento1 páginaMapa Conceptual Equilibrio QuímicoSaletYabour0% (1)
- LeyAcciónMasasEquilibrioQuímicoDocumento3 páginasLeyAcciónMasasEquilibrioQuímicoAlvaro De La Roca GutarraAún no hay calificaciones
- Quimica U9Documento3 páginasQuimica U9Valentino MorosiniAún no hay calificaciones
- Equilibrio Químico 1nfografia 1Documento1 páginaEquilibrio Químico 1nfografia 1mramireznegreteAún no hay calificaciones
- Semana 11. Equilibrio QuimicoDocumento35 páginasSemana 11. Equilibrio QuimicoAlexander DuránAún no hay calificaciones
- Equilibrio QuimicoDocumento2 páginasEquilibrio QuimicoClayton JairoAún no hay calificaciones
- Q10 EquilibrioQuimico BDocumento11 páginasQ10 EquilibrioQuimico Bfmartineznavarro7343Aún no hay calificaciones
- Apuntes U1 FQ IIDocumento26 páginasApuntes U1 FQ IIAranza DavilaAún no hay calificaciones
- Mapa MentalDocumento1 páginaMapa MentalYaritza MendozaAún no hay calificaciones
- Química General 2 (4 Unidades)Documento35 páginasQuímica General 2 (4 Unidades)Rodrigo Ignacio Chacon RivasAún no hay calificaciones
- Equilibrio - 2do c2012Documento11 páginasEquilibrio - 2do c2012LndIngenieria0% (1)
- Quimica U9Documento3 páginasQuimica U9Paul Mijael Perez DiazAún no hay calificaciones
- TEMA 6-CompletoDocumento50 páginasTEMA 6-CompletoJose Luis ValenciaAún no hay calificaciones
- Equilibrio Químico: Factores que Afectan la PosiciónDocumento5 páginasEquilibrio Químico: Factores que Afectan la PosiciónFacundo zarachoAún no hay calificaciones
- Equilibrio Quíimico y Principio de Le ChatelierDocumento11 páginasEquilibrio Quíimico y Principio de Le Chateliercamila obandoAún no hay calificaciones
- T 7 EquilibrioDocumento8 páginasT 7 EquilibrioJaime De VillaAún no hay calificaciones
- Actividad 1.1a Mapa ConceptualDocumento1 páginaActividad 1.1a Mapa ConceptualJuan RamónAún no hay calificaciones
- CUADRO CINETICAdocxDocumento4 páginasCUADRO CINETICAdocxKatya BuenrostroAún no hay calificaciones
- Informe Principio de Le ChatelierDocumento8 páginasInforme Principio de Le ChatelierAndres Camilo GVAún no hay calificaciones
- Equilibrio Químico Clase1Documento16 páginasEquilibrio Químico Clase1kdaguileraAún no hay calificaciones
- Informe Equilibrio QuimicoDocumento8 páginasInforme Equilibrio Quimico23780798alejaAún no hay calificaciones
- Constante de equilibrio y cociente de reacciónDocumento8 páginasConstante de equilibrio y cociente de reacciónEmily SeguraAún no hay calificaciones
- Equilibrio QuimicoDocumento14 páginasEquilibrio QuimicoAlex AguinagaAún no hay calificaciones
- COo2goWzalK5Ej2s_PbiixzE-459bIR_3-Módulo 4 - Lectura 2 (13)Documento25 páginasCOo2goWzalK5Ej2s_PbiixzE-459bIR_3-Módulo 4 - Lectura 2 (13)Natalia ChurquinaAún no hay calificaciones
- Equilibrio QuimicoDocumento8 páginasEquilibrio QuimicoMaria Chantal CarballoAún no hay calificaciones
- Equilibrop QuímicoDocumento29 páginasEquilibrop QuímicoMANUEL ELIAS SALGUERO FERNANDEZAún no hay calificaciones
- Equilibrio Químico.Documento35 páginasEquilibrio Químico.pamrvAún no hay calificaciones
- Equilibrio MolecularDocumento9 páginasEquilibrio MolecularDeysi CamachoAún no hay calificaciones
- Eq Qco - 2023 CompletoDocumento22 páginasEq Qco - 2023 CompletoMicaela GonzálezAún no hay calificaciones
- Equilibrio químico: Factores que afectan la constante de equilibrio KcDocumento42 páginasEquilibrio químico: Factores que afectan la constante de equilibrio KcPaty Fong IngunzaAún no hay calificaciones
- Tema - 06 - Equilibrio QuímicoDocumento13 páginasTema - 06 - Equilibrio QuímicoMaria RegeneaAún no hay calificaciones
- 07 Equilibrio 2 BachDocumento2 páginas07 Equilibrio 2 BachNuclearcakeAún no hay calificaciones
- Practica 3 - Equilibrio Químico - Principio de Le ChatelierDocumento16 páginasPractica 3 - Equilibrio Químico - Principio de Le ChatelierVictor Johann Miramón PérezAún no hay calificaciones
- Equilibrio 2021Documento6 páginasEquilibrio 2021Patricio PalummoAún no hay calificaciones
- Equilibrio Químico 2023 IIDocumento56 páginasEquilibrio Químico 2023 IIPamela Leslie CTAún no hay calificaciones
- T7 Eq GuionDocumento2 páginasT7 Eq GuionElena Yauyo QuispeAún no hay calificaciones
- P2017 Equilibrio químicoDocumento4 páginasP2017 Equilibrio químicoRoberto FernandezAún no hay calificaciones
- Semana 13equil - QuimicolxrevDocumento13 páginasSemana 13equil - QuimicolxrevAnderAún no hay calificaciones
- Equilibrio QuímicoDocumento5 páginasEquilibrio QuímicoDANIELA CAMEJOAún no hay calificaciones
- Mapa Conceptual Equilibrio QuímicoDocumento1 páginaMapa Conceptual Equilibrio Químicobraae100% (5)
- Importante Trabajo de Equilibri Qui 1Documento19 páginasImportante Trabajo de Equilibri Qui 1Anonymous OrRURipAún no hay calificaciones
- Ley Debye Huckel Fuerza Iónica Equilibrio QuímicoDocumento36 páginasLey Debye Huckel Fuerza Iónica Equilibrio QuímicoDAVID ISRAEL SANTI CHAGALLANAún no hay calificaciones
- Equilibrio QuímicoDocumento43 páginasEquilibrio Químicotu maiAún no hay calificaciones
- CicloalcanosDocumento45 páginasCicloalcanosEDISON PALMAAún no hay calificaciones
- Mapa Conceptual Doodle A Mano MulticolorDocumento1 páginaMapa Conceptual Doodle A Mano MulticolorMonserrat MarroquínAún no hay calificaciones
- 9-Equilibrio Quimico IDocumento45 páginas9-Equilibrio Quimico Ivalentina buendiaAún no hay calificaciones
- Wuolah-free-TEMA 6_ Equilibrio Químico (Mat. Honor) _ QuímicaDocumento9 páginasWuolah-free-TEMA 6_ Equilibrio Químico (Mat. Honor) _ Químicaluciamonterogallard30Aún no hay calificaciones
- Equilibrio QuímicoDocumento24 páginasEquilibrio QuímicoCarolina PeñúñuriAún no hay calificaciones
- Clase Equilibrio Químico UJAP 2020Documento9 páginasClase Equilibrio Químico UJAP 2020Ivan VAún no hay calificaciones
- C4 Equilibrio QuimicoDocumento52 páginasC4 Equilibrio QuimicoLocaAún no hay calificaciones
- Equilibrio Químico, KPS, Efecto Ion Común - QG-G4-VIERNES 8-10 - 00 AMDocumento15 páginasEquilibrio Químico, KPS, Efecto Ion Común - QG-G4-VIERNES 8-10 - 00 AMEvelyn Lizbeth Rodriguez SalazarAún no hay calificaciones
- InsectosDocumento3 páginasInsectosEvelyn Lizbeth Rodriguez SalazarAún no hay calificaciones
- MedioCursoEGral II 21Documento3 páginasMedioCursoEGral II 21Evelyn Lizbeth Rodriguez SalazarAún no hay calificaciones
- TrichodermaDocumento2 páginasTrichodermaEvelyn Lizbeth Rodriguez SalazarAún no hay calificaciones
- Flujograma Cinetico Quimica Qg-ViernesDocumento6 páginasFlujograma Cinetico Quimica Qg-ViernesEvelyn Lizbeth Rodriguez SalazarAún no hay calificaciones
- Ejercicios Propuestos-12-Qg-MartesDocumento4 páginasEjercicios Propuestos-12-Qg-MartesEvelyn Lizbeth Rodriguez SalazarAún no hay calificaciones
- Laboratorio de Acido BaseDocumento9 páginasLaboratorio de Acido BaseJose Gabriel Caamaño100% (1)
- Bioquimica Practica 2Documento11 páginasBioquimica Practica 2VivianaAún no hay calificaciones
- Reacciones ácido-base neutralizaciónDocumento2 páginasReacciones ácido-base neutralizaciónKate Aylín Patlán LunaAún no hay calificaciones
- Unidad 2 Plus Buffers 2021 COMPARTIR NovDocumento64 páginasUnidad 2 Plus Buffers 2021 COMPARTIR NovPaola Karina Caballero MedinaAún no hay calificaciones
- Qma-111-U3 Guía de LecturaDocumento14 páginasQma-111-U3 Guía de LecturaLorna GonzálezAún no hay calificaciones
- Solucion A La PracticaDocumento14 páginasSolucion A La Practicaalexander beltranAún no hay calificaciones
- Alternativa A Experimento 03Documento2 páginasAlternativa A Experimento 03ROSSEMERY MELISSA ENRRIQUEZ SIGÜENZAAún no hay calificaciones
- Presentacion - Bioquimica - Del - PH - S3 - Teoria 2023aDocumento29 páginasPresentacion - Bioquimica - Del - PH - S3 - Teoria 2023aSUCAPUCA MARUYAMA DIANA VICTORIA DE ROCIOAún no hay calificaciones
- Practica 8 - PH Del SueloDocumento6 páginasPractica 8 - PH Del SueloJeam Jonathan Cabanillas CordovaAún no hay calificaciones
- Práctica Nº04 - Identificación de Ácido - BaseDocumento5 páginasPráctica Nº04 - Identificación de Ácido - Basejhoana terrones torresAún no hay calificaciones
- Acidos y Bases CaracteristicasDocumento15 páginasAcidos y Bases CaracteristicasSanta Alia100% (1)
- Guía Grado Noveno PH y pOHDocumento2 páginasGuía Grado Noveno PH y pOHplacido10100% (1)
- Formulario 1Documento1 páginaFormulario 1alan696Aún no hay calificaciones
- Fundamentos TeoricosDocumento3 páginasFundamentos TeoricosMario YassAún no hay calificaciones
- Solucionario Guía Reacciones Ácido Base PDFDocumento6 páginasSolucionario Guía Reacciones Ácido Base PDFdanielAún no hay calificaciones
- Ácidos y bases: concepto, características y ejemplosDocumento7 páginasÁcidos y bases: concepto, características y ejemplosClaudia Miriam RamosAún no hay calificaciones
- Actividad 15-ACIDO-BASEDocumento3 páginasActividad 15-ACIDO-BASEJoseph Diaz QAún no hay calificaciones
- 30 Ejercicios de Redox Nernst, Equilibrio Quimico y Constante de EquilibrioDocumento11 páginas30 Ejercicios de Redox Nernst, Equilibrio Quimico y Constante de EquilibrioBraan Brandon Brandi100% (1)
- PH Soluciones BufferDocumento37 páginasPH Soluciones BufferJordan Torres RiveraAún no hay calificaciones
- Acidos y BasesDocumento8 páginasAcidos y BasesRonny Ordoñez BustosAún no hay calificaciones
- Manual Ácido BaseDocumento31 páginasManual Ácido BasePaulo Alejandro Araos BritoAún no hay calificaciones
- Titulacion Acido-BaseDocumento5 páginasTitulacion Acido-BaseJose SierraAún no hay calificaciones
- Cinética de Hidrólisis del Acetato de EtiloDocumento5 páginasCinética de Hidrólisis del Acetato de EtiloAlberto Salgado Carmona100% (1)
- Practica 10 Procedimiento PDFDocumento20 páginasPractica 10 Procedimiento PDFAngie JaimesAún no hay calificaciones
- Practica Est and Ariza C I OnDocumento19 páginasPractica Est and Ariza C I OnAngie Lizeth Pancho PoloAún no hay calificaciones
- El Papel Indicador UniversalDocumento7 páginasEl Papel Indicador UniversalLaura Rodríguez NeiraAún no hay calificaciones
- Ejercicios Sobre Volumetría ÁcidoDocumento3 páginasEjercicios Sobre Volumetría ÁcidoJose Cervantes RuizAún no hay calificaciones
- 5 EQUILIBRIO DE Iones ComplejosDocumento6 páginas5 EQUILIBRIO DE Iones ComplejosConstanza VilchesAún no hay calificaciones
- Taller 6 Titulaciones Acido BaseDocumento2 páginasTaller 6 Titulaciones Acido BaseSoportes JulioAún no hay calificaciones
- 3-4 Tipos de EquilibrioDocumento9 páginas3-4 Tipos de EquilibrioMax Bryan Rodriguez GarciaAún no hay calificaciones
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (200)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Reconstrucción de dientes endodonciados: Pautas de actuación clínicaDe EverandReconstrucción de dientes endodonciados: Pautas de actuación clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Neurociencia para vencer la depresión: La esprial ascendenteDe EverandNeurociencia para vencer la depresión: La esprial ascendenteCalificación: 4.5 de 5 estrellas4.5/5 (10)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Desastres y emergencias. Prevención, mitigación y preparaciónDe EverandDesastres y emergencias. Prevención, mitigación y preparaciónCalificación: 4 de 5 estrellas4/5 (5)
- El libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)De EverandEl libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)Calificación: 3 de 5 estrellas3/5 (2)
- Prescripción de ejercico físico para la saludDe EverandPrescripción de ejercico físico para la saludCalificación: 5 de 5 estrellas5/5 (1)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Trucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasDe EverandTrucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasCalificación: 4.5 de 5 estrellas4.5/5 (3)
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)