Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Guía Práctica No 3 - Fundamentos Biología Molecular May-Sept 2020
Cargado por
Sebastian ZuritaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Guía Práctica No 3 - Fundamentos Biología Molecular May-Sept 2020
Cargado por
Sebastian ZuritaCopyright:
Formatos disponibles
GUÍA PARA LAS PRÁCTICAS DE LABORATORIO, CÓDIGO DE
TALLER O CAMPO DOCUMENTO:
DCIV-GUI-2019-V1-
008
CIENCIAS DE LA VIDA Y LA
DEPARTAMENTO: AGRICULTURA
CARRERA: ☐ Ing. Agropecuaria ☒ Ing. Biotecnología
PERIODO
ASIGNATURA: Fundamentos de Biología Molecular MAY20-SEPT-20 NIVEL: IV
LECTIVO:
DOCENTE: Dra. Karina Proaño NRC: PRÁCTICA N°: 3
LABORATORIO DONDE SE DESARROLLARÁ LA PRÁCTICA LABORATORIOS MULTIDISCIPLINARIOS
TEMA DE LA
EXTRACCIÓN CASERA DE AC. NUCLEICOS
PRÁCTICA:
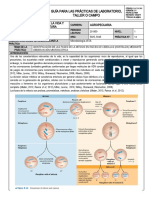
INTRODUCCIÓN:
El DNA es la molécula que guarda el código genético de todas las células, sin importar que el organismo sea multicelular o
unicelular, eucariota o procariota, todos tiene el DNA como vehículo de su código genético. Como el DNA se encuentra en todas
las células de los seres vivos, incluyendo los vegetales, se puede extraer esta molécula a partir de una fruta que se puede obtener
fácilmente. El proceso de extracción de DNA desde una célula es el primer paso para muchos procedimientos (protocolos) de los
laboratorios de biotecnología.
OBJETIVOS:
Identificar las etapas del proceso de extracción casera de DNA.
Conocer la técnica y/o procedimiento que se debe seguir para realizar una extracción casera con DNA.
MATERIALES:
INSUMOS:
REACTIVOS:
2 tazas o vasos plásticos de 200 mL
Champú o Lavaplatos
Cucharita plástica 5 mL
Sal de mesa
Cuchara sopera plástica (10 mL)
Agua destilada
Filtro cónico de café o varias capas de gasa para hacer un
Alcohol frío (guardado en el freezer)
filtro
Pipeta Pasteur plástica
Tubo de ensayo
Varilla de vidrio pequeña
Plátano u otra fruta o verdura (kiwi, coliflor, cebolla)
EQUIPOS:
Licuadora
MUESTRA:
Plátano u otra fruta o verdura (kiwi, coliflor, cebolla).
INSTRUCCIONES:
1. Utilice mandil en cada una de las prácticas, éste debe estar perfectamente abrochado y sólo destinado para este
laboratorio.
2. Utilice guantes en cada una de las prácticas, estos deben desecharse inmediatamente después de terminado el
laboratorio.
3. Coloque sus pertenencias personales en un sitio que no incomode el paso y no produzca contaminación.
4. Lávese meticulosamente las manos y brazos con agua y jabón antes y después de cada práctica. Utilice desinfectante al
final. Repita este procedimiento incluso cuando salga del laboratorio por un breve periodo.
5. Limpie la mesa con desinfectante antes y después de cada práctica, colocando luego todos los materiales en el mismo
lugar.
6. Al concluir cada laboratorio, deje todas las instalaciones y equipos de forma ordenada y limpia. Comunique al profesor o
encargado sobre cualquier equipo defectuoso. Habrán recipientes destinados al papel y material de desechos de
laboratorio.
7. Asegúrese que todos los equipos eléctricos estén desconectados antes de salir del laboratorio.
8. Lea detenidamente las instrucciones de los equipos y reactivos antes de utilizarlos.
9. No se permite comer, beber, fumar o masticar chicle en el laboratorio.
10. Mantenga sus manos alejadas del rostro y cabello mientras trabaja.
11. Mantenga su pelo recogido del fuego del mechero y si es posible recogido.
CODIGO: FRM 6.3 REV. UPDI: 2019-nov-21
GUÍA PARA LAS PRÁCTICAS DE LABORATORIO, CÓDIGO DE
TALLER O CAMPO DOCUMENTO:
DCIV-GUI-2019-V1-
008
12. No transporte, mueva o saque del laboratorio equipos, medios o cultivos microbianos.
13. Trate de permanecer en su lugar de trabajo. No de vueltas innecesarias, así evitará accidentes y confusión
ACTIVIDADES POR DESARROLLAR:
1. En una licuadora, mezclar un plátano pelado con una taza de agua destilada durante 15-20 segundos, hasta que se
produzca una mezcla homogénea. No licuar por mucho tiempo porque se puede romper el ADN. Si no se tiene una
licuadora se puede moler bien el plátano con un tenedor junto con el agua.
2. En una taza preparar una solución con una cucharadita de champú y dos pizcas de sal de mesa. Puedes usar champú o
lavaplatos de diferentes marcas para comparar la eficiencia de la extracción al final del experimento. Agregar 20 mL (4
cucharaditas) de agua destilada o llenar la taza hasta 1/3.
3. Disolver la sal y el champú mezclando lentamente con la cuchara sin producir espuma.
4. Agregar a la solución preparada en el paso 2, tres cucharas soperas llenas de la mezcla de plátano (u otra fruta) del paso
1. Mezclar la solución con la cuchara por 5 a 10 minutos sin producir espuma.
5. Colocar el filtro de café en una segunda taza. Dobla la orilla del filtro alrededor de la taza, para que el filtro no toque el
fondo de la taza y el líquido se junte al fondo.
6. Filtrar la mezcla vertiéndola en el filtro y deja pasar la solución durante varios minutos hasta tener aproximadamente 5 mL
de filtrado para la prueba (que cubra el fondo de la taza).
7. Llenar un tubo de ensayo con el alcohol frío que tenías guardado en el freezer. Si no tienes freezer, mantén el alcohol en
hielo. Para mejores resultados el alcohol debe estar lo más frío posible
8. Llenar la pipeta plástica con la solución filtrada de plátano.
9. Agregar la solución al alcohol. Déjala reposar por 2-3 minutos sin perturbarla. Es importante no agitar el tubo de ensayo.
10. Anotar en el cuaderno de registro su uso respectivo.
TOMAR EN CUENTA:
11. Se puede observar el precipitado blanco del DNA en la capa de alcohol. El DNA tiene apariencia de una sustancia mucosa
blanca y filamentosa.
RESULTADOS OBTENIDOS:
Describir la función que realiza cada reactivo utilizado en la práctica.
Adjuntar como cuestionario:
- Comparar las preparaciones obtenidas a partir de diferentes frutas o verduras. ¿Tienen todas las mismas cantidades de DNA?
- ¿Qué habría pasado si antes de agregar la solución de DNA al alcohol la hubieras agitado fuertemente? ¿Por qué?
CONCLUSIONES:
Con el conocimiento derivado de sus observaciones, indique conclusiones sobre la extracción casera.
RECOMENDACIONES:
Describa recomendaciones de cómo evitar degradar el DNA extraído.
NOTA: Incluir BIBLIOGRAFÍA. Siguiendo las instrucciones del manual detalle cada una de las direcciones electrónicas y consultas
bibliográficas realizadas.
FIRMAS
F: ……………………………………………. F: ………………………………………………. F: ……………………………………………………
Nombre: Dra. Karina Proaño, Ph.D. Nombre: Nombre: Dra. Patricia Jiménez, Ph.D.
Docente Coordinador de Área de Conocimiento Jefe de Laboratorios Multidisciplinarios
CODIGO: FRM 6.3 REV. UPDI: 2019-nov-21
También podría gustarte
- Manual de practicas de laboratorio de MicrobiologíaDe EverandManual de practicas de laboratorio de MicrobiologíaCalificación: 4 de 5 estrellas4/5 (7)
- 11 Guia para Practicas de Laboratorio DCVA ACTUALDocumento3 páginas11 Guia para Practicas de Laboratorio DCVA ACTUALEsteban GarcesAún no hay calificaciones
- SCREENING FITOQUÍMICO DE TANINOS y SAPONINAS - GUIADocumento3 páginasSCREENING FITOQUÍMICO DE TANINOS y SAPONINAS - GUIAJefferson CriolloAún no hay calificaciones
- Lab 13Documento2 páginasLab 13Danny CevallosAún no hay calificaciones
- Trampas de ArrozDocumento2 páginasTrampas de Arrozpepe67% (9)
- 2 - QPN GUÍA 2-Signed-SignedDocumento3 páginas2 - QPN GUÍA 2-Signed-Signedagalban2Aún no hay calificaciones
- PRÁCTICA N 3 - USO DE LA CENTRÍFUGA, MICROPIPETAS Y MEDICIÓN DEL Ph-SignedDocumento2 páginasPRÁCTICA N 3 - USO DE LA CENTRÍFUGA, MICROPIPETAS Y MEDICIÓN DEL Ph-SignedASHLEY GUAMANTAQUIAún no hay calificaciones
- Tema - Técnicas de FlotaciónDocumento3 páginasTema - Técnicas de FlotaciónMarilys RendónAún no hay calificaciones
- P6. Permeabilidad MembranaDocumento2 páginasP6. Permeabilidad MembranaAbigail CarrascoAún no hay calificaciones
- GUIA LABORATORIO 1-Signed-SignedDocumento2 páginasGUIA LABORATORIO 1-Signed-SignedGIULLIANNA ALEJANDRA CRIOLLO CEVALLOSAún no hay calificaciones
- Guía para El Desarrollo Del Componente Práctico - Fase 4 - Actividad de Apropiación. Realizar Práctica de LaboratorioDocumento16 páginasGuía para El Desarrollo Del Componente Práctico - Fase 4 - Actividad de Apropiación. Realizar Práctica de LaboratorioHector Fabio DuranAún no hay calificaciones
- 02 Guia Separacion de LinfocitosDocumento3 páginas02 Guia Separacion de LinfocitosSophyAraujoAún no hay calificaciones
- Guía para El Desarrollo Del Componente Práctico - Fase 4 - Actividad de Apropiación - Práctica de LaboratorioDocumento16 páginasGuía para El Desarrollo Del Componente Práctico - Fase 4 - Actividad de Apropiación - Práctica de LaboratorioTania SalgueroAún no hay calificaciones
- Guía para El Desarrollo Del Componente Práctico - Fase 4 - Actividad de Apropiación - Práctica de LaboratorioDocumento16 páginasGuía para El Desarrollo Del Componente Práctico - Fase 4 - Actividad de Apropiación - Práctica de LaboratorioCataliaAún no hay calificaciones
- GUIA LAB 5-SignedDocumento3 páginasGUIA LAB 5-SignedJenny S-boomAún no hay calificaciones
- Guia 3. Filtracion Cristalizacion y Sublimacion de Compuestos OrganicosDocumento4 páginasGuia 3. Filtracion Cristalizacion y Sublimacion de Compuestos OrganicosKaren GonzalezAún no hay calificaciones
- Práctica para Extracción de DNA Por Método CaseroDocumento3 páginasPráctica para Extracción de DNA Por Método CaseroAlanis Yossie Duran NuñezAún no hay calificaciones
- Extracción de Terpenos (1) - Signed-Signed-SignedDocumento2 páginasExtracción de Terpenos (1) - Signed-Signed-Signedameliacoro09Aún no hay calificaciones
- Práctica Biotecnología No3Documento2 páginasPráctica Biotecnología No3fran asanzaAún no hay calificaciones
- Determinación de GrasaDocumento3 páginasDeterminación de GrasaDiana G RoseroAún no hay calificaciones
- GUIA #4 Cultivo y Aislamiento de BacteriasDocumento15 páginasGUIA #4 Cultivo y Aislamiento de BacteriasSara RomeroAún no hay calificaciones
- Práctica Biotecnología No 4Documento2 páginasPráctica Biotecnología No 4fran asanzaAún no hay calificaciones
- Extracción de ADN PDFDocumento2 páginasExtracción de ADN PDFOmayda SerranoAún no hay calificaciones
- Guía de Laboratorio - Citología e Histologia Vegetal - 202251Documento3 páginasGuía de Laboratorio - Citología e Histologia Vegetal - 202251Kevin Jefferson BalladaresAún no hay calificaciones
- GUIA Extracción de ADNDocumento4 páginasGUIA Extracción de ADNLiliana Burgos TrianaAún no hay calificaciones
- Extracción de ADN, Cuantificación y ElectroforesisDocumento11 páginasExtracción de ADN, Cuantificación y ElectroforesisSantiago Santos JaraAún no hay calificaciones
- BITACORA PRACTICA 1 (Recuperado Automáticamente)Documento4 páginasBITACORA PRACTICA 1 (Recuperado Automáticamente)AlejandroAún no hay calificaciones
- Laboratorio 2 Extracción de ADN para FirmaDocumento5 páginasLaboratorio 2 Extracción de ADN para FirmaEduardo ParedesAún no hay calificaciones
- Práctica No.3. MA-Gastronomía. HACCPDocumento5 páginasPráctica No.3. MA-Gastronomía. HACCPcarlina mesaAún no hay calificaciones
- Extraccion de Adn PlatanoDocumento11 páginasExtraccion de Adn Platanolady.toapanta9365Aún no hay calificaciones
- Práctica Screening FlavonoidesDocumento2 páginasPráctica Screening FlavonoidesJefferson CriolloAún no hay calificaciones
- Guia de Laboratorio Bioquimica ..RediseñoDocumento12 páginasGuia de Laboratorio Bioquimica ..RediseñoRicachi NxrAún no hay calificaciones
- Lab FrutoDocumento3 páginasLab FrutoAmy MorejónAún no hay calificaciones
- SCGDI505 Gui769a para Pra769cticas de Laboratorio Taller o Campo TalloDocumento9 páginasSCGDI505 Gui769a para Pra769cticas de Laboratorio Taller o Campo TalloIka AllanAún no hay calificaciones
- Lab 14Documento5 páginasLab 14Danny CevallosAún no hay calificaciones
- Práctica de Laboratorio 2-Mecatronica 7683 - AlumnoDocumento4 páginasPráctica de Laboratorio 2-Mecatronica 7683 - AlumnoRonald CatagñaAún no hay calificaciones
- Biotecnologia (Practicario)Documento30 páginasBiotecnologia (Practicario)Maryan Lizetth Quirarte SainzAún no hay calificaciones
- Sem 14 Uso de MicropipetaDocumento9 páginasSem 14 Uso de MicropipetaJennifer Obregon LopezAún no hay calificaciones
- Extraccion de Adn en CebollaDocumento12 páginasExtraccion de Adn en CebollaMartha Callejas Montoya0% (1)
- Guia PRÁCTICA 1. EXTRACCIÓN DE ADNDocumento3 páginasGuia PRÁCTICA 1. EXTRACCIÓN DE ADNDiego Humberto Cubillos GonzalesAún no hay calificaciones
- Practica 5 Determinacion de Acidez en VinagreDocumento2 páginasPractica 5 Determinacion de Acidez en VinagreDiana SalcedoAún no hay calificaciones
- Guia Practica CervezaDocumento3 páginasGuia Practica CervezaBBAún no hay calificaciones
- BI - Guía Práctica 2 - Cultivos CelularesDocumento3 páginasBI - Guía Práctica 2 - Cultivos CelularesDaniela MoreiraAún no hay calificaciones
- Guia de Lab 2 Reconocimiento de ADNDocumento4 páginasGuia de Lab 2 Reconocimiento de ADNManuel ManueldjAún no hay calificaciones
- Informe BiologiaDocumento6 páginasInforme BiologiaisiAún no hay calificaciones
- Guía para El Desarrollo Del Componente Práctico - Fase 4 - Actividad de Apropiación - Práctica de LaboratorioDocumento16 páginasGuía para El Desarrollo Del Componente Práctico - Fase 4 - Actividad de Apropiación - Práctica de LaboratorioLuis Alfredo Arguello DiazAún no hay calificaciones
- 69 Extraccion de ADN (Procedimiento Basico)Documento6 páginas69 Extraccion de ADN (Procedimiento Basico)Manuel JimenezAún no hay calificaciones
- QPN GUÍA 1-Signed-TerpenosDocumento3 páginasQPN GUÍA 1-Signed-Terpenosagalban2Aún no hay calificaciones
- B.cel. Extraccion Del Adn 2Documento61 páginasB.cel. Extraccion Del Adn 2Jhonatan A. OZAún no hay calificaciones
- Guía Laboratorio 1 EnzimologíaDocumento2 páginasGuía Laboratorio 1 EnzimologíaHyllary BorjaAún no hay calificaciones
- Práctica #2 Extracción de ADNDocumento6 páginasPráctica #2 Extracción de ADNLuis E Aguilar RAún no hay calificaciones
- Extraccion de AdnDocumento4 páginasExtraccion de AdnChris Ramiro MendezAún no hay calificaciones
- Cuadernillo de Prácticas Biología 1Documento42 páginasCuadernillo de Prácticas Biología 1ErikaRevadivigoÜ100% (1)
- Laboratorio Microbiologia AmbientalDocumento14 páginasLaboratorio Microbiologia AmbientalUnad unadAún no hay calificaciones
- Practica 6 Extracción de Adn 2016Documento3 páginasPractica 6 Extracción de Adn 2016SaidyVillalba100% (1)
- Bioquímica para AgrónomosDocumento59 páginasBioquímica para AgrónomosJaime CubillosAún no hay calificaciones
- Practica PPAN N°07 - Elaboracion de Gel DesinfectanteDocumento5 páginasPractica PPAN N°07 - Elaboracion de Gel DesinfectanteCarlos Guarniz ChambaAún no hay calificaciones
- Informe de Laboratorio Sem12Documento9 páginasInforme de Laboratorio Sem12JASON ALBERTO VILCAHUAMAN PUCHOCAún no hay calificaciones
- Practica de Laboratorio 2Documento6 páginasPractica de Laboratorio 2César OrmazaAún no hay calificaciones
- Cuaderno de Prácticas 2 Evaluación PDFDocumento10 páginasCuaderno de Prácticas 2 Evaluación PDFdesireeAún no hay calificaciones
- ACTIVIDAD Trabajo Individual Primera Parte Comprensión EDocumento12 páginasACTIVIDAD Trabajo Individual Primera Parte Comprensión EIsabella Diaz OrtizAún no hay calificaciones
- Consideraciones Generales Sobre La GanaderiaDocumento15 páginasConsideraciones Generales Sobre La GanaderiaJENNIFER TATIANA PORRAS OLIVEROSAún no hay calificaciones
- Act.3 Ensayo Bioctenologia ContemporaneaDocumento3 páginasAct.3 Ensayo Bioctenologia ContemporaneaLilibeth PaezAún no hay calificaciones
- Clase 1.bases de La Organizacion BiologicaDocumento21 páginasClase 1.bases de La Organizacion Biologicascribd_lostandfoundAún no hay calificaciones
- Amplificación de Ácidos Nucleicos - Tipos de PCR y AplicacionesDocumento8 páginasAmplificación de Ácidos Nucleicos - Tipos de PCR y AplicacionesKarol Morales ArdilaAún no hay calificaciones
- Repaso Univesidad Nacional de Trujillo 2021 BDocumento51 páginasRepaso Univesidad Nacional de Trujillo 2021 BHansking Poincaire ErizoAún no hay calificaciones
- HomeostasisDocumento13 páginasHomeostasisEstefanía LimjiAún no hay calificaciones
- CTA - U5 - 4to Grado - Sesion 01Documento6 páginasCTA - U5 - 4to Grado - Sesion 01Lida Gonzales GuardiaAún no hay calificaciones
- Informe de Lab.1 - Extraccion de Adn (2020)Documento4 páginasInforme de Lab.1 - Extraccion de Adn (2020)Ivan HerreraAún no hay calificaciones
- Ejercicios de Genetica Carrera de Medicina VeterinariaDocumento2 páginasEjercicios de Genetica Carrera de Medicina VeterinariaFrancisca IbáñezAún no hay calificaciones
- Biologia 1 Esorefuerzo - 1 - 379568 PDFDocumento3 páginasBiologia 1 Esorefuerzo - 1 - 379568 PDFElizabeth VelascoAún no hay calificaciones
- examenUNSA IIordinario2020 Socialesi PDFDocumento10 páginasexamenUNSA IIordinario2020 Socialesi PDFyurienocAún no hay calificaciones
- IntroducciónDocumento3 páginasIntroducciónNay BautistaAún no hay calificaciones
- Encuesta de Alimentos TransgénicosDocumento31 páginasEncuesta de Alimentos TransgénicosCésar OrtegaAún no hay calificaciones
- Clasificación de Los Ácidos NucleicosDocumento1 páginaClasificación de Los Ácidos NucleicosClases particularesAún no hay calificaciones
- 2021 Orto-6 SolDocumento76 páginas2021 Orto-6 SolMarta Alvarez Cañibano100% (2)
- Los Amantes de Valdaro-AbrazadosDocumento2 páginasLos Amantes de Valdaro-AbrazadosjcarloslluchAún no hay calificaciones
- Primer Material de Antropologia CulturalDocumento17 páginasPrimer Material de Antropologia CulturalNathanael ReyesAún no hay calificaciones
- Ppt. Sesión 14 BioéticaDocumento20 páginasPpt. Sesión 14 BioéticaStacy ValdiviezoAún no hay calificaciones
- Pate Sci BacteriaDocumento10 páginasPate Sci BacteriaAndrea OcampoAún no hay calificaciones
- Marcador Molecular 1KbDocumento2 páginasMarcador Molecular 1KbAna Lidia QuinteroAún no hay calificaciones
- Laboratorio Mitosis Cebolla PendienteDocumento8 páginasLaboratorio Mitosis Cebolla Pendientejhon muesesAún no hay calificaciones
- Cuestionario 4 GeneticaDocumento4 páginasCuestionario 4 GeneticaVICTOR JAVIER DIAZ ALCAYAAún no hay calificaciones
- Tarea6 Calle Bure EstefanyDocumento2 páginasTarea6 Calle Bure EstefanyEstefany CalleAún no hay calificaciones
- Ensayo de BiologuiaDocumento14 páginasEnsayo de BiologuiaAlexander VelascoAún no hay calificaciones
- AVANCES DE LA INGENIERIA GENÉTICA Y EL CANCER Agenda 3 BiologiaDocumento1 páginaAVANCES DE LA INGENIERIA GENÉTICA Y EL CANCER Agenda 3 Biologiamalu cavasAún no hay calificaciones
- UntitledDocumento52 páginasUntitledKelly SócolaAún no hay calificaciones
- Anatomía y FisiologíaDocumento24 páginasAnatomía y FisiologíaAimeé GuerreroAún no hay calificaciones
- Actividades Tema 3Documento10 páginasActividades Tema 3Ruth Guevara MenaAún no hay calificaciones
- Und. I Pueblos IndigenasDocumento9 páginasUnd. I Pueblos IndigenasOmar Jose Jiménez PeñaAún no hay calificaciones
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- GuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisDe EverandGuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisCalificación: 4 de 5 estrellas4/5 (9)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Notas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesDe EverandNotas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesAún no hay calificaciones
- Neuropsicología: Los fundamentos de la materiaDe EverandNeuropsicología: Los fundamentos de la materiaCalificación: 5 de 5 estrellas5/5 (1)
- El cerebro del niño explicado a los padresDe EverandEl cerebro del niño explicado a los padresCalificación: 4.5 de 5 estrellas4.5/5 (147)
- Nuestra mente nos engaña: Sesgos y errores cognitivos que todos cometemosDe EverandNuestra mente nos engaña: Sesgos y errores cognitivos que todos cometemosCalificación: 3.5 de 5 estrellas3.5/5 (6)
- Sacale partido a tu cerebro: Todo lo que necesitas saber para mejorar tu memoria, tomar decisiones y aprovechar todo tu potencialDe EverandSacale partido a tu cerebro: Todo lo que necesitas saber para mejorar tu memoria, tomar decisiones y aprovechar todo tu potencialCalificación: 3 de 5 estrellas3/5 (1)
- Minerales y vitaminas: Micronutrientes esenciales en la alimentación, nutrición y salud.De EverandMinerales y vitaminas: Micronutrientes esenciales en la alimentación, nutrición y salud.Calificación: 3 de 5 estrellas3/5 (2)
- Inteligencia artificial: Una exploración filosófica sobre el futuro de la mente y la concienciaDe EverandInteligencia artificial: Una exploración filosófica sobre el futuro de la mente y la concienciaAna Isabel Sánchez DíezCalificación: 4 de 5 estrellas4/5 (3)
- Los cinco ritos tibetanos de la eterna juventud: El ojo de la revelaciónDe EverandLos cinco ritos tibetanos de la eterna juventud: El ojo de la revelaciónCalificación: 4.5 de 5 estrellas4.5/5 (12)
- Curso Práctico de Química GeneralDe EverandCurso Práctico de Química GeneralCalificación: 4 de 5 estrellas4/5 (4)
- Cerebros rotos: Pacientes asombrosos que me enseñaron a vivirDe EverandCerebros rotos: Pacientes asombrosos que me enseñaron a vivirCalificación: 5 de 5 estrellas5/5 (3)
- 200 tareas en terapia breve: 2ª ediciónDe Everand200 tareas en terapia breve: 2ª ediciónCalificación: 4.5 de 5 estrellas4.5/5 (33)
- Abrázame fuerte: Siete conversaciones para un amor duraderoDe EverandAbrázame fuerte: Siete conversaciones para un amor duraderoManu BerásteguiCalificación: 4.5 de 5 estrellas4.5/5 (13)
- Cómo dormir bien: Cómo reconocer, prevenir y tratar las dificultades para dormir bienDe EverandCómo dormir bien: Cómo reconocer, prevenir y tratar las dificultades para dormir bienCalificación: 5 de 5 estrellas5/5 (1)
- El perfil psicológico de Jesús: Aprendamos del Maestro a manejar efectivamente nuestras emocionesDe EverandEl perfil psicológico de Jesús: Aprendamos del Maestro a manejar efectivamente nuestras emocionesCalificación: 4 de 5 estrellas4/5 (4)
- Sesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesDe EverandSesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesCalificación: 4.5 de 5 estrellas4.5/5 (13)
- Flujo de fluidos e intercambio de calorDe EverandFlujo de fluidos e intercambio de calorCalificación: 1 de 5 estrellas1/5 (1)
- El autismo: Reflexiones y pautas para comprenderlo y abordarloDe EverandEl autismo: Reflexiones y pautas para comprenderlo y abordarloCalificación: 4 de 5 estrellas4/5 (7)
- Fisicoquímica II: Materia, electricidad y magnetismo. Fuerzas y camposDe EverandFisicoquímica II: Materia, electricidad y magnetismo. Fuerzas y camposAún no hay calificaciones